En este artículo se revisa el perfil de seguridad de la anfotericina B liposomal, haciendo hincapié en la toxicidad renal; se incluyen los factores de riesgo para su presentación, incidencia, gravedad y potencial reversibilidad.
This article reviews the safety profile of liposomal amphotericin B, emphasizing the renal toxicity; the risk factors for its presentation, incidence, severity, and potential reversibility are expounded.
La anfotericina B (AmB) fue aprobada por primera vez por la US Food and Drug Administration de los Estados Unidos en 1959 en una formulación solubilizada con desoxicolato de sodio (anfotericina B desoxicolato [AmB-D]). Sin embargo, debido a los importantes efectos tóxicos que limitaban el uso del fármaco, la AmB se reformuló con lípidos para reemplazar el desoxicolato de su composición. Actualmente hay disponibles tres formulaciones lipídicas de AmB. Estas formulaciones difieren en dosis, perfil de toxicidad, estabilidad, farmacocinética, tamaño y forma de sus unidades estructurales y componentes lipídicos15.
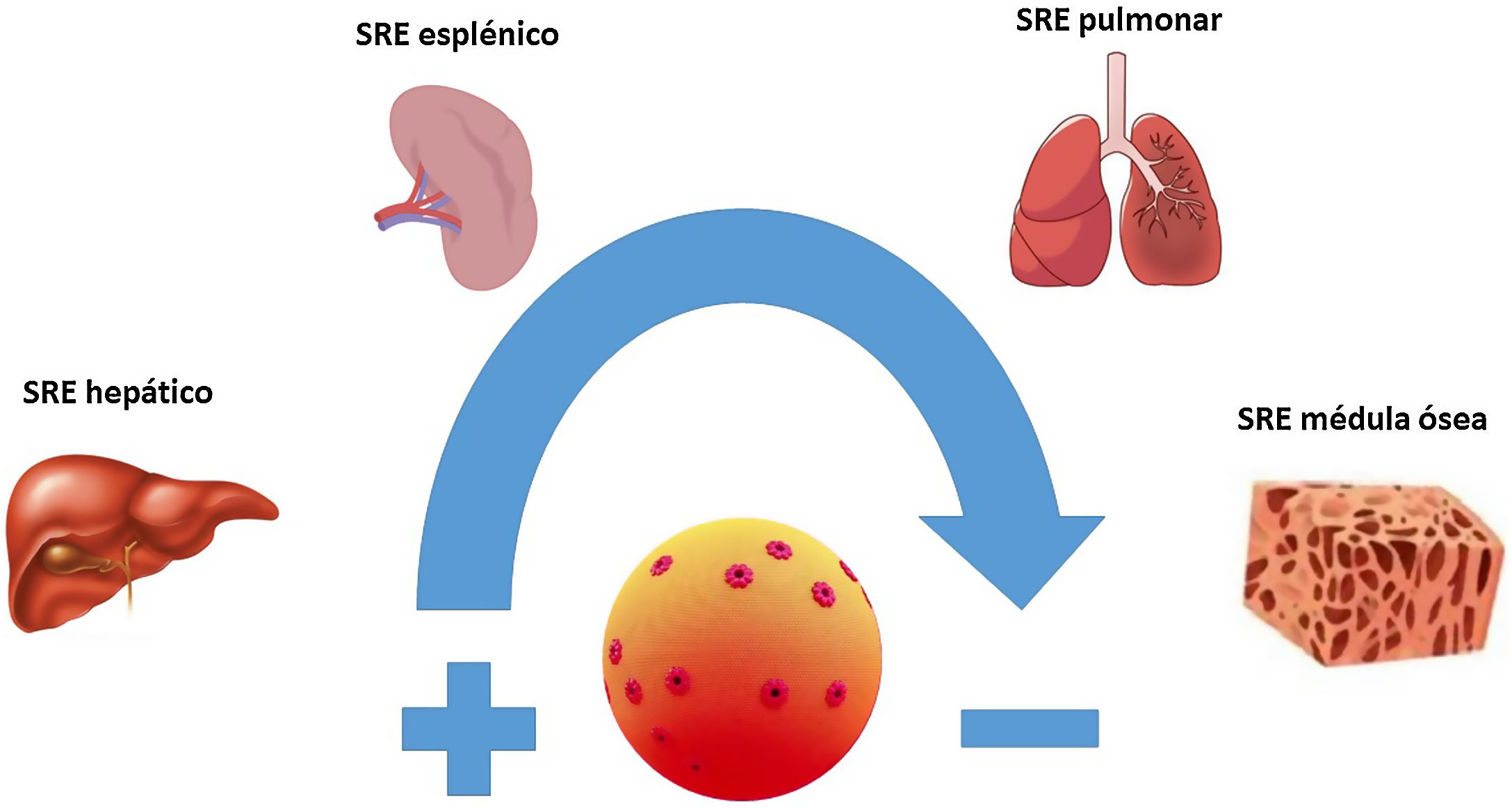
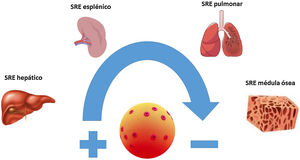
La AmB es un macrólido heptaeno con una molécula de micosamina en un extremo y siete grupos hidroxilo en el otro. A diferencia del resto de las formulaciones lipídicas, la anfotericina B liposomal (AmB-L) se compone de pequeños liposomas o vesículas unilamelares esféricas compuestas por fosfatidilcolina de soja hidrogenada, colesterol, diestearoil fosfatidilglicerol y tocoferol, con las moléculas de AmB dispersas por toda la superficie de la bicapa lipídica. El elemento clave en la estructura de la AmB-L es el liposoma. Los liposomas evitan que un fármaco se metabolice antes de llegar a los tejidos diana y, simultáneamente, minimizan la exposición de los tejidos sanos al fármaco encapsulado durante su circulación por la sangre4. En un estudio de fase iv realizado en personas sanas se observó que hasta el 97% de la AmB permanecía unida al liposoma transcurridas 4horas de la administración, siendo necesario que transcurrieran 168horas para que el porcentaje de AmB libre del liposoma se acercase al 50%. De esta manera la liberación de AmB se va produciendo de forma gradual según esta se disocia del liposoma. Este porcentaje inicialmente alto de AmB, unida a la estructura liposomal, explicaría la reducción en la liberación de factor de necrosis tumoral alfa (TNF-α), responsable de las reacciones relacionadas con la perfusión presentes en otras presentaciones de AmB, además de proteger el riñón al no existir concentraciones elevadas de AmB libre circulante y, por ello, susceptible de ser filtrada17. El fármaco que se libera del liposoma se une rápidamente a las proteínas plasmáticas (>95%) debido a su insolubilidad en agua. A diferencia de lo que sucede en la formulación liposomal, cuando la AmB de la AmB-D se libera de su portador interactúa preferentemente con las lipoproteínas de baja densidad (LDL) y lipoproteínas de muy baja densidad. Por su parte, la AmB liberada de la AmB-L lo hace con lipoproteínas de alta densidad (HDL). Este complejo AmB-HDL es captado fundamentalmente por los fagocitos mononucleares del sistema retículo-endotelial. De esta manera, los macrófagos del sistema retículo-endotelial podrían actuar como reservorios de la AmB y, por ende, como herramienta para su entrega en los tejidos infectados. Es por tanto en estos tejidos ricos en sistema retículo-endotelial, como el hígado, el bazo, los pulmones o la médula ósea y en aquellos que presentan un proceso infeccioso activo, donde la AmB-L tenderá a acumularse (fig. 1), mientras que la AmB-D tiende a distribuirse a tejidos ricos en receptores LDL, como el riñón y el músculo esquelético5,17,18.
En relación con el tratamiento con AmB-L se han descrito diferentes efectos adversos con una incidencia y gravedad variables. No tanto por su frecuencia, sino por su potencial gravedad, en este trabajo nos centraremos exclusivamente en la toxicidad renal.
AmB-D puede provocar toxicidad renal a través de diferentes mecanismos y sobre distintas localizaciones anatómicas7. Se une a las células del endotelio renal a través de los receptores de la lipoproteína LDL, que son mayoritarios frente a la mínima expresión que presentan los receptores HDL en dichas células33. El daño glomerular depende de la vasoconstricción de la arteriola aferente por alteración del sistema de retroalimentación tubuloglomerular, responsable de un descenso en el flujo renal y por ello de la tasa de filtración glomerular. En este mecanismo desempeñaría un importante papel el TNF-α, que activa el sistema de retroalimentación tubuloglomerular por inhibición de la absorción proximal de solutos24. Igualmente la propia AmB-D posee un efecto vasoconstrictor y puede provocar toxicidad tubular directa36.
Se han barajado diferentes motivos para explicar la menor toxicidad renal de la AmB-L respecto a la AmB-D. En primer lugar, la tasa de eliminación renal de ambas moléculas es muy diferente. Así, mientras la AmB-D no se metaboliza significativamente y aproximadamente el 21% se filtra por vía renal y se excreta sin cambios a través de la orina, solo el 4,5% de la AmB-L se elimina siguiendo esta vía17. Además, algunos autores sugieren que la menor toxicidad renal de la AmB-L se debe, al menos en parte, a una diferente interacción de esta con las membranas celulares. La AmB-L presenta una alta afinidad por el ergosterol que forma parte de las membranas celulares de los hongos, afinidad superior a la que posee la AmB-D, que tendería en mayor medida a unirse también a las membranas celulares humanas causando toxicidad19. Esta toxicidad podría deberse también a diferencias en el modelo de distribución farmacocinética, de manera que mientras la AmB-D llega al riñón en una fase muy temprana, la AmB-L se acumula preferentemente en los órganos del sistema retículo-endotelial, lo que reduce la concentración plasmática del fármaco y el aclaramiento renal21. El proceso celular de degradación y liberación de AmB-L, para lo cual se necesitan enzimas lipasas y fosfolipasas que no están presentes en las células glomerulares o células epiteliales del túbulo renal, podría tener igualmente un papel13. Finalmente, otros autores argumentan que la mayor temperatura de transición de los fosfolípidos de la AmB-L evitaría su liberación antes de llegar a la célula fúngica1.
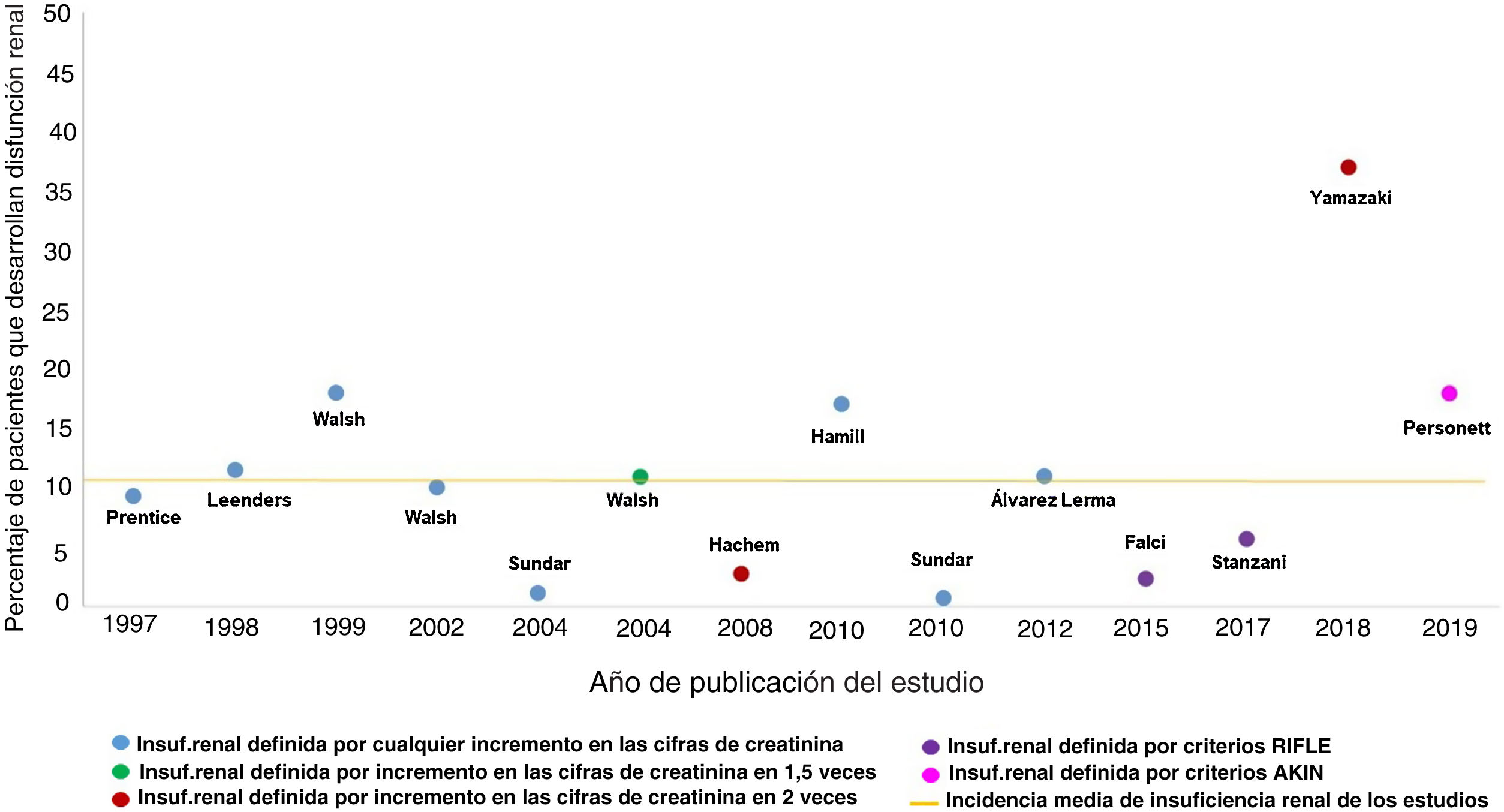
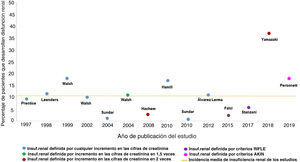
No es sencillo cuantificar la incidencia real de la insuficiencia renal por la administración de AmB-L, ni demostrar la relación causal de esta con el fracaso renal. El número de estudios al respecto es limitado; incluye poblaciones muy heterogéneas, muchas de ellas con elevado riesgo para la presentación de insuficiencia renal, y las definiciones de insuficiencia renal son variables, como también lo son las indicaciones para el empleo del fármaco antifúngico y las dosis empleadas. Además, el tratamiento concomitante con otros fármacos potencialmente nefrotóxicos dificulta la interpretación de la causalidad de los distintos agentes en relación con el deterioro de la función renal. Las consecuencias de todo lo anteriormente expuesto se plasman en una gran variabilidad de la incidencia de insuficiencia renal asociada al empleo de AmB-L descrita en la bibliografía (fig. 2), que va desde el 0,2% descrito por Sundar en 2010 hasta el 38% del grupo de Yamazaki en 201827,35. La incidencia media de insuficiencia renal detallada en estos trabajos sería del 11% (fig. 2) asumiendo que, como se ha expuesto, la heterogeneidad de estos hace que sea ciertamente artificioso realizar comparaciones entre ellos.
Cinco revisiones y múltiples estudios clínicos sugieren que la AmB-L es menos nefrotóxica que otras formulaciones de AmB. Entre los estudios publicados destaca el de Falci et al.8, que compararon, de acuerdo con los criterios RIFLE16 modificados, la nefrotoxicidad en 431 pacientes tratados con las diferentes presentaciones de AmB (AmB-D, n=236; AmB-L, n=105; anfotericina B complejo lipídico [AmB-CL], n=90). La frecuencia de nefrotoxicidad grave fue del 11,5%, 2,4% y 7,2% para AmB-D, AmB-L y AmB-CL, respectivamente (p=0,046). El uso de AmB-L se mostró como un factor protector independiente (OR: 0,18; IC 95%: 0,03-0,64; p=0,006), tanto en el desarrollo de nefrotoxicidad grave como en la mortalidad (OR: 0,56; IC 95%: 0,32-0,99; p=0,046)8. Por su parte, Walsh et al32. llevaron a cabo un ensayo multicéntrico, doble ciego y aleatorizado que comparó AmB-L con AmB-D como terapia antifúngica empírica en pacientes diagnosticados de leucemia, linfoma u otros cánceres, o que habían sido sometidos a un trasplante de precursores hematopoyéticos. El desarrollo de nefrotoxicidad (definido por la duplicación de los valores de creatinina basal) se produjo en el 12% de los que recibieron AmB-L, en comparación con el 26% de los tratados con AmB-D (p<0,001)32. Otros grupos, como los de Wingard o Hachem, cosecharon resultados similares11,34. El primero evaluó, en un estudio aleatorizado y doble ciego, la seguridad de AmB-L frente a AmB-CL en el tratamiento empírico de la neutropenia febril. La tasa de nefrotoxicidad, definida como un incremento de la creatinina sérica igual o superior a dos veces el valor basal, fue significativamente más baja en el grupo de pacientes que recibió AmB-L frente al grupo tratado con AmB-CL (14% frente a 42%)34. En una población de características similares, y empleando los mismos criterios de nefrotoxicidad, el grupo de Hachem igualmente observó una mayor tasa de disfunción renal en el tratamiento con AmB-CL frente a AmB-L (21,2% y 2,8%; p<0,001)11. Finalmente, respecto a la potencial reversibilidad del fracaso renal, a diferencia de lo que sucede en el caso de la AmB-D, el fracaso renal asociado a la administración de AmB-L parece ser reversible en la mayor parte de los casos23.
Los estudios publicados sobre el tema han sido evaluados de forma conjunta en varios metaanálisis. En 2015 Botero et al.6 publicaron una revisión Cochrane que incluyó diez estudios con un total de 2.172 pacientes. En este trabajo la administración de AmB-L se asoció a una reducción significativa del riesgo de presentación de insuficiencia renal (RR: 0,49; IC 95%: 0,40 a 0,59) en comparación con AmB-D6. Más recientemente, en 2017, se publicaron otros tres artículos de revisión26,29,30. Los trabajos de los grupos de Steimbach y Tonin26,30 eran metaanálisis focalizados en trabajos que incluyeran pacientes diagnosticados de cáncer/leucemia, infección por el VIH/sida, fiebre de origen desconocido o pacientes a los que se les había administrado AmB por infección fúngica invasora probada, probable o posible. Ambos autores evaluaron la aparición de efectos adversos tanto si los pacientes recibían AmB-D o cualquiera de las formulaciones basadas en lípidos. Las presentaciones lipídicas, especialmente AmB-L, presentaron menor toxicidad renal26,30. Por su parte, Takemoto et al.29 estudiaron la relación de las características farmacocinéticas de la AmB-L con su seguridad y eficacia. Los autores concluyeron que la AmB-L provocaba menos efectos adversos graves que la AmB-D, siendo estos en su mayoría reversibles. Según estos autores este beneficio se relacionaba con la estabilidad de los liposomas, que no liberan las moléculas de AmB, lo que produce una menor distribución del antifúngico en las regiones no infectadas de varios tejidos, incluido el riñón. Fundamentándose en su potencial toxicidad renal, las guías de práctica clínica recomiendan tener precaución cuando se utiliza en pacientes especialmente sensibles, como los pacientes en estado crítico, receptores de trasplantes, ancianos, o pacientes con disfunción renal previa o administración simultánea de otros fármacos nefrotóxicos10,23. Aunque limitada, existe evidencia científica sobre el comportamiento de la AmB-L en estos grupos poblacionales.
Álvarez Lerma et al2. evaluaron el efecto de AmB-L sobre la función renal a través de un estudio retrospectivo, multicéntrico y comparativo de dos cohortes de pacientes en estado crítico tratados con dicho fármaco durante tres o más días. Ambos grupos se diferenciaban por la concentración de creatinina al inicio del tratamiento (función renal normal con creatinina sérica inferior a 1,5mg/dl, o alterada si era mayor de 1,5mg/dl). En los pacientes con función renal alterada al inicio del tratamiento con AmB-L, no solo no se produjo un incremento de las cifras de creatinina, sino que se observó una reducción absoluta de la misma de 1,08mg/dl (p<0,001). La creatinina bajó a valores normales en el 50% de los pacientes, descendió pero sin llegar a valores normales en el 37,5% y solo se elevó en un paciente (6,25%). En ningún caso se suspendió el tratamiento con AmB-L por nefrotoxicidad, ni se precisaron técnicas de depuración extrarrenal. Sorprendentemente, en el grupo con función renal normal al inicio del tratamiento, 13 pacientes (12,3%) presentaron un incremento en sus cifras de creatinina, 9 de los cuales recibieron tratamiento concomitante con uno o más fármacos nefrotóxicos: en dos casos tuvieron que utilizarse técnicas de depuración extrarrenal2. El mismo grupo publicaría un año después su experiencia en el empleo de AmB-L en enfermos que requirieron de técnicas de reemplazo renal, llegando a la conclusión de que esta es efectiva tanto desde el punto de vista de la curación clínica como de la microbiológica3. El grupo de Kato14 obtuvo resultados similares a los expuestos por Álvarez-Lerma. Este grupo investigó la incidencia de nefrotoxicidad (definida como un aumento de la creatinina de ≥0,5mg/dl) en 65 enfermos tratados con AmB-L. Los pacientes se distribuyeron en cuatro grupos según su tasa de filtración glomerular (TFG) al inicio del tratamiento: TFG≥60ml/min/1,73m2 (n=37), 60ml/min/1,73m2>TFG≥30ml/min/1,73m2 (n=13), TFG<30ml/min/1,73m2 (n=10) y pacientes en hemodiálisis (n=5). No se observaron diferencias significativas en la incidencia de nefrotoxicidad entre los cuatro grupos (TFG≥60, 27%; 60>TFG≥30, 30,8%; TFG<30, 50%; y hemodiálisis, 40%, p=0,56). Sin embargo, sí que se observó un aumento significativo en la concentración de creatinina en el grupo con TFG≥60ml/min (p<0,01). Este fue el único en el cual se incluyeron pacientes con administración concomitante de otros fármacos nefrotóxicos14. Por su parte, Stanzani et al.25 examinaron retrospectivamente la incidencia, los factores de riesgo y la evolución de la disfunción renal aguda (clasificada según criterios RIFLE16) durante 103 tratamientos con AmB-L en 97 enfermos. Casi dos tercios (61,7%) de los pacientes del estudio no presentaban los criterios de inclusión en alguna categoría de la clasificación RIFLE, el 19,4% fueron clasificados como de riesgo, el 13,6% cumplía el criterio de lesión y el 5,8% el de insuficiencia renal.
El grupo de Yamazaki es el que ha reportado cifras más elevadas de disfunción renal por la administración de AmB-L35. Estos autores analizaron retrospectivamente el desarrollo y la evolución de la disfunción renal durante la administración de AmB-L en 115 pacientes con procesos oncohematológicos o que habían recibido un trasplante de precursores hematopoyéticos. Se definió la disfunción renal de la siguiente manera: grado 1, aumento de la creatinina sérica en más de 0,3mg/dl o de 0,5 a dos veces las concentraciones de referencia; grado 2, de dos a tres veces las concentraciones basales; grado 3, más de tres veces el valor inicial o más de 4mg/dl; y grado 4, indicación de hemodiálisis. La tasa global de aparición de disfunción renal fue del 56,5%, si bien en 44 pacientes (38%) las cifras de creatinina sérica se incrementaron en al menos el doble de los valores basales. En ningún caso fue necesaria la utilización de técnicas de reemplazo renal. El principal factor de riesgo para el desarrollo de disfunción renal fue la administración simultánea de otros fármacos nefrotóxicos (RR: 2,89; IC 95%: 1,7-4,8; p=0,000069). De hecho, el 37% de los enfermos incluidos en este trabajo recibió un tratamiento con algún tipo de fármaco nefrotóxico, una cifra llamativamente elevada en comparación con las presentadas en otras series como la de Kato14, en la que esta población supone tan solo el 7% del total.
La edad es, per se, un factor de riesgo para el desarrollo de insuficiencia renal12. En relación con la toxicidad renal asociada al empleo de AmB-L, la edad es un factor de riesgo descrito con frecuencia en los trabajos que versan sobre el tema. Sin embargo, varios estudios que han evaluado específicamente esta variable no han encontrado asociación entre la edad y el riesgo de presentación de disfunción renal en pacientes añosos. Ueda et al.31 evaluaron la seguridad de AmB-L en dos grupos de pacientes con enfermedades hematológicas, con edad≥65años y menores de 65 años. En los mayores de 65 años no se observaron elevaciones de la creatinina sérica en los grados de mayor intensidad (grados 3 o 4), mientras que el 9,5% de los individuos jóvenes los presentaron. El porcentaje de individuos en los que se duplicó su creatinina basal fue del 21,2% en el grupo de mayor edad y del 38,1% en el de menor edad. Con respecto a los factores de riesgo para un incremento de dos veces la concentración de creatinina basal, solo el uso concurrente de antibióticos nefrotóxicos fue un factor de riesgo significativo (p=0,029)31. Más recientemente Yoshida et al.37 llevaron a cabo un estudio similar en 424 pacientes distribuidos en tres grupos de edad (<15 años, 16-64 años y>65años). El grupo correspondiente a los enfermos de menos de 15 años presentó menos episodios de alteración de la función renal que el resto. Sin embargo, no se observaron diferencias entre los mayores y menores de 65 años37.
Así pues, el papel que desempeña la coadministración junto con AmB-L de otros fármacos con potencial efecto nefrotóxico parece ser relevante en el desarrollo de la insuficiencia renal. Mientras que algunos tóxicos renales, como los contrastes yodados, parecen no tener un gran efecto deletéreo20, otros, como determinados antibióticos y fármacos antivíricos, fármacos anticancerígenos e inmunosupresores se han asociado repetidamente con un incremento en el riesgo de insuficiencia renal al administrarse junto con la AmB-L2,22,25,35,37, y por ello deben ser tenidos en cuenta a la hora de ser administrados conjuntamente con esta. Otros factores, como el déficit de vitamina D o la hipoalbuminemia, se han postulado recientemente como posibles potenciadores del efecto nefrotóxico de la AmB-L9,28. Sin embargo, la evidencia existente al respecto es muy reducida.
ConclusionesLa amplia experiencia acumulada con la utilización de AmB-L en la práctica clínica en estos últimos 30 años permite conocer de forma detallada su perfil de seguridad y sus efectos adversos. Es un fármaco, por lo general, bien tolerado y con una relación eficacia-seguridad óptima, pero cuenta con una mal merecida etiqueta de fármaco altamente nefrotóxico. Evidentemente su uso acarrea una cierta toxicidad renal, menor que la del resto de los fármacos antifúngicos de su familia, especialmente cuando se emplea de forma concomitante con otros fármacos nefrotóxicos. Por ello, se recomienda un control regular de la función renal en estas situaciones.
FinanciaciónLa publicación de este artículo ha sido financiada por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.
Conflicto de interesesBorja Suberviola ha participado en asesoramiento y conferencias en encuentros patrocinados por Pfizer, MSD, Astellas y Gilead.