En los últimos años estamos asistiendo a un aumento en la incidencia de la candidemia causada por especies de Candida no Candida albicans. Dentro del complejo Candida glabrata se han descrito 2 especies crípticas, Candida nivariensis y Candida bracarensis, que pueden presentar problemas en la identificación de los aislamientos en el laboratorio y una mayor resistencia a fluconazol.
ObjetivosSe describe el primer aislamiento en la Península Ibérica de C. nivariensis en un paciente con fungemia asociada a catéter.
Caso clínicoVarón de 81 años que ingresó en nuestro hospital con una fístula intestinal y en estado de malnutrición. En los hemocultivos y en la punta del catéter venoso central se aisló una levadura que crecía formando colonias blancas en medio BD CHROMagar Candida® y que no pudo ser identificada por la metodología convencional. A pesar del tratamiento intravenoso con fluconazol, los hemocultivos persistían positivos después de 5 días de tratamiento. Las CMI obtenidas fueron: 1μg/ml para anfotericina B, 0,015μg/ml para anidulafungina, 0,125μg/ml para caspofungina, 0,015μg/ml para micafungina, 4μg/ml para fluconazol, 0,25μg/ml para itraconazol, 0,25μg/ml para posaconazol, y 0,03μg/ml para voriconazol. Se sustituyó el fluconazol por caspofungina, que se mantuvo durante 2 semanas. El paciente fue intervenido y dado de alta tras un postoperatorio sin complicaciones. Finalmente, el aislamiento fue identificado como C. nivariensis mediante secuenciación de las regiones ITS del rARN.
ConclusionesC. nivariensis es una levadura emergente cuya identificación debe basarse en pruebas de biología molecular. En el caso clínico que presentamos el tratamiento con caspofungina fue eficaz.
In recent years the incidence of candidemia caused by non-albicans Candida species has been increasing. Two cryptic species have been described within the Candida glabrata complex, Candida nivariensis and Candida bracarensis, which may be troublesome in laboratory identification and have lower susceptibility to fluconazole.
AimsTo describe the first isolation of C. nivariensis in the Iberian Peninsula from a patient suffering from a catheter-related fungemia.
Case reportAn 81-year-old man was hospitalized for surgical treatment of an intestinal fistula that was associated to a severe malnutrition. Cultures of the patient's central venous catheter tip and blood yielded white colonies in BD CHROMagar Candida® medium, which could not be identified by conventional microbiological methods. Although intravenous fluconazole was administered, blood cultures continued being positive 5 days later. The MIC values of the isolate were as follows: 1μg/ml for amphotericin B, 0.015μg/ml for anidulafungin, 0.125μg/ml for caspofungin, 0.015μg/ml for micafungin, 4μg/ml for fluconazole, 0.25μg/ml for itraconazole, 0.25μg/ml for posaconazole, and 0.03μg/ml for voriconazole. Antifungal treatment was changed to intravenous caspofungin for 2 weeks. The intestinal fistula was surgically treated. There was no evidence of relapse during the following month, and the patient was discharged. The isolate was identified as C. nivariensis based on DNA sequencing of the ITS regions of rRNA.
ConclusionsC. nivariensis should be regarded as an emerging pathogen which requires molecular methods for a definitive identification. Our patient was successfully treated with caspofungin.
La candidemia es la presentación clínica más común de la candidiasis invasora y está asociada con una alta morbimortalidad3. En los últimos años estamos asistiendo a un aumento en la incidencia de la candidemia y a cambios profundos en su epidemiología, con un incremento de las causadas por especies de Candida diferentes de Candida albicans8. Dentro de este género fúngico, se han descrito recientemente 2 especies crípticas, Candida bracarensis y Candida nivariensis, que forman parte del complejo-especie Candida glabrata, y que pueden causar problemas en la identificación de los aislamientos clínicos en el laboratorio cuando se utilizan métodos convencionales. Además, estas especies se han relacionado con una resistencia mayor a fluconazol2,9, antifúngico de primera elección recomendado en diferentes guías para el tratamiento empírico de la candidemia en pacientes sin factores de riesgo3.
Caso clínicoVarón de 81 años, que ingresó en nuestro hospital en octubre de 2010 por presentar diarrea de año y medio de evolución sin sangre, moco ni pus; en los 5 últimos meses se acompañaba de astenia, anorexia y pérdida importante de peso (10kg). El paciente no refería ningún antecedente de importancia, excepto una intervención quirúrgica en el año 2003 por una obstrucción intestinal por íleo biliar.
Durante su ingreso al paciente se le diagnosticó una fístula yeyunocólica acompañada de malnutrición grave con déficit vitamínico, anemia secundaria y tromboembolismo pulmonar bilateral. Se pautó un tratamiento de nutrición parenteral mediante catéter venoso central en la vena femoral derecha y anticoagulación con heparina de bajo peso molecular, en previsión de realizar tratamiento quirúrgico.
El día 15 del ingreso presentó fiebre (39°C), tiritona y escalofríos, sin signos de sepsis o inestabilidad hemodinámica. La exploración general no mostró cambios significativos. La analítica de sangre demostró que el paciente tenía anemia y la radiografía de tórax fue normal. Tras la extracción de sangre periférica a través del catéter venoso con objeto de realizar hemocultivos, se inició tratamiento con daptomicina 6mg/kg/día.
El paciente continuaba con fiebre 24h después. En la tinción de Gram de una muestra del frasco de hemocultivo se observaron células ovales de pared gruesa y gemantes, por lo que se suspendió el tratamiento con daptomicina y se inició una terapia con fluconazol intravenoso: 6mg/kg/12h el primer día, seguido de 6mg/kg/24h. Asimismo se procedió a la retirada del catéter. Tras 24h de incubación a 35°C, en los hemocultivos de sangre extraída a través del catéter y en el cultivo semicuantitativo de la punta del catéter (técnica de Maki y recuento superior a 1.000UFC) se obtuvo el crecimiento de colonias de levaduras que eran lisas, cremosas y blancas en el medio BD CHROMagar Candida® (BD-Diagnostic Systems, Alemania). Las levaduras no producían tubos germinales en suero y únicamente asimilaban glucosa en la galería ID32C y en la tarjeta VITEK® 2 (bioMérieux, Marcy-l’Etoile, Francia), y ninguno de estos métodos aportaba una identificación concluyente. En los cultivos de sangre periférica se obtuvo el crecimiento de la misma levadura tras 7 días de incubación.
A las 24h de retirar el catéter el paciente se encontraba afebril. El ecocardiograma transtorácico y el examen oftalmológico no mostraron alteraciones. En los hemocultivos practicados en el quinto día de tratamiento se aislaba de nuevo la levadura.
Las pruebas de sensibilidad in vitro mediante Sensititre Yeast One® 010 (Trek Diagnostic Systems, Inglaterra) para azoles, equinocandinas, 5-fluorocitosina y anfotericina B, mostraron los siguientes valores de CMI: 0,125μg/ml para 5-fluorocitosina, 1μg/ml para anfotericina B, 0,015μg/ml para anidulafungina, 0,125μg/ml para caspofungina, 0,015μg/ml para micafungina, 4μg/ml para fluconazol, 0,25μg/ml para itraconazol, 0,25μg/ml para posaconazol, y 0,03μg/ml para voriconazol.
Ante estos resultados, se sustituyó el fluconazol por caspofungina intravenosa 70mg/día el primer día, seguido de 50mg/día. Se mantuvo el tratamiento con caspofungina intravenosa durante 2 semanas. Tanto en el sexto día de recibir caspofungina como al finalizar el tratamiento los hemocultivos realizados fueron negativos.
El paciente fue intervenido el día 28 del ingreso, practicándose una sección de la fístula y resección del yeyuno afectado, con anastomosis término-terminal. El postoperatorio se desarrolló sin complicaciones y 4 semanas después fue dado de alta.
El aislamiento fue finalmente identificado como C. nivariensis mediante secuenciación de las regiones ITS1, ITS2 y 5.8 rARN con primers ITS-1 (5’-TCCGTAGGTGAACCTGCGG-3’) e ITS-4 (5’-TCCTCCGCTTATTGATATGC-3’). La PCR se realizó con un volumen final de 50μl, que contenía 1μM de cada primer, 200μM de cada dNTP (Sigma, EE.UU.), 2,5U de AmpliTaq®DNA Polymerase (Applied Biosystems, EE.UU.) y 5μl de GeneAmp®10X PCR Buffer (Applied Biosystems, EE.UU.). La amplificación se llevó a cabo sin extracción de ADN, por homogeneizado de una colonia en la mezcla de reacción. Después de una predesnaturalización de 5min a 94°C, se realizaron 35 ciclos de 95°C (30s), 50°C (1min) y 72°C (1min), seguidos de una extensión final de 7min a 72°C.
La secuencia fue analizada utilizando el programa BLAST de GenBank® (n° de acceso JN253181, con un 100% de similitud con la secuencia para el mismo locus de la cepa tipo C. nivariensis NRRL Y-48269 y n° de acceso a GenBank® JN882341).
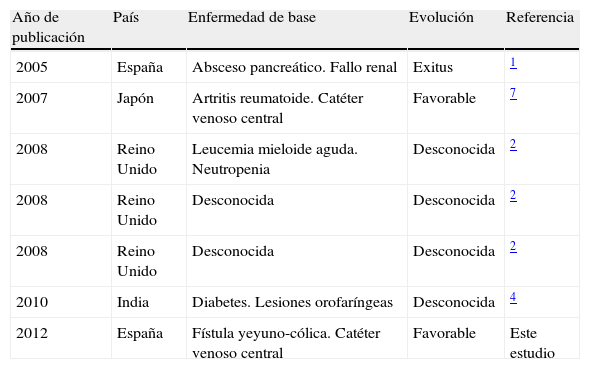
C. nivariensis es una levadura emergente, relacionada filogenéticamente con C. glabrata y C. bracarensis1,5. Fue descrita por primera vez en las Islas Canarias, al caracterizar 3 cepas atípicas de C. glabrata aisladas en muestras de sangre, lavado broncoalveolar y orina de 3 pacientes del mismo hospital1. Desde entonces no se ha documentado ningún caso clínico en nuestro país, a pesar de que se ha investigado la presencia de esta especie en colecciones de cepas hospitalarias de C. glabrata remitidas a centros de referencia estatales y en aislamientos clínicos obtenidos en estudios multicéntricos de candidemias6,10,11. En otros países la prevalencia es baja2,4,9 y los casos de fungemia descritos en la literatura hasta el momento son escasos (tabla 1).
Aislamientos de C. nivariensis en sangre descritos en la literatura
| Año de publicación | País | Enfermedad de base | Evolución | Referencia |
| 2005 | España | Absceso pancreático. Fallo renal | Exitus | 1 |
| 2007 | Japón | Artritis reumatoide. Catéter venoso central | Favorable | 7 |
| 2008 | Reino Unido | Leucemia mieloide aguda. Neutropenia | Desconocida | 2 |
| 2008 | Reino Unido | Desconocida | Desconocida | 2 |
| 2008 | Reino Unido | Desconocida | Desconocida | 2 |
| 2010 | India | Diabetes. Lesiones orofaríngeas | Desconocida | 4 |
| 2012 | España | Fístula yeyuno-cólica. Catéter venoso central | Favorable | Este estudio |
No hay demasiadas publicaciones sobre la epidemiología de las infecciones causadas por esta especie de Candida, aunque los jardines o las macetas con plantas de los hospitales son una fuente posible de infección o colonización de los pacientes1. El caso que describimos en este artículo corresponde a una infección nosocomial que se manifiesta clínicamente 2 semanas después del ingreso del paciente. La colonización de la punta del catéter con más de 1.000UFC del microorganismo y el tiempo transcurrido entre el crecimiento de la levadura en los hemocultivos extraídos a través del catéter y los de sangre periférica sugieren que el catéter central era el foco de la candidemia. El paciente no refería viajes ni otros antecedentes epidemiológicos de interés, y tampoco se investigó la existencia de portadores ni la presencia de esta levadura en el medio ambiente hospitalario, por lo que es difícil establecer con seguridad el origen de esta infección.
El aislamiento clínico no fue identificado inicialmente como C. glabrata. Al igual que los aislamientos descritos por otros autores2,4 y al contrario de su descripción inicial1, este únicamente asimilaba la glucosa y no la trehalosa. La falta de resultados concluyentes en los sistemas comerciales de identificación y el hecho de que se tratara de un aislamiento de sangre nos llevaron a realizar estudios moleculares para su identificación definitiva. Sin embargo, es posible que esta especie haya pasado desapercibida en otras muestras clínicas menos relevantes o haya sido confundida con otras especies con perfiles de asimilación de sustratos similares e identificada incorrectamente, lo que nos lleva a pensar que su frecuencia es probablemente más alta de la señalada en la literatura.
Se han descrito aislamientos de C. nivariensis resistentes a los azoles y se ha sugerido que la profilaxis con fluconazol podría contribuir a la selección de esta especie2,7. A pesar de la falta de puntos de corte clínicos o epidemiológicos específicos para esta especie de Candida, en nuestro caso, los resultados de sensibilidad in vitro, junto con la persistencia de candidemia después de 5 días de tratamiento con fluconazol, sugerían una menor sensibilidad a fluconazol. Este hecho aconsejaba el cambio del tratamiento antifúngico por otro más eficaz y se consideró que la caspofungina era el fármaco más adecuado. La posibilidad de resistencia a azoles y la buena evolución de nuestro paciente con el tratamiento con una candina, al igual que en el caso descrito por Fujita et al.7, respaldan el uso de este grupo de antifúngicos en el tratamiento de las infecciones producidas por C. nivariensis.
Como conclusión de la descripción de este primer caso de infección por C. nivariensis en la Península Ibérica, podemos resaltar la dificultad existente para llevar a cabo su identificación por las técnicas convencionales, y que no siempre los resultados obtenidos con estas pruebas nos orientan a considerar estos aislamientos como C. glabrata, por lo que la identificación molecular de los aislamientos atípicos de Candida de muestras clínicas relevantes es indispensable. Además, está justificado el estudio in vitro de la sensibilidad a los antifúngicos, aunque en el caso clínico que presentamos el tratamiento con caspofungina fue eficaz.
Conflicto de interesesLos autores no tienen potenciales conflictos de intereses que declarar.