Avaliar prevalência, espirometria e fatores de risco para asma em escolares que foram recém‐nascidos de muito baixo peso com e sem displasia broncopulmonar.
MétodosEstudo observacional e transversal. Aplicou‐se aos pais e/ou responsáveis o questionário International Study of Asthma and Allergies in Childhood. Foi feito teste cutâneo de hipersensibilidade imediata e espirometria nos escolares.
ResultadosAvaliados 54 escolares que foram recém‐nascidos de muito baixo peso e 43 preencheram critérios para espirometria. A idade na avaliação (displasia broncopulmonar=9,5±0,85; sem displasia broncopulmonar=10,1±0,86 anos) e o peso de nascimento (displasia broncopulmonar=916,7±251,2; sem displasia broncopulmonar=1.171,3±190,5g) foram menores no grupo com displasia broncopulmonar (p<0,05). A prevalência de asma entre os recém‐nascidos de muito baixo peso foi de 17/54 (31,5%); no grupo com displasia broncopulmonar, de 6/18 (33,3%). Houve associação entre uso de cobertor de lã no primeiro ano de vida (p=0,026) com presença de asma na idade escolar. O teste cutâneo de hipersensibilidade imediata foi positivo em 13/17 (76,5%) e 23/37 (62,2%) nos grupos com e sem asma, respectivamente. Os escolares com asma apresentaram menores valores em z‐score do fluxo expiratório forçado entre 25% e 75% da capacidade vital forçada (n=16; −1,04±1,19) comparados com os do grupo de pacientes sem asma (n=27; −0,38±0,93) (p=0,049). Não houve diferença entre as variáveis da espirometria no grupo com relação à presença ou não de displasia broncopulmonar.
ConclusõesOs recém-nascidos de muito baixo peso, com e sem displasia broncopulmonar, apresentaram prevalência elevada de asma (33,3% e 30,6%, respectivamente). Os fluxos pulmonares das pequenas vias aéreas foram menores nos escolares com asma.
to assess the prevalence, spirometry findings and risk factors for asthma in schoolchildren who were very low birth weight infants with and without bronchopulmonary dysplasia.
MethodsObservational and cross‐sectional study. The parents and/or tutors answered the International Study of Asthma and Allergies in Childhood questionnaire. The schoolchildren were submitted to the skin prick test and spirometry assessment.
Results54 schoolchildren who were very low birth weight infants were assessed and 43 met the criteria for spirometry. Age at the assessment (bronchopulmonary dysplasia=9.5±0.85; without bronchopulmonary dysplasia=10.1±0.86 years) and birth weight (bronchopulmonary dysplasia=916.7±251.2; without bronchopulmonary dysplasia=1,171.3±190.5g) were lower in the group with bronchopulmonary dysplasia (p<0.05). The prevalence of asthma among very low birth weight infants was 17/54 (31.5%), being 6/18 (33.3%) in the group with bronchopulmonary dysplasia. There was an association between wool blanket use in the first year of life (p=0.026) with the presence of asthma at school age. The skin prick test was positive in 13/17 (76.5%) and 23/37 (62.2%) of patients with and without asthma, respectively. The schoolchildren with asthma had lower z‐score values of forced expiratory flow between 25% and 75% of forced vital capacity (n=16; −1.04±1.19) when compared to the group of patients without asthma (n=27; −0.38±0.93) (p=0.049). There was no difference between the spirometry variables in the groups regarding the presence or absence of bronchopulmonary dysplasia.
ConclusionsVery low birth weight infants with and without bronchopulmonary dysplasia showed a high prevalence of asthma (33.3% and 30.6%, respectively). Pulmonary flow in the small airways was lower in children with asthma.
A partir de 1960, com a melhoria da assistência perinatal, houve redução da mortalidade de recém‐nascidos (RN) com peso de nascimento (PN) inferior a 1.500g, denominados de RN de muito baixo peso (RNMBP).1 Em contrapartida, houve aumento das complicações decorrentes da prematuridade e a mais grave complicação da prematuridade é a displasia broncopulmonar (DBP), a mais precoce das doenças pulmonares obstrutivas crônicas que afetam o ser humano.1
Nesse período, a prevalência da DBP é elevada e aumenta à medida que diminuem a idade gestacional e o PN.2 A DBP acomete 30% dos RNMBP<1.000g, 52% com peso entre 501‐750g e 7% com peso entre 1.251‐1500g.2,3
A prematuridade se manifesta com desequilíbrio imunológico, maior predisposição a infecções virais4,5 e absorção a alérgenos.6 Os RN com DBP apresentam inflamação crônica pulmonar, que predispõe a infecções e internações. Esses fatores de risco podem estar associados à prevalência de sibilos em lactentes2 e asma na infância e adolescência.7‐14
Crianças com DBP têm alta prevalência de sibilância recorrente.6 Em contrapartida, os efeitos da DBP no aparecimento de atopia, asma e/ou sibilância recorrente em idades mais avançadas apresentam resultados controversos.3,4,9,13,15,16 O efeito da DBP na função pulmonar em longo prazo tem sido avaliado em numerosas faixas etárias, incluindo RN,17 lactentes,18 pré‐escolares,19 escolares,7‐11 adolescentes12‐14 e adultos.20‐22 Os estudos mostram volumes pulmonares reduzidos nas diferentes faixas etárias, porém com baixa associação com sintomas clínicos. Fato ainda não explicado na literatura.
A asma é uma doença de grande importância na saúde pública mundial.23 A prevalência varia de 2,1%‐32,2% e 4,1%‐32,1% em escolares e adolescentes, respectivamente.23 Porém os estudos ainda não conseguem definir qual é o fator de risco de maior importância para a asma na infância nos RNMBP: se é a prematuridade propriamente dita ou DBP.
Considerando que cada vez mais os prematuros apresentam evolução favorável e que há poucos estudos no Brasil sobre prevalência de asma em prematuros, com e sem DBP,7,22 o objetivo do presente estudo foi determinar a presença de asma e atopia em crianças nascidas com muito baixo peso na idade escolar e avaliar a função pulmonar por meio da espirometria, de acordo com a presença ou não de DBP.
MétodoEstudo observacional e transversal aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário (n° 569/2010 e n° 605/2010). Todos os pais e/ou responsáveis legais assinaram o termo de consentimento livre e esclarecido. Inicialmente foram selecionados todos os prontuários dos RNMBP nascidos entre 10/2000 e 11/2004 no hospital universitário. Foram excluídos os óbitos e aqueles com doenças crônicas, doenças genéticas, anel vascular, hérnia diafragmática, sequestro pulmonar, deformidade da caixa torácica e discinesia ciliar.
O diagnóstico de DBP foi definido nos RN que aos 28 dias de vida apresentavam insuficiência respiratória e encontravam‐se dependentes de oxigênio em concentrações acima de 21% para manter a pressão parcial de oxigênio >50mmHg.1 Foram considerados dois grupos: com e sem DBP.
Fizeram‐se contatos telefônicos para participação na pesquisa dos escolares entre 7 e 12 anos. Os critérios de exclusão, anteriormente citados, foram aplicados novamente. Foi feita entrevista pessoalmente com os pais e/ou responsáveis legais que responderam aos questionários escritos International Study of Asthma and Allergies in Childhood (ISAAC) fase I (QI) e ISAAC complementar fase II (QIC).23 Os fatores de risco avaliados pelo QIC23 no primeiro ano de vida e no último ano foram: tempo de aleitamento, irmãos mais velhos (independentemente da presença de atopia e/ou asma), idade de início na creche ou escola primária, atopia em pai e mãe, contato com animais dentro e fora do domicílio, tabagismo na casa e materno atual, pré‐ e pós‐natal, mofo nas paredes, tipo de piso, travesseiro, coberta e residir em zona rural ou urbana. Questões sobre antecedentes familiares de atopia em irmãos, pais e avós, pneumonias, dermatite atópica, rinite alérgica, bronquiolite, doenças cardíacas, internações, alergia a medicamentos, medicação para asma de alívio e rotina foram adicionalmente feitas.
Asma foi definida pelas respostas afirmativas para a questão dois do QI: “Nos últimos 12 meses seu filho (a) teve sibilos (chiado no peito)?” Essa pergunta apresenta sensibilidade de 100%, especificidade de 78%, valor preditivo positivo de 73% e valor preditivo negativo de 100% para o diagnóstico de asma.23 A prevalência de asma grave foi considerada para aqueles que responderam sim a pelo menos duas das questões do QI:23 “Nos últimos 12 (doze) meses, quantas crises de sibilos (chiado no peito) seu filho(a) teve?”; “Nos últimos 12 (doze) meses, com que frequência seu filho(a) teve o sono perturbado por chiado no peito?”; “Nos últimos 12 (doze) meses, o chiado de seu filho(a) foi tão forte a ponto de impedir que ele(a) conseguisse dizer mais de duas palavras entre cada respiração?” ou “Nos últimos 12 (doze) meses, seu filho(a) já teve chiado no peito após exercícios físicos?”
Os participantes foram submetidos a exame clínico, teste cutâneo de hipersensibilidade imediata (TCHI), espirometria e medida da hiper‐reatividade brônquica (HRB) pela concentração de metacolina que produzia queda de 20% nos valores do volume expiratório forçado no primeiro segundo (VEF1) na espirometria (PC20 de metacolina). Todos os procedimentos foram feitos no laboratório de fisiologia pulmonar do Centro de Investigação em Pediatria da Faculdade de Ciências Médicas.
O TCHI foi feito pela técnica de puntura23 no antebraço, com puntores plásticos (Alergoprick‐Flexor®, Sertãozinho, SP, Brasil). Usou‐se um conjunto de puntores para cada criança e um puntor para cada extrato. Usaram‐se extratos purificados glicerinados a 50% da IPI‐ASAC® (São Paulo, SP, Brasil): Dermatophagoides pteronyssinus, D. farinae, Blomia tropicalis, Blatella germanica, mix de fungos (Alternaria alternata, Cladosporodium herbarum, Aspergilus fumigatus e Penicilium), Canis familiaris, Felis domesticus, controles: positivo (histamina) e negativo (solução fisiológica 0,9%). Os resultados foram aferidos após 15min e considerados positivas as reações ≥3mm para pápula, com controle negativo não reagente e controle positivo com pápula ≥3mm.23 A atopia foi considerada pela presença de resposta positiva no TCHI.
Na espirometria avaliaram‐se a capacidade vital forçada (CVF), VEF1, índice de Tiffeneau (VEF1/CVF) e fluxo expiratório médio entre 25 e 75% da CVF (FEF 25%‐75%). Usou‐se espirômetro modelo CPFS/D (Medical‐Graphics, Saint‐Paul, Minessota, EUA). A espirometria seguiu as recomendações da European Respiratory Society (ERS) e American Thoracic Society (ATS).24 A criança fez o teste em pé e usou o clipe nasal, com manobra aberta. Foi solicitada à criança manobra expiratória vigorosa e prolongada até atingir o critério de reprodutibilidade do software de espirometria: Breeze PF versão 3.8 for Windows 95/98/NT. A avaliação de CVF, VEF1, VEF1/CVF e FEF 25%‐75% foi feita segundo as equações padrões referências de Quanjer et al.,24 baseados em idade, sexo, peso e etnia. Definiram‐se como obstrução das vias aéreas valores de VEF1/CVF abaixo do limite inferior da normalidade e para gravidade o z‐score do VEF1%, aceitaram‐se duas categorias: (i) obstrução leve: z‐score≥−2 ou 70% do previsto; (ii) obstrução moderada: −2,5≤z‐score<−2,0 ou 60%‐69% do previsto.24,25
A medida da HRB seguiu as recomendações da ERS/ATS.24 Fizeram‐se nebulizações com Acetyl‐beta‐methylcoline (Methacoline‐Chloride) (código A2251, Sigma) com as diluições em mg/mL: 0,125; 0,25; 0,5; 1; 2; 4; 8; 16 e 32. Feita espirometria inicial e um minuto após cada nebulização com metacolina. A prova foi interrompida ao atingir queda ≥20% do VEF1 basal. Em seguida cada sujeito recebeu salbutamol inalatório: quatro jatos de 100mcg e após 30 minutos obteve‐se o último registro de VEF1. O teste foi considerado positivo quando a queda de 20% do VEF1 ocorreu abaixo de 4mg de metacolina. Graduada em leve: (i) 1‐4mg/mL de metacolina; (ii) moderada a grave nas concentrações <1mg/mL.
Os dados foram processados pelo programa Statistical Package for the Social Sciences versão 16.0 (SPSS Inc., Chicago‐USA) e Epi‐Info 6.04b (CDC‐USA). Para comparar as proporções empregou‐se o teste do χ2 ou, quando indicado, o teste exato de Fisher para tabelas com distribuição 2×2 ou exato de Fisher‐Freeman‐Halton para as tabelas maiores. No caso do teste de Fisher‐Freeman‐Halton, a probabilidade bilateral foi estimada pelo método Monte Carlo. Para comparação das médias de dois grupos independentes, empregou‐se o teste t de Student. As prevalências e os respectivos intervalos de confiança de 95% foram calculados pelo método exato (distribuição binominal) com o emprego da rotina Epitable do software Epi‐Info. A odds ratio (OR) e o respectivo intervalo de confiança de 95% da asma em relação à DBP foram determinados com o emprego da rotina StatCalc do software Epi‐Info. Determinaram‐se os valores de média, desvio padrão, mínimo e máximo das variáveis quantitativas dos pacientes em relação ao diagnóstico de asma e BDP. Adotou‐se o nível de significância de p<0,05.
Para o presente estudo o poder da amostra calculado pelo programa G*Power 3.1.9.2, que teve como parâmetro o grupo de pacientes com asma, para o teste exato de Fisher apresentou poder da amostra maior do que 0.8003402, acima do valor de corte de 80%. O cálculo do poder amostral foi feito após o estudo.
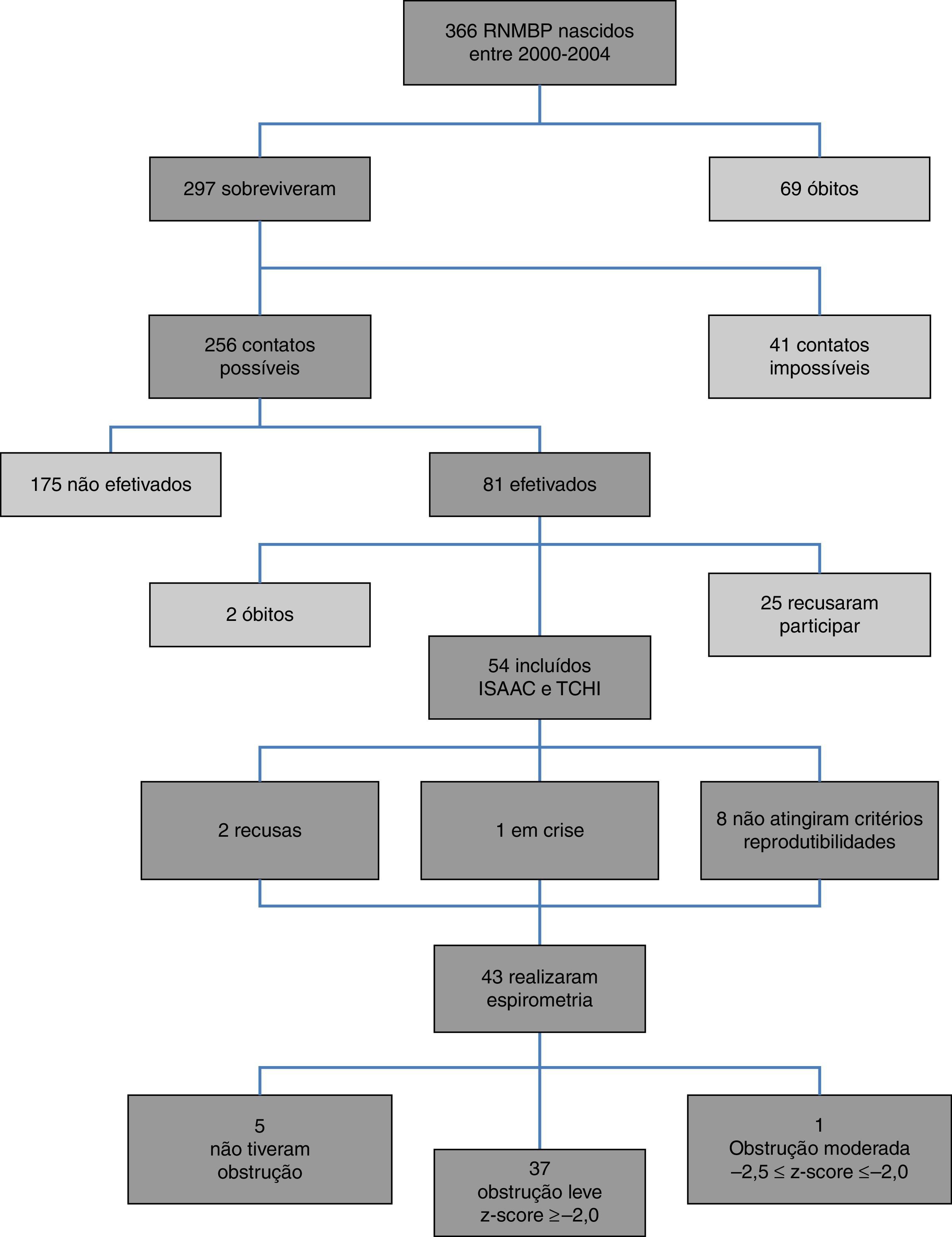
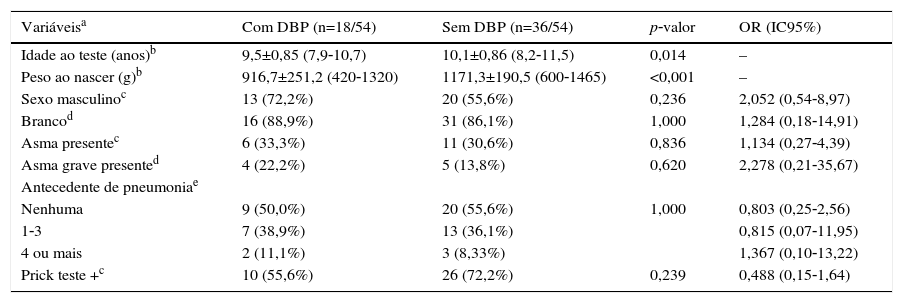
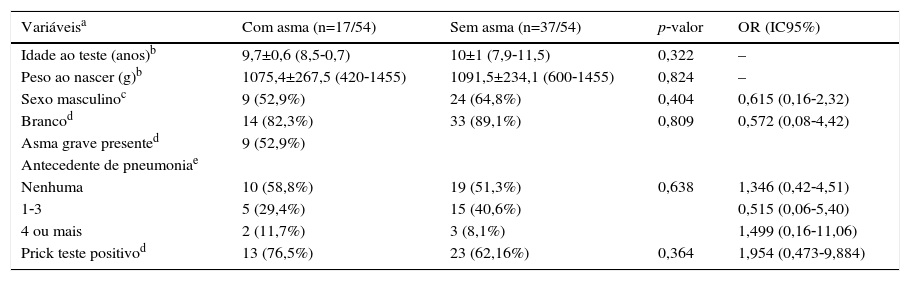
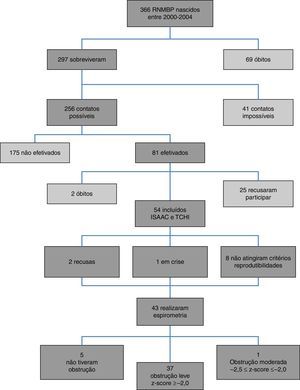
ResultadosO diagrama de fluxo de inclusão está apresentado na figura 1. Dos 54 pacientes incluídos, 33/54 (61,1%) eram masculinos, com 9,9±0,92 anos, e 21/54 (38,9%) femininos, com 9,9±0,90 anos (p=0,810). Os RNMBP masculinos e femininos tiveram PN semelhantes: 1.065,1±243,8g e 1.120±243g, respectivamente (p=0,423). Houve maior prevalência de brancos (47/54‐87%). A tabela 1 apresenta as características dos RNMBP com DBP. A idade no momento do estudo foi menor no grupo com DBP (p=0,014). Na tabela 2 estão as características dos RNMBP com e sem asma.
Caracterização da população de nascidos com peso inferior a 1.500g considerando a presença de displasia bronco pulmonar (DBP)
| Variáveisa | Com DBP (n=18/54) | Sem DBP (n=36/54) | p‐valor | OR (IC95%) |
|---|---|---|---|---|
| Idade ao teste (anos)b | 9,5±0,85 (7,9‐10,7) | 10,1±0,86 (8,2‐11,5) | 0,014 | – |
| Peso ao nascer (g)b | 916,7±251,2 (420‐1320) | 1171,3±190,5 (600‐1465) | <0,001 | – |
| Sexo masculinoc | 13 (72,2%) | 20 (55,6%) | 0,236 | 2,052 (0,54‐8,97) |
| Brancod | 16 (88,9%) | 31 (86,1%) | 1,000 | 1,284 (0,18‐14,91) |
| Asma presentec | 6 (33,3%) | 11 (30,6%) | 0,836 | 1,134 (0,27‐4,39) |
| Asma grave presented | 4 (22,2%) | 5 (13,8%) | 0,620 | 2,278 (0,21‐35,67) |
| Antecedente de pneumoniae | ||||
| Nenhuma | 9 (50,0%) | 20 (55,6%) | 1,000 | 0,803 (0,25‐2,56) |
| 1‐3 | 7 (38,9%) | 13 (36,1%) | 0,815 (0,07‐11,95) | |
| 4 ou mais | 2 (11,1%) | 3 (8,33%) | 1,367 (0,10‐13,22) | |
| Prick teste +c | 10 (55,6%) | 26 (72,2%) | 0,239 | 0,488 (0,15‐1,64) |
DBP, displasia broncopulmonar; g, gramas; n, número de pacientes; OR, odds ratio; IC95%, intervalo de confiança de 95%.
Os dados para variáveis com distribuição categórica estão representados como número de pacientes com a variável/número total de indivíduos incluídos no grupo e porcentagem referente à variável analisada dentro dos grupos possíveis; os dados com distribuição numérica estão apresentados pela média±desvio padrão; mínimo‐máximo.
Caracterização da população de nascidos com peso inferior a 1.500g considerando a presença de asma
| Variáveisa | Com asma (n=17/54) | Sem asma (n=37/54) | p‐valor | OR (IC95%) |
|---|---|---|---|---|
| Idade ao teste (anos)b | 9,7±0,6 (8,5‐0,7) | 10±1 (7,9‐11,5) | 0,322 | – |
| Peso ao nascer (g)b | 1075,4±267,5 (420‐1455) | 1091,5±234,1 (600‐1455) | 0,824 | – |
| Sexo masculinoc | 9 (52,9%) | 24 (64,8%) | 0,404 | 0,615 (0,16‐2,32) |
| Brancod | 14 (82,3%) | 33 (89,1%) | 0,809 | 0,572 (0,08‐4,42) |
| Asma grave presented | 9 (52,9%) | |||
| Antecedente de pneumoniae | ||||
| Nenhuma | 10 (58,8%) | 19 (51,3%) | 0,638 | 1,346 (0,42‐4,51) |
| 1‐3 | 5 (29,4%) | 15 (40,6%) | 0,515 (0,06‐5,40) | |
| 4 ou mais | 2 (11,7%) | 3 (8,1%) | 1,499 (0,16‐11,06) | |
| Prick teste positivod | 13 (76,5%) | 23 (62,16%) | 0,364 | 1,954 (0,473‐9,884) |
g, gramas; n, número de pacientes; OR, odds ratio; IC95%, intervalo de confiança de 95%.
Os dados para variáveis com distribuição categórica estão representados como número de pacientes com a variável/número total de indivíduos incluídos no grupo e porcentagem referente à variável analisada dentro dos grupos possíveis; os dados com distribuição numérica estão apresentados pela média±desvio padrão; mínimo‐máximo.
A prevalência de asma nos RNMBP foi de 17/54 (31,5%). No grupo com e sem DBP houve prevalência semelhante, respectivamente 6/18 (33,3%) e 11/36 (30,6%) (p=0,836) (tabelas 1 e 2).
O PN no grupo com DBP (916,7±251,2g) foi menor do que no grupo sem DBP (1.171,3±190,5g) (p<0,001). Não houve associação entre DBP e gravidade da asma (p=0,620), assim como entre DBP e número de pneumonias (p=1,0) (tabela 1).
O TCHI foi positivo em 10/18 (55,6%) e 26/36 (72,2%) no grupo com e sem DBP, respectivamente (p=0,239) (tabela 1). Enquanto que no grupo com e sem asma o TCHI foi positivo em 13/17 (76,5%) e 23/37 (62,2%) respectivamente (p=0,364) (tabela 2). Em ambos os casos não houve associação positiva.
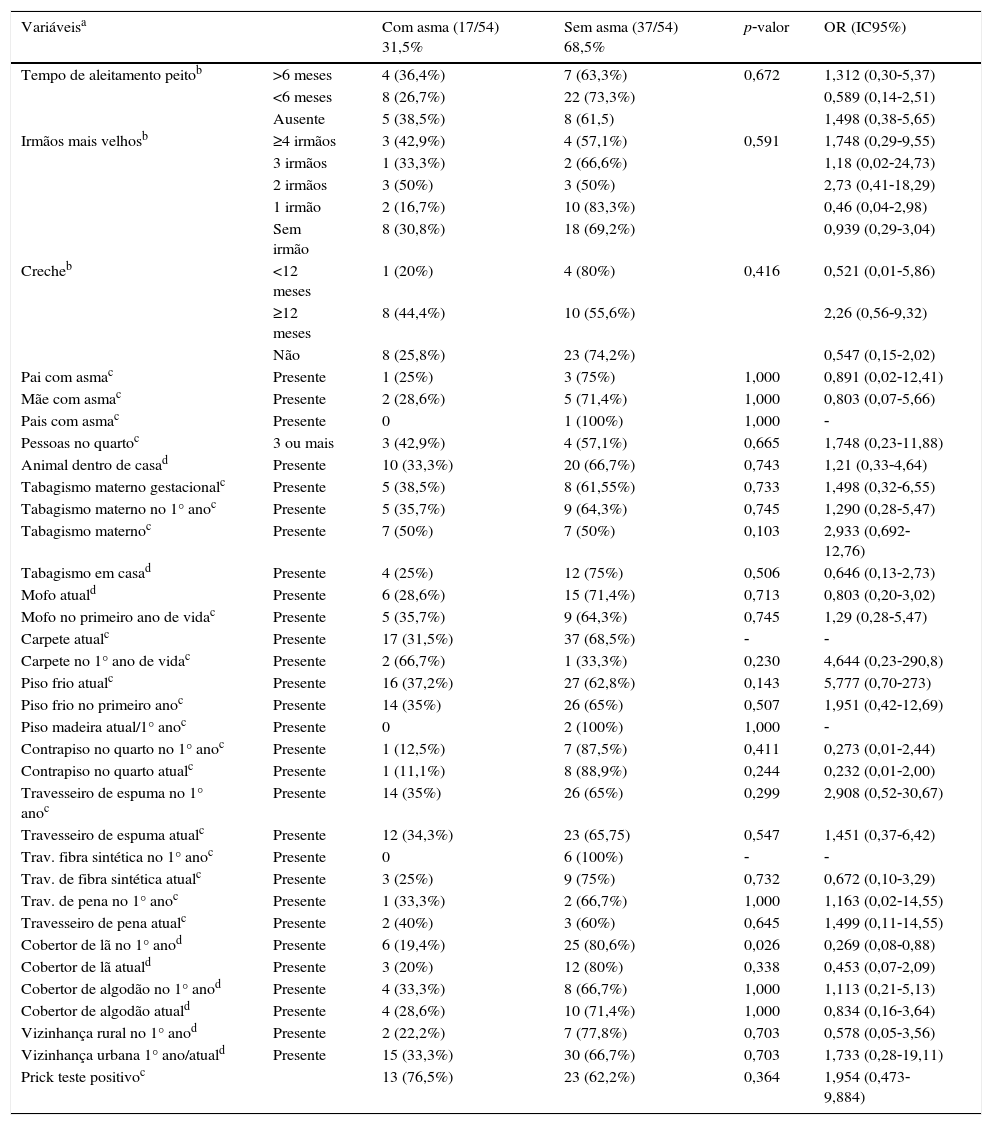
Dentre as variáveis analisadas para o questionário ISAAC foi encontrada associação para o uso de cobertor de lã no primeiro ano de vida (p=0,026) [(Com asma e cobertor de lã: 6/17 indivíduos com asma) e (sem asma e com cobertor de lã: 25/37 indivíduos sem asma); OR=0,269; IC95%=0,08‐0,088].
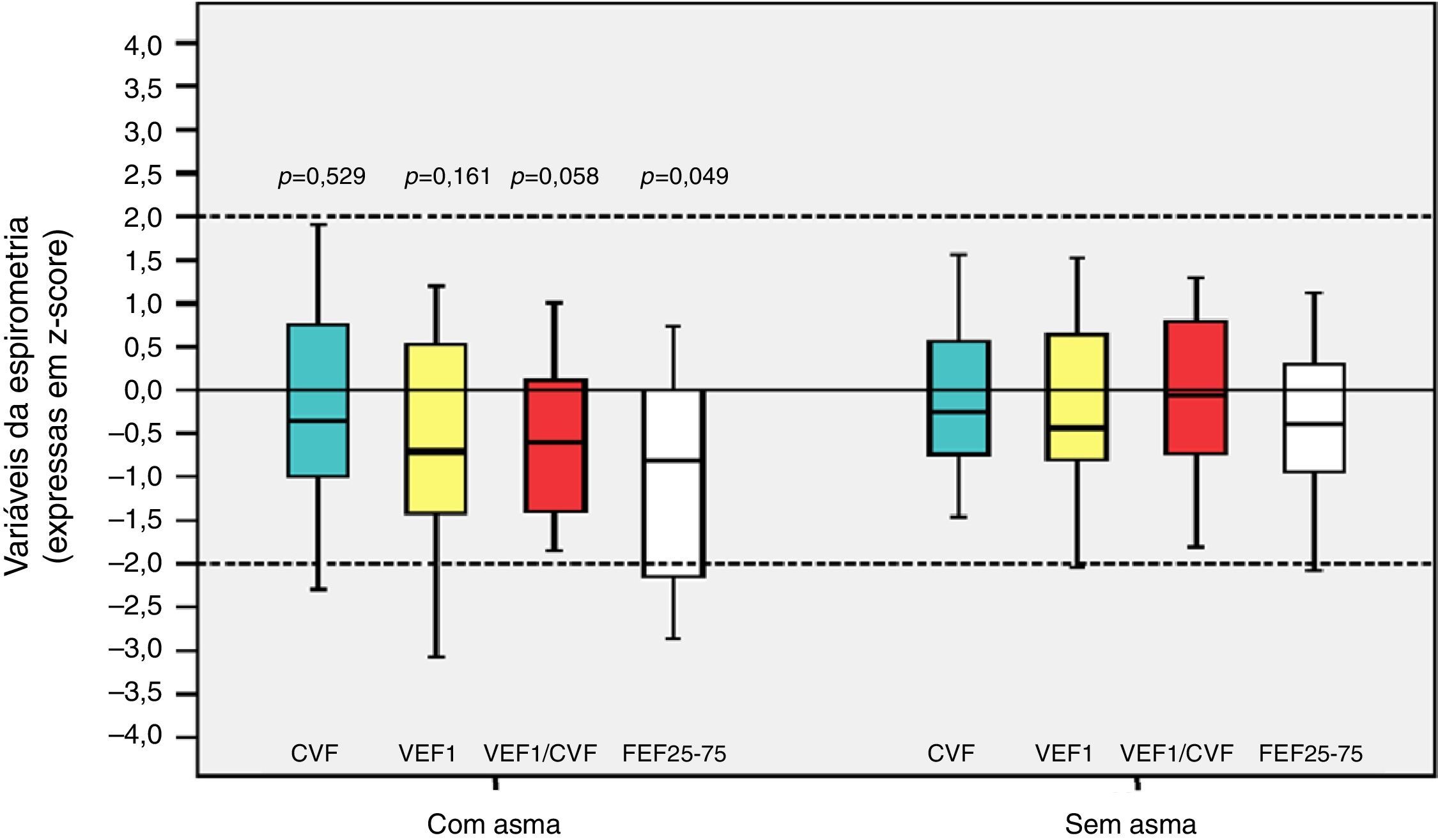
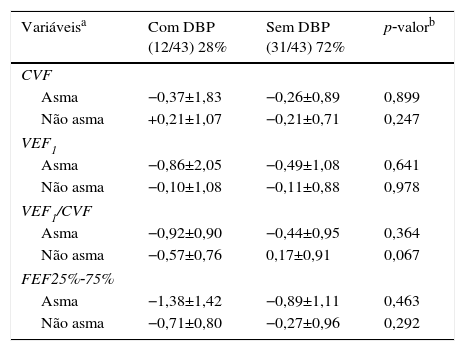
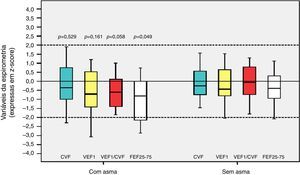
Entre os 43 escolares e adolescentes que fizeram a espirometria, cinco não apresentaram obstrução, 37 obstrução leve e um adolescente apresentou obstrução moderada.24 A tabela 3 apresenta a distribuição do z‐score dos valores da espirometria dos pacientes com e sem DBP em relação aos que desenvolveram ou não asma. A média do z‐score do FEF25%‐75% no grupo com asma (−1,04±1,19) foi menor do que no grupo sem asma (−0,38±0,82) (p=0,049) (fig. 2). Não houve diferença entre as variáveis da espirometria no grupo com relação à presença ou não de DBP, assim como em relação à presença ou não de asma.
Distribuição do z‐escore da espirometria (CVF, VEF1, VEF1/CVF e FEF25%‐75%) dos escolares e adolescentes que foram recém‐nascidos de muito baixo peso (RNMBP) com e sem displasia broncopulmonar (DBP) em relação aos que desenvolveram ou não asma
| Variáveisa | Com DBP (12/43) 28% | Sem DBP (31/43) 72% | p‐valorb |
|---|---|---|---|
| CVF | |||
| Asma | −0,37±1,83 | −0,26±0,89 | 0,899 |
| Não asma | +0,21±1,07 | −0,21±0,71 | 0,247 |
| VEF1 | |||
| Asma | −0,86±2,05 | −0,49±1,08 | 0,641 |
| Não asma | −0,10±1,08 | −0,11±0,88 | 0,978 |
| VEF1/CVF | |||
| Asma | −0,92±0,90 | −0,44±0,95 | 0,364 |
| Não asma | −0,57±0,76 | 0,17±0,91 | 0,067 |
| FEF25%‐75% | |||
| Asma | −1,38±1,42 | −0,89±1,11 | 0,463 |
| Não asma | −0,71±0,80 | −0,27±0,96 | 0,292 |
| Variáveis | Com asma (16/43) 37,2% | Sem asma (27/43) 62,8% | p‐valorb |
|---|---|---|---|
| CVF | |||
| DBP | −0,37±1,83 | +0,21±1,07 | 0,230 |
| Não DBP | −0,26±0,89 | −0,21±0,71 | 0,776 |
| VEF1 | |||
| DBP | −0,86±2,05 | −0,10±1,08 | 0,412 |
| Não DBP | −0,49±1,08 | −0,11±0,88 | 1,000 |
| VEF1/CVF | |||
| DBP | −0,92±0,90 | −0,57±0,76 | 0,648 |
| Não DBP | −0,44±0,95 | 0,17±0,91 | 0,066 |
| FEF25%‐75% | |||
| DBP | −1,38±1,42 | −0,71±0,80 | 0,527 |
| Não DBP | −0,89±1,11 | −0,27±0,96 | 0,244 |
CVF, capacidade vital forçada; DBP, displasia broncopulmonar; FEF25%‐75%, fluxo expiratório médio entre 25% e 75% da CVF; VEF1, volume expiratório forçado no primeiro segundo; VEF1/CVF, relação entre VEF1 e CVF.
Os dados para variáveis com distribuição categórica estão representados como número de pacientes com a variável/número total de indivíduos incluídos no grupo e porcentagem referente à variável analisada dentro dos grupos possíveis; os dados com distribuição numérica estão apresentados pela média±desvio padrão.
Distribuição dos escores z em relação à asma nos escolares e adolescentes que foram recém‐nascidos de muito baixo peso (RNMBP) para variáveis da espirometria. CVF, capacidade vital forçada; VEF1, volume expiratório forçado no primeiro segundo; VEF1/CVF, relação entre VEF1 e CVF; e FEF25%‐75%, fluxo expiratório médio entre 25% e 75% da CVF; p, valor do p. As medianas estão presentes como linhas horizontais que dividem os retângulos, que contêm 50% dos valores. As barras se estendem aos valores máximos e mínimos. Teste t de Student bilateral.
Os valores da PC20 de metacolina no grupo de RNMBP com asma foram menores do que para o grupo sem asma (p=0,022). Em contrapartida, os valores da PC20 de metacolina entre os RNMBP com e sem DBP foram semelhantes (p=0,72). Os dados, considerando as variáveis do ISAAC e a presença de asma, estão descritos na tabela 4 e na tabela 5 temos a descrição da gravidade da asma com a DBP e o PN.
Fatores de risco do ISAAC nos recém‐nascidos de muito baixo peso com e sem asma
| Variáveisa | Com asma (17/54) 31,5% | Sem asma (37/54) 68,5% | p‐valor | OR (IC95%) | |
|---|---|---|---|---|---|
| Tempo de aleitamento peitob | >6 meses | 4 (36,4%) | 7 (63,3%) | 0,672 | 1,312 (0,30‐5,37) |
| <6 meses | 8 (26,7%) | 22 (73,3%) | 0,589 (0,14‐2,51) | ||
| Ausente | 5 (38,5%) | 8 (61,5) | 1,498 (0,38‐5,65) | ||
| Irmãos mais velhosb | ≥4 irmãos | 3 (42,9%) | 4 (57,1%) | 0,591 | 1,748 (0,29‐9,55) |
| 3 irmãos | 1 (33,3%) | 2 (66,6%) | 1,18 (0,02‐24,73) | ||
| 2 irmãos | 3 (50%) | 3 (50%) | 2,73 (0,41‐18,29) | ||
| 1 irmão | 2 (16,7%) | 10 (83,3%) | 0,46 (0,04‐2,98) | ||
| Sem irmão | 8 (30,8%) | 18 (69,2%) | 0,939 (0,29‐3,04) | ||
| Crecheb | <12 meses | 1 (20%) | 4 (80%) | 0,416 | 0,521 (0,01‐5,86) |
| ≥12 meses | 8 (44,4%) | 10 (55,6%) | 2,26 (0,56‐9,32) | ||
| Não | 8 (25,8%) | 23 (74,2%) | 0,547 (0,15‐2,02) | ||
| Pai com asmac | Presente | 1 (25%) | 3 (75%) | 1,000 | 0,891 (0,02‐12,41) |
| Mãe com asmac | Presente | 2 (28,6%) | 5 (71,4%) | 1,000 | 0,803 (0,07‐5,66) |
| Pais com asmac | Presente | 0 | 1 (100%) | 1,000 | ‐ |
| Pessoas no quartoc | 3 ou mais | 3 (42,9%) | 4 (57,1%) | 0,665 | 1,748 (0,23‐11,88) |
| Animal dentro de casad | Presente | 10 (33,3%) | 20 (66,7%) | 0,743 | 1,21 (0,33‐4,64) |
| Tabagismo materno gestacionalc | Presente | 5 (38,5%) | 8 (61,55%) | 0,733 | 1,498 (0,32‐6,55) |
| Tabagismo materno no 1° anoc | Presente | 5 (35,7%) | 9 (64,3%) | 0,745 | 1,290 (0,28‐5,47) |
| Tabagismo maternoc | Presente | 7 (50%) | 7 (50%) | 0,103 | 2,933 (0,692‐12,76) |
| Tabagismo em casad | Presente | 4 (25%) | 12 (75%) | 0,506 | 0,646 (0,13‐2,73) |
| Mofo atuald | Presente | 6 (28,6%) | 15 (71,4%) | 0,713 | 0,803 (0,20‐3,02) |
| Mofo no primeiro ano de vidac | Presente | 5 (35,7%) | 9 (64,3%) | 0,745 | 1,29 (0,28‐5,47) |
| Carpete atualc | Presente | 17 (31,5%) | 37 (68,5%) | ‐ | ‐ |
| Carpete no 1° ano de vidac | Presente | 2 (66,7%) | 1 (33,3%) | 0,230 | 4,644 (0,23‐290,8) |
| Piso frio atualc | Presente | 16 (37,2%) | 27 (62,8%) | 0,143 | 5,777 (0,70‐273) |
| Piso frio no primeiro anoc | Presente | 14 (35%) | 26 (65%) | 0,507 | 1,951 (0,42‐12,69) |
| Piso madeira atual/1° anoc | Presente | 0 | 2 (100%) | 1,000 | ‐ |
| Contrapiso no quarto no 1° anoc | Presente | 1 (12,5%) | 7 (87,5%) | 0,411 | 0,273 (0,01‐2,44) |
| Contrapiso no quarto atualc | Presente | 1 (11,1%) | 8 (88,9%) | 0,244 | 0,232 (0,01‐2,00) |
| Travesseiro de espuma no 1° anoc | Presente | 14 (35%) | 26 (65%) | 0,299 | 2,908 (0,52‐30,67) |
| Travesseiro de espuma atualc | Presente | 12 (34,3%) | 23 (65,75) | 0,547 | 1,451 (0,37‐6,42) |
| Trav. fibra sintética no 1° anoc | Presente | 0 | 6 (100%) | ‐ | ‐ |
| Trav. de fibra sintética atualc | Presente | 3 (25%) | 9 (75%) | 0,732 | 0,672 (0,10‐3,29) |
| Trav. de pena no 1° anoc | Presente | 1 (33,3%) | 2 (66,7%) | 1,000 | 1,163 (0,02‐14,55) |
| Travesseiro de pena atualc | Presente | 2 (40%) | 3 (60%) | 0,645 | 1,499 (0,11‐14,55) |
| Cobertor de lã no 1° anod | Presente | 6 (19,4%) | 25 (80,6%) | 0,026 | 0,269 (0,08‐0,88) |
| Cobertor de lã atuald | Presente | 3 (20%) | 12 (80%) | 0,338 | 0,453 (0,07‐2,09) |
| Cobertor de algodão no 1° anod | Presente | 4 (33,3%) | 8 (66,7%) | 1,000 | 1,113 (0,21‐5,13) |
| Cobertor de algodão atuald | Presente | 4 (28,6%) | 10 (71,4%) | 1,000 | 0,834 (0,16‐3,64) |
| Vizinhança rural no 1° anod | Presente | 2 (22,2%) | 7 (77,8%) | 0,703 | 0,578 (0,05‐3,56) |
| Vizinhança urbana 1° ano/atuald | Presente | 15 (33,3%) | 30 (66,7%) | 0,703 | 1,733 (0,28‐19,11) |
| Prick teste positivoc | 13 (76,5%) | 23 (62,2%) | 0,364 | 1,954 (0,473‐9,884) |
ISAAC, International Study of Asthma and Allergies in Childhood; OR, odds ratio; IC95%, intervalo de confiança 95%.
Teste t de Student.
Caracterização da população de nascidos com peso inferior a 1.500 g considerando a gravidade da asma
| Variáveisa | Asma grave | Asma leve | p‐valor | OR (IC95%) |
|---|---|---|---|---|
| Peso ao nascimento (g)b | 1076,44±341,98; 1150 (420‐1455) | 1074,25±172,83; 1063 (805‐1295) | 0,987 | |
| DBP (presente)c | 4 (66,7%) | 2 (33,3%) | 0,620 | 2,278 (0,21‐35,67) |
g, gramas; OR, odds ratio; IC95%, intervalo de confiança 95%.
Os dados para variáveis com distribuição categórica estão representados como número de pacientes com a variável/número total de indivíduos incluídos no grupo e porcentagem referente a variável analisada dentro dos grupos possíveis; os dados com distribuição numérica estão apresentados pela média±desvio padrão; mediana (mínimo‐máximo).
O presente estudo evidenciou prevalência elevada de asma em RNMBP, na idade escolar, independentemente da presença ou não de DBP e fatores de risco associados. Estudos que buscam analisar a influência de doenças pulmonares no início da vida e repercussões na adolescência e na vida adulta têm aumentado nas últimas décadas. Muitos desses estudos tentam responder à pergunta se a DBP e/ou a prematuridade são fatores de risco para asma.4,11,21,26 Assim como verificado em nosso estudo, outros encontraram maior prevalência de asma em RNMBP quando comparados com a prevalência de asma na população mundial,7,11,19,22,27 com valores para os prematuros extremos entre 26%5,19,27 e 40%.22
Os RN que desenvolvem DBP apresentam alta prevalência de inflamação e diminuição dos fluxos pulmonares na infância e vida adulta.1,4,28 As manifestações inflamatórias iniciais decorrem de suscetibilidade genética, alterações endócrinas, infecções, volutrauma, barotrauma, toxicidade pelo oxigênio e persistência do canal arterial.3 A complexidade da presença e das interações desses fatores, que contribuem para o desenvolvimento e gravidade da DBP, pode afetar em maior ou menor intensidade o crescimento e a função pulmonar.3,4 Em contrapartida, a influência da prematuridade, DBP ou interação de ambas na prevalência de asma permanece controversa.11,21,26 Enquanto a maioria dos estudos exibe associação positiva entre DBP2,7‐14,17,20,22,26 ou prematuridade28,29 como fator de risco para asma, outro não apresenta essa associação.21 Nosso estudo mostrou que a prevalência de asma foi elevada, porém semelhante nos RNMBP que desenvolveram ou não DBP. Possivelmente a prematuridade tenha sido fator mais importante do que a DBP para o desenvolvimento de asma nos escolares em nossa casuística, fato também observado por Bronstron et al.9 Além do nosso estudo, apenas outro não encontrou associação entre DBP e asma. Narang et al. estudaram 110 pacientes aos 21 anos, 60 RN a termo (RNT) e 50 RNMBP, sete tiveram DBP. Esses autores não encontraram diferença entre os RNMBP com e sem DBP em relação à asma.21
Outro fato de interesse é a constatação da influência do sexo na prevalência das doenças pulmonares obstrutivas em crianças e adolescentes. Enquanto os lactentes masculinos apresentam vias aéreas mais estreitas e maior prevalência de sibilância,6 as diferenças na função pulmonar diminuem com o crescimento e chegam a se inverter na adolescência.2 Acredita‐se que isso ocorra devido às alterações hormonais no sexo feminino, com maior risco de asma nessa faixa etária.2 Para os RNMBP do nosso estudo, não houve diferença entre os sexos tanto para a DBP quanto para asma. Esse resultado foi semelhante ao obtido por Fawke et al.,14 que estudaram sintomas respiratórios e função pulmonar em RNMBP aos 11 anos e não verificaram diferenças entre os sexos. Isso justifica que as diferenças na função pulmonar diminuem com a idade, entre os sexos.
A maioria dos autores que estudaram a presença de associação entre prematuridade/DBP e asma futura5,7,8,11,14,15,18,19,27 incluiu fatores de risco do ISAAC23 e índices preditivos para asma (IPA).6 Embora não tenhamos avaliados especificamente os IPA, todas as variáveis neles contidas, com exceção do número de eosinófilos no sangue periférico, foram analisadas e não houve diferenças nos dois grupos estudados. Ressaltam‐se, em nosso estudo, as elevadas prevalências de tabagismo nos pais (25%), a frequência à creche no primeiro ano de vida (50%), a baixa prevalência de aleitamento materno e antecedente materno/paterno para asma em 20% dos escolares. Apesar de a prevalência de asma ter sido elevada, o único fator de risco associado do QIC foi o uso de cobertores de lã no primeiro ano de vida (p=0,026). Esse fato pode refletir maior exposição a fatores alergênicos, que junto a alterações inflamatórias da prematuridade poderiam facilitar o início da asma por sensibilização alérgica precoce.6 Diferentemente dos nossos achados, Palta et al. encontraram maior prevalência de asma em RNMBP com DBP, comparados com os sem DBP. Nesse estudo, o grupo com DBP tinha maior frequência de fatores de risco para asma, o que incluía infecções respiratórias repetidas no primeiro ano de vida, história familiar positiva para asma, tabagismo nos pais e maior renda familiar.7 Kwinta et al. avaliaram fatores de risco para asma em RNMBP que evoluíram com ou sem DBP, comparados com crianças saudáveis nascidas a termo. Verificaram que os RNMBP tinham mais sibilância recorrente (OR=5,38; IC95%=2,14‐13,8) e apresentavam maior prevalência de fatores de risco, como hospitalização e sibilos abaixo de 24 meses.11
Fatores de risco para asma podem ter pesos diferentes em crianças e adolescentes que foram RNMBP ou RNT. Enquanto esses fatores têm sido exaustivamente estudados6 em crianças saudáveis ao nascimento, não existem estudos na mesma proporção em RNMBP. Desse modo, a avalição de grandes coortes de seguimento de RNMBP, com e sem DBP, poderá elucidar se existem ou não diferenças entre eles quanto à exposição a fatores de risco e desenvolvimento de doenças crônicas futuras.
Numerosos pesquisadores buscam verificar se agravos no período neonatal afetam a função pulmonar na infância, adolescência e em idades posteriores.2,4,5,7‐15,17‐22,27 Enquanto a relação entre asma e DBP permanece controversa,4,15 a diminuição da função pulmonar de RNMBP, ao longo da vida, tem sido documentada.8‐10,26,28 Alguns estudos,8,19,20,26 inclusive o nosso, mostraram menores volumes pulmonares nas vias aéreas periféricas em crianças com asma que foram RNMBP. A presença ou não de DBP não aumentou a prevalência de asma nem de obstrução das vias aéreas nos nossos pacientes. Assim, possivelmente a prematuridade tem maior probabilidade de associação com asma do que a DBP.
Gough et al. avaliaram adultos entre 24 a 25 anos que foram RNMBP com e sem DBP. Aqueles com DBP apresentaram duas vezes mais episódios de chiado e usaram três vezes mais medicamentos para asma.22 Um estudo prospectivo demonstrou que, aos 11 anos, RNMBP com DBP tinham menores volumes pulmonares na espirometria e maior resposta ao broncodilatador, em relação aos que não desenvolveram DBP.14 Doyle et al. acompanharam coorte de 147 RNMBP com e sem DBP, avaliados aos 2; 5; 8; 11; 14 e 18 anos. Esses autores observaram que os volumes pulmonares apresentaram maiores quedas entre 8‐18 anos, mais acentuadas no grupo com DBP.8 Recentemente, Von Hove et al. avaliaram os sintomas respiratórios e a função pulmonar de adolescentes que foram RNMBP, 28 com e 28 sem DBP. Concluíram que aqueles com DBP são mais propensos a anormalidades da função pulmonar.12
A maior causa de sibilância recorrente em crianças é a asma atópica. Não encontramos na presente pesquisa associação de alergia, comprovada por história clínica e TCHI, com DBP ou asma. Vários estudos, entre eles a revisão de Peres e Navarro, avaliaram as associações entre prematuridade com e sem DBP com atopia/alergia futura e demonstraram que a DBP não apresenta relação longitudinal com atopia ou HRB.2,3,9,13,30 Um único estudo encontrou associação entre DBP e atopia futura.16 Posteriormente, vários autores não conseguiram evidenciar essa associação em crianças que foram RNMBP.9,13,30
Uma das limitações do nosso estudo e do de Narang et al. foi o baixo número de pessoas recrutadas, comparadas com o número total de elegíveis. Tivemos 25 (30,86%) recusas em participar do estudo entre 7‐12 anos, dentre os sujeitos elegíveis. Em contrapartida, avaliamos os fatores de risco para asma na infância, o que não foi estudado por Narang et al. Outro aspecto é que os nossos pacientes usaram surfactante, enquanto os sujeitos de Narang não usaram.21 Além disso, vale citar como limitação da presente pesquisa a impossibilidade de obter dados da gravidade da DBP, tempo de ventilação mecânica e outros diagnósticos respiratórios no período neonatal. Um aspecto de difícil avaliação e que pode se constituir em viés amostral é se os indivíduos que decidiram participar do nosso estudo teriam maiores morbidades, incluindo a asma, tendo em vista que os RNMBP com DBP tiveram menor PN e eram mais novos no momento do exame.
Considerando o diagnóstico de asma pelo questionário ISAAC, o presente trabalho mostrou que os RNMBP, principalmente os de mais baixo peso, apresentaram maior prevalência de asma, sem diferença com relação à presença de DBP. Pesquisas adicionais que incluam a comparação evolutiva entre lactentes, pré‐escolares e escolares por meio da função pulmonar por espirometria, lung clearence index e lavado broncoalveolar podem responder sobre as diferenças entre a presença de HRB e asma após a prematuridade e DBP. Como essas ferramentas são difíceis de ser usadas na prática clínica, os estudos epidemiológicos de follow‐up e multicêntricos devem ser estimulados para permitir amostras suficientemente adequadas para comparações em análises uni e multivariadas.
Conclui‐se que prematuros com e sem DBP têm maior prevalência de asma na infância e adolescência quando comparamos com dados referenciados na literatura para indivíduos na mesma faixa etária. O impacto da DBP na prevalência e na gravidade da asma permanece controverso.
FinanciamentoO estudo não recebeu financiamento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse
À maternidade do hospital universitário e ao laboratório de fisiologia pulmonar da universidade.