PEPs es un estudio multicéntrico, naturalístico, prospectivo y longitudinal diseñado para evaluar las variables clínicas, neuropsicológicas, de neuroimagen, bioquímicas, ambientales y genéticas en una muestra de casi 350 pacientes con un primer episodio psicótico y 250 controles sanos. El proyecto PEPs ha sido realizado en España desde enero de 2009 hasta diciembre de 2011.
En este artículo se describe la justificación de los métodos de evaluación adoptados, proporcionando una breve descripción de las medidas clínicas y funcionales seleccionadas. Los objetivos principales son: a) el examen clínico y la caracterización neuropsicológica de una muestra de primeros episodios de psicosis, y b) el estudio de las interacciones entre las variables genéticas y ambientales seleccionadas para predecir los resultados clínicos y de estructura cerebral y determinar la relación de polimorfismos genéticos implicados en la farmacocinética y la farmacodinámica, y la respuesta en los efectos adversos del tratamiento.
The PEPs study is a multicenter, naturalistic, prospective, longitudinal study designed to evaluate clinical, neuropsychological, neuroimaging, biochemical, environmental and pharmacogenetic variables in a sample of nearly 350 first episode of psychosis patients and 250 healthy controls. The PEPs project was conducted in Spain from January 2009 to December 2011.
This article describes the rationale for the measurement approach adopted, providing an overview of the selected clinical and functional measures. The main objectives are: a) the thorough clinical and neurocognitive characterization of a sample of first episodes of psychosis, and b) the study of the interactions between the genetic and environmental variables selected to predict clinical and brain structural outcomes, and to determine the relationship of genetic polymorphisms involved in the pharmacokinetics and pharmacodynamics, and the responses and adverse effects of treatment.
El episodio psicótico se caracteriza por la presencia de síntomas afectivos y cognitivos de índole positiva (delirios, alucinaciones y conducta extraña) y también, con frecuencia, de índole negativa (apatía y alogia, por ejemplo).
Alrededor del 3% de la población general sufre un episodio psicótico a lo largo de su vida1. El primer episodio de psicosis (PEP) suele ocurrir entre los 15 y los 30 años. En estas edades, las habilidades académicas, profesionales y sociales están en momentos de gran expansión. En los varones, la edad de aparición suele ser más temprana. La aparición precoz se asocia con una mayor carga genética, un deterioro cognitivo grave y una peor evolución y pronóstico2–5.
La evolución clínica después de un PEP suele ser hacia un cuadro crónico y variable, y causa una gran pérdida en la calidad de vida de los pacientes y de sus familias, en la salud física y, además, supone un elevado coste para la sociedad, ya que, en Europa, representa el 11,2% de la carga mundial de las enfermedades cerebrales6. La remisión completa solo se produce en un tercio de los pacientes7. Hasta un 80% de los pacientes sufre una recaída en los 5 años siguientes al PEP, con un riesgo importante de presentar, además, resistencia al tratamiento8.
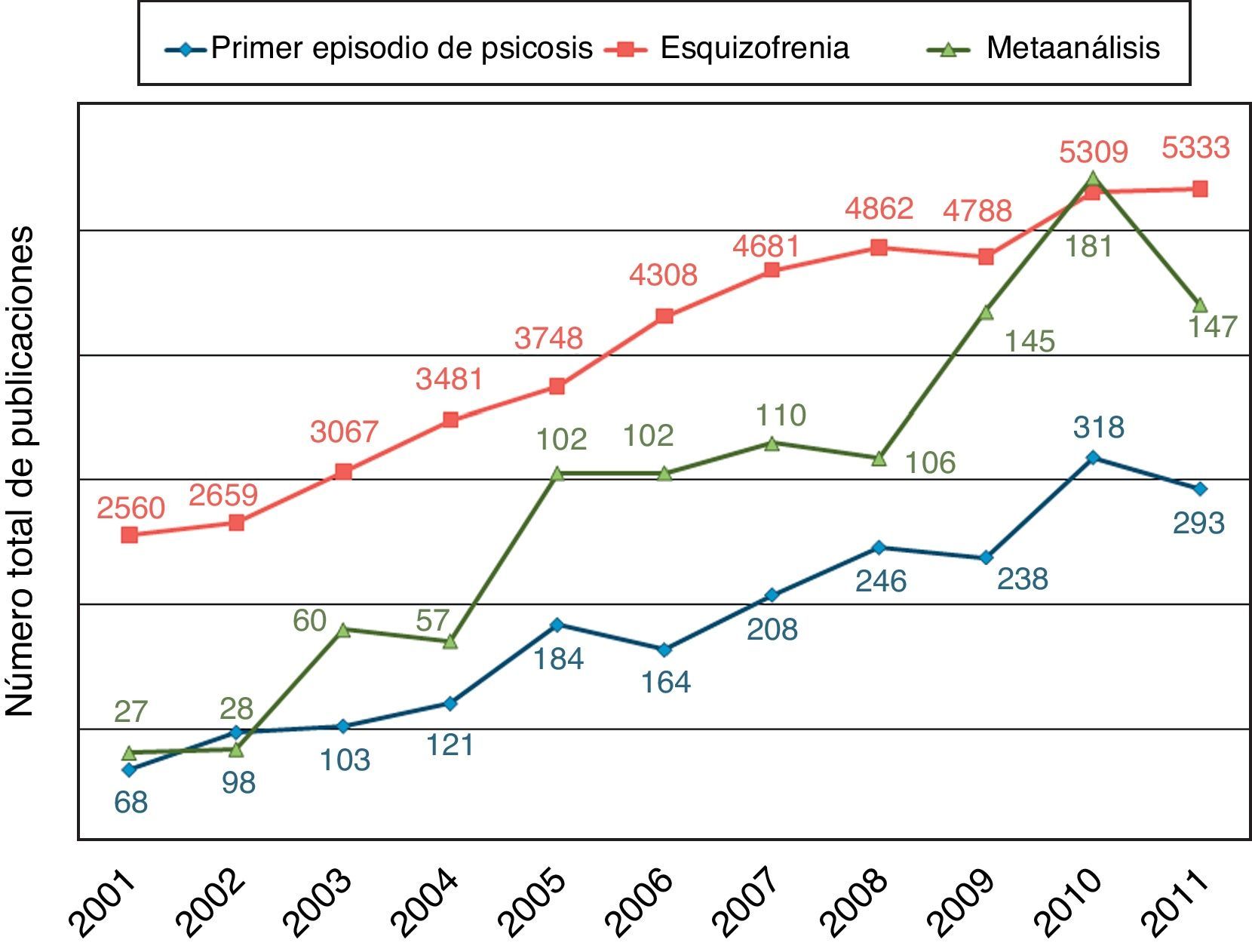
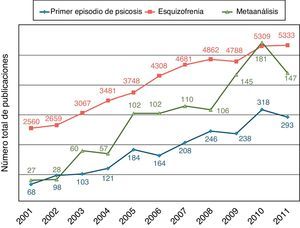
Si bien existen estudios naturalísticos de gran extensión, enmarcados en la vida real de pacientes con esquizofrenia crónica9, la población PEP representa una oportunidad única para evaluar de una manera más clara las variables clínicas y los resultados funcionales de los trastornos psicóticos. La caracterización de la población con un PEP se ha convertido en un área prioritaria en investigaciones recientes, y goza de un interés creciente, con estudios llevados a cabo y a gran escala en los Estados Unidos10, Europa11–13 y también en España14–16. De hecho, en la última década, el número de publicaciones sobre PEP, esquizofrenia y los metaanálisis sobre esta sigue una línea ascendente (fig. 1). Además, recientemente han aparecido algunas revistas monográficas sobre este tema17, se incluirá un debate nosológico sobre su representación en la próxima edición del DSM-V18,19, y los sistemas de salud han aumentado la inversión económica para crear programas de asistencia específicos para esta población20.
La realización de estudios longitudinales en el inicio de la enfermedad es especialmente importante, ya que evita el efecto de las variables de confusión tales como la influencia del tratamiento antipsicótico o la cronicidad11. Tales variables provocan cambios estructurales a largo plazo y tal vez sirvan para explicar la inconsistencia de los hallazgos obtenidos hasta el momento15. Los pacientes con un PEP son, por lo tanto, un excelente grupo para estudiar los factores de riesgo ligados al desarrollo de la esquizofrenia y otros trastornos psicóticos relacionados con procesos de estrés neural.
El diseño general de los estudios con PEP presenta ciertos desafíos que deben tenerse en cuenta a la hora de diseñar nuevos estudios. Las muestras suelen ser heterogéneas, a menudo no incluyen niños ni adolescentes, los instrumentos de evaluación varían entre los diversos estudios y, por lo general, excluyen aquellos casos en los que existe comorbilidad por consumo de drogas o riesgo de suicidio, 2 condiciones habituales en el PEP11,15. Por esta razón, se necesitan estudios realistas que representen la totalidad de la población con PEP.
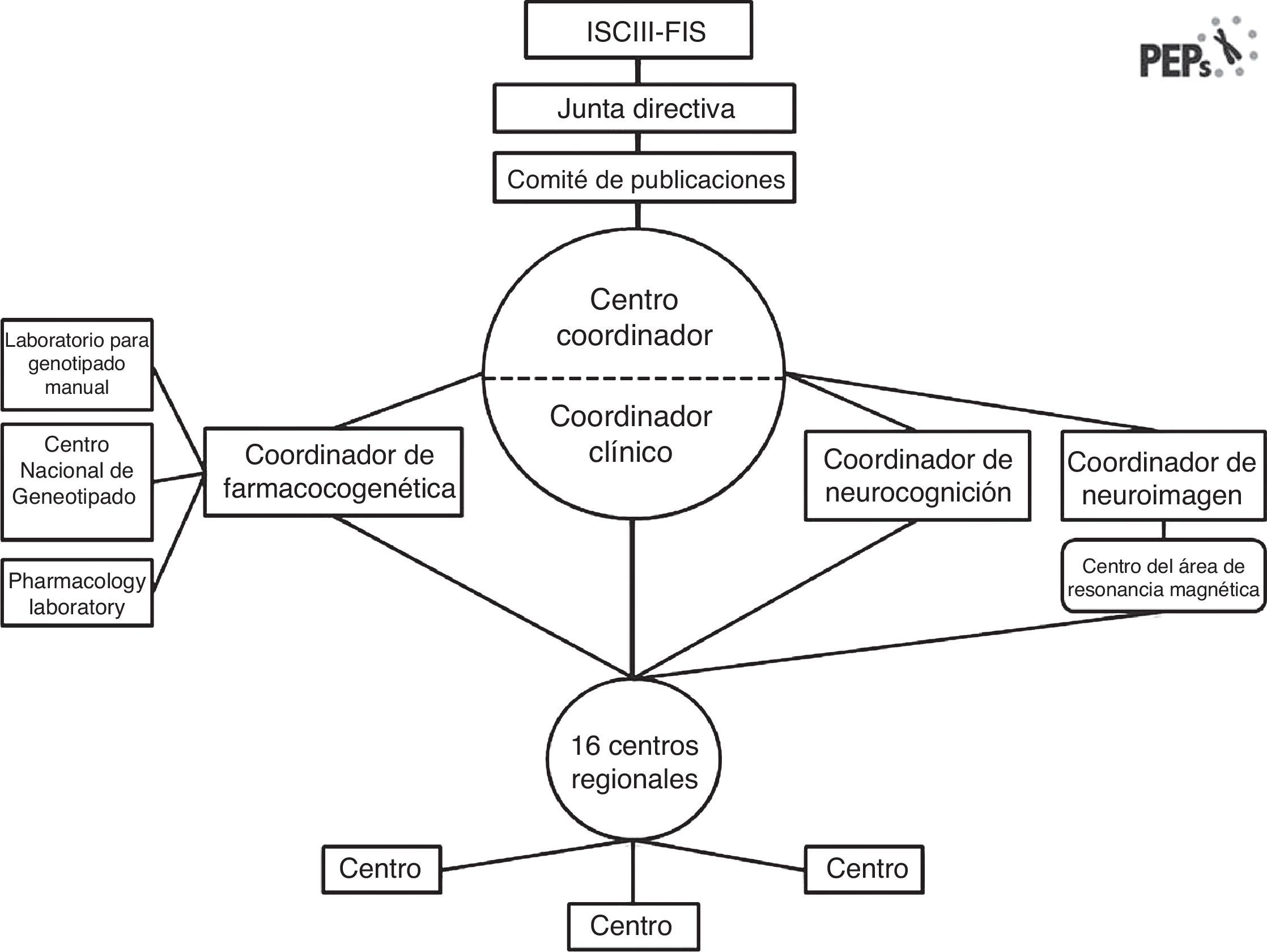
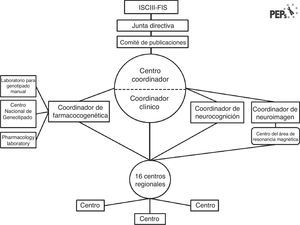
La interacción «fenotipo-genotipo y ambiente. Aplicación de un modelo predictivo en los primeros episodios psicóticos». El estudio PEPs es un estudio multicéntrico, prospectivo, longitudinal, naturalístico y de seguimiento, diseñado para evaluar las variables clínicas, neuropsicológicas, bioquímicas y genéticas y de neuroimagen en una muestra de 350 pacientes con un PEP en España, y emparejados con controles sanos por edad, sexo y nivel socioeconómico. Este proyecto está financiado por el sistema sanitario público español a través del Fondo de Investigación Sanitaria. Los pacientes fueron reclutados en 16 centros ubicados por todo el territorio español y con experiencia en la realización y evaluación de diagnósticos, así como en la administración de entrevistas semiestructuradas y escalas clínicas para valoración y tratamiento. Este estudio es un esfuerzo conjunto de investigación colaborativa que está surgiendo en España21, y es un buen ejemplo de la sinergia entre los diversos enfoques interdisciplinarios en materia de salud mental22. Catorce de los equipos son miembros del Centro de Investigaciones Biomédicas en Red en Salud Mental (CIBERSAM), una red española de investigación translacional en aspectos neurocientíficos relacionados con la salud y la enfermedad mental (www.cibersam.es). Los otros 2 hospitales son centros colaboradores. El objetivo es evaluar las características clínicas, los factores pronósticos funcionales, las especificidades diagnósticas de los hallazgos y los cambios fisiopatológicos en el cerebro durante los primeros 2 años después de sufrir un episodio psicótico mediante el empleo de un enfoque integrativo y translacional. El estudio se organiza del modo ilustrado en la figura 2.
La investigación de las últimas décadas demuestra la heterogeneidad de la etiología de los trastornos psicóticos, en los que los factores genéticos y ambientales desempeñan un papel clave. La genética juega un papel importante en los trastornos psicóticos, como lo demuestra la existencia de familias con varios individuos afectados o los estudios con gemelos monocigóticos23. La heredabilidad de la enfermedad se estima en torno al 80%24, con mayor prevalencia de la patología cuanto mayor sea la carga genética compartida con el familiar afectado25,26. Sin embargo, estos estudios no evalúan la contribución de la interacción entre los genes y el ambiente27–30.
Como sucede en otros trastornos complejos, las variantes genéticas comunes suelen tener una penetración baja y un efecto moderado sobre el riesgo, mientras que las variantes raras pueden explicar un mayor efecto en una proporción más reducida de casos31,32. Por otra parte, las asociaciones obtenidas en estos estudios están más relacionadas con los mecanismos de la enfermedad, su evolución y clasificación que con el riesgo de desarrollar el trastorno33.
En los últimos años, se ha reformulado el concepto clásico de enfermedad psicótica34,35, que además de su expresión psiquiátrica, pasa a ser un trastorno heterogéneo con un impacto multisistémico36–42. En pacientes con un diagnóstico de psicosis no afectiva reciente, se han descrito un número considerable de anormalidades cardiovasculares y metabólicas, antes de iniciar tratamiento con medicación antipsicótica, lo que supone una esperanza de vida más corta. Entre estos hallazgos se encuentran una tolerancia anormal a la glucosa y diabetes36–42, acortamiento de los telómeros e incremento de la presión del pulso43, síndrome metabólico44–47, aumento de la grasa visceral43,48, algunos polimorfismos en el gen de la enzima conversiva de la angiotesina49, una tasa superior de muerte súbita de origen cardiaco50,51, así como una aceleración en los procesos de envejecimiento52.
La literatura del campo ha detectado como principales condiciones ambientales de riesgo de psicosis: el estrés prenatal, padres de edad avanzada, malnutrición, infecciones durante el embarazo, hipoxia perinatal, presencia de acontecimientos traumáticos, ser urbano, pobreza, pertenecer a un grupo étnico minoritario y el consumo de cannabis53,54. En el caso del cannabis, el aumento del riesgo de psicosis se asocia con la exposición al mismo antes de alcanzar la edad adulta, lo que sugiere una interacción con el desarrollo55. Siguiendo el concepto de sensibilización56, existen pruebas de que la exposición a ciertos factores ambientales, que interactúan con factores genéticos, puede alterar la transmisión dopaminérgica, la funcionalidad cognitiva y neuroendocrina, los patrones de interacción interpersonal y el procesamiento afectivo, y, por lo tanto, puede conducir a un mayor empeoramiento de la psicopatología56–59.
A diferencia de otros estudios anteriores con un enfoque más ajustado, y dada la diversidad de la presentación de síntomas y de funcionamiento global asociada a los trastornos psicóticos, uno de los grandes desafíos a los que se enfrentó el estudio PEPs fue la selección de métodos de evaluación eficaces para este tipo de estudio longitudinal, naturalístico y de seguimiento.
Un estudio de este tipo, realizado en condiciones reales de tratamiento, debe emplear métodos rápidos y de gran relevancia que se puedan administrar en la práctica clínica. Además, el estudio PEPs también ofrece una oportunidad para comprobar la eficacia de estas medidas de evaluación y la posibilidad de introducir otras nuevas que podrían representar dominios y métodos de evaluación novedosos. El objetivo principal de esta evaluación es la precisa caracterización de una muestra de pacientes con un PEP a fin de optimizar la supervisión de su evolución, las herramientas terapéuticas y el pronóstico funcional.
El ámbito y nivel de detalle de las evaluaciones del estudio se reconsideraron de acuerdo con el tiempo necesario para recoger la información de cada sujeto, así como con la relevancia de los diversos dominios para las hipótesis de interacción ambiental y genética, la fiabilidad del instrumento, y la frecuencia con la que este había sido utilizado previamente en estudios sobre trastornos psicóticos tanto clínicos como en la comunidad.
Obviamente, los costes de realización están en gran parte directamente relacionados con el número y la frecuencia de las evaluaciones realizadas en el estudio. Al tratarse de un proyecto de financiación pública, este aspecto se ha tenido especialmente en cuenta.
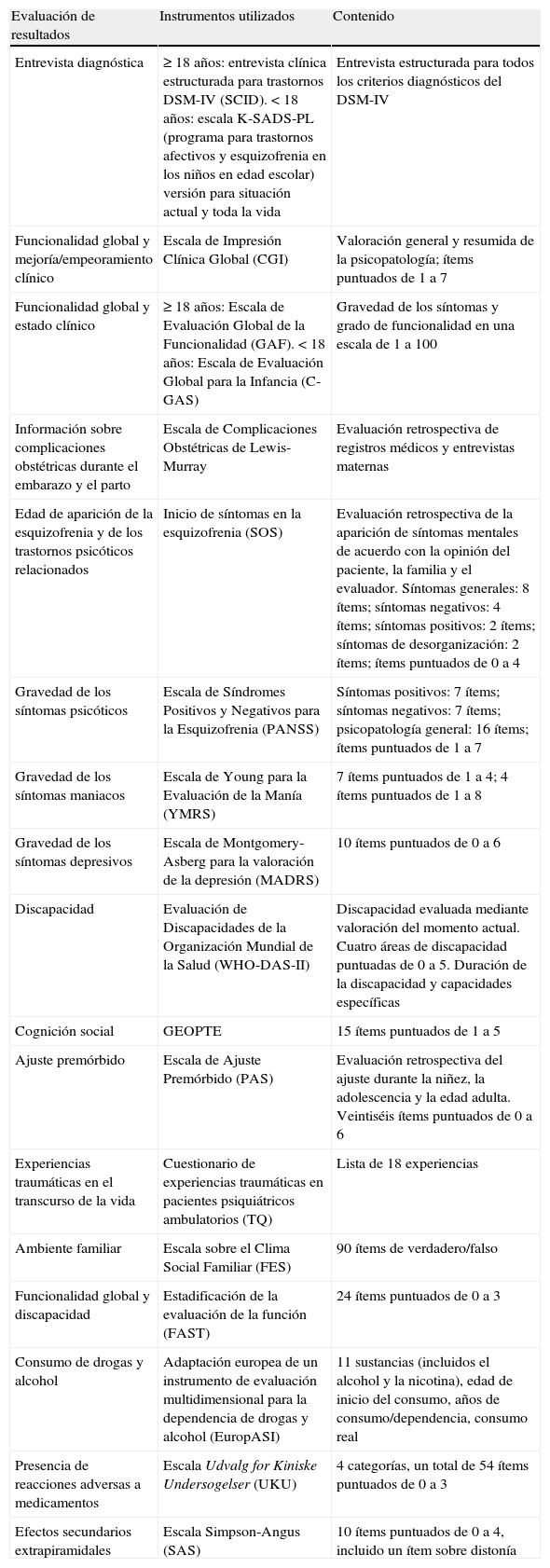
En este artículo se describen las medidas de evaluación utilizadas en el estudio PEPs, que se enumeran en la tabla 1 y se desarrollan con más detalle a continuación.
Estudio PEPs y criterios de valoración clínicos y funcionales
| Evaluación de resultados | Instrumentos utilizados | Contenido |
| Entrevista diagnóstica | ≥18 años: entrevista clínica estructurada para trastornos DSM-IV (SCID). <18 años: escala K-SADS-PL (programa para trastornos afectivos y esquizofrenia en los niños en edad escolar) versión para situación actual y toda la vida | Entrevista estructurada para todos los criterios diagnósticos del DSM-IV |
| Funcionalidad global y mejoría/empeoramiento clínico | Escala de Impresión Clínica Global (CGI) | Valoración general y resumida de la psicopatología; ítems puntuados de 1 a 7 |
| Funcionalidad global y estado clínico | ≥18 años: Escala de Evaluación Global de la Funcionalidad (GAF). <18 años: Escala de Evaluación Global para la Infancia (C-GAS) | Gravedad de los síntomas y grado de funcionalidad en una escala de 1 a 100 |
| Información sobre complicaciones obstétricas durante el embarazo y el parto | Escala de Complicaciones Obstétricas de Lewis-Murray | Evaluación retrospectiva de registros médicos y entrevistas maternas |
| Edad de aparición de la esquizofrenia y de los trastornos psicóticos relacionados | Inicio de síntomas en la esquizofrenia (SOS) | Evaluación retrospectiva de la aparición de síntomas mentales de acuerdo con la opinión del paciente, la familia y el evaluador. Síntomas generales: 8 ítems; síntomas negativos: 4 ítems; síntomas positivos: 2 ítems; síntomas de desorganización: 2 ítems; ítems puntuados de 0 a 4 |
| Gravedad de los síntomas psicóticos | Escala de Síndromes Positivos y Negativos para la Esquizofrenia (PANSS) | Síntomas positivos: 7 ítems; síntomas negativos: 7 ítems; psicopatología general: 16 ítems; ítems puntuados de 1 a 7 |
| Gravedad de los síntomas maniacos | Escala de Young para la Evaluación de la Manía (YMRS) | 7 ítems puntuados de 1 a 4; 4 ítems puntuados de 1 a 8 |
| Gravedad de los síntomas depresivos | Escala de Montgomery-Asberg para la valoración de la depresión (MADRS) | 10 ítems puntuados de 0 a 6 |
| Discapacidad | Evaluación de Discapacidades de la Organización Mundial de la Salud (WHO-DAS-II) | Discapacidad evaluada mediante valoración del momento actual. Cuatro áreas de discapacidad puntuadas de 0 a 5. Duración de la discapacidad y capacidades específicas |
| Cognición social | GEOPTE | 15 ítems puntuados de 1 a 5 |
| Ajuste premórbido | Escala de Ajuste Premórbido (PAS) | Evaluación retrospectiva del ajuste durante la niñez, la adolescencia y la edad adulta. Veintiséis ítems puntuados de 0 a 6 |
| Experiencias traumáticas en el transcurso de la vida | Cuestionario de experiencias traumáticas en pacientes psiquiátricos ambulatorios (TQ) | Lista de 18 experiencias |
| Ambiente familiar | Escala sobre el Clima Social Familiar (FES) | 90 ítems de verdadero/falso |
| Funcionalidad global y discapacidad | Estadificación de la evaluación de la función (FAST) | 24 ítems puntuados de 0 a 3 |
| Consumo de drogas y alcohol | Adaptación europea de un instrumento de evaluación multidimensional para la dependencia de drogas y alcohol (EuropASI) | 11 sustancias (incluidos el alcohol y la nicotina), edad de inicio del consumo, años de consumo/dependencia, consumo real |
| Presencia de reacciones adversas a medicamentos | Escala Udvalg for Kiniske Undersogelser (UKU) | 4 categorías, un total de 54 ítems puntuados de 0 a 3 |
| Efectos secundarios extrapiramidales | Escala Simpson-Angus (SAS) | 10 ítems puntuados de 0 a 4, incluido un ítem sobre distonía |
Los 16 centros participantes en el proyecto PEPs reclutaron de forma prospectiva, entre abril de 2009 y abril de 2011, a pacientes con un diagnóstico de PEP y a personas sanas con características similares para el grupo de control procedentes de sus propios centros.
Aquellos pacientes que cumplieron los criterios de inclusión y fueron atendidos en dichos centros durante el periodo de reclutamiento mencionado fueron invitados a participar en el estudio.
Los criterios de inclusión de los pacientes fueron: edad comprendida entre los 7 y los 35 años en el momento de la primera evaluación, presencia de síntomas psicóticos de duración inferior a los 12 meses, hablar español correctamente y firmar el consentimiento informado.
Los criterios de exclusión para los pacientes fueron: retraso mental según los criterios del DSM-IV60 (lo que incluye, además de un coeficiente intelectual por debajo de 70, problemas de funcionalidad), antecedentes de traumatismo craneoencefálico con pérdida de conciencia y enfermedad orgánica con repercusiones mentales.
Los pacientes se emparejaron con individuos sanos por edad (±10%), sexo y estatus socioeconómico de los padres, medido por el Índice de posición social de Hollingshead-Redlich (±1 nivel). Los controles debían hablar español correctamente y firmar el consentimiento informado.
Los criterios de exclusión para los controles fueron: presencia de trastorno psicótico en el pasado o el presente, trastorno de depresión mayor o retraso mental según los criterios del DSM-IV60 (que incluye, además de un coeficiente intelectual por debajo de 70, funcionalidad alterada), traumatismo craneoencefálico con pérdida de conciencia, enfermedad orgánica con repercusiones mentales y contar con un familiar de primer grado con historial de trastornos psicóticos.
El estudio fue aprobado por los Comités de Ética de Investigación Clínica de todos los centros clínicos participantes. Se obtuvo el consentimiento informado de todos los sujetos incluidos. En el caso de los niños menores de 16 años, los padres o tutores cumplimentaron el consentimiento informado por escrito antes de iniciar el estudio, y los pacientes accedieron a participar. La sección genética contaba con un formulario específico de consentimiento informado. Cuando así lo solicitaron, los participantes en el estudio recibieron un informe sobre los resultados de las pruebas.
Puesto que se trataba de un estudio naturalístico, no hubo directrices sobre el tratamiento administrado (fármacos y psicoterapia).
Criterios de valoración clínicosLa selección de los métodos de evaluación se inició mediante la identificación de aquellos dominios más relevantes para el estudio de la interacción genética y ambiental. Los investigadores principales, tras la reducción de áreas superpuestas y duplicadas, propusieron medidas disponibles para los dominios seleccionados. Después de decidir los instrumentos de evaluación principales, se debatió ampliamente el protocolo a seguir para los métodos de evaluación con consultores externos y los investigadores de los centros. Estos debates dieron lugar a recomendaciones para refinar las mediciones y reducir aún más aquellas medidas innecesarias y redundantes.
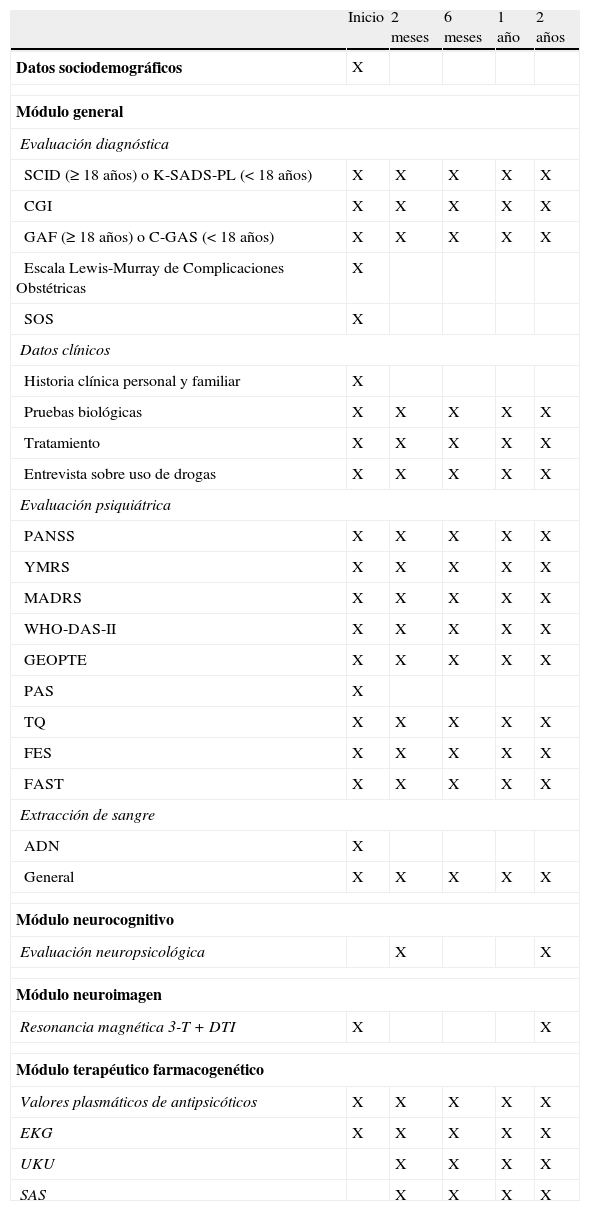
Módulo generalTodos los grupos participaron en este módulo. Al inicio del estudio, se realizó una evaluación completa (entrevista estructurada, escalas clínicas, ambiente familiar, escalas pronósticas y de ajuste premórbido, evaluación genética y analítica) (tabla 1). También se registraron el tratamiento farmacológico y las reacciones adversas a medicamentos (RAM), como se describirá más adelante. Las escalas clínicas, funcionales y de discapacidad se administraron de nuevo a los 2, 6, 12 y 24 meses (tabla 2).
Periodicidad y programación de la evaluación
| Inicio | 2 meses | 6 meses | 1 año | 2 años | |
| Datos sociodemográficos | X | ||||
| Módulo general | |||||
| Evaluación diagnóstica | |||||
| SCID (≥18 años) o K-SADS-PL (<18 años) | X | X | X | X | X |
| CGI | X | X | X | X | X |
| GAF (≥18 años) o C-GAS (<18 años) | X | X | X | X | X |
| Escala Lewis-Murray de Complicaciones Obstétricas | X | ||||
| SOS | X | ||||
| Datos clínicos | |||||
| Historia clínica personal y familiar | X | ||||
| Pruebas biológicas | X | X | X | X | X |
| Tratamiento | X | X | X | X | X |
| Entrevista sobre uso de drogas | X | X | X | X | X |
| Evaluación psiquiátrica | |||||
| PANSS | X | X | X | X | X |
| YMRS | X | X | X | X | X |
| MADRS | X | X | X | X | X |
| WHO-DAS-II | X | X | X | X | X |
| GEOPTE | X | X | X | X | X |
| PAS | X | ||||
| TQ | X | X | X | X | X |
| FES | X | X | X | X | X |
| FAST | X | X | X | X | X |
| Extracción de sangre | |||||
| ADN | X | ||||
| General | X | X | X | X | X |
| Módulo neurocognitivo | |||||
| Evaluación neuropsicológica | X | X | |||
| Módulo neuroimagen | |||||
| Resonancia magnética 3-T+DTI | X | X | |||
| Módulo terapéutico farmacogenético | |||||
| Valores plasmáticos de antipsicóticos | X | X | X | X | X |
| EKG | X | X | X | X | X |
| UKU | X | X | X | X | |
| SAS | X | X | X | X | |
C-GAS: Children's Global Assessment Scale; CGI: Clinical Global Impression Scale; ADN: extracción de muestra genética; DTI: tractografía; EKG: electrocardiograma; FAST: Functional Assessment Staging; FES: Family Environment Scale; GAF: Global Assessment of Functioning Scale; GEOPTE: Escala de cognición social del Grupo Español para la Optimización y Tratamiento de la Esquizofrenia; K-SADS-PL: Kids Schedule for Affective Disorders and Schizophrenia for School-Age Children-Present and Lifetime version; MADRS: Montgomery-Asberg Depression Rating Scale; PANSS: Positive and Negative Syndrome Scale; PAS: Premorbid Adjustment Scale; SAS: Simpson-Angus Scale; SCID: Structured Clinical Interview for DSM-IV; SOS: Symptom Onset in Schizophrenia; TQ: Traumatic Experiences in Psychiatric Outpatients Questionary; UKU: Scale of the Udvalg for Kiniske Undersogelser; WHO-DAS-II: World Health Organization Disability Assessment Schedule version ii; YMRS: Young Mania Rating Scale; 3-T: 3teslas.
Uno de los puntos clave del estudio PEPs fue confirmar el diagnóstico de trastorno psicótico. Para ello, se utilizaron entrevistas semiestructuradas adecuadas para la edad del paciente.
La K-SADS-PL es una entrevista diagnóstica semiestructurada diseñada para evaluar la psicopatología actual y pasada en niños y adolescentes según los criterios del DSM-IV60. Se utilizó la traducción al español de la K-SADS-PL61.
Las SCID-I y II, con traducción al español disponible, son entrevistas semiestructuradas de diagnóstico diseñadas para evaluar psicopatologías actuales y pasadas, así como trastornos de la personalidad en adultos, de acuerdo con los criterios del DSM-IV60,62–65. El uso de una entrevista semiestructurada como la SCID ha demostrado mejorar la fiabilidad de las evaluaciones diagnósticas y, por lo tanto, ayuda a garantizar que todos los pacientes incluidos en el estudio cumplan, de hecho, los criterios del DSM-IV respecto al trastorno psicótico66.
A pesar de los esfuerzos de investigación y las necesidades clínicas, se sabe poco sobre la etapa inicial de los trastornos psicóticos. A menudo, los primeros síntomas de un trastorno psicótico son síntomas prodrómicos, por ejemplo, alteraciones de la percepción, de las creencias, la cognición, el afecto y la conducta. Con el fin de caracterizar y datar retrospectivamente los primeros síntomas de una enfermedad psicótica se utilizó el inventario Symptom Onset in Schizophrenia (SOS, «inicio de los síntomas de esquizofrenia»)67.
El estado clínico globalEl curso y los resultados de los trastornos psicóticos se caracterizan más por la heterogeneidad no explicada que por resultados deficientes y uniformes68, lo que indica la importancia de evaluar los resultados globales respecto a la funcionalidad. Para este propósito se utilizaron 4 escalas diferentes, con el fin de conseguir la mejor calidad posible respecto a la información de funcionalidad global.
La Clinical Global Impression Scale (CGI69, «Escala de la Impresión Clínica Global») evalúa la gravedad y la mejoría de la sintomatología global. Es particularmente útil para evaluaciones repetidas de la psicopatología global.
La Global Assessment of Functioning Scale (GAF, «Escala de Evaluación Global de la Funcionalidad») y la Children's Global Assessment Scale (C-GAS, «Escala de Evaluación Global para Niños») miden la gravedad de los síntomas y el nivel de funcionalidad70,71.
El Cuestionario para la Evaluación de Discapacidades de la Organización Mundial de la Salud (WHO-DAS-II72) es un instrumento que evalúa las dificultades para mantener la higiene personal, realizar tareas laborales y funcionar en la familia y el entorno social.
La Functional Assessment Staging (FAST73, «Estadificación de la Evaluación de la Función») evalúa el grado de dificultad que presenta el paciente respecto a autonomía, funcionalidad laboral y cognitiva, economía personal, relaciones interpersonales y funcionalidad durante el tiempo libre.
Factores demográficos, clínicos y ambientales generalesAl inicio del estudio, se realizó un historial familiar y personal completo, que incluía el historial farmacológico.
En cada caso, la evaluación de medicamentos registraba el nombre del sujeto, la dosis y la presencia de reacciones adversas graves (entendidas como aquellas que llevaron al médico a cambiar la práctica habitual, por ejemplo, solicitando una analítica o enviando al paciente a Urgencias).
En cada visita, se determinaron las concentraciones plasmáticas de antipsicóticos como medida indirecta del grado de cumplimiento farmacológico de los pacientes.
También se obtuvieron en cada evaluación el peso, la talla, el índice de masa corporal, la tensión arterial y el perímetro abdominal para supervisar los indicadores de salud física. Para estudiar la posible aparición de alteraciones cardiacas secundarias al tratamiento farmacológico (por ejemplo, segmento QT largo), cada paciente fue sometido a un electrocardiograma en cada visita.
En las mujeres, se registraron la edad de la menarquia y la fecha de la última menstruación. Se les preguntó si estaban embarazadas o habían utilizado una prueba de embarazo en el mes anterior.
Puesto que el estudio permitía la inclusión de niños y adolescentes, en los sujetos menores de 18 años se estableció la madurez sexual con la escala de Tanner74.
Factores ambientalesSon varias las variables ambientales que se han relacionado con el riesgo de desarrollar psicosis53. Al tratarse de un estudio sobre la interacción entre genes y ambiente, además de registrar el carácter urbano de los sujetos, se evaluaron los antecedentes familiares, las experiencias traumáticas y las complicaciones obstétricas.
El ambiente familiar se evaluó mediante la Family Environment Scale (FES75, «Escala sobre el Clima social Familiar»), una escala autoinformada que incluye 10 subescalas que reflejan las características socioambientales de las familias.
El número de experiencias traumáticas se recogió a partir de la lista de eventos que aparecen en el Traumatic Experiences in Psychiatric Outpatients Questionary (Cuestionario TQ76, de experiencias traumáticas en pacientes psiquiátricos ambulatorios). Se trata de un cuestionario autoinformado.
Las complicaciones obstétricas se registraron mediante la Lewis-Murray Scale of Obstetric Data Scale («Escala de Complicaciones Obstétricas de Lewis-Murray»77). El evaluador valoró la información sobre complicaciones obstétricas de forma retrospectiva. Para la mayoría de los eventos prenatales y perinatales se comprobó si las madres proporcionaban informes precisos en comparación con los datos recogidos en la historia clínica78.
Consumo de alcohol y drogasLas personas que experimentan un primer episodio de psicosis suelen presentar simultáneamente trastornos relacionados con el consumo de drogas, que generalmente incluyen el alcohol y el cannabis, lo que les pone en riesgo de una psicosis más prolongada, recaídas psicóticas, y otros desenlaces adversos79. El uso de alcohol y otras drogas es factor de riesgo de violencia, falta de cumplimiento, recaídas, y de otros resultados deficientes en la esquizofrenia80.
El abuso de drogas se evaluó en cada visita mediante un fragmento del EuropASI (adaptación europea de un instrumento de evaluación multidimensional para la dependencia de drogas y alcohol81). En la visita de inclusión se realizó un registro sistemático de los hábitos de consumo de drogas.
Escalas de evaluación clínicaSe utilizaron escalas originalmente diseñadas para uso en muestras de adultos, con el fin de estudiar a los adolescentes de modo longitudinal, y usar estas evaluaciones como comparaciones de referencia.
Las escalas utilizadas fueron las siguientes:
Síntomas psicóticosLa gravedad de los síntomas y el estado funcional se valoraron mediante diferentes instrumentos de evaluación. La Positive and Negative Symptom Scale (PANSS, «Escala de Síntomas Positivos y Negativos»)82 comprende 3 subescalas. Se eligió la PANSS por su uso generalizado en estudios clínicos de la psicosis y su fiabilidad demostrada en la evaluación de psicopatologías en una variedad de poblaciones de pacientes. Para mejorar su fiabilidad, la PANSS incluye un sistema de anclaje bien desarrollado. Además, los criterios de remisión de la esquizofrenia se basan en algunos de sus ítems83,84. Se utilizó la versión española validada85.
Síntomas afectivosLos criterios de inclusión no excluían a pacientes que presentasen síntomas afectivos además de psicóticos. Por esta razón, se seleccionaron 2 instrumentos para evaluar tanto los síntomas maníacos como los depresivos.
La Escala de Young para la evaluación de la Manía, versión española validada de la Young Mania Rating Scale (YMRS), diseñada para evaluar la severidad de los síntomas maníacos86,87.
Para la evaluación de la severidad de la depresión, se optó por la versión española validada de la Montgomery-Asberg Depression Rating Scale88,89 (MADRS, «Escala de Montgomery-Asberg para la Valoración de la Depresión»). La presencia concurrente de depresión puede afectar de forma demostrable los resultados en pacientes con trastornos psicóticos.
Cognición socialLa cognición social parece mediar de forma indirecta y significativa entre la neurocognición y el desenlace funcional90. Para la medición de la cognición social se utilizó la escala GEOPTE, caracterizada por su sencillez de uso y diseño91.
Ajuste premórbidoEl ajuste premórbido es uno de los factores más estudiados para la prognosis de los trastornos psicóticos92. La Premorbid Adjustment Scale (PAS93, «Escala de Ajuste Premórbido») explora la sociabilidad y el retraimiento, las relaciones con compañeros, el rendimiento escolar, la adaptación a la escuela, y la capacidad para establecer relaciones socioafectivas y sexuales. La escala considera 4 intervalos de edad: infancia (hasta los 11 años), adolescencia temprana (de 12 a 15 años), adolescencia tardía (de 16 a 18 años) y adulto (más de 19 años). Esta escala se cumplimentó con información obtenida de pacientes y padres.
Evaluación de las reacciones adversas a medicamentosTodos los tratamientos, tanto farmacológicos como no farmacológicos, pueden causar reacciones adversas. Algunos fármacos antipsicóticos tienen con frecuencia efectos secundarios que pueden en sí mismos causar síntomas similares a los de la esquizofrenia. Por ejemplo, en un síndrome parkinsoniano inducido por antipsicóticos puede aparecer enlentecimiento cognitivo, disminución de la motivación y entumecimiento emocional. Algunos sujetos pueden desarrollar efectos secundarios que son nuevos síntomas, tales como galactorrea, función sexual alterada, o sedación. En algunos casos, la angustia subjetiva y el deterioro funcional que resultan de los efectos secundarios de los medicamentos determinan el cumplimiento deficiente del tratamiento94.
Se consideraron como RAM aquellos efectos que ocasionaron que el médico cambiase su práctica clínica habitual (por ejemplo, ingreso hospitalario del paciente, solicitud inesperada de analítica sanguínea, etc.), y también se registraron.
Para evaluar con detalle las RAM se siguieron 2 procedimientos: a) informes espontáneos de RAM, y b) evaluación sistemática de efectos específicos (como síndrome metabólico, cardiotoxicidad o síntomas extrapiramidales) a partir de la exploración física (electrocardiograma, niveles plasmáticos de antipsicóticos y analítica sanguínea general), y se administraron 2 escalas en cada visita, salvo en la inicial.
Reacciones adversas generales a los psicofármacosSe utilizó la escala Udvalg for Kiniske Undersogelser (UKU)95, una exhaustiva escala de valoración diseñada para evaluar los efectos secundarios generales de los fármacos psicotrópicos.
Reacciones adversas extrapiramidalesLa segunda escala utilizada para evaluar los efectos secundarios fue la Simpson-Angus Scale (SAS96, «Escala de Simpson-Angus»), que está más orientada a valorar los efectos secundarios extrapiramidales. El parkinsonismo inducido por fármacos es un efecto adverso frecuente y mal tolerado de los antipsicóticos de primera generación y también acontece con antipsicóticos de segunda generación, especialmente con dosis elevadas. Existen pocas comparaciones de parkinsonismo inducido por fármacos con los antipsicóticos de segunda generación.
NeuroimagenSe realizaron escáneres de resonancia magnética (RM) al inicio del estudio y a los 2 años en 6 escáneres diferentes: un Siemens Symphony 1.5 t, 2 General Electric Signa, un Philips Achieva 3T, un Philips Intera 1.5T y un Siemens Magneton Trio 3T. Se recogieron datos de cada centro y se procesaron en un solo lugar. Las secuencias fueron adquiridas en orientación axial para cada sujeto, con secuencias de eco de gradiente 3D T1-weighted (tamaño de vóxel 1×1×1,5mm) y de eco Turbo Spin T2-weighted (tamaño de vóxel 1×1×3,5mm).
En los estudios multicéntricos de RM, la combinación de datos volumétricos requiere una evaluación previa de la compatibilidad entre las diferentes máquinas utilizadas. En la primera fase del estudio se evaluó la compatibilidad entre los 6 escáneres utilizados mediante la repetición de las exploraciones a 6 voluntarios en cada uno de los centros. Mediante el uso de un método semiautomático basado en el atlas de Talairach, y los algoritmos SPM para la segmentación de tejido (multimodal T1 y T2, o solo T1), se obtuvieron las medidas volumétricas de los principales lóbulos cerebrales (frontal, parietal, occipital, temporal) y de cada tipo de tejido y de paciente. Las imágenes de RM se procesaron con un software desarrollado localmente y que incorpora una variedad de técnicas de procesamiento de imágenes y herramientas de cuantificación97,98. Nuestros resultados preliminares muestran que la variabilidad derivada de la inclusión de 6 máquinas diferentes era del 20%, frente al 80% de la variabilidad derivada de los propios participantes.
Evaluación neuropsicológicaLa batería neuropsicológica utilizada en este estudio fue diseñada para abordar distintos dominios cognitivos mediante pruebas neuropsicológicas estandarizadas que presentan una sensibilidad y especificidad demostradas. La batería es muy amplia y abarca las áreas propuestas por el consenso NIMH MATRICS, salvo la memoria verbal99,100. Estas pruebas se han utilizado previamente para la evaluación cognitiva de este tipo de pacientes y fueron administradas por neuropsicólogos especializados.
La evaluación neuropsicológica en niños y adolescentes debe tener en cuenta los niveles de desarrollo de los sujetos. Con el fin de estimar la funcionalidad global, en la forma de coeficiente intelectual, se utilizó el subtest de vocabulario del WISC-IV101 o del WAIS-III102 con los pacientes y los controles menores y mayores de 16 años de edad, respectivamente.
Los dominios con posible deficiencia cognitiva se evaluaron mediante los siguientes instrumentos:
- •
La atención, mediante el Conners’ Continuous Performance Test-II103, el subtest Dígitos en ordenación directa del WAIS-III102 en adultos o del WISC-IV101 en niños, la prueba de Stroop104 y la prueba Trail Making-Parte A105.
- •
La memoria operativa, mediante el subtest Dígitos en ordenación inversa y el subtest Números y letras del WAIS-III en adultos y del WISC-IV101 en niños.
- •
Las funciones ejecutivas, mediante la Prueba de Clasificación de Tarjetas de Wisconsin106,107 y la prueba Trail Making-Parte B105.
- •
La fluidez verbal108 −con puntuación fonética y categórica−, la memoria y el aprendizaje verbal, mediante la Prueba de Aprendizaje Verbal España-Complutense109 para adultos y TAVECi110 para niños.
- •
La cognición social, con la prueba de Mayer-Salovey-Caruso Emotional Intelligence Test (MSCEIT, «Test de Inteligencia Emocional de Mayer-Salovey-Caruso»)111, incluida en la batería MATRICS99,100,112.
La evaluación y el análisis de lateralidad se realizaron con el Inventario de Edimburgo113.
La evaluación neuropsicológica se realizó en el segundo mes de la evaluación para asegurar que el paciente estaba psicopatológicamente estable. La batería neuropsicológica se repitió en la visita programada a los 2 años.
Para evaluar las diferencias entre evaluadores, también se realizó un estudio de fiabilidad entre evaluadores con los distintos neuropsicólogos de cada centro. Aquellos que no superaron la primera evaluación, fueron reevaluados. El método completo y los resultados detallados del estudio de fiabilidad entre evaluadores se describirán en otro trabajo dedicado a dicho tema.
Procesamiento de datosSe utilizó la herramienta Gridsam para la entrada de datos. Su concepción sigue la filosofía de PsyGrid114, y define una Arquitectura Orientada a Servicios sobre la que se construyen varias aplicaciones web que interactúan con una base de datos central. Gridsam permite la captura de datos mediante un sistema informatizado de redes múltiples, que no solo integra la información disponible, sino que además facilita la explotación y gestión de datos más eficiente115.
DiscusiónPresentamos aquí los criterios de valoración clínicos y de funcionamiento adoptados en el estudio PEPs. El objetivo de la presente investigación fue tratar de minimizar la heterogeneidad clínica de otros estudios, en busca de un diseño más válido desde el punto de vista de la eficiencia y de la relevancia clínica. Solo estudios longitudinales de primeros episodios, como el que aborda este proyecto, pueden ayudar a resolver estos problemas. En nuestro caso, la selección de la muestra procuró imitar a un conjunto de pacientes del «mundo real» con un PEP. En nuestra opinión, este diseño aporta al estudio una validez única comparada con otros trabajos previos que utilizan muestras más extensas. Este es un factor clave para evaluar la aplicabilidad de los resultados a la práctica clínica diaria. Por otra parte, el tamaño de la muestra, con casi 350 PEPs y 250 controles, es otro factor esencial para evaluar la aplicabilidad de los resultados a la práctica clínica diaria.
Diseñamos, pues, un estudio que pretendía establecer un equilibrio entre un protocolo eficaz, clínicamente relevante y administrado de manera estructurada, y la necesidad de captar la complejidad del heterogéneo cuadro clínico que supone un PEP con sus influencias ambientales.
Otra característica clave de este estudio es que la edad de inclusión es más amplia que en otros trabajos anteriores, ya que incluye niños y adolescentes, además de adultos. Este hecho hizo que aumentase el número de pacientes en el grupo de <20 años. Esta amplia franja de edad resalta el hecho de que la edad media de la muestra (23,63±5,9) tiende a ser inferior a la de otros estudios con cohortes de PEP de gran tamaño (estudio OPUS: 26,6±6,4; estudio EUFEST: 26±5,6)11,12.
Otro punto fuerte del estudio PEPs es la amplia batería neuropsicológica utilizada. Comparada con la otros proyectos centrados en el PEP, por ejemplo el EUFEST, que utilizó una reducida batería de evaluación (velocidad de procesamiento, motricidad, memoria verbal y flexibilidad cognitiva)116,117, la batería neuropsicológica de nuestro estudio es muy amplia y abarca las áreas propuestas por el consenso NIMH MATRICS (salvo la memoria verbal)99,100.
Un beneficio para los pacientes que aceptaron participar en este estudio es que recibieron un exhaustivo seguimiento durante 2 años, con pruebas analíticas, electrocardiogramas, 2 RM y 2 evaluaciones cognitivas. Esta monitorización no invasiva aportó a los pacientes una mejor caracterización clínica y una atención personalizada superior a la habitual, con independencia de los resultados obtenidos tras la conclusión del proyecto. En nuestra opinión, este hecho explica por qué la mayoría de los pacientes a los que se les ofreció participar en este protocolo aceptaron la invitación.
Una limitación en la evaluación de la evolución de algunas variables puede ser el diseño naturalístico del estudio, pero, por otra parte, dicho enfoque aumenta el reclutamiento y ofrece una imagen global del tratamiento habitual y de los resultados clínicos en estos pacientes.
Un problema adicional es el uso de determinadas escalas para adultos cuyo lenguaje no está adaptado a niños, aunque se ha realizado un gran esfuerzo por utilizar escalas adaptadas para la evaluación cognitiva y clínica. Este problema requiere mayor consideración y, para algunos análisis, es posible que haya que excluir a los niños de menos edad.
Otra limitación del estudio es que no hubo una evaluación específica del insight, aparte de ciertos elementos incluidos en algunas escalas (por ejemplo, el ítem G12 de la escala PANSS, lack of judgment and insight, traducido como «falta de juicio e introspección») o el ítem 11 de la escala Young, insight and self-awareness, traducido como «conciencia de la enfermedad». Además, la determinación de las concentraciones plasmáticas de antipsicóticos en cada visita constituyó una aproximación indirecta al cumplimiento farmacológico (y por lo tanto, del insight), sin olvidar que mide solo un aspecto parcial e indirecto de la conciencia de tener una enfermedad mental (sobre todo en menores de edad). Otros estudios han realizado una evaluación profunda del insight y el cumplimiento farmacológico, ya que está relacionado con el riesgo de sufrir una recaída en pacientes con un PEP8.
Desde que en 2007 se creó CIBERSAM, la red española de salud mental, este es el mayor proyecto de colaboración emprendido en nuestro país21. La magnitud de un estudio como este debería aumentar la posibilidad de hallazgos relevantes y resultados aplicables a la gestión diaria de los pacientes psicóticos, a la vez que aumenta la complejidad general del proyecto.
La caracterización de una muestra española de pacientes que han presentado un PEP es de gran interés, puesto que conocemos el riesgo elevado de presentar un segundo episodio psicótico8.
El enfoque a la evaluación de los resultados clínicos y funcionales adoptado en este análisis de interacción genética-ambiental en el PEP pretende satisfacer las necesidades de un estudio de seguimiento naturalístico con casos y controles dispersados geográficamente. La metodología de evaluación pretende dar la misma importancia a los resultados clínicos que a los funcionales y de la manera más eficiente posible. Los datos recopilados deberían resultar valiosos para una amplia gama de investigadores interesados en los resultados del tratamiento en esta población.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del Comité de Experimentación Humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos aquellos incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio fue en parte subvencionado por el Ministerio Español de Economía y Competitividad, Instituto de Salud Carlos III, FEDER de la Unión Europea, Generalitat de Catalunya, Secretaria d’Universitats i Recerca del Departament d’Economia i Coneixement (2009SGR1295), Universitats i Comissionat por Recerca del Departamento d’Innovació, Universitats i Empresa (DIUE) (2009SGR1295), el centro Esther Koplowitz y CIBERSAM.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Investigadores principales del proyecto FIS Interacción genotipo-fenotipo y ambiente. Aplicación a un modelo predictivo en primeros episodios psicóticos, que crearon el grupo PEPs: Miguel Gutiérrez, Vicent Balanzá, Salvador Sarró, Ana González-Pinto, Gabriel Rubio, Judith Usall, Iluminada Corripio, Manuel Bousoño, Carmen Leal, Fernando Contreras, Antonio Bulbena, Antonio Lobo.