La diabetes mellitus (DM) incrementa el riesgo de presentar complicaciones tanto microvasculares como macrovasculares. Aunque reducir la glucemia hasta los objetivos recomendados reduce el riesgo de complicaciones microvasculares, el efecto de los antidiabéticos sobre las complicaciones macrovasculares y la muerte cardiovascular es motivo de preocupación. Es más, algunos antidiabéticos podrían ser hasta perjudiciales desde el punto de vista de seguridad cardiovascular.
En este contexto, las diferentes agencias reguladoras han establecido la necesidad de realizar estudios específicamente diseñados acerca de la seguridad cardiovascular de los antidiabéticos. Recientemente se han publicado los resultados de 2 ensayos clínicos que aportan información relevante acerca de la seguridad cardiovascular de los inhibidores de la dipeptidil peptidasa-4 (DPP-4).
El objetivo del presente artículo es revisar la evidencia científica disponible acerca de la seguridad cardiovascular de los diferentes antidiabéticos no insulínicos y realizar unas recomendaciones prácticas sobre su uso en este contexto.
Diabetes increases the risk of both microvascular and macrovascular complications. Although reducing plasma glucose levels to recommended targets decreases the risk of microvascular outcomes, the effects of anti-diabetic drugs on macrovascular complications and cardiovascular death are of concern. In fact, it has been suggested that some anti-diabetic agents could even be harmful for cardiovascular outcomes.
In this context, several health care regulatory agencies have established the need for performing clinical trials specifically designed to assess the cardiovascular safety of anti-diabetic drugs. The results of 2 clinical trials have recently been published that provide important information on the cardiovascular safety of dipeptidyl peptidase 4 (DPP-4) inhibitors.
The aim of this document was to review the available evidence on the cardiovascular safety of non-insulin anti-diabetic drugs and provide practical recommendations on their use in this context.
La diabetes mellitus (DM) constituye actualmente un grave problema de salud pública en España. Existen datos recientes del estudio di@bet.es señalando que la prevalencia actual en España de DM, ajustada por edad y sexo, es del 13,8% (7,8% para la DM conocida y 6,0% para la desconocida), cifra que asciende a casi el 30% si se considera cualquier tipo de alteración del metabolismo hidrocarbonado1. Sin embargo, es muy posible que estas cifras aumenten en los próximos años como consecuencia del aumento de la obesidad y de la vida sedentaria2. Aunque los pacientes con DM tienen un riesgo incrementado de muerte por cualquier causa (Hazard Ratio [HR] 1,80; intervalo de confianza [IC] 95% 1,71-1,90), el motivo principal de muerte en esta población es de origen cardiovascular (HR 2,32; IC 95% 2,11-2,56)3. De hecho, se estima que los pacientes con DM tienen un riesgo de presentar un evento cardiovascular (infarto de miocardio, ictus o muerte por cualquier causa) unos 15 años antes que los no diabéticos4. Además, la DM se asocia con importantes complicaciones microvasculares, que incluyen la retinopatía (es la primera causa de ceguera en adultos), la nefropatía (es la primera causa de insuficiencia renal terminal) y la neuropatía (es la primera causa de amputación no traumática de extremidad inferior)5–8. Todo esto hace que los costes asociados a la DM sean muy elevados. Se ha estimado que en España supone un 8% del total del gasto del Sistema Nacional de Salud, y esto solo considerando los costes directos9.
Se ha demostrado que el control global de los factores de riesgo cardiovascular es imprescindible en el paciente con DM para reducir el riesgo de presentar complicaciones cardiovasculares y microvasculares10. Dentro de esta aproximación global del paciente con DM, el control del metabolismo glucémico es imprescindible. En el United Kingdom Prospective Diabetes Study (UKPDS) se evaluó en pacientes con DM tipo 2 el efecto del control glucémico (sulfonilureas, insulina y, en pacientes con sobrepeso, metformina) frente a la terapia convencional (dieta) sobre las complicaciones micro y macrovasculares asociadas a la DM. Por cada 1% en el descenso de la HbA1c se redujo de manera significativa el riesgo de presentar cualquier evento asociado a la DM (21%), de muerte asociada a la DM (21%), de infarto de miocardio (14%), y de complicaciones microvasculares (37%)11. El tratamiento con metformina (HbA1c media 7,4%) frente a la terapia convencional (HbA1c media 8,0%) redujo las complicaciones relacionadas con la DM en pacientes con sobrepeso y se asoció con una menor ganancia de peso y un menor riesgo de hipoglucemias que la insulina o las sulfonilureas, lo que la convierte en el tratamiento de primera elección en esta población12.
Sin embargo, no todos los fármacos antidiabéticos han demostrado ser beneficiosos y seguros, incluso algunos podrían ser perjudiciales desde el punto de vista de seguridad cardiovascular. Así, en un metaanálisis publicado en el año 2007 se observó que el tratamiento con rosiglitazona estaba asociado con un aumento significativo en el riesgo de infarto de miocardio (OR 1,43; p=0,03), y con una tendencia a una mayor muerte de causa cardiovascular (OR 1,63; p=0,06)13.
Además, datos del estudio Action to Control Cardiovascular Risk in Diabetes (ACCORD) mostraron que, si bien el tratamiento intensivo de la hiperglucemia (HbA1c 6,4 frente a 7,5%; seguimiento medio 3,5 años) redujo el riesgo de complicaciones microvasculares, este se asoció con un aumento de la mortalidad y un riesgo incrementado de hipoglucemias severas, sin una reducción significativa de los eventos cardiovasculares14,15. En el Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE), el tratamiento intensivo de la hiperglucemia (HbA1c 6,5 frente a 7,3%, seguimiento medio 5 años), basado en gliclazida, si bien redujo la incidencia de complicaciones microvasculares, a expensas principalmente de un menor riesgo de nefropatía, en cambio no redujo el riesgo de eventos macrovasculares, las muertes cardiovasculares o las muertes por cualquier causa, y hubo un mayor riesgo de hipoglucemias severas16.
Con todos estos datos, en el año 2008 la Food and Drug Administration (FDA) propuso que para poder conceder la aprobación para el uso clínico de un nuevo antidiabético, ya no es suficiente con demostrar que es capaz de reducir eficazmente la HbA1c, sino que además tiene que demostrar que es seguro desde un punto de vista cardiovascular. Posteriormente otras agencias han tomado medidas similares.
En la actualidad existen varios grupos farmacológicos para el tratamiento de la DM, con diferentes mecanismos de acción, que aunque amplían las posibilidades terapéuticas en el paciente con DM, también lo hacen más complejo. Entre estos grupos terapéuticos se encuentran las sulfonilureas, las biguanidas, los inhibidores de las alfa glucosidasa, las tiazolidindionas, las meglitinidas, los inhibidores de la enzima dipeptil dipeptidasa 4 (DPP-4), los agonistas del receptor del péptido similar a glucagón de tipo 1 (GLP-1) y más recientemente, los inhibidores de los cotransportadores de la bomba de sodio-glucosa a nivel renal (SGLT2).
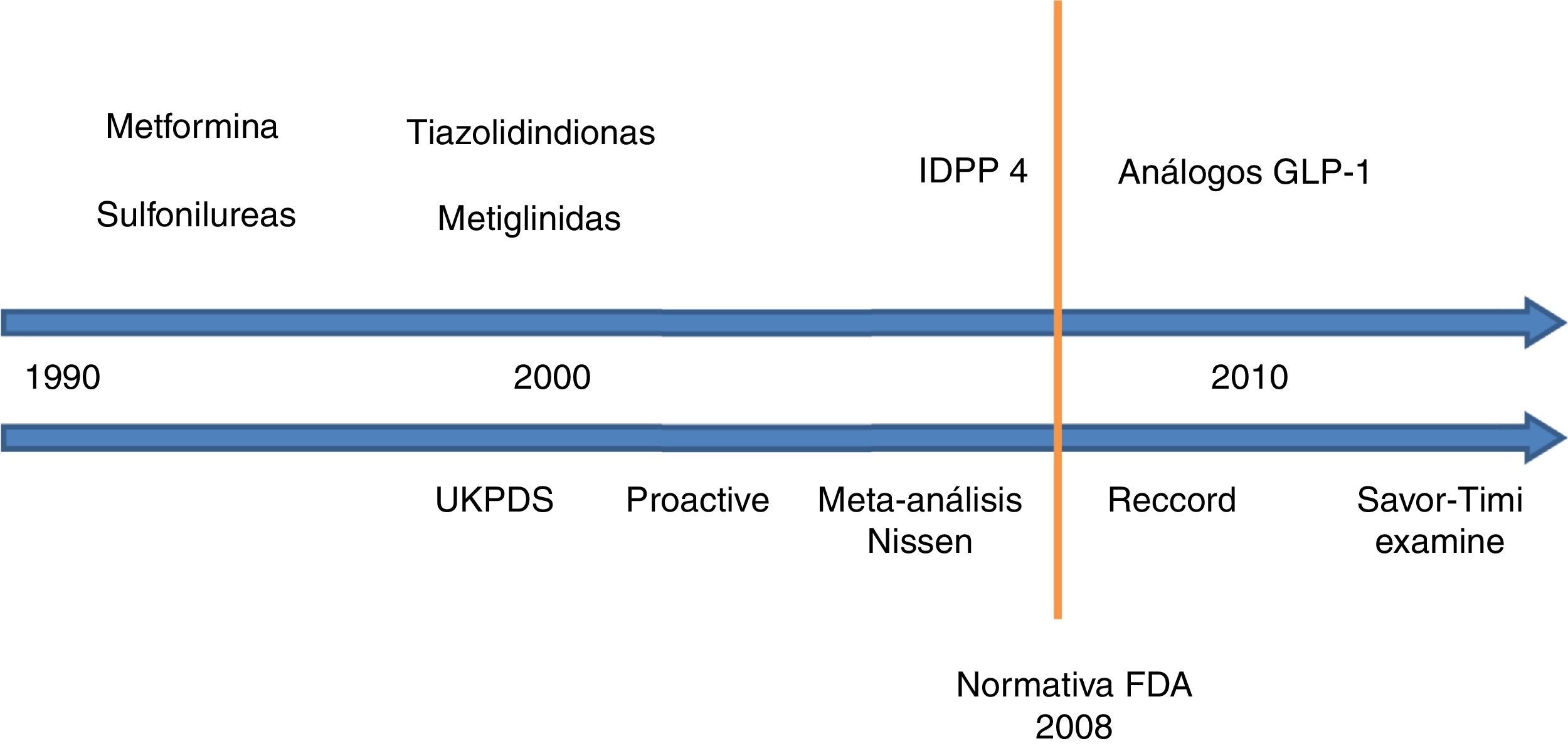
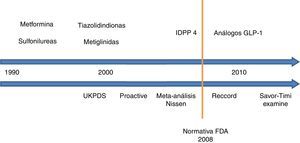
El objetivo del presente artículo ha sido realizar un análisis exhaustivo de la evidencia científica disponible acerca de la seguridad cardiovascular de los diferentes antidiabéticos no insulínicos (fig. 1), estableciendo unas conclusiones claras y concisas que permitan facilitar al clínico el manejo de estos fármacos en su práctica diaria.
Seguridad cardiovascular de los antidiabéticos no insulínicos. Evolución cronológica.
UKPDS: United Kingdom Prospective Diabetes Study; PROACTIVE: PROspective pioglitAzone Clinical Trial In macroVascular Events; IDPP 4: inhibidores de la dipeptil dipeptidasa 4; FDA: Food and Drug Administration; RECORD: Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycemia in Diabetes; GLP-1: péptido similar a glucagón de tipo 1; SAVOR-TIMI 53: Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus–Thrombolysis in Myocardial Infarction; EXAMINE: Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care.
Para el desarrollo de esta iniciativa, se realizó una revisión exhaustiva de los artículos de la base de datos MEDLINE, utilizando los siguientes términos de búsqueda: «Hypoglycemic agent», «glucose lowering agent», «antihyperglycemic therapy», «biguanides», «metformin», «sufonylureas», «glyburide», «glibenclamide», «glipizide», «gliclazide», «glimepiride», «meglitinides», «glinides», «replaglinide», «nateglinide», «thiazolidinediones», «pioglitazone», «rosiglitazone», «alpha glucosidase inhibitors», «acarbose», «miglitol», «voglibose», «DPP 4 inhibitors», «dipeptidil peptidase 4 inhibitors», «alogliptin», «linagliptin», «saxagliptin», «sitagliptin», «vildagliptin», «GLP1agonist», «exenatide», «liraglutide», «lixisenatide», «sglt-2 inhibitors», «sodium glucose co-transporter 2 inhibitors», «sodium glucose cotransporter 2 inhibitors», «canagliflozin» o «dapagliflozin», en combinación con alguno de los siguientes términos: «atherosclerosis», «cardiovascular», «coronary heart disease» o «stroke».
Asimismo, también se revisaron las referencias de los documentos seleccionados, y se incluyeron aquellos manuscritos que si bien no cumplían los requisitos iniciales de búsqueda, resultaron ser de interés para la visión general del tema en evaluación.
Los resultados de esta búsqueda bibliográfica fueron posteriormente evaluados y sometidos a la revisión crítica por parte de los autores con el fin de consensuar unas recomendaciones prácticas y concretas acerca de la seguridad cardiovascular de los antidiabéticos no insulínicos.
Grupos farmacológicos- BiguanidasLa metformina constituye actualmente el tratamiento de inicio de primera elección en la mayoría de los pacientes con DM tipo 2. Su principal mecanismo de acción consiste en la disminución hepática de la producción de glucosa a través de la activación de la AMP-cinasa, existe una amplia experiencia de uso, se considera que tiene un efecto neutro sobre el peso o incluso favorable, y que el riesgo de hipoglucemia es bajo (tabla 1)17,18.
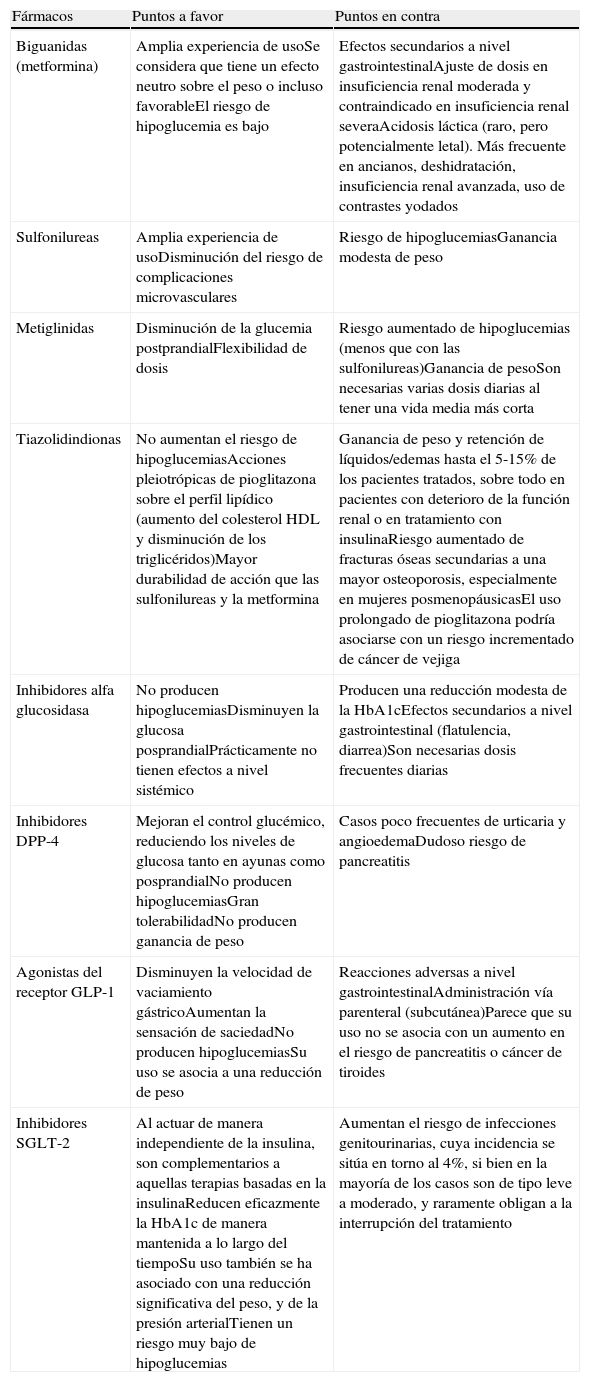
Ventajas e inconvenientes de los antidiabéticos no insulínicos
| Fármacos | Puntos a favor | Puntos en contra |
| Biguanidas (metformina) | Amplia experiencia de usoSe considera que tiene un efecto neutro sobre el peso o incluso favorableEl riesgo de hipoglucemia es bajo | Efectos secundarios a nivel gastrointestinalAjuste de dosis en insuficiencia renal moderada y contraindicado en insuficiencia renal severaAcidosis láctica (raro, pero potencialmente letal). Más frecuente en ancianos, deshidratación, insuficiencia renal avanzada, uso de contrastes yodados |
| Sulfonilureas | Amplia experiencia de usoDisminución del riesgo de complicaciones microvasculares | Riesgo de hipoglucemiasGanancia modesta de peso |
| Metiglinidas | Disminución de la glucemia postprandialFlexibilidad de dosis | Riesgo aumentado de hipoglucemias (menos que con las sulfonilureas)Ganancia de pesoSon necesarias varias dosis diarias al tener una vida media más corta |
| Tiazolidindionas | No aumentan el riesgo de hipoglucemiasAcciones pleiotrópicas de pioglitazona sobre el perfil lipídico (aumento del colesterol HDL y disminución de los triglicéridos)Mayor durabilidad de acción que las sulfonilureas y la metformina | Ganancia de peso y retención de líquidos/edemas hasta el 5-15% de los pacientes tratados, sobre todo en pacientes con deterioro de la función renal o en tratamiento con insulinaRiesgo aumentado de fracturas óseas secundarias a una mayor osteoporosis, especialmente en mujeres posmenopáusicasEl uso prolongado de pioglitazona podría asociarse con un riesgo incrementado de cáncer de vejiga |
| Inhibidores alfa glucosidasa | No producen hipoglucemiasDisminuyen la glucosa posprandialPrácticamente no tienen efectos a nivel sistémico | Producen una reducción modesta de la HbA1cEfectos secundarios a nivel gastrointestinal (flatulencia, diarrea)Son necesarias dosis frecuentes diarias |
| Inhibidores DPP-4 | Mejoran el control glucémico, reduciendo los niveles de glucosa tanto en ayunas como posprandialNo producen hipoglucemiasGran tolerabilidadNo producen ganancia de peso | Casos poco frecuentes de urticaria y angioedemaDudoso riesgo de pancreatitis |
| Agonistas del receptor GLP-1 | Disminuyen la velocidad de vaciamiento gástricoAumentan la sensación de saciedadNo producen hipoglucemiasSu uso se asocia a una reducción de peso | Reacciones adversas a nivel gastrointestinalAdministración vía parenteral (subcutánea)Parece que su uso no se asocia con un aumento en el riesgo de pancreatitis o cáncer de tiroides |
| Inhibidores SGLT-2 | Al actuar de manera independiente de la insulina, son complementarios a aquellas terapias basadas en la insulinaReducen eficazmente la HbA1c de manera mantenida a lo largo del tiempoSu uso también se ha asociado con una reducción significativa del peso, y de la presión arterialTienen un riesgo muy bajo de hipoglucemias | Aumentan el riesgo de infecciones genitourinarias, cuya incidencia se sitúa en torno al 4%, si bien en la mayoría de los casos son de tipo leve a moderado, y raramente obligan a la interrupción del tratamiento |
En el UKPDS se observó que el tratamiento con metformina se asoció con una reducción de las complicaciones relacionadas con la DM en diabéticos con sobrepeso, y se asoció con una menor ganancia de peso y un menor riesgo de hipoglucemias que la insulina o las sulfonilureas12. En el seguimiento a 10 años del UKPDS se observó que, tras la finalización del periodo de intervención, en el grupo de metformina persistía la reducción de las complicaciones asociadas a la DM (21%; p=0,01), así como del riesgo de infarto de miocardio (33%; p=0,005), y de muerte por cualquier causa (27%; p=0,002)19. En un metaanálisis en el que se incluyeron 35 ensayos clínicos con una duración ≥52 semanas, con un total de 7.171 pacientes tratados con metformina y 11.301 pacientes en el grupo control, el tratamiento con metformina se asoció con una reducción de los eventos cardiovasculares en comparación con placebo/no tratamiento (Odds Ratio [OR] 0,79; IC 95% 0,64-0,98; p=0,031), pero no cuando se comparaba con otro tratamiento activo (OR 1,03; IC 95% 0,72-1,77; p=0,89). Sin embargo, parece que el beneficio de metformina era mayor en los estudios con un seguimiento más largo que incluyeran a pacientes más jóvenes, con una tendencia a que metformina en monoterapia mejorara la supervivencia (OR 0,8; IC 95% 0,62-1,02; p=0,076). En cambio, el tratamiento concomitante con sulfonilureas se asoció con una reducción de la supervivencia (OR 1,43; IC 95% 1,06-1,91; p=0,016) (tabla 2)20.
Principales evidencias sobre la seguridad cardiovascular de los antidiabéticos no insulínicos
| Fármacos | Seguridad cardiovascular |
| Biguanidas (metformina) | En el UKPDS se observó que metformina reducía las complicaciones relacionadas con la diabetes en diabéticos con sobrepesoEn el seguimiento a 10 años del UKPDS, en el grupo de metformina persistía la reducción de las complicaciones asociadas a la diabetes (21%; =0,01), del riesgo de infarto de miocardio (33%; p=0,005), y de muerte por cualquier causa (27%; p=0,002)En un metaanálisis de 35 ensayos clínicos con una duración ≥52 semanas, metformina redujo los eventos cardiovasculares en comparación con placebo/no tratamiento (OR 0,79; p=0,031), pero no cuando se comparaba con otro tratamiento activo (OR 1,03; p=0,89). Hubo una tendencia a que metformina en monoterapia mejorara la supervivencia (OR 0,8; p=0,076). En cambio, el tratamiento concomitante con sulfonilureas se asoció con una reducción de la supervivencia (OR 1,43; p=0,016) |
| Sulfonilureas | En el UKPDS metformina mostró un mayor efecto que clorpropamida, glibenclamida, o insulina sobre las complicaciones relacionadas con la diabetes (p=0,0034), mortalidad por cualquier causa (p=0,021), e ictus (p=0,032)La adición precoz de metformina a los pacientes tratados con sulfonilureas podría asociarse con un incremento en el riesgo de muertes relacionadas con la diabetesEn comparación con el tratamiento convencional con dieta, el tratamiento con sulfonilureas redujo el riesgo de complicaciones microvasculares, aunque no de las macrovascularesEn el seguimiento a 10 años del UKPDS, en el grupo inicialmente asignado a insulina-sulfonilureas se observó una reducción significativa de las complicaciones relacionadas con la diabetes (9%; p=0,04), de la enfermedad microvascular (24%; p=0,001), y del riesgo de infarto de miocardio (15%; p=0,01) y muerte por cualquier causa (13%; p=0,007)En el ADVANCE, el tratamiento intensivo basado en gliclazida redujo la incidencia de complicaciones microvasculares, pero no el riesgo de eventos macrovasculares, las muertes cardiovasculares o las muertes por cualquier causa |
| Metiglinidas | Nateglinida no redujo significativamente la incidencia acumulada de diabetes ni las complicaciones cardiovasculares en pacientes con tolerancia a la glucosa alterada y enfermedad cardiovascular o factores de riesgo cardiovascularRepaglinida en pacientes con diabetes tipo 2 se asocia con una mejoría del riesgo cardiovascular, y con un riesgo de muerte similar a la metformina |
| Tiazolidindionas | En el estudio PROactive, tras 34,5 meses de seguimiento medio, hubo una tendencia a presentar una reducción de la variable primaria con pioglitazona (HR 0,90; p=0,095). Pioglitazona sí redujo significativamente el riesgo de muerte por cualquier causa, infarto de miocardio no mortal e ictus (HR 0,84; p=0,027). Pioglitazona aumentó el riesgo de ingreso por insuficiencia cardiaca. En el PROFIT-J, pioglitazona no redujo el riesgo de la variable primariaEn el metaanálisis de Nissen, rosiglitazona aumentó el riesgo de infarto de miocardio (OR 1,43; p=0,03), y presentó una tendencia a un mayor riesgo de muerte de causa cardiovascular (OR 1,64; p=0,06) En el estudio RECORD, tras un seguimiento de 3,75 años (análisis intermedio no previsto), rosiglitazona no aumentó el riesgo de la variable primaria (HR 1,08; IC 95% 0,89-1,31), ni en el riesgo de infarto de miocardio, ni en el de muerte de causa cardiovascular o por cualquier causa, pero sí el de insuficiencia cardiaca. Estos datos fueron confirmados en el análisis completo (seguimiento medio 5,5 años) |
| Inhibidores alfa glucosidasa | En un metaanálisis de 41 estudios realizados en pacientes con diabetes tipo 2 con una duración de al menos 12 semanas, no se encontró ningún efecto significativo sobre la morbilidad o la mortalidadEn otro metaanálisis en el que se incluyeron 7 ensayos clínicos con una duración mínima de 52 semanas en pacientes con diabetes tipo 2, acarbosa redujo el riesgo de infarto de miocardio (HR 0,36; p=0,012) y de cualquier evento cardiovascular (HR 0,65; p=0,0061)En el STOP-NIDDM, tras un seguimiento de 3,3 años, acarbosa redujo en un 49% el riesgo de desarrollar eventos cardiovasculares (HR 0,51; p=0,03), sobre todo de infarto de miocardio en pacientes con tolerancia a la glucosa alterada |
| Inhibidores DPP-4 | Globalmente algunos metaanálisis han aportado datos positivos. En un metaanálisis de 18 ensayos clínicos con una duración ≥24 semanas, el riesgo relativo para cualquier evento cardiovascular con los inhibidores de DPP-4 en comparación con otros antidiabéticos orales o placebo fue 0,48 (p=0,001), y 0,40 (p=0,02) para el riesgo de infarto de miocardio no mortal o síndrome coronario agudoEn otro metaanálisis que incluyó 70 estudios, con 41.959 pacientes y un seguimiento medio de 44,1 semanas, en comparación con placebo u otros fármacos, el tratamiento con los inhibidores de DPP-4 se asoció con una reducción significativa de eventos cardiovasculares mayores (OR 0,71; IC 95% 0,59-0,86), de infarto de miocardio (OR 0,64; IC 95% 0,44-0,94), de ictus (OR 0,77; IC 95% 0,48-1,24) y de muerte (OR 0,60; IC 95% 0,41-0,88)52En el EXAMINE, en el que se incluyeron 5.380 pacientes con diabetes tipo 2 y un infarto agudo de miocardio o angina inestable que requiriesen hospitalización en los 15-90 días previos, tras un seguimiento medio de 18 meses, alogliptina fue no inferior a placebo (añadidos al tratamiento antidiabético previo) en cuanto al riesgo de muerte de causa cardiovascular, infarto de miocardio no mortal o ictus no mortalEn el SAVOR-TIMI 53, en el que se incluyeron a 16.492 pacientes con diabetes tipo 2 y antecedentes o con riesgo de presentar eventos cardiovasculares, tras un seguimiento medio de 2,1 años, saxagliptina fue no inferior a placebo en cuanto al riesgo de muerte cardiovascular, infarto de miocardio o ictus isquémico |
| Agonistas del receptor GLP-1 | Estudios a corto plazo sugieren un efecto cardioprotector de exenatida en pacientes con insuficiencia cardiaca e infarto de miocardioEn un estudio que analizó la seguridad cardiovascular de exenatida frente a placebo o insulina en 12 ensayos clínicos de 12-52 semanas de seguimiento se observó que exenatida no aumentaba el riesgo cardiovascularEn un metaanálisis en el que se compararon los efectos de los agonistas del receptor GLP-1 frente a placebo y a otros comparadores activos en pacientes con diabetes tipo 2, no hubo diferencias significativas en cuanto a la seguridad cardiovascular, sin encontrar diferencias significativas entre los gruposEn un metaanálisis de 37 ensayos clínicos con una duración ≥6 meses que compararon los agonistas del receptor GLP-1 con otros antidiabéticos en sujetos con diabetes tipo 2, si bien no hubo diferencias significativas en cuanto a la incidencia de eventos cardiovasculares mayores con todos los comparadores en su conjunto, sí la hubo al compararse con placebo y pioglitazona. Aunque no se observó un efecto significativo de los agonistas del receptor GLP-1 sobre la mortalidad, hubo una tendencia a su favor en comparación con placebo |
| Inhibidores SGLT-2 | En un análisis de 21 estudios clínicos, en comparación con placebo o tratamiento activo, dapagliflozina no se asoció con un aumento de los eventos cardiovasculares, ni en la variable primaria del estudio compuesta por muerte cardiovascular, infarto de miocardio, ictus u hospitalización por angina inestable (HR 0,787; IC 95% 0,579-1,070), ni en la variable secundaria, compuesta por muerte cardiovascular, infarto de miocardio, ictus, hospitalización por angina inestable, revascularización coronaria no planeada y hospitalización por insuficiencia cardiaca (HR 0,758; IC 95% 0,581-0,988) |
Fuente: Group Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes12; Nissen13; Patel et al.16; Holman19; Lamanna20; UK Prospective Diabetes Study (UKPDS) Group25; Evans26; Holman et al.31; Derosa32; Schramm et al.33; Dormandy et al.36; Yoshii et al.38; Home et al.41; Home et al.42; van de Laar46; Hanefeld47; Chiasson48; Patil et al.51; Monami52; White et al.54; Scirica et al.55; Mikhail63; Woo et al.64; Ratner65; Sun et al.66; Monami67; Langkilde73.
Aunque la metformina se tolera bien en general, el principal efecto secundario es a nivel gastrointestinal. Dado que la metformina se elimina por vía renal tanto a nivel glomerular como a nivel de secreción tubular, existe riesgo de acumulación del fármaco en caso de insuficiencia renal. Aunque según la ficha técnica, metformina está contraindicada en pacientes con un filtrado glomerular<60ml/min, algunos autores sugieren que, ajustando la dosis, podría ser seguro su uso en pacientes con insuficiencia renal moderada17,21. Por otra parte, el efecto secundario más grave y potencialmente letal asociado a la metformina es la acidosis láctica. Afortunadamente es poco frecuente, y generalmente en el contexto de determinadas situaciones como la deshidratación, la insuficiencia renal avanzada, o el uso de contrastes yodados. En consecuencia, en estas circunstancias se debería evitar el uso de metformina (tabla 1)17.
Aunque inicialmente se contraindicó el uso de metformina en pacientes con insuficiencia cardiaca debido a un posible mayor riesgo de acidosis láctica, lo cierto es que en un estudio realizado en más de 6.100 sujetos con insuficiencia cardiaca y DM, tras 2 años de seguimiento, el tratamiento con metformina (25,2% de los pacientes) se asoció con una reducción significativa de la mortalidad, con tasas similares de hospitalizaciones totales y por insuficiencia cardiaca22. También se ha observado este efecto beneficioso en pacientes ancianos con insuficiencia cardiaca y DM. Además, el riesgo de acidosis metabólica fue muy bajo (2,3 frente al 2,6% de los no tratados con un sensibilizador de la insulina; p=0,40) 23.
- SulfonilureasLas sulfonilureas se han empleado durante décadas para el tratamiento de la DM. Aumentan la secreción de insulina mediante el cierre de canales de potasio ATP dependientes en las células β. Las sulfonilureas de primera generación (clorpropamida, tolbutamida) se abandonaron por el riesgo de hipoglucemias prolongadas. En cambio, las sulfonilureas de segunda generación, como gliburida/glibenclamida, glipizida, gliclazida, o glimepirida, tienen una duración de acción que llega hasta las 24 horas, y presentan un riesgo moderado de hipoglucemia. Las hipoglucemias con las sulfonilureas son más rápidas y más intensas que con rosiglitazona17,24. Sin embargo, existen diferencias entre las distintas sulfonilureas, ya que la glibenclamida tiene un riesgo de hipoglucemia superior al resto de sulfonilureas de segunda generación, y además una vida media de hasta 36 horas. Por otra parte, el tratamiento con sulfonilureas se asocia con una ganancia modesta de peso (tabla 1)7,18.
En cuanto a la seguridad cardiovascular, en el UKPDS se observó que metformina mostró un mayor efecto que clorpropamida, glibenclamida, o insulina sobre las complicaciones relacionadas con la DM (p=0,0034), mortalidad por cualquier causa (p=0,021), e ictus (p=0,032). En este estudio se sugirió que la adición precoz de metformina a los pacientes tratados con sulfonilureas podría asociarse con un incremento en el riesgo de muertes relacionadas con la DM, hecho que también se observó en el metaanálisis de Lamanna12,20. Sin embargo, en comparación con el tratamiento convencional con dieta, el tratamiento con sulfonilureas redujo el riesgo de complicaciones microvasculares, aunque no de las macrovasculares25. En el seguimiento a 10 años del UKPDS, en el grupo inicialmente asignado a insulina-sulfonilureas se observó una reducción significativa de las complicaciones relacionadas con la DM (9%; p=0,04), de la enfermedad microvascular (24%; p=0,001), y del riesgo de infarto de miocardio (15%; p=0,01) y muerte por cualquier causa (13%; p=0,007) (tabla 2)19.
En el ADVANCE, el tratamiento intensivo basado en gliclazida redujo la incidencia de complicaciones microvasculares, pero no el riesgo de eventos macrovasculares, las muertes cardiovasculares o las muertes por cualquier causa16. En una cohorte de pacientes con DM tipo 2 que comenzaban tratamiento con sulfonilureas y/o metformina (metformina sola, sulfonilurea sola, sulfonilureas añadida a metformina, metformina añadida a sulfonilurea, o ambos fármacos simultáneamente), los pacientes que tomaron sulfonilurea sola tuvieron un riesgo incrementado de muerte por cualquier causa y muerte de causa cardiovascular. Los pacientes tratados con la combinación de ambos fármacos presentaron un riesgo incrementado de hospitalización de causa cardiovascular, muerte por cualquier causa y muerte cardiovascular (tabla 2)26. Sin embargo, este estudio tiene limitaciones importantes, como que los datos se obtuvieron de diversas fuentes, y se limitó a un ámbito local.
Por otra parte, se ha sugerido que algunas sulfonilureas podrían agravar la isquemia miocárdica, si bien esto no queda claro27. De hecho, en un registro nacional de pacientes hospitalizados por infarto agudo de miocardio no se observó un riesgo aumentado asociado al uso previo de sulfonilureas. Además, los pacientes que estaban siendo previamente tratados con gliclazida/glimepirida presentaron menos complicaciones intrahospitalarias en comparación con los que tomaban glibenclamida28. Tampoco se observó en el UKPDS una relación entre el empleo de sulfonilureas y la mortalidad por insuficiencia cardiaca25. En pacientes ancianos con insuficiencia cardiaca tampoco se ha evidenciado un aumento de la mortalidad asociado al tratamiento con sulfonilureas23.
- MetiglinidasDentro de este grupo farmacológico se encuentran la nateglinida y la repaglinida. Actúan aumentando la secreción de insulina mediante el cierre de los canales de potasio ATP dependientes de las células β. Reducen antes los niveles de glucosa que las sulfonilureas, pero tienen una vida media y una duración de acción más corta. Como principales ventajas se encuentran la disminución de la glucemia posprandial y la flexibilidad de las dosis. Sin embargo, su uso se ha asociado con un riesgo aumentado de hipoglucemias, con ganancia de peso, y son necesarias varias dosis diarias al tener una vida media más corta18,29. Se pueden emplear en lugar de las sulfonilureas, y también pueden ser especialmente útiles en pacientes con un horario irregular de comidas o que desarrollan hipoglucemia posprandial tardía con sulfonilureas (tabla 1)18,30.
En cuanto a la seguridad cardiovascular, el tratamiento con nateglinida (hasta 60mg 3 veces al día) en pacientes con tolerancia a la glucosa alterada y enfermedad cardiovascular o factores de riesgo cardiovascular no redujo significativamente la incidencia acumulada de DM ni las complicaciones cardiovasculares31. Asimismo, varios estudios han objetivado que el tratamiento con repaglinida en pacientes con DM tipo 2 se asocia con una mejoría del riesgo cardiovascular, y con un riesgo de muerte similar a la metformina (tabla 2)32,33.
- TiazolidindionasDentro de este grupo se encuentran la pioglitazona y la rosiglitazona. Actúan aumentando la sensibilidad a la insulina mediante la activación del factor nuclear de transcripción PPAR- γ. Estos fármacos mejoran la sensibilidad a la insulina a nivel hepático, tejido adiposo y músculo, lo que permite un control glucémico duradero8,17,18,34.
Como principales ventajas de su uso se encuentran que no aumentan el riesgo de hipoglucemias, las acciones pleiotrópicas de pioglitzona sobre el perfil lipídico (aumento del colesterol HDL y disminución de los triglicéridos), y la mayor durabilidad de acción que las sulfonilureas y la metformina (tabla 1)8,18,24.
En cambio, su uso se ha asociado con ganancia de peso y retención de líquidos/edemas hasta el 5-15% de los pacientes tratados, sobre todo en pacientes con deterioro de la función renal o en tratamiento con insulina, así como con un riesgo aumentado de fracturas óseas secundarias a una mayor osteoporosis, especialmente en mujeres posmenopáusicas8,17,18,34. Asimismo, recientemente se ha planteado la posibilidad de que el uso prolongado de pioglitazona podría asociarse con un riesgo incrementado de cáncer de vejiga35. En consecuencia, no se recomienda su empleo en pacientes con antecedentes de cáncer de vejiga, y se debe valorar su uso en pacientes con factores de riesgo para el cáncer de vejiga, como la edad, el hábito tabáquico o la exposición a ciertos quimioterápicos (tabla 1)17.
En cuanto a la seguridad cardiovascular, pioglitazona y rosiglitazona han tenido resultados muy distintos. En el estudio PROspective pioglitAzone Clinical Trial In macroVascular Events (PROactive) se incluyeron a más de 5.200 pacientes con DM tipo 2 y evidencia de enfermedad macrovascular. Los pacientes fueron aleatorizados a pioglitazona o placebo, añadidos a su tratamiento habitual, que podía incluir otros antidiabéticos. Tras un seguimiento medio de 34,5 meses, hubo una tendencia a presentar una reducción de la variable primaria, que incluía mortalidad por cualquier causa, infarto de miocardio no mortal, ictus, síndrome coronario agudo, intervención endovascular o quirúrgica a nivel coronario o de las arterias de los miembros inferiores, y la amputación por encima del tobillo (HR 0,90; IC 95% 0,80-1,02; p=0,095). En cambio, pioglitazona sí redujo significativamente el riesgo de la variable compuesta por muerte por cualquier causa, infarto de miocardio no mortal e ictus (HR 0,84; IC 95% 0,72-0,98; p=0,027). Aproximadamente el 6% de los pacientes tratados con pioglitazona ingresaron por insuficiencia cardiaca, frente al 4% en el grupo placebo (p=0,007), si bien la mortalidad por insuficiencia cardiaca fue similar en ambos grupos36. También se ha sugerido que el tratamiento con pioglitazona podría suprimir la proliferación neointimal intrastent y reducir así la incidencia de reestenosis y la necesidad de revascularización tras un intervencionismo coronario percutáneo en pacientes con DM tipo 237. En el PRimary prevention OF hIgh risk Type 2 diabetes in Japan (PROFIT-J) se incluyeron a 522 pacientes japoneses con DM tipo 2 y un alto riesgo de ictus. Los pacientes fueron aleatorizados a tratamiento con o sin pioglitazona durante un seguimiento medio de 672 días. No hubo diferencias significativas en cuanto al riesgo de la variable primaria (muerte por cualquier causa, ictus no mortal, e infarto de miocardio no mortal) entre ambos grupos de tratamiento38. Actualmente está en marcha el estudio Thiazolidinediones Or Sulphonylureas and Cardiovascular Accidents. Intervention Trial (TOSCA.IT), que está evaluando en pacientes con DM tipo 2 no adecuadamente controlados con metformina, los efectos de añadir pioglitazona o sulfonilureas sobre la mortalidad por cualquier causa, el infarto de miocardio no mortal, el ictus no mortal y la revascularización coronaria (tabla 2)39.
Con respecto a rosiglitazona, como consecuencia de las dudas sobre su seguridad, sobre todo en combinación, en cuanto al riesgo de infarto de miocardio, rosiglitazona fue retirada en Europa y la FDA impuso importantes restricciones de uso. Así, en el metaanálisis de Nissen, en el que se incluyeron 42 estudios de más de 24 semanas de duración, el tratamiento con rosiglitazona se asoció con un aumento en el riesgo de infarto de miocardio (OR 1,43; IC 95% 1,03-1,98; p=0,03), y con una tendencia a un mayor riesgo de muerte de causa cardiovascular (OR 1,64; IC 95% 0,98-2,74; p=0,06) (tabla 2)13. No obstante, este metaanálisis tiene importantes limitaciones, que incluyen que los autores no tuvieron acceso a los datos originales, que los estudios incluidos no fueron específicamente diseñados para estudiar el riesgo cardiovascular, y que muchos estudios tenían un periodo de seguimiento limitado, lo que hizo que el número de eventos fuese bajo. En un metaanálisis posterior realizado por los mismos autores, observaron los mismos resultados40. Sin embargo, el estudio Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycemia in Diabetes (RECORD) aportó resultados diferentes. En este ensayo clínico se incluyeron cerca de 4.500 pacientes con DM tipo 2 no adecuadamente controlados con metformina o sulfonilureas. Los pacientes fueron aleatorizados a añadir rosiglitazona al tratamiento que tomaba el paciente o a recibir la combinación de metformina más sulfonilurea (grupo control). La variable primaria del estudio fue la hospitalización o muerte de causa cardiovascular. Tras un seguimiento de 3,75 años (análisis intermedio no previsto), no hubo diferencias significativas entre los 2 grupos de tratamiento ni en el riesgo de la variable primaria (HR 1,08; IC 95% 0,89-1,31), ni en el riesgo de infarto de miocardio, ni en el de muerte de causa cardiovascular o por cualquier causa. Sin embargo, hubo más pacientes con insuficiencia cardiaca en el grupo de rosiglitazona (HR 2,15; IC 95% 1,30-3,57)41. En el análisis completo, con un seguimiento medio de 5,5 años, tampoco se encontraron diferencias significativas entre los grupos ni en la variable primaria del estudio, ni en el riesgo de infarto de miocardio, muerte cardiovascular o ictus. Sin embargo, el tratamiento con rosiglitazona sí se asoció con un riesgo aumentado de insuficiencia cardiaca y de algunas fracturas, principalmente en mujeres (tabla 2)42. La FDA pidió una reevaluación de los datos del RECORD sobre la seguridad cardiovascular, confirmando los resultados publicados previamente43. La FDA eliminó las restricciones de uso de rosiglitazona a finales de 2013.
Actualmente en Europa el tratamiento con pioglitazona está aprobado para el tratamiento de los pacientes con DM tipo 2 que no toleran o que no están adecuadamente controlados con metformina. Por otra parte, lo que sí parece más claro es que las tiazolidindionas no deberían usarse en diabéticos con insuficiencia cardiaca o con riesgo de desarrollarla8,18.
- Inhibidores alfa-glucosidasaDentro de este grupo se incluyen la acarbosa y el miglitol. Disminuyen la absorción de hidratos de carbono mediante la inhibición de la alfa-glucosidasa intestinal. Como principales ventajas se encuentran el hecho de que no producen hipoglucemias, disminuyen la glucosa posprandial, y prácticamente no tienen efectos a nivel sistémico. Sin embargo, producen una reducción modesta de la HbA1c, tienen efectos secundarios a nivel gastrointestinal (flatulencia, diarrea), y son necesarias dosis frecuentes diarias (tabla 1)8,18.
En cuanto a los efectos de los inhibidores de la alfa-glucosidasa sobre los eventos cardiovasculares, la información disponible es limitada44,45. En un metaanálisis de 41 estudios realizados en pacientes con DM tipo 2 con una duración de al menos 12 semanas (30 acarbosa, 7 miglitol, 1 voglibosa, y 3 combinaciones), no se encontró ningún efecto significativo sobre la morbilidad o la mortalidad46. En otro metaanálisis en el que se incluyeron 7 ensayos clínicos aleatorizados, doble ciego y controlados con placebo con una duración mínima de 52 semanas, pacientes con DM tipo 2 fueron aleatorizados a acarbosa (n=1.248) o placebo (n=932). El tratamiento con acarbosa se asoció con una reducción en el riesgo de infarto de miocardio (HR 0,36; IC 95% 0,16-0,80; p=0,0120) y de cualquier evento cardiovascular (HR 0,65; IC 95% 0,48-0,88; p=0,0061). Igualmente, también mejoró el control glucémico, los niveles de triglicéridos, peso corporal y la presión arterial sistólica (tabla 2)47.
En el Study to Prevent Non-Insulin-Dependent Diabetes Mellitus (STOP-NIDDM) se incluyeron a cerca de 1.400 pacientes con tolerancia a la glucosa alterada que fueron aleatorizados a placebo o a acarbosa durante un seguimiento medio de 3,3 años. El tratamiento con acarbosa redujo la hiperglucemia posprandial y redujo en un 49% el riesgo de desarrollar eventos cardiovasculares (HR 0,51; IC 95% 0,28-0,95; p=0,03), sobre todo de infarto de miocardio. Además, la acarbosa redujo en un 34% el riesgo de nuevos casos de hipertensión (HR 0,66; IC 95% 0,49-0,89; p=0,006) (tabla 2)48.
En definitiva, la acarbosa puede administrase sola o en combinación con otros antidiabéticos orales e insulina. La acarbosa es particularmente eficaz en aquellos pacientes con tolerancia a la glucosa alterada y la DM en sus primeros estadios así como en pacientes con síndrome metabólico44,45.
- Inhibidores de la dipeptidilpedidasa-4Dentro de este grupo se encuentran la sitagliptina, vildagliptina, saxagliptina, linagliptina y alogliptina. Actúan aumentando la secreción de insulina y disminuyendo la secreción de glucagón dependientes de glucosa mediante la inhibición de la Dipeptidil peptidasa 4 (DPP4), aumentando las concentraciones posprandiales de incretinas activas (GLP-1, GIP)18,49. Los inhibidores de la DPP-4 mejoran el control glucémico, reduciendo los niveles de glucosa tanto en ayunas como posprandial. Como principales ventajas se encuentran que no producen hipoglucemias, la gran tolerabilidad y que no producen ganancia de peso. En cambio, se han descrito casos poco frecuentes de urticaria y angioedema18,49. Además, existe cierta preocupación por si los inhibidores de la DPP-4 podrían aumentar el riesgo de pancreatitis. Sin embargo, en un metaanálisis que incluyó 134 ensayos clínicos, con una duración de al menos 12 semanas, en pacientes con DM tipo 2 y en los que se comparaban los inhibidores de la DPP-4 con placebo o fármacos activos, no hubo diferencias significativas ni en el riego de pancreatitis ni de cáncer de páncreas (OR 0,93; IC 95% 0,51-1,69; p=0,82) (tabla 1)50.
En cuanto a la seguridad a nivel cardiovascular, globalmente algunos metaanálisis han aportado datos positivos. En un metaanálisis que analizó la evidencia disponible hasta el 30 de septiembre de 2011, se incluyeron 18 ensayos clínicos con una duración de al menos 24 semanas. Se compararon los inhibidores de la DPP-4 con otros antidiabéticos orales o placebo. En total 4.998 pacientes fueron aleatorizados a los inhibidores de DPP-4 y 3.546 al grupo comparador. La duración media fue de 46,4 semanas. En el análisis global, el riesgo relativo para cualquier evento cardiovascular con los inhibidores de DPP-4 fue 0,48 (IC 95% 0,31-0,75; p=0,001), y 0,40 (IC 95% 0,18-0,88; p=0,02) para el riesgo de infarto de miocardio no mortal o síndrome coronario agudo51. En otro metaanálisis que incluyó 70 estudios, con 41.959 pacientes y un seguimiento medio de 44,1 semanas, en comparación con placebo u otros fármacos, el tratamiento con los inhibidores de DPP-4 se asoció con una reducción significativa de eventos cardiovasculares mayores (OR 0,71; IC 95% 0,59-0,86), de infarto de miocardio (OR 0,64; IC 95% 0,44-0,94), de ictus (OR 0,77; IC 95% 0,48-1,24) y de muerte (OR 0,60; IC 95% 0,41-0,88) (tabla 2)52. En la tabla 3 se resumen las estimaciones de riesgo de eventos cardiovasculares basadas en análisis de estudios de fase II y III53.
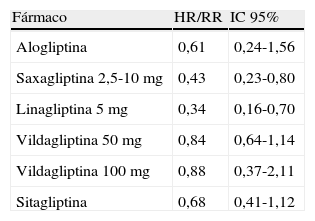
Estimaciones de riesgo de eventos cardiovasculares con los inhibidores de la DPP-4 basadas en análisis de estudios de fase II y III (resultados previos a la publicación de los estudios EXAMINE Y SAVOR-TIMI 53)
| Fármaco | HR/RR | IC 95% |
| Alogliptina | 0,61 | 0,24-1,56 |
| Saxagliptina 2,5-10mg | 0,43 | 0,23-0,80 |
| Linagliptina 5mg | 0,34 | 0,16-0,70 |
| Vildagliptina 50mg | 0,84 | 0,64-1,14 |
| Vildagliptina 100mg | 0,88 | 0,37-2,11 |
| Sitagliptina | 0,68 | 0,41-1,12 |
HR: Hazard Ratio; IC: intervalo de confianza; RR: riesgo relativo.
Modificado de Rosenstock et al.53.
Sin embargo, la información más relevante en este sentido proviene de los estudios específicamente diseñados sobre la seguridad cardiovascular con los inhibidores de IDPP-4. Si bien algunos están todavía en marcha como los estudios Trial Evaluating Cardiovascular Outcomes with Sitagliptin; NCT00790205 (TECOS) con sitagliptina y Cardiovascular Outcome Study of Linagliptin versus Glimepiride in Patients with Type 2 Diabetes (CAROLINA); NCT01243424 con linagliptina, otros ya han finalizado y publicado sus resultados principales, como el Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care (EXAMINE); NCT00968708 con alogliptina y el Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus–Thrombolysis in Myocardial Infarction (SAVOR-TIMI-53); NCT01107886 con saxagliptina53–55. En el estudio EXAMINE se incluyeron a un total de 5.380 pacientes con DM tipo 2 y un infarto agudo de miocardio o angina inestable que requiriesen hospitalización en los 15-90 días previos. Los pacientes fueron aleatorizados a recibir alogliptina o placebo, añadidos al tratamiento antidiabético previo. Fue un estudio doble ciego, de no inferioridad (margen preespecificado de no inferioridad de 1,3 para el riesgo de la variable primaria compuesta por muerte de causa cardiovascular, infarto de miocardio no mortal o ictus no mortal). Tras un seguimiento medio de 18 meses, la reducción de la HbA1c fue superior en el grupo de alogliptina (–0,36%; p<0,001). El 11,3% de los pacientes asignados a alogliptina presentaron un evento incluido en la variable primaria, frente al 11,8% de los asignados a placebo (HR 0,96; límite superior del intervalo de confianza 1,16; p<0,001 para no inferioridad). Tampoco hubo mayor incidencia ni de hipoglucemias, ni de cáncer ni de pancreatitis (tablas 2 y 4)54.
Principales resultados de los estudios EXAMINE y SAVOR-TIMI 53
| EXAMINE | SAVOR-TIMI 53 |
| Población | |
| • 5.380 pacientes con diabetes tipo 2 y un infarto agudo de miocardio o angina inestable que requiriese hospitalización en los 15-90 días previos• Los pacientes fueron aleatorizados a alogliptina o placebo (añadido a tratamiento estándar)• Seguimiento medio 18 meses | • 16,492 pacientes con diabetes tipo 2 con alto riesgo o antecedentes de eventos cardiovasculares• Los pacientes fueron aleatorizados a saxagliptina o placebo (añadido a tratamiento habitual)• Seguimiento medio 2,1 años |
| Variable | HR | p | HR | p |
| Variable primaria* | 0,96 | 0,32 | 1,00 | 0,99 |
| Muerte de causa cardiovascular | 0,79 | 0,10 | 1,03 | 0,72 |
| Muerte por cualquier causa | 0,88 | 0,23 | 1,11 | 0,15 |
| Infarto de miocardio | 1,08 | 0,47 | 0,95 | 0,52 |
| Ictus | 0,91 | 0,71 | 1,11 | 0,38 |
En el SAVOR-TIMI 53, 16.492 pacientes con DM tipo 2 y antecedentes o con riesgo de presentar eventos cardiovasculares, fueron aleatorizados a recibir saxagliptina o placebo, añadidos a su tratamiento habitual, que podía incluir otros antidiabéticos. Tras un seguimiento medio de 2,1 años, el 7,3% de los pacientes asignados a saxagliptina y el 7,2% de los pacientes asignados a placebo presentaron un evento de la variable primaria, compuesto por muerte cardiovascular, infarto de miocardio o ictus isquémico (HR 1,00; IC 95% 0,89-1,12; p=0,99 para superioridad; p<0,001 para no inferioridad). Lo mismo ocurrió para la variable secundaria compuesta por muerte cardiovascular, infarto de miocardio, ictus, hospitalización por angina inestable, revascularización coronaria o insuficiencia cardiaca (HR 1,02; IC 95% 0,94-1,11; p=0,66); sin embargo, hubo más casos de hospitalización por insuficiencia cardiaca con saxagliptina (3,5 y 2,8%, respectivamente; HR 1,27; IC 95% 1,07-1,51; p=0,007). Saxagliptina redujo el desarrollo y la progresión de la microalbuminuria. La incidencia de pancreatitis y cáncer de páncreas fue similar en ambos grupos (tablas 2 y 4)55.
- Agonistas del receptor agonistas del receptor del péptido similar a glucagón de tipo 1En este grupo se incluyen la exenatida, la liraglutida, y la lixisenatida, que actúan activando los receptores GLP-1. Esto tiene como consecuencia el aumento de la secreción de insulina y la disminución de la secreción de glucagón dependientes de glucosa. Además, disminuyen la velocidad de vaciamiento gástrico y aumentan la sensación de saciedad (tabla 1)18,56.
Como principales ventajas se encuentran que no producen hipoglucemias, y que su uso se asocia a una reducción de peso. Como principales inconvenientes se encuentran las reacciones adversas a nivel gastrointestinal, y que se administran por vía parenteral (subcutánea)18,56. Por otra parte, a pesar de las preocupaciones iniciales, parece que su uso no se asocia con un aumento en el riesgo de pancreatitis o cáncer de tiroides (tabla 1)57.
Estudios muy preliminares sugieren que los agonistas del receptor GLP-1 podrían asociarse con una mejoría del perfil de riesgo cardiovascular58. Estudios experimentales han objetivado la mejoría de la función ventricular en modelos animales con insuficiencia cardiaca, la limitación del tamaño del infarto al mejorar el acondicionamiento por isquemia, la inhibición de la respuesta inflamatoria y la mejora de la función endotelial, entre otros56,59,60. Asimismo, también se ha observado que el uso de los agonistas del receptor GLP-1 es capaz de, además de controlar la hiperglucemia, mejorar otros factores de riesgo cardiovascular, entre los que se incluyen la reducción del peso y de la presión arterial sistólica, así como una mejoría del perfil lipídico61,62.
Con respecto a la seguridad cardiovascular, estudios a corto plazo sugieren un efecto cardioprotector de exenatida en pacientes con insuficiencia cardiaca e infarto de miocardio63,64. En un estudio que analizó la seguridad cardiovascular de exenatida frente a placebo o insulina en 12 ensayos clínicos de 12-52 semanas de seguimiento se observó que exenatida no aumentaba el riesgo cardiovascular (tabla 2)65.
En un metaanálisis en el que se compararon los efectos de los agonistas del receptor GLP-1 frente a placebo y a otros comparadores activos en estudios de al menos 8 semanas de duración en pacientes con DM tipo 2, se incluyeron 45 ensayos clínicos con 15.883 sujetos para valorar la seguridad cardiovascular, sin encontrar diferencias significativas entre los grupos66. En otro metaanálisis en el que se incluyeron 37 ensayos clínicos con una duración de al menos 6 meses que compararon los agonistas del receptor GLP-1 con otros antidiabéticos en sujetos con DM tipo 2, si bien no hubo diferencias significativas en cuanto a la incidencia de eventos cardiovasculares mayores con todos los comparadores en su conjunto, sí la hubo al compararse con placebo y pioglitazona. Aunque no se observó un efecto significativo de los agonistas del receptor GLP-1 sobre la mortalidad, hubo una tendencia a su favor en comparación con placebo (tabla 2)67.
Actualmente se están desarrollando estudios específicamente diseñados para conocer la seguridad cardiovascular de los agonistas del receptor GLP-1: el Liraglutide Effect and Action in Diabetes: Evaluation of cardiovascular outcome Results (LEADER), NCT01179048 con liraglutida, el Exenatide Study of Cardiovascular Event-Lowering Trial (EXSCEL), NCT01144338 con exenatida LAR (long acting release, administración semanal), y el Evaluation of Cardiovascular Outcomes in Patients With Type 2 Diabetes After Acute Coronary Syndrome During Treatment With AVE0010 (Lixisenatide) (ELIXA), NCT01147250 con lixisenatida68,69.
- Inhibidores del co-transportador de glucosa tipo 2 dependiente del sodioDentro de este grupo terapéutico actualmente se encuentran la dapagliflozina, la canagliflozina y la empagliflozina. Actúan reduciendo la reabsorción de glucosa en el túbulo proximal mediante la inhibición del SGLT-2. Al actuar de manera independiente de la insulina, son complementarios a aquellas terapias basadas en la insulina. Han demostrado reducir eficazmente la HbA1c de manera mantenida a lo largo del tiempo. Su uso también se ha asociado con una reducción significativa del peso y de la presión arterial. Además, tienen un riesgo muy bajo de hipoglucemias. Sin embargo, aumentan el riesgo de infecciones genitourinarias, cuya incidencia se sitúa en torno al 4%, si bien en la mayoría de los casos son de tipo leve a moderado, y raramente obligan a la interrupción del tratamiento (tabla 1)70–72. En cuanto a la seguridad cardiovascular, en un estudio cuyos resultados han sido recientemente presentados, se analizaron los datos provenientes de 21 estudios clínicos (n=9.339), incluyendo 2 estudios exclusivamente formados por pacientes con antecedentes de enfermedad cardiovascular. Se compararon los efectos de dapagliflozina frente a placebo o tratamiento activo. El tratamiento con dapagliflozina no se asoció con un aumento de los eventos cardiovasculares, ni en la variable primaria del estudio compuesta por muerte cardiovascular, infarto de miocardio, ictus u hospitalización por angina inestable (HR 0,787; IC 95% 0,579-1,070), ni en la variable secundaria, compuesta por muerte cardiovascular, infarto de miocardio, ictus, hospitalización por angina inestable, revascularización coronaria no planeada y hospitalización por insuficiencia cardiaca (HR 0,758; IC 95% 0,581-0,988) (tabla 2)73.
Sin embargo, los resultados más importantes acerca de la seguridad cardiovascular de este grupo terapéutico provendrán de la información aportada por los ensayos clínicos que están actualmente en marcha, y que incluyen el Dapagliflozin Effect on CardiovascuLAR Events (DECLARE-TIMI 58), NCT01730534 con dapagliflozina, el CANagliflozin cardioVascular Assessment Study (CANVAS), NCT01032629 con canagliflozina y el BI 10773 (Empagliflozin) Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (NCT01131676) con empagliflozina.
Posicionamiento y conclusionesLa DM supone actualmente una epidemia en España, que lejos de resolverse, cada vez es más frecuente. Su presencia se asocia con un aumento tanto de las complicaciones microvasculares como macrovasculares. En consecuencia, parece lógico pensar que reducir la HbA1c hasta los objetivos recomendados disminuiría el riesgo de desarrollar ambas complicaciones. Sin embargo, aunque los efectos beneficiosos sobre las complicaciones microvasculares (retinopatía, nefropatía, neuropatía) debidos a la reducción de la glucemia con los fármacos actuales parecen claros, no ocurre lo mismo con las complicaciones macrovasculares. Es más, incluso algunos fármacos antidiabéticos podrían resultar hasta perjudiciales desde el punto de vista cardiovascular. Por ejemplo, existen dudas sobre la seguridad cardiovascular de las sulfonilureas, sobre todo cuando se asocian a metformina, y rosiglitazona fue retirada del mercado por aumentar el riesgo de infarto de miocardio, si bien esto no se confirmó en el estudio RECORD.
En este contexto, primero la FDA, pero luego también otras agencias reguladoras, han establecido como objetivo para los nuevos fármacos antidiabéticos no solo que redujeran la HbA1c con un adecuado perfil de efectos secundarios, sino también la necesidad de realizar estudios específicamente diseñados acerca de la seguridad cardiovascular. Es decir, se ha pasado de intentar buscar fármacos antidiabéticos que reduzcan el riesgo de presentar complicaciones macrovasculares, incluyendo tanto el riesgo de infarto de miocardio como de muerte cardiovascular, a buscar fármacos que, reduciendo la HbA1c y el riesgo de complicaciones microvasculares, sean seguros desde un punto de vista cardiovascular. En este sentido, tanto el EXAMINE (pacientes con DM tipo 2 e infarto o angina inestable recientes) como el SAVOR-TIMI 53 (pacientes con DM tipo 2 y antecedentes o con riesgo de presentar eventos cardiovasculares) son los 2 primeros estudios de seguridad cardiovascular desarrollados bajo la nueva normativa de la FDA. Tienen un diseño específico para demostrar la seguridad de los fármacos (endpoints, perfil del paciente…). Ambos estudios son aleatorizados, doble ciego y controlados con placebo. Globalmente, los resultados demuestran que el tratamiento con estas moléculas (alogliptina y saxagliptina) no aumenta el riesgo de eventos cardiovasculares, si bien en diferentes contextos clínicos, el primero en un contexto más agudo (cardiólogo), y el segundo más crónico (atención primaria).
Actualmente se recomienda la metformina como tratamiento de primera elección en el paciente con DM tipo 2 y como tratamiento de segunda línea, en caso de que no se consigan alcanzar los objetivos de HbA1c, la asociación de metformina con sulfonilureas, tiazolidindionas, inhibidores de la DPP-4, agonistas del GLP-1, y más recientemente con los inhibidores de SGLT2. En caso de que no se tolerase o estuviese contraindicada la metformina, los tratamientos de segunda línea pasarían al primer escalón. Sin embargo, teniendo en cuenta la seguridad cardiovascular, y a la luz de las evidencias actuales, habría que inclinarse más por utilizar aquellos fármacos que actualmente hayan demostrado ser más seguros.
Conflicto de interesesEstudio elaborado con la colaboración de AstraZeneca.
AgradecimientosLos autores quieren agradecer a Huascar Pimentel su asesoramiento técnico.