La anemia es una entidad clínica que se detecta frecuentemente en la evaluación preoperatoria, especialmente en pacientes de edad avanzada. Se asocia a un aumento de la morbimortalidad perioperatoria, así como a una mayor probabilidad de transfusión de sangre alogénica (TSA), con los riesgos que ello implica.
Aunque la anemia puede ser multifactorial y difícil de tipificar en algunos casos, sus causas más frecuentes son las deficiencias nutricionales (hierro, ácido fólico y vitaminaB12) y la anemia por enfermedad crónica o anemia inflamatoria.
En el paciente candidato a cirugía vascular arterial la prevalencia de anemia preoperatoria se sitúa alrededor del 50%. Además, uno de cada 3 pacientes presenta anemia en los 3meses previos a la cirugía.
El estado inflamatorio, inherente al proceso crónico vascular, y las pérdidas sanguíneas quirúrgicas favorecen la predisposición a padecer anemia.
La anemia, como factor de mal pronóstico perioperatorio, exige su diagnóstico y tratamiento.
Se proponen algoritmos para el manejo de la anemia, diferenciando la cirugía programada de la urgente. Se destaca la administración preferente de hierro por vía intravenosa en los períodos preoperatorio y postoperatorio precoz.
Anaemia is a clinical condition that is frequently detected in the pre-operative evaluation, particularly in elderly patients. Anaemia is associated with increased peri-operative morbidity and mortality, as well as a greater likelihood of allogeneic blood transfusion, along with the risks involved.
Although anaemia can be due to many factors and difficult to establish in some cases, its most common causes are nutritional deficiencies (iron, folic acid, and vitaminB12) and anaemia of chronic inflammatory disease.
In patient candidates for arterial vascular surgery, preoperative anaemia prevalence is around 50%. In addition, one out of three patients has anaemia in the 3months prior to surgery.
The inflammatory condition, inherent to chronic vascular processes, and surgical blood loss favours the predisposition to anaemia.
Anaemia, as factor of poor peri-operative prognosis, requires diagnosis and treatment.
Algorithms are proposed for managing the anaemia, differentiating scheduled from urgent surgery. The administration of IV iron should be in the preoperative and early postoperative periods.
La anemia es una entidad clínica que se detecta frecuentemente en la evaluación preoperatoria y, de forma especial, en la población de edad avanzada1. Se asocia a un aumento de la morbimortalidad perioperatoria2,3, así como a una mayor probabilidad de transfusión de sangre alogénica (TSA), con los riesgos que ello implica4. Supone, además, una disminución en la calidad de vida del paciente postoperado, frecuentemente ignorada.
La literatura existente sobre el riesgo perioperatorio de la anemia en cirugía ortopédica5-7 y cirugía cardiaca8-12 ha conducido al desarrollo de protocolos para optimizar su diagnóstico y su manejo. Sin embargo, en cirugía vascular la investigación es más escasa, condicionando su abordaje en la práctica clínica.
En el paciente candidato a cirugía vascular arterial la prevalencia de anemia preoperatoria es aproximadamente del 50%, aunque supera este porcentaje en mayores de 75años y en pacientes con diabetes, hipertensión, cardiopatía e insuficiencia renal13-17, enfermedades típicamente presentes en este tipo de pacientes. El estado inflamatorio —inherente al proceso crónico vascular— y las pérdidas sanguíneas quirúrgicas aumentan todavía más la predisposición a padecer anemia. La cardiopatía (por baja reserva y/o por coronariopatía) disminuye la capacidad para tolerarla.
Diversos factores, entre los que destacan la anemia y la TSA, son predictores independientes de morbimortalidad a los 30días de una cirugía arterial. Cada punto de descenso del valor normal de hemoglobina supone un aumento del 4,2% del riesgo de mortalidad a los 30días, siendo esta mucho mayor en pacientes con anemia preoperatoria14,15,18,19. Un valor de Hb<10g/dl en el preoperatorio se ha identificado como un factor de riesgo de mortalidad inmediata y tardía en pacientes sometidos a cirugía vascular20.
La TSA, pese a sus incuestionables indicaciones y beneficios en determinados casos, no es una medida exenta de riesgos. Sus efectos negativos sobre la morbimortalidad perioperatoria están sobradamente demostrados.
Por todo lo expuesto, actualmente se considera la anemia preoperatoria como un marcador de mala situación sistémica basal y exige por nuestra parte intentos de corrección de la misma tanto pre como postoperatorios para optimizar los resultados a corto y a largo plazo.
Etiología y fisiopatología de la anemia preoperatoriaLa anemia, según los criterios de la OMS, se define como un valor de hemoglobina (Hb) inferior a 12g/dl en mujeres y menor a 13g/dl en varones. Aunque la anemia puede ser multifactorial y difícil de tipificar en algunos casos, sus causas más frecuentes son las deficiencias nutricionales (hierro, ácido fólico y vitaminaB12) y la anemia por enfermedad crónica (también llamada anemia de la inflamación).
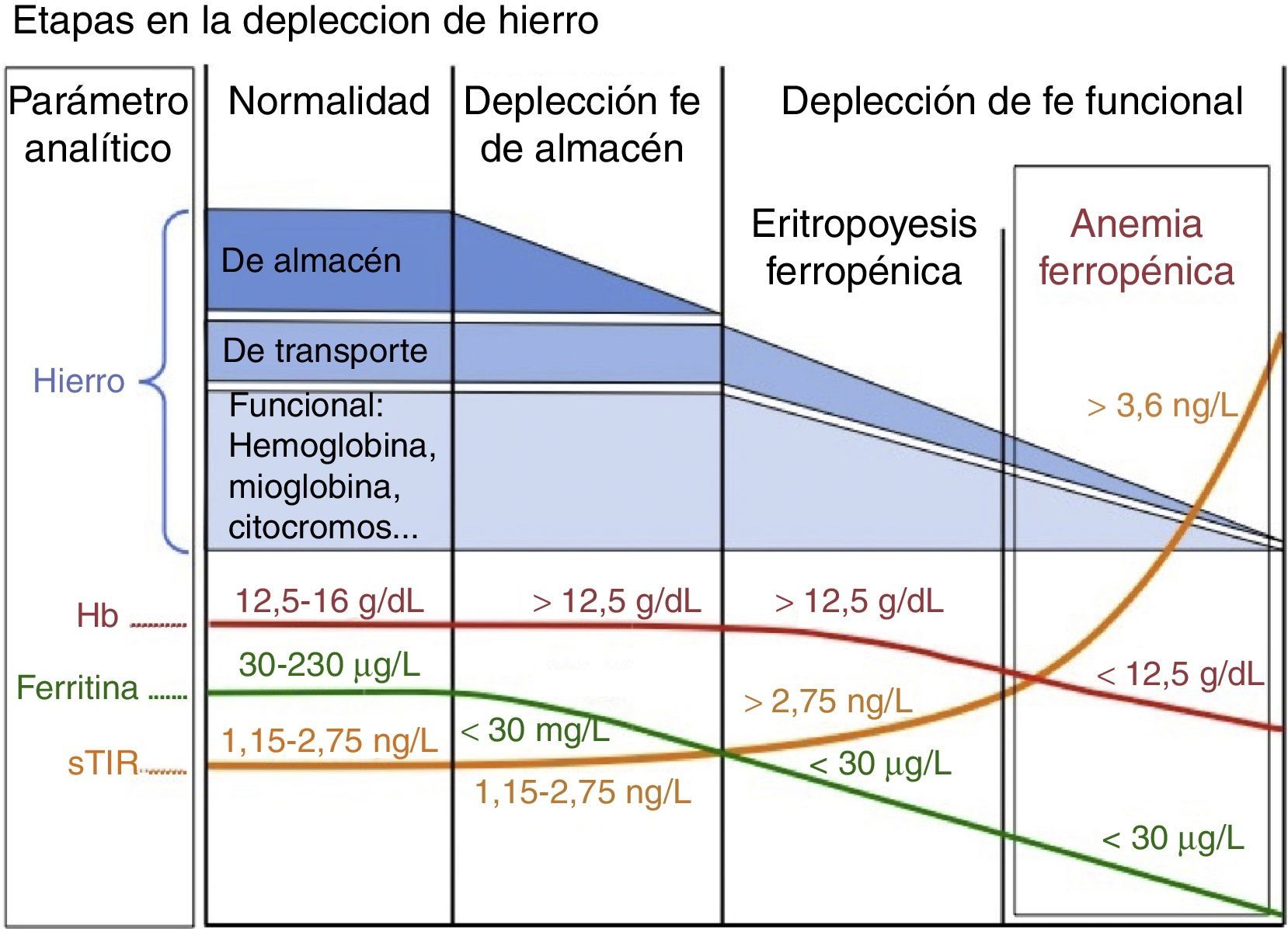
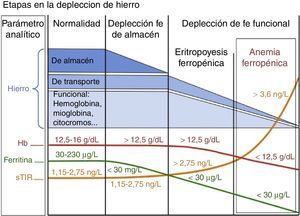
La ferropenia es la deficiencia nutricional más común en el mundo industrializado. Asimismo puede haber carencia de otros nutrientes eritropoyéticos —como vitaminaB12 y folatos—, especialmente en pacientes ancianos y en pacientes desnutridos21-23. La mayor parte del hierro necesario para la eritropoyesis proviene del reciclado del grupo hem de los eritrocitos en las células del sistema fagocítico mononuclear (SFM). Cuando aumentan las demandas o las pérdidas o disminuye la absorción se ha de recurrir a los depósitos de hierro, que irán disminuyendo. El déficit de hierro presenta varios estadios, empezando por la depleción férrica, que es seguida por la eritropoyesis ferropénica y acaba originando una anemia ferropénica (típicamente microcítica e hipocrómica) cuando no se dispone del hierro suficiente para la síntesis de la hemoglobina (fig. 1).
La anemia de la inflamación es especialmente prevalente en los pacientes candidatos a cirugía vascular debido a la repercusión sistémica de la propia vasculopatía, a la cronicidad de la misma y a la florida comorbilidad acompañante. En muchas ocasiones también se asocia a ferropenia verdadera. Las principales características de la anemia de la inflamación son24:
- •
Bloqueo de la absorción digestiva de hierro por aumento de la síntesis hepática de hepcidina.
- •
Secuestro de hierro en las células del SFM, lo que perpetúa la eritropoyesis ferropénica.
- •
Hipersecreción de mediadores inflamatorios con bloqueo de la producción y de la respuesta a la eritropoyetina endógena y alteración de los progenitores eritroides.
Como hemos apuntado antes, la anemia acompaña a la senectud de manera frecuente. Conforme la edad avanza aumenta el tamaño de los hematíes y la viscosidad de la sangre. Paralelamente disminuye la vida media del eritrocito, el número de células eritropoyéticas, su respuesta a la eritropoyetina endógena y la producción de esta25. Además, la participación de citoquinas (aun en ausencia de enfermedad crónica) y alteraciones en la función renal contribuyen a la alta prevalencia de anemia en los pacientes ancianos. En este rango de edad la etiología se reparte a partes iguales entre la anemia por déficit de nutrientes, la anemia de la inflamación y la anemia de causa desconocida23.
Tipificación de la anemia preoperatoriaPese a la ausencia de síntomas, la anemia en pacientes candidatos a cirugía vascular debe considerarse un signo de alerta y se ha de investigar y tratar para asegurar la mejor preparación perioperatoria.
La conducta clínica comienza por descartar la presencia de pérdidas sanguíneas (digestivas o ginecológicas). Complementaremos el cribado de la anemia con:
- -
Estudio del metabolismo del hierro (sideremia, ferritina, índice de saturación de la transferrina [IST] y receptor soluble de la transferrina [sTfR]).
- -
Determinación de otros nutrientes implicados en la eritropoyesis (vitaminaB12 y ácido fólico).
- -
Valoración del perfil inflamatorio sistémico (proteínaC reactiva [PCR] y/o velocidad de sedimentación globular [VSG]).
Los índices eritrocitarios, especialmente el volumen corpuscular medio, solo se ven alterados ante deficiencias prolongadas. No debe esperarse a que aparezca una microcitosis para iniciar el tratamiento de corrección de la anemia, ya que se trata de un indicador tardío26 que refleja una depleción de depósitos importante.
Se considera patológico un valor de ferritina <15ng/ml, aunque para aumentar la sensibilidad se suele incrementar este umbral a 30ng/ml. Sin embargo, la ferritina es un reactante de fase aguda, y múltiples factores (inflamación, neoplasia, edad…) hacen aumentar sus niveles. Podríamos decir que una ferritina baja confirma una ferropenia, pero una elevación de la misma no la descarta. El valor umbral del IST es del 16%, o algo más alto (20%) en presencia de inflamación26. Desafortunadamente es un valor muy cambiante debido a la variabilidad circadiana de la sideremia y de la transferrina, necesarias para su cálculo. El receptor soluble de la transferrina (sTfR) aumenta ante el déficit de hierro funcional y se ve inalterado en la inflamación y en la enfermedad crónica, lo que sirve de ayuda para discriminar casos de ferropenia con ferritina «falsamente» elevada27 (tabla 1).
Diferentes tipos de anemia y parámetros férricos
| Parámetro | Anemia ferropénica | Anemia por enfermedad crónica o inflamatoria | Anemia mixta |
|---|---|---|---|
| Ferritina | Baja (a veces alta; ver texto) | Normal o alta | Normal |
| IST | Baja | Normal o baja | Baja |
| sTfR | Alta | Normal | Alta o normal |
IST: índice de saturación de la transferrina; sTfR: receptor soluble de la transferrina.
El tratamiento preoperatorio de la anemia en pacientes de cirugía vascular mayor debería realizarse con hierro intravenoso (i.v.) por 2 razones: por su rapidez de efecto y por la presencia de hepcidina circulante (que bloquea la absorción digestiva de hierro oral y la liberación de hierro intracelular del SFM).
Los preparados de hierro i.v. de uso actual en clínica son hierro sacarosa (Venofer®) y hierro carboximaltosa (Ferinject®). La eficacia de ambos preparados férricos y sus perfiles de seguridad han sido valorados en diferentes situaciones clínicas, tanto en pacientes médicos como quirúrgicos, encontrándose con hierro carboximaltosa una mayor rapidez de recuperación de la anemia (por permitir administrar dosis mayores y en menor tiempo), una mayor comodidad para el paciente y una reducción de recursos sanitarios28-30.
Existen estudios farmacoeconómicos (de coste-beneficio, de minimización de costes y análisis coste-utilidad) que demuestran que el hierro carboximaltosa tiene la mejor relación coste-efectividad de los preparados de hierro i.v. disponibles en la actualidad31-34, tanto en el paciente ambulatorio como en el hospitalizado.
Cuando el paciente padece anemia inflamatoria, asociada o no a ferropenia, puede estar indicada la estimulación eritropoyética, con eritropoyetina recombinante humana (rHuEPO). Esta se ha utilizado ampliamente en la anemia asociada a la insuficiencia renal y en oncohematología, aunque en los últimos años se ha extendido su uso a otras indicaciones, como donación autógena de sangre y trasplante alogénico de médula. El preparado comercial recomendado para el entorno quirúrgico es la eritropoyetina alfa. Sin embargo, no es un tratamiento exento de riesgos (se ha asociado a incremento de eventos tromboembólicos35). Junto con el uso de rHuEPO, es imprescindible el tratamiento complementario con hierro para evitar el déficit funcional36. Existen estudios de alta calidad metodológica que avalan la eficacia del tratamiento con hierro i.v. y eritropoyetina en pacientes candidatos a cirugía cardíaca y a cirugía oncológica colorrectal37,38.
Mantener los parámetros hematológicos en rangos de normalidad es complicado durante el perioperatorio de la cirugía vascular mayor por la pérdida hemática intraoperatoria y por la vulnerabilidad sistémica posterior. En dicho escenario, la TSA es una medida rápida de corrección de la anemia aguda, especialmente en quirófano y en las horas siguientes. Actualmente se recomiendan esquemas transfusionales restrictivos. En el paciente vascular parece juicioso un umbral transfusional que esté en torno a 8g/dl (más cerca de 9g/dl si hay cardiopatía isquémica). Diversos estudios abogan por la utilización de la transfusión autógena intraoperatoria con dispositivos tipo recuperador celular tanto en la cirugía programada como en la urgente de aneurisma de aorta abdominal39.
Asimismo, tras la cirugía se debe garantizar la reposición de los depósitos de hierro deplecionados por el episodio quirúrgico. Con ello se puede conseguir un aumento significativo de la Hb a los 30días de la intervención y mejorar algunos aspectos de la calidad de vida40.
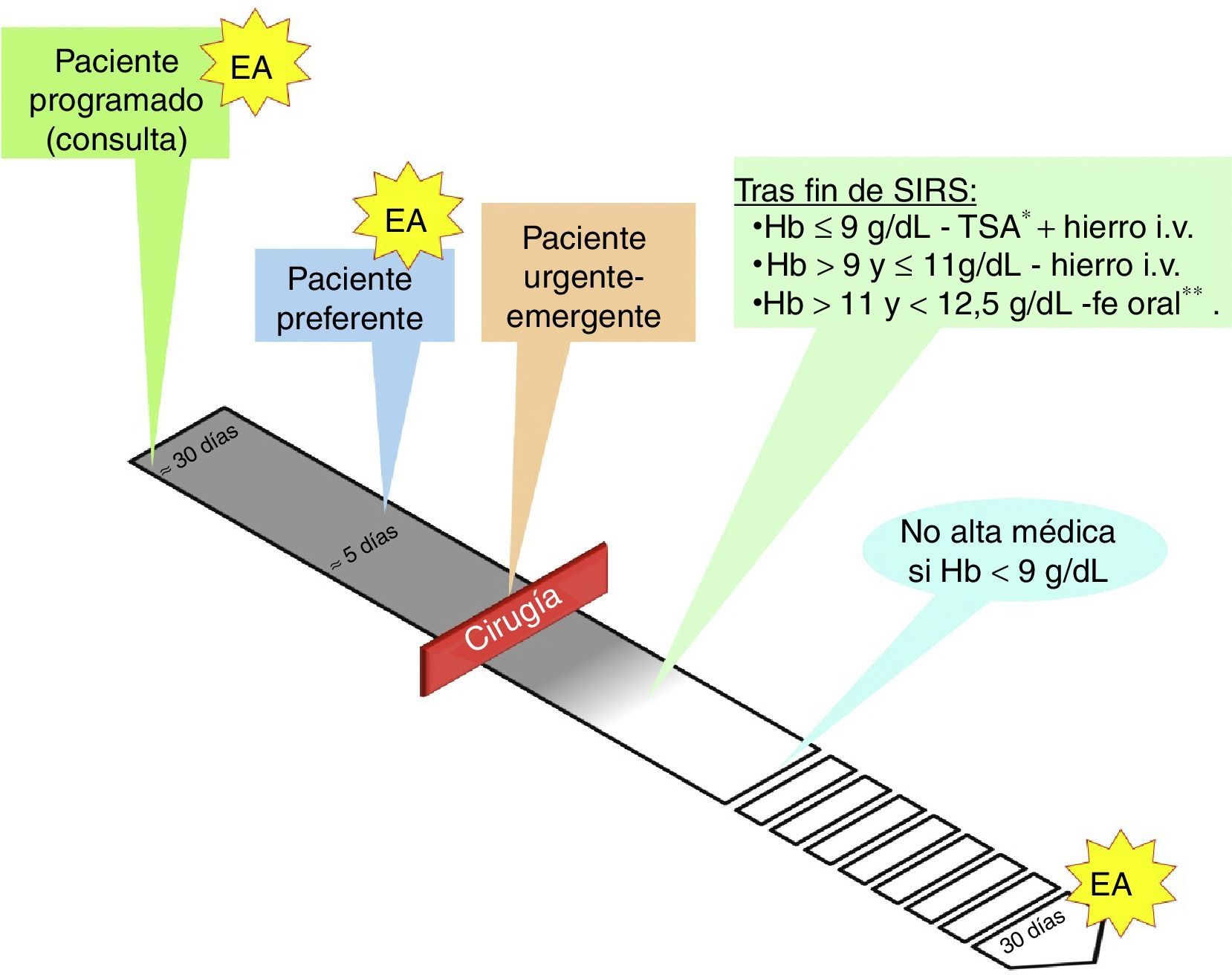
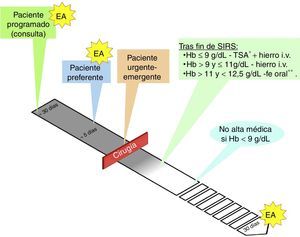
Aspectos prácticos en el manejo de la anemia en cirugía vascularLa figura 2 representa de forma esquemática los diferentes tipos de pacientes en cirugía vascular y cuando se aconseja el estudio de anemia.
Manejo perioperatorio en cirugía vascular.
EA: estudio de anemia: Hb, ferritina, IST, sTfR, VSG/PCR, vitamina B12, ácido fólico.
* Umbral transfusional en torno a 8g/dl, más cerca de 9g/dl si hay cardiopatía isquémica.
** Hierro i.v. si presenta intolerancia/ineficacia conocida a hierro oral, cardiopatía descompensada, FEVI<40% o ERC.
ERC: enfermedad renal crónica; FEVI: fracción de eyección de ventrículo izquierdo; Hb: hemoglobina; IST: índice de saturación de la transferrina; PCR: proteína C reactiva; SIRS: respuesta inflamatoria sistémica; sTfR: receptor soluble de la transferrina; VSG: velocidad de sedimentación globular.
En la práctica clínica nos podemos encontrar con 3 escenarios para los que proponemos los siguientes algoritmos:
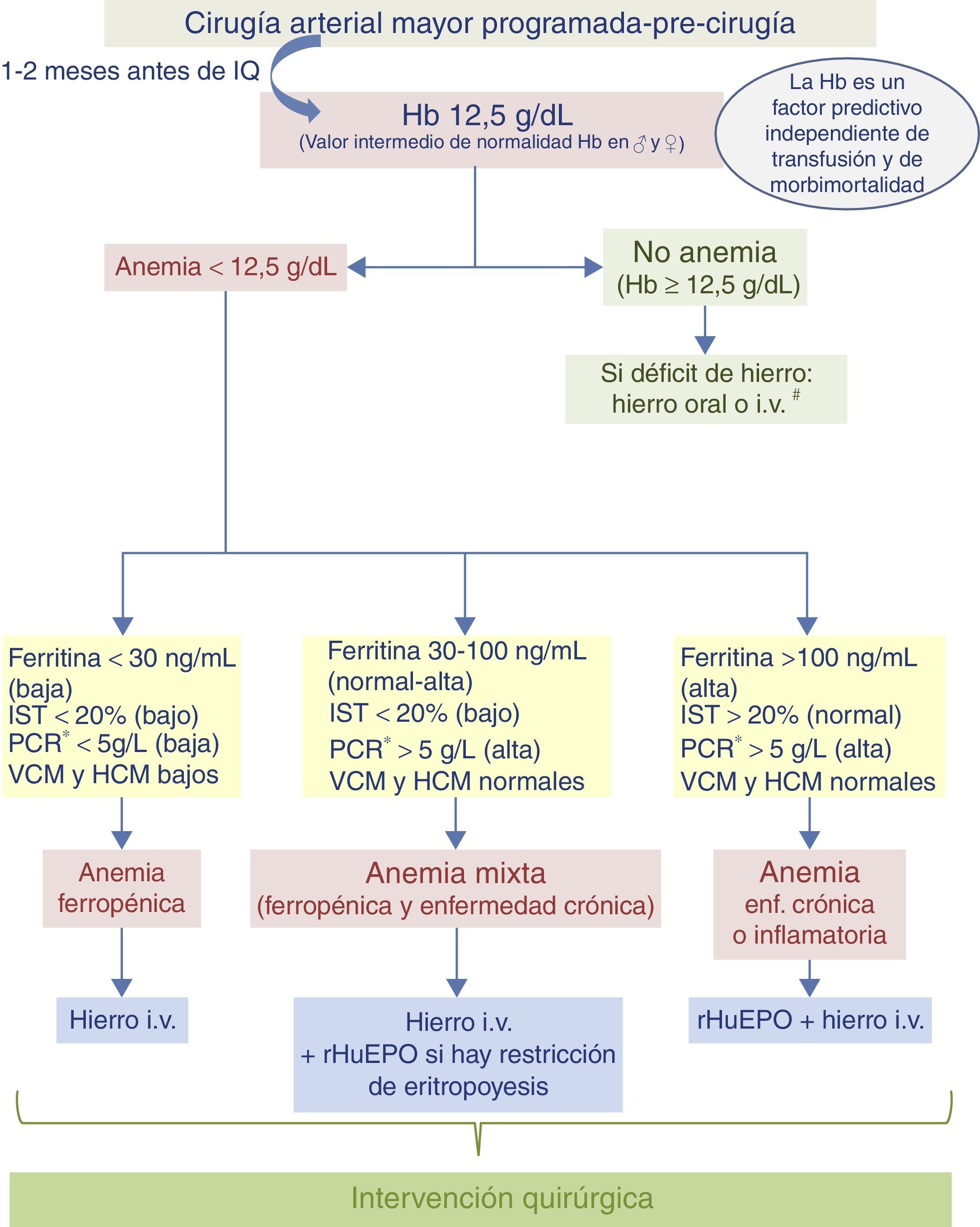
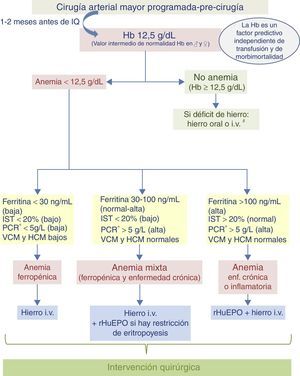
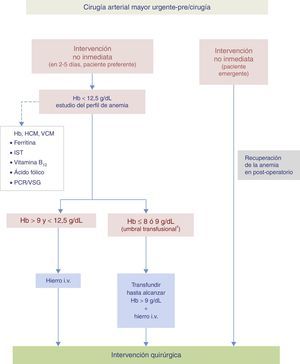
Algoritmo 1. Paciente programado para cirugía vascular (fig. 3)En la visita preoperatoria de los pacientes programados para cirugía vascular (1-2meses antes de la intervención quirúrgica) se realizará una analítica con hemograma, parámetros férricos y marcadores de inflamación (PCR o VSG) para diagnosticar el tipo de anemia que padece el paciente y cuál es el tratamiento más adecuado. Si se confirma una anemia ferropénica, el tratamiento recomendado es el hierro i.v. En el caso de pacientes con anemia inflamatoria o con anemia mixta (ferropénica+enfermedad crónica), se recomienda hierro i.v.+rHuEPO.
Algoritmo para el manejo de la anemia del paciente programado para cirugía vascular
# Hierro i.v. si presenta intolerancia/ineficacia conocida a hierro oral, cardiopatía descompensada, FEVI≤40% o ERC.
* Determinación de la PCR o, en caso contrario, determinar la VSG.
ERC: enfermedad renal crónica; FEVI: fracción de eyección de ventrículo izquierdo; Hb: hemoglobina; HCM: hemoglobina corpuscular media; i.v.: intravenoso; IQ: intervención quirúrgica; IST: índice de saturación de la transferrina; PCR: proteína C reactiva; rHuEPO: eritropoyetina recombinante humana; VCM: volumen corpuscular medio; VSG: velocidad de sedimentación globular.
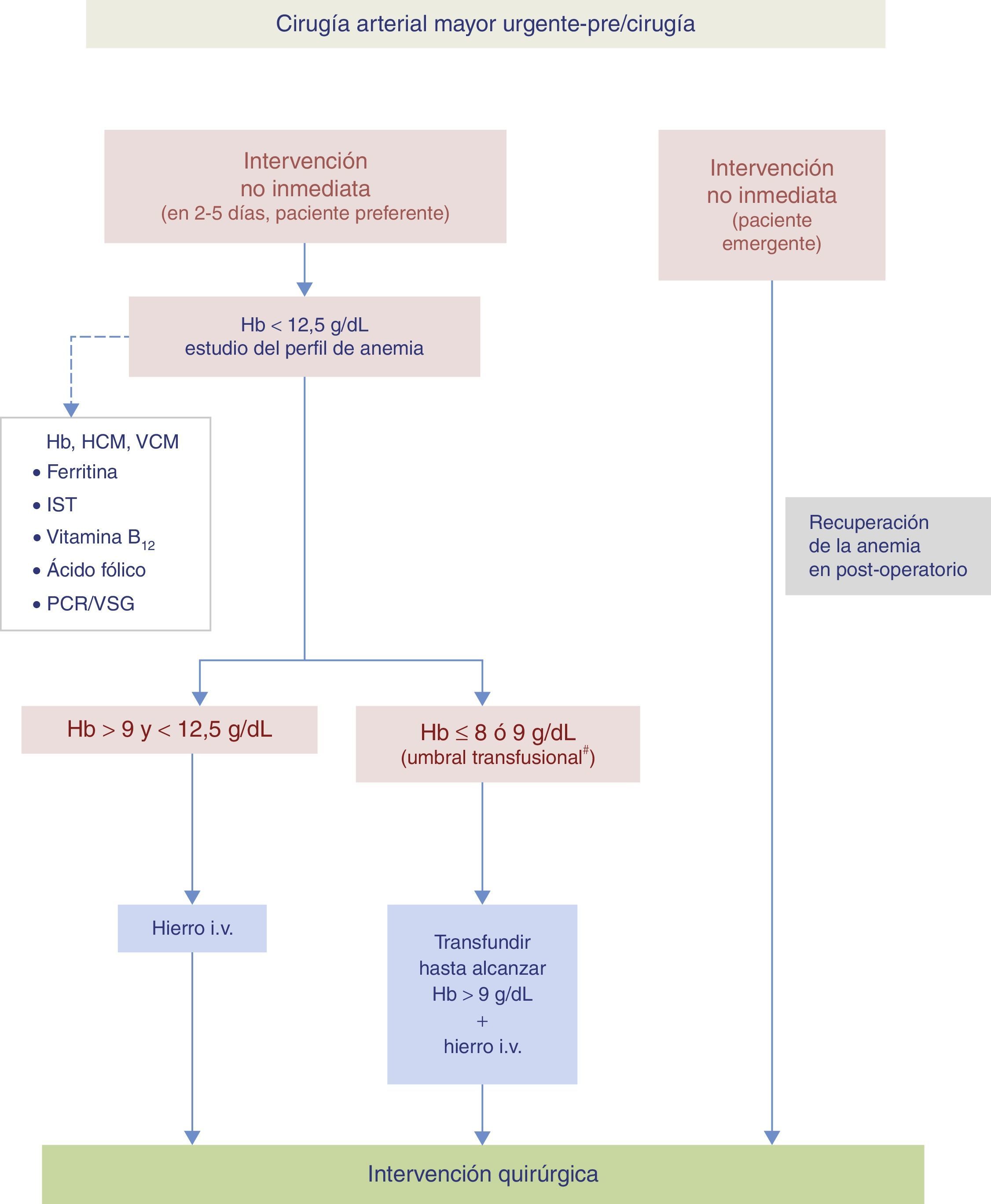
En el paciente sometido a cirugía de emergencia, todos los esfuerzos se dirigirán a minimizar las pérdidas hemáticas, mejorar la tolerancia a la anemia y tratar las complicaciones del postoperatorio.
Algoritmo para el manejo de la anemia preoperatoria del paciente sometido a cirugía vascular urgente.
# Umbral transfusional en torno a 8g/dl, más cerca de 9g/dl si hay cardiopatía isquémica.
Hb: hemoglobina; HCM: hemoglobina corpuscular media; i.v.: intravenoso; IST: índice de saturación de la transferrina; PCR: proteína C reactiva; VCM: volumen corpuscular medio; VSG: velocidad de sedimentación globular.
Cuando la intervención sea urgente pero diferible se valorará el tratamiento con hierro i.v. si su nivel de Hb es superior al umbral transfusional propuesto.
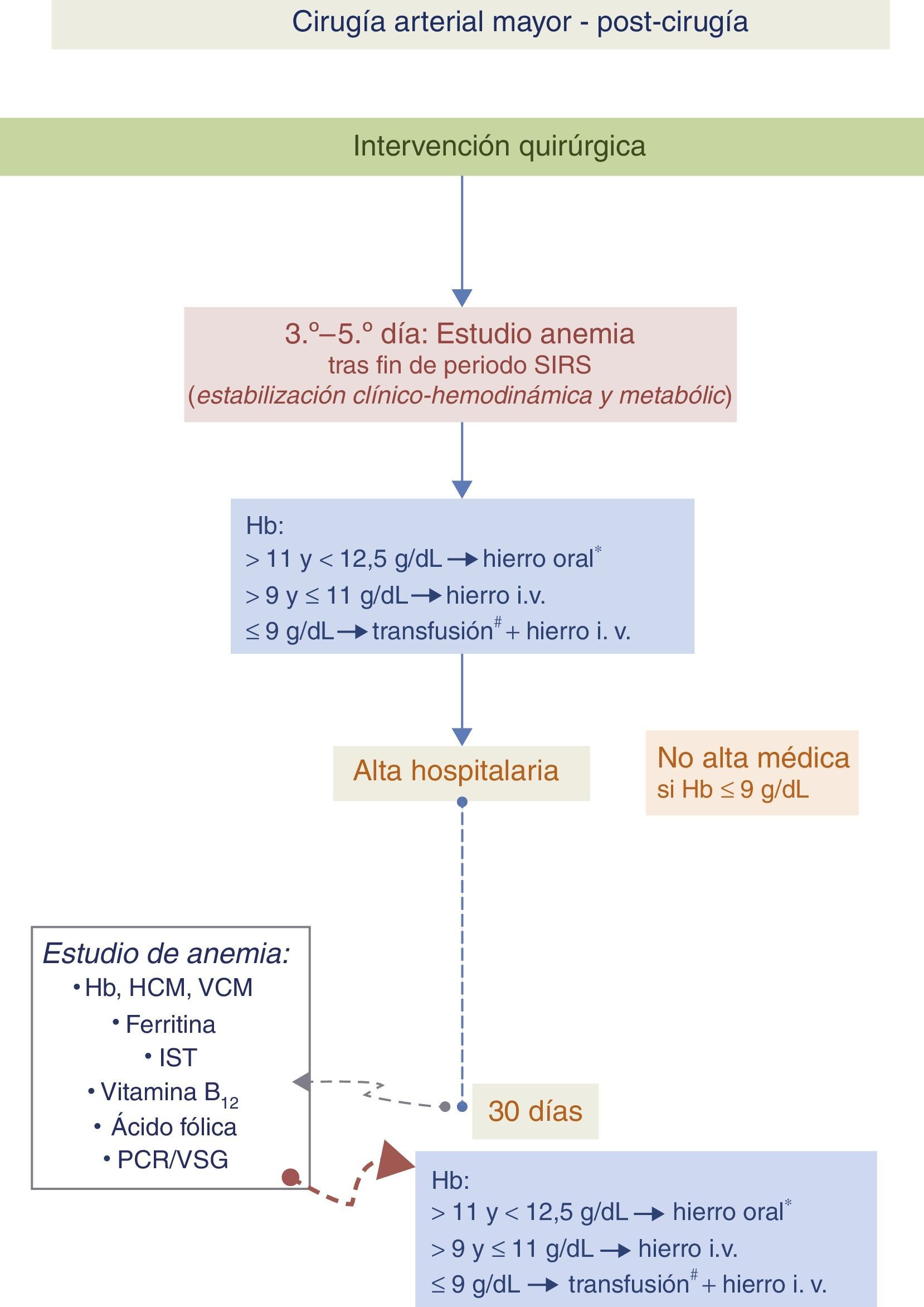
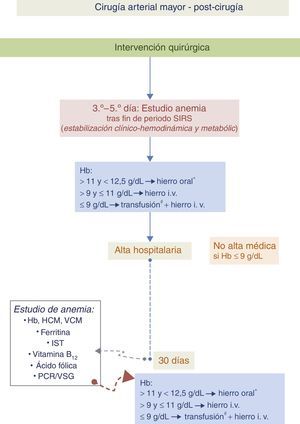
Algoritmo 3. Paciente con anemia en el postoperatorio de cirugía vascular (fig. 5)En el postoperatorio se recomienda reevaluar los valores de Hb cuando haya transcurrido el periodo inflamatorio asociado a la cirugía. Este momento variará en cada paciente y vendrá dado por una situación de estabilidad clínica en la que habrán desaparecido los signos clínicos de respuesta inflamatoria sistémica (SIRS)41. Un valor de Hb inferior al umbral transfusional comentado anteriormente nos obligará a realizar una TSA. Por encima de estos valores, ante anemias moderadas, el tratamiento de elección será el hierro i.v. (el hierro oral no resultará eficaz).
Algoritmo para el manejo de la anemia en el postoperatorio de cirugía vascular.
* Hierro i.v., si presenta intolerancia/ineficacia conocida a hierro oral, cardiopatía descompensada, FEVI≤40% o ERC.
# Umbral transfusional en torno a 8g/dl, más cerca de 9g/dl si hay cardiopatía isquémica.
Hb: hemoglobina; HCM: hemoglobina corpuscular media; i.v.: intravenoso; IST: índice de saturación de la transferrina; PCR: proteína C reactiva; VCM: volumen corpuscular medio; VSG: velocidad de sedimentación globular.
En pacientes con anemia leve (Hb>11g/dl) el tratamiento se realizará con hierro oral, excepto en aquellos con intolerancia o no respondedores al mismo, cardiopatía descompensada, fracción de eyección de ventrículo izquierdo (FEVI) ≤40% o enfermedad renal crónica (ERC). En estos casos se administrará hierro i.v.
Debemos tener en cuenta que normalmente, tras el alta hospitalaria, los depósitos férricos siguen descendiendo. Al mes del alta se realizará una analítica con hemograma y determinación de parámetros férricos y se procederá de la misma manera que la comentada previamente.
Mensajes clave- •
La anemia preoperatoria es una entidad estrechamente relacionada con la necesidad de transfusiones sanguíneas perioperatorias que se asocia a un incremento de la morbimortalidad, compromete la recuperación postoperatoria, los resultados quirúrgicos y la calidad de vida de los pacientes candidatos a cirugía vascular mayor.
- •
La anemia en el preoperatorio de cirugía vascular afecta alrededor del 50% de los pacientes.
- •
El 34% de los pacientes intervenidos de cirugía vascular mayor refieren anemia en los 3meses previos a la cirugía42.
- •
Para mejorar la recuperación perioperatoria, los resultados quirúrgicos y la calidad de vida postoperatoria de los pacientes, el tratamiento de la anemia debe formar parte de los esquemas terapéuticos perioperatorios.
- •
No debería realizarse una intervención quirúrgica programada mayor (y por tanto con riesgo de sangrado importante) en pacientes con valores de Hb<12,5g/dl y en quienes no se haya investigado, y tratado, si es posible, la anemia preoperatoria.
- •
El tratamiento de recuperación de la anemia preoperatoria en los pacientes de cirugía mayor vascular debe hacerse con hierro i.v., añadiendo, cuando esté indicado, estimulantes de la eritropoyesis.
- •
La transfusión de sangre alogénica es el tratamiento de elección en pacientes con Hb inferior al umbral transfusional establecido y sin olvidar replecionar los depósitos de hierro con hierro i.v.
- •
Administrar en el postoperatorio hierro i.v. para reponer los depósitos de hierro deplecionados y corregir la anemia siempre que los signos clínicos de respuesta inflamatoria sistémica (SIRS) inherente a la cirugía hayan desaparecido.
- •
No dejar de tratar cualquier valor de Hb≤9g/dl aunque se dé el alta hospitalaria al paciente.
- •
Solicitar un estudio de anemia a los 30días del alta hospitalaria por su médico de cabecera.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo ha habido fuentes externas de financiación para la realización de este manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.