Los anticuerpos contra canales de potasio dependientes de voltaje (CKVD) poseen 2 antígenos principales, la proteína 1 inactivada del glioma rica en leucina (leucine rich glioma inactivated protein 1 [LGI1]), vinculado a encefalitis límbica, y la proteína símil 2 asociada a contactina (contactin-associated protein-like 2 [CASPR2]), vinculado a encefalitis, neuromiotonía, síndrome de Morvan y neuropatía dolorosa1. La encefalitis límbica anti-LGI1 tiene un inicio subagudo, más frecuente en varones, con una edad media de presentación en la sexta década de vida, se caracteriza por pérdida de memoria a corto plazo, crisis focales, siendo la mayoría distónicas facio-braquiales, alteraciones psiquiátricas, alteraciones del sueño, actividad epileptiforme interictal temporal o frontocentral en el electroencefalograma (EEG), hiperintensidades en T2 y FLAIR a nivel de lóbulos temporales en la resonancia magnética (RM) cerebral e hiponatremia1–6. La asociación entre encefalitis límbica anti-LGI1 y tumores es infrecuentes, en caso de existir lo más habitual es que se trate de un timoma1. Presentamos el caso de un paciente con una forma agresiva de encefalitis límbica debido a anticuerpos CKVD contra LGI1 que respondió a rituximab.
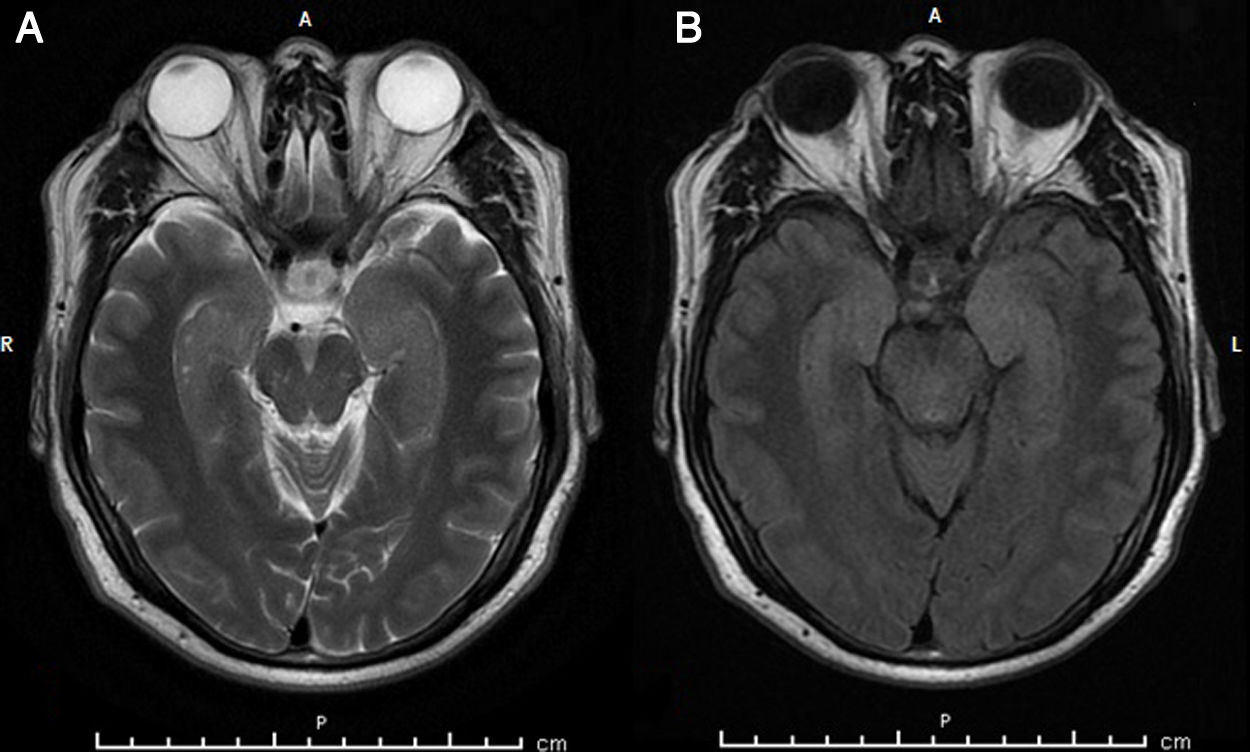
Varón de 61 años, diestro, que acudió por alteración de memoria rápidamente progresiva, insomnio y crisis epilépticas focales, sin alteración de consciencia, de 15-20s de duración, 15 por día, de 6 meses de evolución. Historia perinatal y familiar anodina, sin alergias medicamentosas, únicamente hipertensión arterial en buen control con irbesartán. Las crisis inician con aura sensitiva, parestesias en hemicráneo derecho que progresan a cuello y extremidad superior derecha ipsilateral, luego postura tónica breve de extremidad superior derecha. Previamente, se había rehusado a realizar punción lumbar indicada tras la realización de una RM cerebral y un EEG informados sin alteraciones. No respondió a levetiracetam (LEV), valproato sódico, carbamazepina (CBZ), metilprednisolona en bolus de 500mg/día intravenoso durante 3 días, pauta que se repitió tras 2 semanas sin observar cambios clínicos, oxcarbazepina y topiramato. La exploración neurológica mostró alteraciones en el test de evaluación cognitiva de Montreal (MoCA test) 20 puntos, sin otras alteraciones. En la exploración neuropsicológica estructurada mostró índice de neurocognición bajo, 62 puntos, con déficit severo en memoria verbal espontánea, evocación de figura de Rey-Osterrieth y función ejecutiva. Se amplió el estudio que mostró hiponatremia leve 134mmol/l, hemograma, perfil hepático, renal y tiroideo normales. Dos meses después, una nueva RM cerebral mostró hiperintensidades sutiles a nivel temporal mesial bilateral en T2 y FLAIR (fig. 1). El EEG control fue anodino. La punción lumbar mostró líquido cefalorraquídeo (LCR) claro, límpido, incoloro, glucosa 62mg/dl, proteínas 29,1mg/dl, 0 células/mm3, con serologías y cultivos negativos. El estudio de autoinmunidad fue positivo para anticuerpos anti-LGI1 en suero y LCR, fue negativo para anti-MAG, anti-mielina, anti-Yo, anti-Ri, anti-Hu, GABARBI/GABARB2, CASPR2, NMDA, AMPAR2/R1 y DPPX. Se realizó ultrasonido testicular, tomografía computarizada de tórax y abdomen con resultados normales. Tras este resultado se inició inmunoglobulinas intravenosas (IGIV) a dosis de 400mg/kg/día/durante 5 días, con disminución en un 50% de la frecuencia e intensidad de crisis y mejoría subjetiva de la cognición. Debido a la respuesta incompleta, se administró rituximab 2000mg intravenoso dividido en 2 partes, en un intervalo de 15 días. Se objetivó mejoría en su situación cognitiva con MoCA test de 23 puntos y alcanzó libertad de crisis que mantiene 5 meses después del tratamiento con rituximab.
La encefalitis autoinmune es una causa tratable de epilepsia farmacorresistente7. Entre el 70-80% de los casos de encefalitis límbica anti-LGI1 responden a inmunoterapia de primera línea como corticoesteroides, IGIV o plasmaféresis1. En caso de refractariedad, se han descrito resultados favorables con la segunda línea con rituximab2,7–12 o ciclofosfamida1,13. El cuadro de nuestro paciente, con crisis focales sin alteración de consciencia y deterioro de la memoria a corto plazo de inicio subagudo, muestra datos clínicos y analíticos a favor del diagnóstico de encefalitis autoinmune anti-LGI1. Presentó un comportamiento agresivo, con farmacorresistencia y una respuesta insuficiente a la primera línea de inmunoterapia. Fue hasta la segunda dosis de rituximab que se alcanzó libertad de crisis y mejora significativa de la situación cognitiva.
El rituximab es un anticuerpo monoclonal parcialmente humanizado dirigido contra CD20 (del inglés, cluster of differentiation 20), una glucoproteína primariamente encontrada en la superficie de los linfocitos B. Actúa disminuyendo los linfocitos B naïve y de memoria a través de toxicidad celular mediada por anticuerpos, activación del complemento e inducción de apoptosis13. El rituximab es ampliamente utilizado en el tratamiento de múltiples trastornos autoinmunes del sistema nervioso central y periférico13. Este fármaco constituye una terapia de segunda línea, con mayor efectividad reportada1,2,7–14 ante un comportamiento agresivo en las encefalitis autoinmunes.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y han obtenido los permisos correspondientes.
FinanciaciónEsta investigación no recibió ninguna subvención específica de agencias de financiación en los sectores público, comercial o sin fines de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.