Medida de variaciones de la presión intracraneal estimada mediante medida ecográfica del diámetro del nervio óptico en perioperatorio de cirugía traumatológica de extremidad inferior. Comparación de los cambios registrados entre pacientes intervenidos bajo anestesia general o anestesia raquídea.
MetodologíaEstudio de cohortes prospectivo en 30 pacientes programados para cirugía traumatológica: 24 bajo anestesia raquídea y 26 con anestesia general. Se recogieron datos de filiación, anestésico-quirúrgicos y diámetros ecográficos 3 mm retrobulbares bilaterales en tres momentos: basal, 10 minutos tras la punción dural o inducción y 10 minutos tras recuperar bloqueo motor. Análisis estadístico descriptivo de las variables analizadas y estudio de correlación entre los dos grupos (anestesia general y raquídea) en los tres momentos del estudio mediante el índice Rho de Spearman para pruebas no paramétricas.
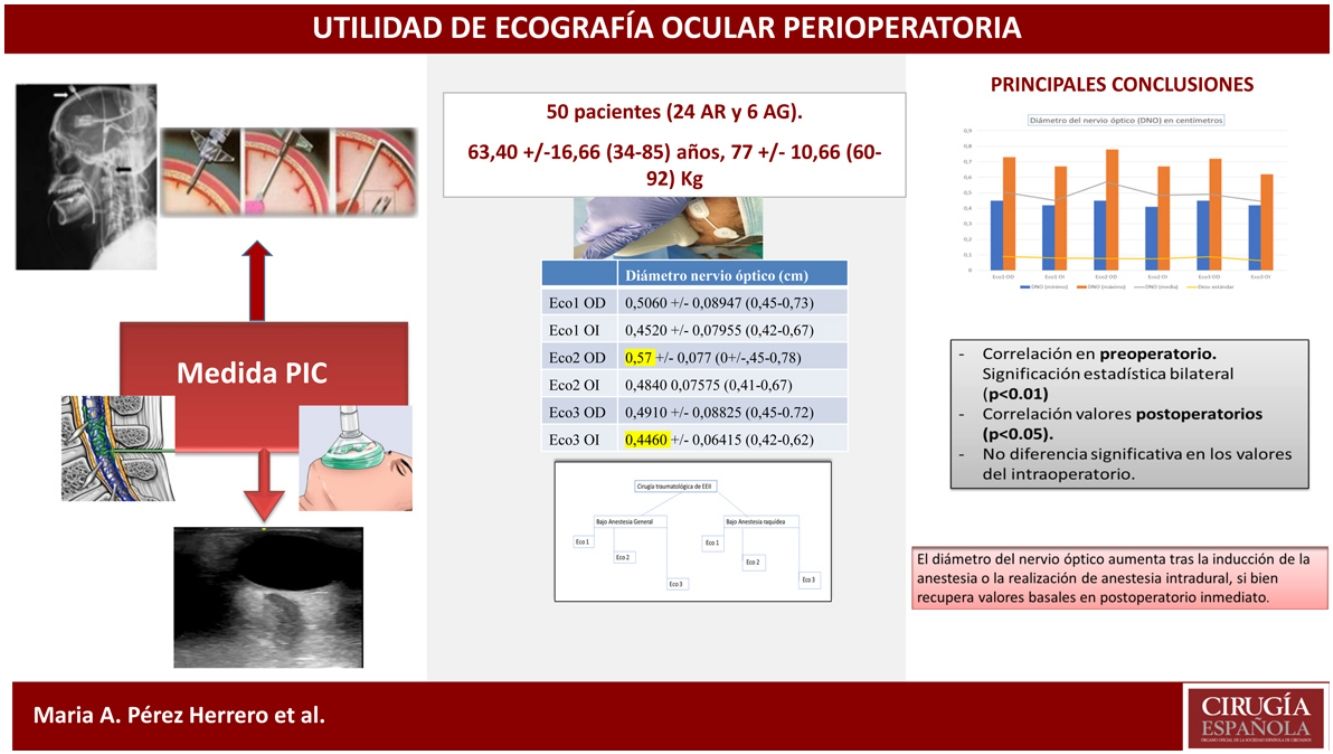
ResultadosSe estudiaron 25 varones y 25 mujeres, de 63,40 ± 16,36 años, 77 ± 10,66 kg de peso, tiempo quirúrgico 93,20 ± 23,659 minutos; 28 casos precisaron isquemia con duración de 58,15 ± 10,57 minutos. Medidas ecográficas del nervio óptico preoperatorias: 5,06 ± 0,89 mm (ojo derecho) y 4,45 ± 0,7955 (ojo izquierdo); intraoperatorias: 5,70 ± 0,77 mm (ojo derecho) y 4,84 ± 0,75 (ojo izquierdo) y postoperatorias: 4,91 ± 0,88 mm (ojo derecho) y 4,46 ± 0,64 (ojo izquierdo). Ambos grupos presentaron parámetros comparables. Significación estadística bilateral entre valores preoperatorios (p < 0,01) y postoperatorios (p < 0,05) en ambos grupos (anestesia general y raquídea).
ConclusionesEl diámetro del nervio óptico aumenta tras la inducción anestésica o anestesia intradural, para recuperar valores basales en postoperatorio inmediato.
Measurement of optic nerve diameter variations in lower limb trauma surgery. Comparation between patients under general or spinal anesthesia changes.
MethodsProspective observational study in 50 patients undergoing lower limb trauma surgery under general (26) or spinal anesthesia (24). Data on filiation, surgical, anesthetic and optic nerve diameter were collected at three moments: before surgery, 10 minutes after dural puncture or anesthesia induction, and 10 minutes after motor blockade recovery. Descriptive statistical analysis and Spearman Index to study groups (general anesthesia and spinal anesthesia) correlation.
Results25 males and 25 females were studied, 63,40 ± 16,36 years aged, 77 ± 10,66 kg weight, 93,20 ± 23,659 minutes of surgery duration. Ischemia was needed on 28 cases, for 58,15 ± 10,57 minutes of duration. Preoperative optic nerve measurements: 5,06 ± 0,89 mm (right eye) and 4,45 ± 0,7955 (left eye); intraoperative: 5,70 ± 0,77 mm (right eye) and 4,84 ± 0,75 (left eye); Postoperative: 4,91 ± 0,88 mm (right eye) and 4,46 ± 0,64 (left eye). Two both groups presented similar data. Bilateral statistic signification between groups in preoperative (p< 0.01) and postoperative data.
ConclusionsOptic nerve diameter grows after spinal anesthesia and general anesthesia as well; to recover preoperative data in immediate postoperative period.
La ultrasonografía a la cabecera del paciente (POCUS) está alcanzando gran desarrollo pues constituye una potente herramienta para la monitorización de los pacientes1. La presión intracraneal puede medirse de forma invasiva (manometría subaracnoidea o intraparenquimatosa) o no invasiva (métodos fluidodinámicos, oftálmicos y óticos, electrofisiología, resonancia magnético nuclear, ecografía Doppler transcraneal, medida de la velocidad de flujo sanguíneo cerebral, espectroscopia de infrarrojos). La medida del diámetro del nervio óptico a nivel retrobulbar mediante ultrasonografía2,3 debería formar parte de la monitorización perioperatoria, junto a la ecografía cardiaca, pulmonar, hemodinámica, abdominal y de vía aérea4–7.
La anestesia espinal está contraindicada en caso de hipertensión intracraneal, por otra parte, se han descrito casos de analgesia obstétrica intradural para el parto en pacientes con hipertensión intracraneal, tras drenaje lumbar de líquido cefalorraquídeo, sin complicaciones8.
Diversos factores anestésico-quirúrgicos se han asociado a aumentos de presión intracraneal, lo cual provoca mayor riesgo de complicaciones neurológicas, un alargamiento del tiempo de recuperación postquirúrgica y peores resultados. Entre estos factores destacan: la cirugía abdominal, la técnica anestésica, las maniobras de intubación o extubación, la aspiración de secreciones bronquiales, la ventilación mecánica (PEEP), cirugía laparoscópica. Actualmente, el uso de anestesia epidural/raquídea suele asociarse a la anestesia general, pero su uso permanece en discusión en pacientes con hipertensión intracraneal9.
Partiendo de la hipótesis de que la monitorización de la presión intracraneal de forma no invasiva (mediante medida del diámetro del nervio óptico a nivel retrobulbar) debería formar parte del estudio perioperatorio, en especial en caso de anestesia espinal, se fijaron varios objetivos de estudio. El principal objetivo fue medir las variaciones ecográficas en el diámetro del nervio óptico (parámetro indirecto de la presión intracraneal) en pacientes sometidos a cirugía traumatológica de extremidad inferior. Otros objetivos que se plantearon fueron comparar los cambios registrados en distintos tiempos del perioperatorio entre pacientes intervenidos bajo anestesia general o anestesia raquídea.
Pacientes y métodosDiseño: Estudio de cohortes prospectivo en pacientes intervenidos de cirugía traumatológica programada de extremidad inferior que aceptaron y firmaron documento de consentimiento informado para participación en el estudio. El estudio forma parte del proyecto sobre la «Utilidad del POCUS en el periodo perioperatorio», el cual fue aprobado por el Comité ético del Hospital Clínico Universitario de Valladolid con código PI 17-634. Fue desarrollado entre el 2 de mayo y el 15 de julio de 2020.
Criterios de inclusión: Pacientes mayores de 18 años con estado físico ASA I-III, programado para cirugía de miembros inferiores bajo anestesia raquídea o general, con consentimiento informado por escrito para participar en este estudio.
Criterios de exclusión: No cumplir criterios de inclusión, contraindicación para realización de la técnica, antecedentes de traumatismo craneoencefálico u ocular, o hipertensión intracraneal crónica, neurocirugía previa, tumor cerebral o enfermedades neurológicas u oftálmicas conocidas.
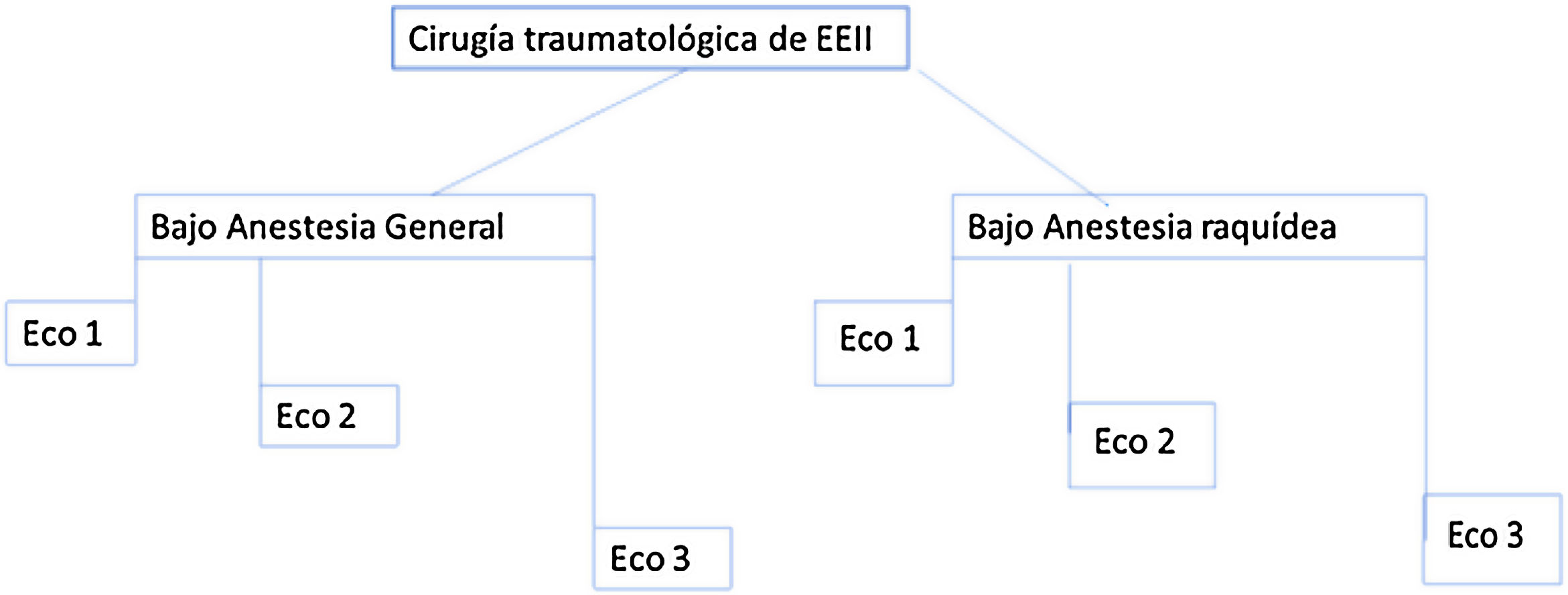
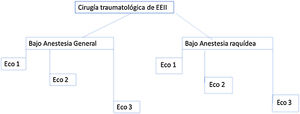
A todos los pacientes se les realizó un estudio ecográfico del diámetro del nervio óptico a 3 mm posterior al globo ocular mediante aparato de ultrasonidos Mindray Diagnostic Ultrasound System Model Z6 en modo-B con transductor lineal de alta frecuencia (6-12 MHz), fijando unos parámetros de índice térmico menor de 1 e índice mecánico menor de 0,2, y colocando el foco a 1-2 cm de la entrada del nervio óptico en el globo ocular. El escaneo se desarrolló en tres momentos: antes de la cirugía, 10 minutos tras la punción dural o inducción y 10 minutos tras recuperar el bloqueo motor en sala de despertar o previo al alta de esta unidad en caso de anestesia general, tal como se resume en la figura 1.
Resumen de la metodología del estudio. Eco 1: en preoperatorio. Eco 2: 10 minutos tras la punción dural en caso de anestesia raquídea o inducción e intubación en caso de anestesia general. Eco 3: una vez recuperado de la anestesia, al alta de la Unidad de Recuperación Postquirúrgica (ya sin bloqueo motor o al menos con movilidad de la rodilla).
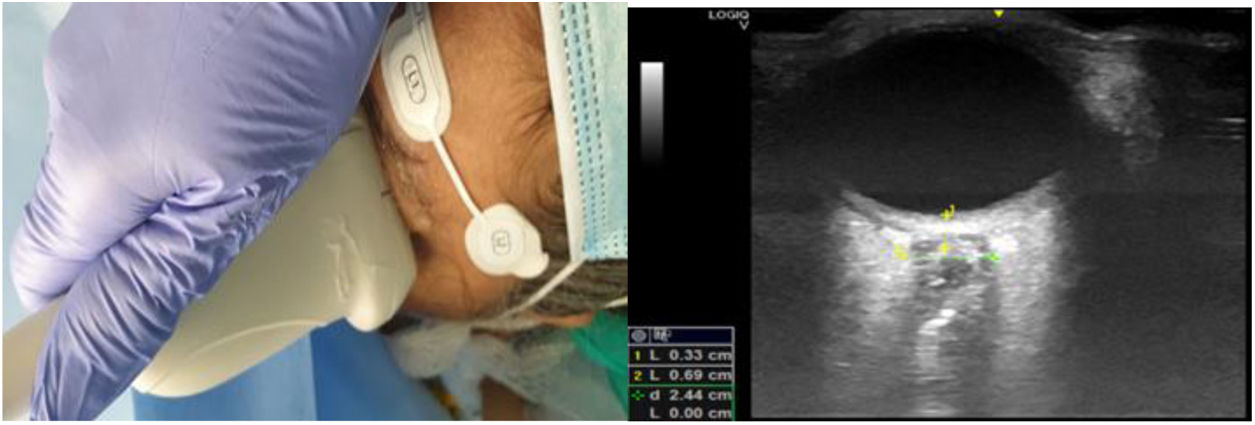
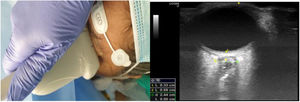
La exploración ecográfica se efectuó con el paciente en decúbito supino con cabeza en posición neutra (flexión de cuello y extensión de cabeza) y ojos cerrados. El operador se situaba a la cabecera del paciente. La sonda ecográfica se apoyaba con suavidad sobre el párpado superior, tras aplicar abundante gel ecogénico, en eje transverso del globo ocular, rotándola hasta encontrar la imagen del nervio óptico, tal como aparece en la figura 2. Se realizaba la medida del diámetro del nervio óptico a 3 mm posteriores a su entrada en el globo ocular.
Colocación de sonda lineal e imagen del globo ocular e imagen ecográfica del globo ocular. El estudio ecográfico se realizaba con aparato de ultrasonidos en modo-B, fijando unos parámetros de índice térmico menor de 1 e índice térmico menor de 0,2. El foco se situaba 1-2 cm por debajo del objetivo (origen del nervio óptico en el globo ocular).
En la sala de preanestesia se realizaba el primer estudio ecográfico (Eco 1), tras obtener el consentimiento verbal y escrito para la realización de la técnica y el estudio, y tras canalizar una vía venosa en la extremidad superior contralateral a la extremidad inferior a intervenir, y monitorización básica (pulsioximetría, electrocardiograma y presión arterial no invasiva).
Todas las imágenes eran recogidas por anestesiólogos con experiencia acreditada en ecografía.
En un segundo tiempo, y ya en la sala quirúrgica, se realizaba la técnica anestésica indicada (anestesia general o raquídea) de la forma habitual:
- -
Grupo de anestesia intradural (grupo AR). Con el paciente en decúbito lateral sobre la extremidad inferior patológica o susceptible de cirugía y monitorización estándar, se realizaba punción intradural aséptica con aguja con punta Whitacre de 26G, inyectando 10-12,5 mg de bupivacaína 0,5% hiperbara. Tras la comprobar la presencia de bloqueo motor y sensitivo adecuado para la intervención, se colocaba al paciente en decúbito supino y en ese momento se obtenía la ecografía del globo ocular (Eco 2) siguiendo técnica explicada en el apartado anterior. Inmediatamente después, el paciente era colocado para la intervención: decúbito supino o decúbito lateral sobre el lado contralateral a la extremidad a operar. En caso de registrar cualquier evento adverso (hipotensión con presión arterial media por debajo de 55 mmHg, bradicardia) eran tratados mediante sueroterapia o inotrópicos y vasoconstrictores, según estuviera indicado.
- -
Grupo anestesia general (Grupo AG). Se procedía a la inducción anestésica intravenosa con el paciente en decúbito supino con Propofol 2 mg/kg, rocuronio (0,6 mg/kg), tras lo cual se procedía a la intubación orotraqueal mediante laringoscopia directa. El mantenimiento anestésico se realizaba con sevoflurano a 1,5-2% inhalatorio, para niveles de PSI de Sedline® de 30-40, bolos intravenosos de fentanilo (0,05 mg) en caso de aumento de la presión arterial o la frecuencia cardiaca por encima de un 20% respecto a los valores basales, y rocuronio en bolus 0,1 mg/kg intravenosos en caso de precisar relajación muscular.
La ecografía ocular (Eco 2) se realizaba en decúbito supino tal como se ha indicado anteriormente. En caso de necesitar recolocar al paciente en decúbito lateral, para iniciar la intervención, se procedía una vez finalizado el estudio ecográfico.
Una vez finalizada la intervención, se revertía la relajación muscular con Sugammadex® a 2 mg/kg intravenosos.
En todos los pacientes se administró 1 g de paracetamol y profilaxis antiemética con dexametasona 0,1 mg/kg intravenosos tras la inducción.
Una vez finalizada la intervención, se revertía la anestesia y se extubaba al paciente (en el grupo de anestesia general) y era trasladado a la Unidad de Recuperación Postquirúrgica (URPA) donde se realizaba monitorización y tratamiento habitual y un tercer estudio ecográfico (Eco 3) antes de dar el alta al paciente, siempre una vez recuperado del bloqueo motor.
Recogida de datosSe recogieron datos de filiación (edad, sexo, peso), anestésico-quirúrgicos (tipo y duración de la cirugía, entendiendo como tiempo quirúrgico el comprendido entre la incisión y la retirada de la isquemia o el último punto de sutura para cierre de piel; tiempo de bloqueo anestésico: entre la punción y la recuperación del bloqueo motor hasta la flexión de la rodilla), diámetros retrobulbares de ojo izquierdo y derecho en los tres momentos descritos en la figura 1.
Análisis estadísticoLos datos se introdujeron en una base de datos Excel® (Microsoft Office, Microsoft, EE. UU.) y se analizaron mediante el paquete estadístico PASW® v22.0 (SPSS, Inc., Chicago, IL, EE. UU.).
Estudio descriptivo de las variables analizadas. Las variables cuantitativas se presentan con la media, los valores máximo y mínimo y la desviación estándar. Las cualitativas se presentaron siguiendo su distribución de frecuencias. Se utilizó el test de Kolmogorov Smirnov para comprobar la normalidad.
Se empleó el índice Rho de Spearman para pruebas no paramétricas para estudiar la correlación entre los diámetros del nervio óptico medidos en los dos grupos (anestesia general y raquídea) en los tres momentos del estudio. Se calculó la significación asintótica bilateral entre las variables medidas. Aquellos valores de p < 0,05 se consideraron estadísticamente significativos.
ResultadosSe registraron datos de 52 pacientes, dos de los cuales fueron excluidos del estudio al haberse sospechado y posteriormente diagnosticado un desprendimiento de retina y una hipertensión intracraneal no conocidas en la ecografía ocular preoperatoria. En el caso de hipertensión intracraneal se objetivó una hemorragia intraparenquimatosa temporal en la resonancia magnética.
Se analizaron datos de 50 pacientes: 24 sometidos a anestesia raquídea y 26 bajo anestesia general. La anestesia general se realizó por imposibilidad de punción (cinco), presencia de cefalea (tres), tratamiento con antiagregantes (10) o preferencia del paciente (ocho).
Se estudiaron datos de 25 varones y 25 mujeres, con una edad media 63,40 años y desviación estándar de 16.365 (rango entre 34 y 85), un peso de 77 kg de media con desviación estándar de 10.656 (rango entre 60 y 92), y un tiempo quirúrgico de 93,20 minutos (rango entre 49 y 130) y desviación estándar de 23.659.
La técnica quirúrgica realizada requirió isquemia en 28 casos, y tuvo una duración de 58,15 minutos con desviación estándar de 10,57 y rango entre 30 y 95.
Los procedimientos realizados fueron los siguientes: artroplastia total de cadera en ocho casos y parcial en tres, artroplastia total de rodilla en 20, osteotomía valguizante de tibia en seis, recambio de prótesis de rodilla en cinco y ligamentoplastia de rodilla en otros ocho. El tiempo de bloqueo motor osciló entre 0 y 160 minutos, con una media de 112,50 y una desviación estándar de 60.519. Ambos grupos (AG y AR) presentaron parámetros comparables.
Se anotaron complicaciones perioperatorias en tres pacientes (todos del grupo de anestesia raquídea): dos casos de infección postoperatoria y una cefalea persistente tras punción.
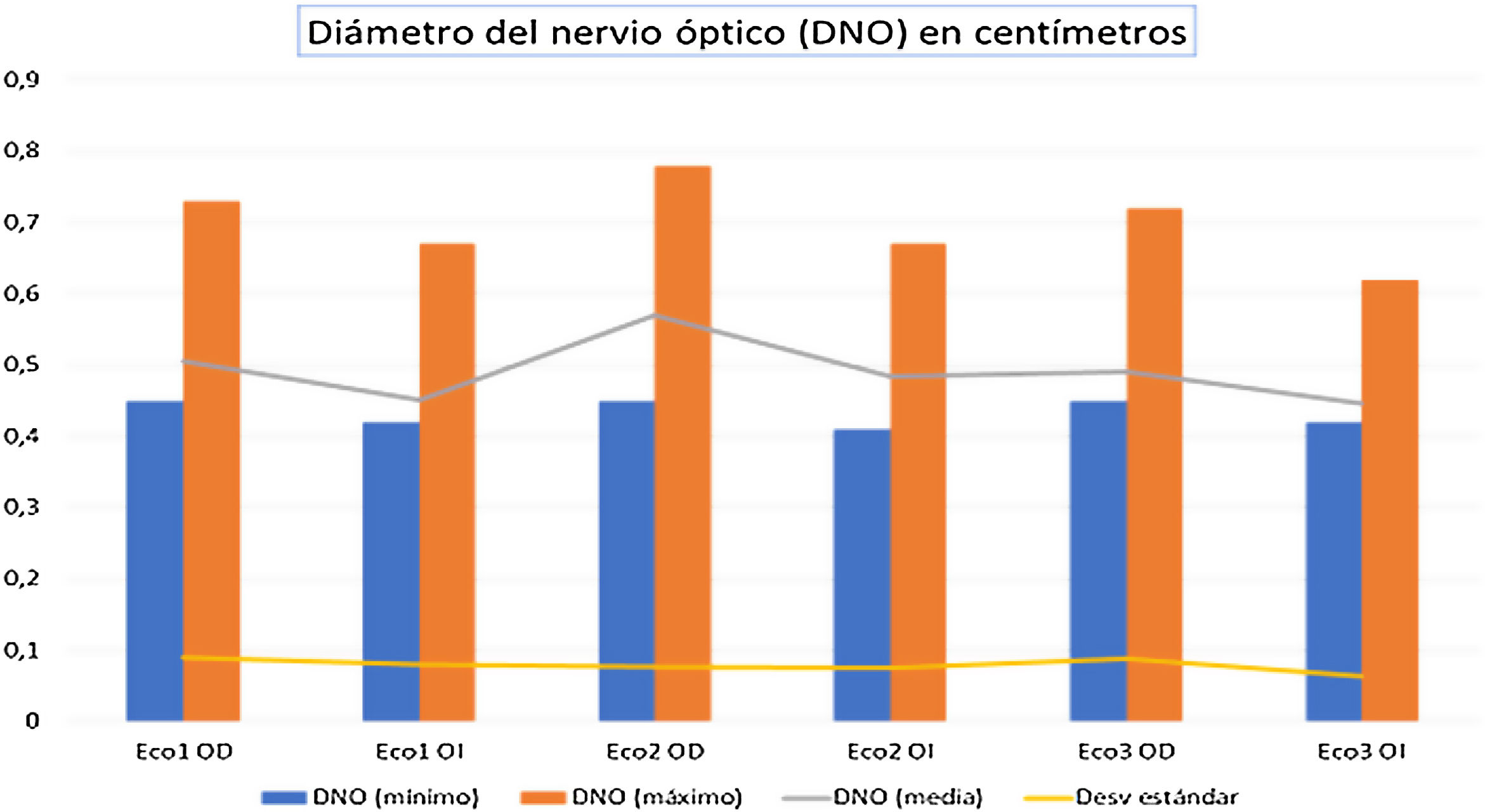
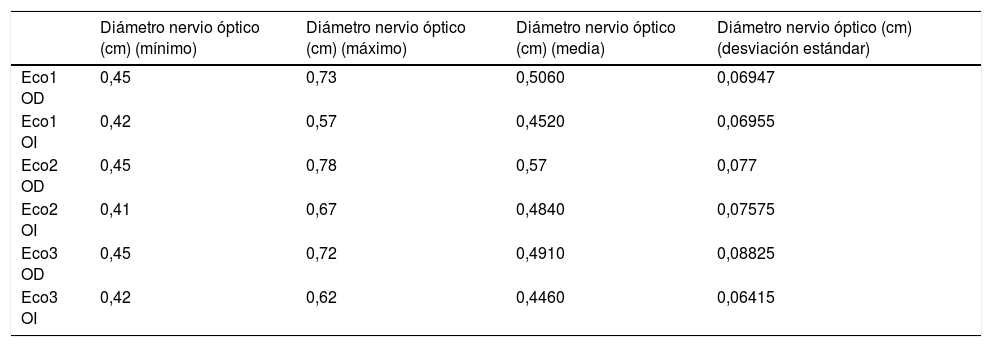
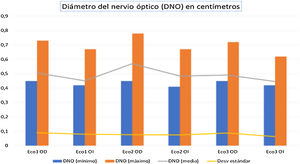
Los datos obtenidos de la medida del nervio óptico se resumen en la tabla 1 y la figura 3.
Medidas del diámetro de nervio óptico a 3 mm de su entrada en el globo ocular
| Diámetro nervio óptico (cm) (mínimo) | Diámetro nervio óptico (cm) (máximo) | Diámetro nervio óptico (cm) (media) | Diámetro nervio óptico (cm) (desviación estándar) | |
|---|---|---|---|---|
| Eco1 OD | 0,45 | 0,73 | 0,5060 | 0,06947 |
| Eco1 OI | 0,42 | 0,57 | 0,4520 | 0,06955 |
| Eco2 OD | 0,45 | 0,78 | 0,57 | 0,077 |
| Eco2 OI | 0,41 | 0,67 | 0,4840 | 0,07575 |
| Eco3 OD | 0,45 | 0,72 | 0,4910 | 0,08825 |
| Eco3 OI | 0,42 | 0,62 | 0,4460 | 0,06415 |
En ojo derecho (OD) e izquierdo (OI), en tres momentos: Eco 1 (preoperatorio), Eco 2 (tras inducción/raquianestesia) y Eco 3 (en postoperatorio inmediato tras recuperar bloqueo motor por completo).
Diámetros de nervio óptico en los tres momentos del estudio: valores máximo, mínimo, media y desviación estándar. Eco 1 OD (Eco preoperatorio en ojo derecho), Eco 1 OI (Eco preoperatorio en ojo izquierdo), Eco 2 OD (Eco intraoperatorio en ojo derecho), Eco2 OI (Eco intraoperatorio en ojo izquierdo), Eco 3 OD (Eco postoperatorio en ojo derecho) y Eco 3 OI (Eco postoperatorio en ojo izquierdo). Las medidas están recogidas en centímetros (cm).
Al aplicar el coeficiente de correlación Rho de Spearman, se encontró significación estadística bilateral (p < 0,01) al comparar los valores registrados en el periodo preoperatorio en el grupo de anestesia general, de anestesia raquídea y en los valores postoperatorios (p < 0,05). No se encontró diferencia estadísticamente significativa entre los valores obtenidos en el intraoperatorio. Asimismo, se alcanzó la correlación máxima (índice de 1) al comparar las medidas obtenidas en el ojo derecho e izquierdo, en cada momento del estudio.
DiscusiónLos resultados de este trabajo demuestran la utilidad de la ecografía ocular en el diagnóstico de patologías oftalmológicas (desprendimiento de retina) o neurológicas (hipertensión intracraneal secundaria a hemorragia intracraneal) en el preoperatorio, que indicarían posponer la intervención o una técnica anestésica no espinal, tal como indican las guías de manejo de diversas patologías neurológicas como el traumatismo craneoencefálico, la hidrocefalia, la hemorragia subaracnoidea, el hematoma intracraneal o la hipertensión intracraneal idiopática del adulto10.
Asimismo, el registro del aumento de la presión intracraneal en el periodo intraoperatorio podría prevenir y tratar patologías neurológicas graves como la neuropatía isquémica del nervio óptico, al controlar de forma inmediata el efecto de las medidas aplicadas para optimizar el flujo sanguíneo cerebral, bien para disminuir la presión intracraneal (PIC) o para aumentar la presión arterial11.
El estudio que se presenta coincide con varias publicaciones que han puesto de manifiesto el rendimiento de la ultrasonografía del nervio óptico para diagnosticar la elevación de la presión intracraneal, complementando al examen clínico, prioritario en pacientes sedoanalgesiados o bajo anestesia general y relajación muscular12.
En general, se registraron mayores valores de diámetro de la vaina del nervio óptico en el ojo derecho frente al izquierdo. El diámetro de la vaina del nervio óptico aumentaba tras la inducción o la inyección intradural de anestésico, para recuperar los niveles basales tras alcanzar la recuperación integral de la anestesia o el bloqueo motor. Estos resultados concuerdan con la literatura en cuanto a indicar la monitorización del diámetro del nervio óptico como herramienta no invasiva tanto en la monitorización perioperatoria como en el enfermo crítico13, de elección frente a la monitorización invasiva de la presión intracraneal14,15.
La medida ecográfica del diámetro de la vaina del nervio óptico a 3 mm de profundidad retrobulbar normal es menor de 5 mm, que equivaldrían a una presión intracraneal (PIC < 20 mmHg)12,16. Diversos estudios han demostrado la reducción inmediata de la presión intracraneal y del diámetro del nervio óptico debido a la disminución del papiledema, bien de forma inmediata17, o 30 minutos tras la punción lumbar18. Si bien, en este trabajo se registraron valores superiores a esta cifra, se modificaron tras la recolocación del paciente, sin embargo, no se reflejan en el estudio por no ser objetivo de comparación del mismo, no asociaban clínica y se recuperaban los niveles basales en el postoperatorio en todos los casos.
La asociación entre factores anestésico-quirúrgicos y los cambios en la presión intracraneal han sido ampliamente documentados. Así, la cirugía laparoscópica se ha relacionado con aumentos de la presión intracraneal, de intensidad proporcional a la duración de la cirugía, la posición en Trendelemburg19, o el anestésico empleado para el mantenimiento de la anestesia, siendo el propofol más efectivo en proteger frente a los factores quirúrgicos que aumentan la presión intracraneal que el sevoflurano®20,21.
Entre las limitaciones del estudio cabe destacar las siguientes:
En primer lugar, a pesar de existir abundante bibliografía en cuanto a factores anestésico-quirúrgicos y su influencia sobre la presión intracraneal, no se han encontrado datos documentados sobre la influencia de la anestesia espinal sin drenaje previo del líquido cefalorraquídeo9. Únicamente se registraron las medidas del diámetro del nervio óptico colocando la sonda en el eje transverso del ojo, a pesar de conocer la variabilidad de la vaina del nervio y la necesidad de recoger el diámetro en eje longitudinal, sin embargo, la mayoría de los pacientes portaban lentes intraoculares que dificultaban la visibilidad en este eje.
No hay que olvidar el gran número de factores perioperatorios que pueden influir en el diámetro de la vaina del nervio óptico, que es difícil de enmascarar con un tamaño muestral como el presentado, sobre todo en el grupo de anestesia general. Los autores somos conscientes de la necesidad de ampliar el tamaño muestral.
Finalmente, no se han tenido en cuenta los valores de la presión arterial en los momentos en que se realizaba el estudio ecográfico, factor clave, junto a la presión intracraneal en el flujo cerebral, no debemos olvidar que los métodos invasivos (catéter intraventricular, subaracnoideo o intraparenquimatoso) permanecen como elección en la medida de la presión intracraneal.
ConclusionesEl diámetro del nervio óptico aumenta tras la inducción de la anestesia o la realización de anestesia intradural, si bien recupera valores basales en postoperatorio inmediato.
La monitorización del diámetro del nervio óptico es una herramienta no invasiva y útil en la monitorización perioperatoria de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.