A pesar de la aparición de numerosas revisiones sistemáticas y metaanálisis sobre el uso de la doble terapia broncodilatadora para el tratamiento de la enfermedad pulmonar obstructiva crónica, la eficacia comparada de estas combinaciones entre sí no se ha explorado tan exhaustivamente. En la presente revisión narrativa se revisan los primeros estudios de doble terapia broncodilatadora y se evalúan los estudios que comparan dobles terapias broncodilatadoras en dispositivos por separado y en un único dispositivo. Los primeros ensayos de doble terapia en dispositivos separados se realizaron como una prueba de concepto sobre la función pulmonar con escaso tiempo de seguimiento o un número de pacientes reducido. Estos estudios mostraban mejorías no consistentes en función pulmonar, con escasa repercusión en síntomas u otros resultados clínicos. Los estudios que han comparado de forma directa la combinación de dos broncodilatadores de acción prolongada a dosis fijas en un único dispositivo han explorado principalmente las diferencias entre umeclidinio-vilanterol y diversas asociaciones. Estos trabajos muestran una mayor capacidad broncodilatadora de umeclidinio-vilanterol, con una reducción del uso de medicación de rescate. Por otro lado, no se observan diferencias aparentes en el control sintomático que ofrecen estas combinaciones entre sí y existen dudas sobre su impacto en la prevención de agudizaciones moderadas o graves. En el futuro sería interesante poder disponer de estudios que indiquen el efecto a largo plazo de estas combinaciones en el curso de la enfermedad, así como estudios encaminados a investigar los determinantes de las respuestas a estos fármacos tanto en función pulmonar como en síntomas, calidad de vida y exacerbaciones.
Despite the publication of numerous systematic reviews and meta-analyses on the use of dual bronchodilator therapy in the treatment of chronic obstructive pulmonary disease, the comparative efficacy of the different combinations has not been explored in depth. In this narrative review, we revisit the initial dual bronchodilator therapy studies and evaluate studies that compare dual bronchodilator therapies administered in separate devices and in a single device. The first trials on dual therapy delivered in separate devices were conducted as proof of concept studies, exploring lung function in limited patient numbers with short follow-up periods. These studies showed inconsistent improvements in lung function with little impact on symptoms or other clinical outcomes. Studies that directly compared fixed doses of long-acting bronchodilators in a single device investigated differences between umeclidinium/vilanterol and other combinations. These studies show increased bronchodilator capacity of umeclidinium/vilanterol with reduced use of rescue medication. However, no apparent differences were observed in the symptomatic control achieved by these different combinations, raising doubts about their impact on prevention in moderate or severe exacerbations. In the future, it would be interesting to see studies that analyze the long-term effect of these combinations on the disease course, as well as studies aimed at investigating the determinants of responses to these drugs in terms of lung function, symptoms, quality of life and exacerbations.
El empleo de combinaciones a dosis fijas (CDF) de fármacos de diversas familias para el tratamiento de la enfermedad pulmonar obstructiva crónica (EPOC) se ha convertido en una manera sencilla de administrar terapias complejas a pacientes con una enfermedad más avanzada. Entre las ventajas que supone unificar varios fármacos en un solo dispositivo de inhalación se pueden mencionar la menor probabilidad de errores críticos en el manejo de los inhaladores1, la posología más cómoda2, una potencial mayor adherencia al tratamiento3 y, finalmente, un menor coste4,5. Por estos motivos, en el paciente con EPOC avanzada es frecuente el uso de estas CDF6. Hasta el momento, en España disponemos de CDF de broncodilatadores de acción prolongada (LABD), LABD con corticosteroides inhalados y triples terapias con 2 LABD y un corticosteroide inhalado.
Debido al importante papel de los LABD en el tratamiento de la EPOC, la CDF de 2 LABD ha sido evaluada en los últimos años en numerosos ensayos clínicos. A pesar de que se han realizado diversas revisiones sistemáticas y metaanálisis sobre el uso de la doble terapia broncodilatadora frente a placebo o frente a la broncodilatación simple7–14, la eficacia entre las diversas CDF en un solo dispositivo de inhalación no se ha explorado tan exhaustivamente. La presente revisión narrativa tiene por objetivo resumir los hallazgos de los estudios comparativos entre dobles terapias broncodilatadoras en CDF mediante la descripción de los ensayos clínicos y estudios observacionales sobre la eficacia de esta opción terapéutica.
Primeros estudios de dobles terapias broncodilatadoras en dispositivos por separadoLos primeros estudios de combinación de 2 LABD fueron tímidos ensayos realizados por Cazzola et al. en 2004 con un estudio evaluando la eficacia de tiotropio (TIO)+formoterol (FOR)15 y otro para TIO+salmeterol16 ese mismo año. Desde entonces, se han ido publicando ensayos clínicos, ya paralelos, ya cruzados, asociando TIO con algún agonista ß2 de acción prolongada en dispositivos por separado. Curiosamente estos estudios utilizan TIO como antimuscarínico de acción prolongada, por lo que no existen estudios con otros antimuscarínicos de acción prolongada en dispositivos por separado.
Cuando se revisan los trabajos de doble broncodilatación en dispositivos por separado, una de las principales consideraciones es que su realización no ha tenido una planificación determinada dirigida a explorar la eficacia de estas combinaciones en distintos resultados clínicos. Por el contrario, parecen más bien estudios exploratorios centrados principalmente en la función pulmonar para explorar el efecto funcional de ambos grupos farmacológicos administrados a la vez. Probablemente por este motivo, la mayoría de ellos son valoraciones funcionales con escaso tiempo de seguimiento o un número de pacientes reducido. Los estudios más importantes en cuanto a número de pacientes fueron los ensayos INTRUST 1 y 2, que se publicaron de manera conjunta por Mahler et al.17 y que aleatorizaron a 1.134 y 1.142 pacientes, respectivamente, para comparar, con un diseño paralelo, la combinación TIO+indacaterol (IND) frente a TIO durante 12 semanas. Los autores encontraron que, en comparación con la monoterapia, IND+TIO proporcionó una mayor broncodilatación y mayor desinsuflación pulmonar en términos de capacidad vital forzada como marcador indirecto. Los acontecimientos adversos fueron similares entre los tratamientos, aparte de la tos leve, que era más común con IND+TIO. Los autores concluían que estos resultados apoyaban las recomendaciones de las guías clínicas de tratamiento de la EPOC para combinar broncodilatadores con diferentes mecanismos de acción.
Posteriormente, el segundo ensayo de mayor relevancia por número de pacientes y tiempo de seguimiento fue realizado por Vogelmeier et al. en 200818. En este trabajo los autores aleatorizaron a 847 pacientes con EPOC para recibir uno de los siguientes 4 tratamientos durante 24 semanas: FOR+TIO, FOR, TIO o placebo. El estudio fue parcialmente cegado sólo para FOR y placebo. Los 3 tratamientos activos fueron superiores al placebo en función pulmonar y algunos resultados clínicos, pero la combinación fue estadísticamente superior a la monoterapia sólo desde el punto de vista funcional.
Tras estos 2 ensayos, tan solo 3 estudios han tenido un número que superase los 100 pacientes aleatorizados y los 3 estudiaron la combinación TIO+FOR. Un primer trabajo estaba realizado por Tashkin et al., quienes aleatorizaron a 129 pacientes comparando TIO+FOR vs. TIO durante 6 semanas19. Un segundo trabajo, también de Tashkin et al., comparaba TIO+FOR vs. TIO en 255 pacientes durante 12 semanas20. El tercer trabajo es de Hanania et al., quienes aleatorizaron 155 casos durante 6 semanas, pero en el que, en este caso, FOR se administraba en una presentación para nebulización21. Los resultados de los trabajos de Tashkin et al. apuntan hacia una mejoría, no consistente, en términos de función pulmonar, con escasa repercusión en los síntomas u otros resultados clínicos.
Comparación entre dobles terapias broncodilatadoras por separadoCuriosamente, tan solo 2 trabajos han comparado 2 dobles terapias broncodilatadoras en dispositivos por separado. Ambos exploraban la combinación TIO+FOR. El primero fue realizado por Cazzola et al. en 200522. Este trabajo utilizaba un diseño cruzado para comparar TIO vs. FOR. Al final de cada periodo de 5 días, los pacientes tomaban o bien TIO seguido de FOR, o bien FOR seguido de TIO con objeto de evaluar posibles diferencias en función pulmonar que, como cabe esperar, no se encontraron. Unos años más tarde, otro grupo italiano diseñó un interesante trabajo con 80 pacientes en un diseño cruzado por periodos de 30 días en el que comparaban 5 grupos de comparación con diversas combinaciones de TIO y FOR23. La hipótesis que querían estudiar era cuál de las 2 era la mejor posología de estos broncodilatadores para cubrir una eficacia de 24h. Los 5 grupos fueron: TIO am, TIO am+FOR pm, FOR am y pm, TIO am+FOR am y pm y, finalmente, TIO pm y FOR am y pm. De estos grupos, los 2 últimos, que incluían la posología normal cambiando TIO de hora (mañana o tarde), consiguieron las mayores mejoras funcionales. De manera global, el tratamiento combinado con TIO administrado por la mañana+FOR cada 12h fue el más eficaz. Curiosamente, en pacientes con síntomas nocturnos, el tratamiento con TIO por la noche junto con FOR cada 12h redujo los síntomas y el uso de salbutamol nocturno y diurno de manera más notable.
De todo lo anteriormente expuesto se deduce que existen pocos datos que informen sobre la comparación de las distintas combinaciones de un agonista ß2 de acción prolongada y un antimuscarínico de acción prolongada en dispositivos por separado. Por tanto, para tener una noción sobre las posibles diferencias entre dobles terapias broncodilatadoras es necesario mirar a los estudios de doble terapia en un solo dispositivo de inhalación.
Comparativa de dobles terapias en un solo dispositivoLos resultados del efecto aditivo de combinar TIO con distintos agonistas ß2 de acción prolongada llevaron a plantear la realización de algún trabajo preliminar preclínico sobre el potencial efecto terapéutico de administrar TIO+salmeterol juntos en un solo dispositivo de inhalación24, o bien TIO+FOR también en una combinación fija en un solo dispositivo25. Sin embargo, las CDF que han progresado su desarrollo clínico y finalmente han sido aprobadas para su utilización en Europa han sido: umeclidinio (UMEC)-vilanterol (VI), aclidinio (ACLI)-FOR, IND-glicopirronio (GLI) y TIO-olodaterol (OLO). Además, la combinación GLI/FOR se ha aprobado en EE. UU. y Europa, aunque no se ha comercializado en España.
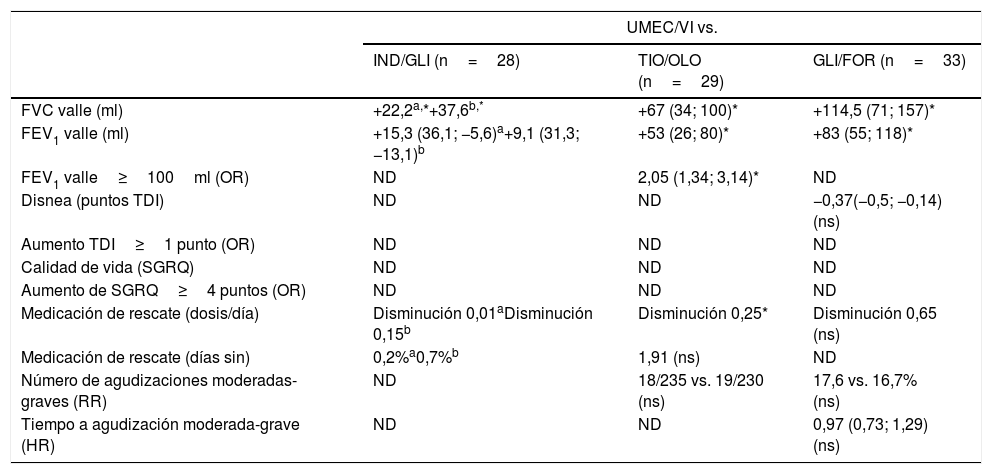
El primero que evaluó una combinación fija de doble terapia broncodilatadora fue el estudio QUANTIFY, que comparaba IND/GLI frente a una doble terapia abierta con TIO y FOR26. En este ensayo clínico de 26 semanas de duración, realizado en pacientes con limitación al flujo aéreo moderada a grave, utilizar IND/GLI se asoció a un similar impacto en la calidad de vida, medida por el cuestionario respiratorio de St. George, frente a TIO+FOR, pero con una mejoría en la función pulmonar, el volumen espirado forzado en un segundo (FEV1) valle de 68ml (IC 95% 37-100) y en el porcentaje de respondedores en el índice transicional de disnea de 49,6 vs. 42,4%. Posteriormente a este trabajo se han realizado comparaciones directas de CDF de dobles terapias broncodilatadoras, todas frente a UMEC/VI, a excepción de un trabajo de coste-efectividad comparando ACLI/FOR vs. TIO/OLO27 (tabla 1).
Detalle de los resultados de los principales ensayos clínicos comparando UMEC/VI vs. otras dobles terapias broncodilatadoras
| UMEC/VI vs. | |||
|---|---|---|---|
| IND/GLI (n=28) | TIO/OLO (n=29) | GLI/FOR (n=33) | |
| FVC valle (ml) | +22,2a,*+37,6b,* | +67 (34; 100)* | +114,5 (71; 157)* |
| FEV1 valle (ml) | +15,3 (36,1; −5,6)a+9,1 (31,3; −13,1)b | +53 (26; 80)* | +83 (55; 118)* |
| FEV1 valle≥100ml (OR) | ND | 2,05 (1,34; 3,14)* | ND |
| Disnea (puntos TDI) | ND | ND | −0,37(−0,5; −0,14) (ns) |
| Aumento TDI≥1 punto (OR) | ND | ND | ND |
| Calidad de vida (SGRQ) | ND | ND | ND |
| Aumento de SGRQ≥4 puntos (OR) | ND | ND | ND |
| Medicación de rescate (dosis/día) | Disminución 0,01aDisminución 0,15b | Disminución 0,25* | Disminución 0,65 (ns) |
| Medicación de rescate (días sin) | 0,2%a0,7%b | 1,91 (ns) | ND |
| Número de agudizaciones moderadas-graves (RR) | ND | 18/235 vs. 19/230 (ns) | 17,6 vs. 16,7% (ns) |
| Tiempo a agudización moderada-grave (HR) | ND | ND | 0,97 (0,73; 1,29) (ns) |
FEV1: volumen espirado forzado en un segundo; FOR: formoterol; FVC: capacidad vital forzada; GLI: glicopirronio; HR: hazard ratio; IND: indacaterol; ND: no disponible; ns: no significativo; OLO: olodaterol; OR: odds ratio; RR: riesgo relativos; SGRQ: St. George's Respiratory Questionnaire; TDI: índice transicional de disnea; TIO: tiotropio; UMEC: umeclidinio; VI: vilanterol.
Las cifras entre paréntesis corresponden al intervalo de confianza al 95%.
La primera comparación entre 2 CDF de LABD proviene de 2 ensayos clínicos aleatorizados, controlados, de diseño cruzado y 12 semanas de duración, en los que se comparó UMEC/VI (en su dosis comercializada de 55/22μg una vez al día) frente a IND/GLI (aunque este último con la dosis aprobada en EE. UU., 27,5/15,6μg 2 veces al día) en pacientes con obstrucción al flujo aéreo de moderada a grave y sintomáticos con≥2 puntos en la escala modificada del Medical Research Council28. El objetivo principal del estudio era demostrar la no inferioridad de IND/GLI frente a UMEC/VI en el área bajo la curva de 0 a 24h del FEV1 (estableciendo el límite inferior de 97,5% del intervalo de confianza de la diferencia entre tratamientos en −20ml). Los 2 estudios aleatorizaron a 355 y 357 pacientes, respectivamente, con un FEV1 cercano al 55%, con un 60% pertenecientes al grupo B de las recomendaciones GOLD. En cuanto al objetivo principal del estudio, IND/GLI no pudo demostrar la no inferioridad frente a UMEC/VI en ninguno de los 2 estudios al incluir el IC al 97,5% de la diferencia entre tratamientos el valor de −20ml. Debido a la jerarquía estadística, al no haberse conseguido demostrar el objetivo principal en ambos estudios, los otros objetivos secundarios (cambios en el área bajo la curva entre 0-12h del FEV1, FEV1 valle en la semana 12 o cambios en la capacidad vital forzada) no fueron analizados. No hubo diferencias entre ambos tratamientos con respecto al uso de medicación de rescate o los diarios de síntomas. Esta primera comparativa entre 2 LABD mostró que no se podía inferir igualdad en la capacidad broncodilatadora entre todas las combinaciones de LABD, aunque planteaba dudas por la comparación de 2 pautas posológicas distintas (24 vs. 12h), aspecto a considerar cuando en España la combinación IND/GLI está comercializada en dosis única diaria.
Comparativa UMEC/VI vs. TIO/OLOA finales del año 2017 vio la luz la única comparación directa entre 2 CDF de LABD de una sola toma diaria: el estudio de Feldman et al.29. Se trata de un ensayo clínico aleatorizado de diseño cruzado, multicéntrico, con tratamiento abierto y 2 periodos de tratamiento de 8 semanas de duración, en el que se comparó la eficacia de UMEC/VI frente a TIO/OLO en capacidad broncodilatadora (expresada como FEV1 valle en la semana 8 de tratamiento). La población de estudio estaba compuesta por pacientes con EPOC moderada (FEV1 entre 50 y 70% del teórico), sintomáticos (definidos como una puntuación en la visita inicial en la escala modificada del Medical Research Council≥2) y que no recibían previamente tratamiento con corticoides inhalados. Tras una visita inicial, los pacientes entraron en una fase de 2 semanas de lavado para después ser aleatorizados a recibir un primer periodo de tratamiento de 8 semanas con una de las 2 LABD de estudio, seguido de un periodo de lavado de 3 semanas y posteriormente un nuevo periodo de tratamiento de 8 semanas con la otra doble terapia.
Participaron en el estudio 443 pacientes, de los que finalmente fueron aleatorizados 236 (población por intención de tratar), completando los 2 periodos de tratamiento 227 pacientes (población por protocolo). La población de estudio era la típica de un ensayo clínico en EPOC al uso, con una edad media cercana a los 65 años, fumadores activos el 53%, y con un grado de síntomas elevados al inicio del ensayo.
Los resultados del estudio mostraron la superioridad de UMEC/VI frente a TIO/OLO en el objetivo principal del estudio, al terminar los pacientes las 8 semanas de tratamiento con UMEC/VI con un FEV1 valle superior al logrado tras 8 semanas de tratamiento con TIO/OLO (52ml en el FEV1 valle, IC 95% 28-77ml). El porcentaje de pacientes que alcanzaron una respuesta clínicamente relevante (definida como una ganancia de al menos 100ml en el FEV1) con UMEC/VI fue superior al de los pacientes con TIO/OLO (66 frente a 48%, respectivamente). De manera interesante, al haber recibido cada paciente los 2 tratamientos, por primera vez pudieron analizarse las respuestas individuales en el FEV1 con cada uno de los brazos de tratamiento, mostrando que la mayoría de los pacientes respondieron más a UMEC/VI que a TIO/OLO (52 vs. 19%). Además, pudieron observarse respuestas individuales muy marcadas en los 2 tratamientos, superiores a más de 500ml en el FEV1.
Sobre el resto de los resultados clínicos, los pacientes precisaron menos medicación de rescate mientras estuvieron en el periodo con UMEC/VI que durante el periodo de tratamiento con TIO/OLO, con una disminución de 0,25 inhalaciones diarias de salbutamol de rescate. Sin embargo, no se encontraron diferencias significativas en el número de días libres de medicación de rescate. Las puntuaciones del COPD Assessment Test (CAT) fueron mejores en las primeras 4 semanas de tratamiento con UMEC/VI frente a TIO/OLO (mejoría de 0,59 puntos), pero este resultado no fue alcanzado a las 8 semanas de tratamiento. El impacto en los síntomas según el cuestionario E-RSCOPD solo se mostró favorable a UMEC/VI en la semana 5 del seguimiento. Sin embargo, no hubo diferencias en el resto de las visitas ni en el porcentaje de pacientes que presentaron una respuesta clínicamente relevante (≥2 puntos en este cuestionario) durante el estudio.
Como dato de interés, un 63% de la población no había recibido ningún tratamiento inhalado para la EPOC en las 4 semanas previas al inicio del estudio. A esta población se la denominó naive. Recientemente se ha publicado un análisis de la población naive del estudio que muestra un efecto de magnitud similar al publicado previamente de UMEC/VI frente a TIO/OLO en este subgrupo de pacientes, favoreciendo al primero con una mejoría incluso mayor que en la población por intención de tratar (ganancia de 57ml en el FEV1 valle a las 8 semanas de tratamiento, IC 95% 23-92ml)30. Aunque el número de inhalaciones de rescate favorecía a la combinación UMEC/VI en este subanálisis, estas diferencias no se confirmaron en el CAT ni en el E-RSCOPD.
El impacto de UMEC/VI frente a TIO/OLO descrito en estos trabajos ha sido evaluado como variable principal en un estudio de vida real retrospectivo basado en el análisis de una base de datos sanitaria en EE. UU. Este trabajo evalúa a 14.324 pacientes tras la fecha de prescripción de una de estas 2 combinaciones durante 12 meses31. En el estudio, 9.549 pacientes iniciaron tratamiento con UMEC/VI y 4.775 con TIO/OLO. Durante los 12 meses de seguimiento, los iniciadores con UMEC/VI utilizaron 0,16 unidades menos de media de dosis de rescate que los iniciadores con TIO/OLO. Además, los sujetos que iniciaron con UMEC/VI alcanzaban mayor adherencia al tratamiento que los que iniciaron con TIO/OLO. Curiosamente, el riesgo ajustado de escalado a triple terapia fue similar entre ambos grupos de tratamiento.
El impacto en coste de esta comparación ha sido evaluado en un trabajo reciente32, mostrando que UMEC/VI es superior a TIO/OLO en términos de coste-efectividad aplicados al sistema sanitario español con un horizonte temporal de 3 años, con pequeñas ganancias en año de vida ajustado por calidad y un ahorro estimado al sistema de salud de 393€/paciente.
Comparativa UMEC/VI vs. FOR/GLIMás recientemente se han comunicado los resultados de un ensayo clínico aleatorizado, controlado, con grupos paralelos comparando FOR/GLI (10/14,4μg 2 veces al día administrados mediante dispositivo MDI) frente a UMEC/VI (en dosis aprobadas), en pacientes con EPOC moderada a muy grave sintomáticos (>10 puntos en el cuestionario CAT), el estudio AERISTO33. El estudio AERISTO es un estudio de 24 semanas de duración con el objetivo principal de demostrar la no inferioridad de FOR/GLI en el FEV1 valle a las 24 semanas de tratamiento frente a UMEC/VI y demostrar diferencias en el FEV1 pico a las 2h de la administración del fármaco. El margen de no inferioridad del FEV1 valle fue establecido en −50ml (límite inferior del IC 97,5%). En el estudio, 1.119 pacientes con EPOC fueron aleatorizados a recibir alguno de los brazos de tratamiento, con un FEV1 medio del 48% y cerca de un 8% de exacerbadores frecuentes. El objetivo principal del estudio no fue alcanzado al no demostrar la no inferioridad de FOR/GLI frente a UMEC/VI (la diferencia del FEV1 valle entre tratamientos en la semana 24 fue de −87ml, incluyendo el límite inferior de no inferioridad de −50ml). En cambio, los investigadores del estudio sí demostraron la no inferioridad de FOR/GLI frente a UMEC/VI en el FEV1 pico a las 2h de administración del fármaco en el día 1 de tratamiento. No hubo diferencias entre los brazos de tratamiento en síntomas matutinos o nocturnos, puntuación del cuestionario CAT, en disnea medida por el índice transicional de disnea o en las exacerbaciones moderadas y graves.
Comparación TIO/OLO vs. ACLI/FORCapel et al. han publicado el único análisis comparativo entre TIO/OLO y ACLI/FOR27 en aspectos de farmacoeconomía, utilizando metaanálisis en red de trabajos previamente publicados y comparando ambas opciones de tratamiento en un ámbito temporal de 5 años. Las 2 opciones de tratamiento proporcionaron similares beneficios en los modelos estudiados en términos de año de vida ajustado por calidad, con un menor coste de ACLI/FOR de 332€ en ese marco temporal.
ConclusionesLa CDF de LABD se ha convertido en el tratamiento de base para la mayoría de los pacientes con EPOC avanzada por sus ventajas frente a las monoterapias y un perfil de seguridad adecuado. Los primeros ensayos de doble terapia en dispositivos separados se realizaron como prueba de concepto sobre la función pulmonar con escaso tiempo de seguimiento o un número de pacientes reducido. Estos estudios mostraban mejorías no consistentes en función pulmonar, con una escasa repercusión en los síntomas u otros resultados clínicos. Hasta la fecha, a excepción de un trabajo27, los estudios que han comparado de forma directa LABD de dosis fijas en un único dispositivo han explorado las diferencias entre UMEC/VI frente a diversas asociaciones28–33. Estos trabajos muestran una mayor capacidad broncodilatadora con una reducción del uso de medicación de rescate, aunque en algunos casos las diferencias de posología podrían no ser aplicables a nuestro país. Por otro lado, no se observan diferencias aparentes en el control sintomático que ofrecen estas combinaciones entre sí y existen dudas sobre su impacto en la prevención de agudizaciones moderadas o graves. En el futuro sería interesante poder disponer de estudios que indiquen el efecto a largo plazo de estas combinaciones en el curso de la enfermedad, así como estudios encaminados a investigar los determinantes de las respuestas a estos fármacos tanto en función pulmonar como en síntomas, calidad de vida y exacerbaciones.
FinanciaciónEste artículo no ha recibido financiación.
Conflicto de interesesJLLC ha recibido honorarios por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, CSL Behring, Esteve, Ferrer, Gebro, GlaxoSmithKline, Grifols, Menarini, Novartis, Rovi y Teva.
BAN declara haber recibido honorarios en los últimos 3 años por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, FAES, Ferrer, GlaxoSmithKline, Menarini, Novartis y Rovi.