El síndrome de encefalopatía posterior reversible constituye un trastorno neurológico agudo, de inicio rápido, generalmente reversible, y con una imagen radiológica distintiva de las áreas del edema predominantemente en la región parietooccipital del cerebro. Su patogenia no es bien conocida, pero suele desarrollarse en los pacientes con hipertensión arterial, u otros factores de riesgo como el tratamiento inmunodepresor o citotóxico, o enfermedades hematológicas, entre otros. En este artículo se describe un caso de síndrome de encefalopatía posterior reversible en una paciente de 64 años sin antecedentes de interés, con un diagnóstico de linfoma B difuso de células grandes no Hodgkin en tratamiento quimioterápico con Hyper-CVAD asociado a la quimioterapia intratecal, que tras ser diagnosticada de síndrome de encefalopatía posterior reversible y tras instaurar el tratamiento adecuado, evolucionó favorablemente hasta la recuperación completa. Este texto trata de describir, tras la revisión de la bibliografía médica existente, las principales características de este síndrome, sus factores de riesgo y manejo, ya que es una condición cada vez más descrita en los últimos años y necesita continuar siendo reportada y estudiada para mejorar nuestro conocimiento al respecto.
Reversible posterior encephalopathy syndrome is an acute neurological disorder, of rapid onset, generally reversible, and with distinctive radiological image of areas of edema predominantly in parieto-occipital region of the brain. Its pathogenesis is not well known, but it usually develops in patients with arterial hypertension, or other risk factors such as immunosuppressive or cytotoxic treatment, or hematologic diseases, among others. In this report we discuss a case of posterior reversible encephalopathy syndrome in a 64-year-old patient without relevant diseases, diagnosed with diffuse large cell non-Hodgkin's B lymphoma, under chemotherapy with HyperCVAD and intrathecal chemotherapy, who after being diagnosed with posterior reversible encephalopathy syndrome and after establishing adequate treatment, had a right progress until full recovery. This paper tries to describe, after medical literature review, main characteristics, of this syndrome, its risk factors and clinical management, since it is a condition increasingly described in recent years and it needs to continue being reported and studied to improve our knowledge about it.
El síndrome de encefalopatía posterior reversible (PRES) constituye un cuadro neurológico agudo caracterizado por síntomas neurológicos de inicio rápido y de gravedad variable, siendo los más frecuentes la cefalea, las alteraciones del nivel de consciencia, la confusión, las crisis convulsivas y las deficiencias visuales como la visión borrosa, hemianopsia homónima o incluso, ceguera cortical, asociados a una imagen radiológica distintiva que muestra áreas de edema vasogénico de predominio en la región parietooccipital con una afectación de la sustancia blanca profunda, pudiendo llegar a afectarse la sustancia gris cortical, en función de la severidad del cuadro.
Por definición se trata de una entidad reversible clínica y radiológicamente, cuyo manejo es básicamente sintomático, consiguiéndose en la mayoría de los casos la reversión completa de la clínica y de las alteraciones radiológicas1. No obstante, con el incremento diagnóstico del síndrome, cada vez son más los reportes de PRES con evolución desfavorable e irreversible2.
Caso clínicoUna mujer de 64 años, sin antecedentes patológicos relevantes, es remitida inicialmente al Servicio de Hematología del Hospital Virgen de la Luz de Cuenca para el estudio de una masa en la fosa nasal izquierda; se realiza una biopsia de la misma, siendo la anatomía patológica diagnóstica de linfoma no hodgkiniano B difuso de células grandes, estadio IE. La masa, de relativamente gran tamaño, presentaba una importante afectación de los senos paranasales y de la órbita, por lo que se inició el tratamiento quimioterápico según el esquema hyper-CVAD (Bloque 1: ciclofosfamida, adriamicina, vincristina, dexametasona) asociado a la quimioterapia intratecal (TIT) (metotrexato, citarabina y glucocorticoide) debido al alto riesgo de infiltración meníngea que presentaba por la proximidad de la masa tumoral al sistema nervioso central. El análisis del LCR no evidenció la afectación del sistema nervioso central por el linfoma.
La paciente ingresó en el hospital para recibir la primera parte del ciclo del esquema de quimioterapia hyper-CVAD del 13 al 23 de octubre de 2020. Como complicaciones durante el ingreso presentó una neutropenia severa asociada a una mucositis grado III, por lo que se prolongó su estancia hospitalaria.
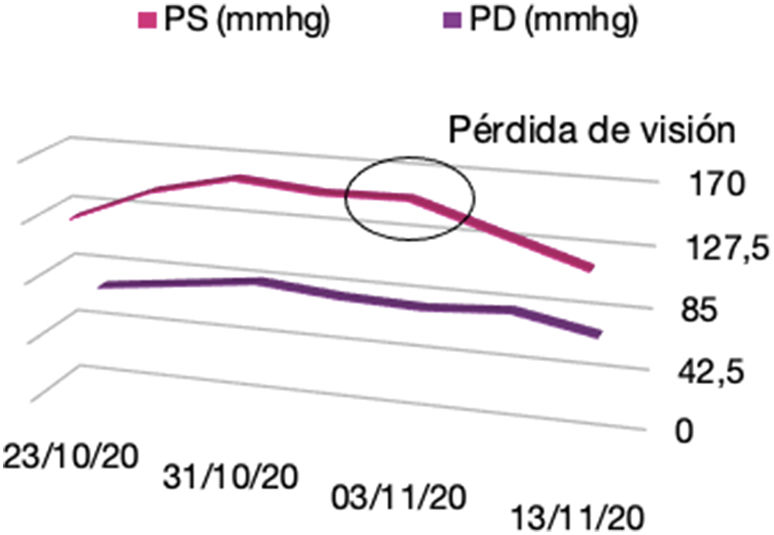
En el día +21 del ciclo, la paciente presentó una pérdida espontánea de la visión binocular asociada a cefalea. No se evidenció focalidad neurológica. Asociado a ello se produjo un cuadro de hipertensión arterial de difícil control con antihipertensivo oral (ibesartán) pautado, manteniéndose con una presión arterial sistólica de 170-174mmHg (al ingreso sobre 120mmHg y diastólica en cifras normales). Analíticamente destacaba únicamente la existencia de una leve elevación de leucocitos de 13.200 a expensas de los neutrófilos, con una función renal conservada y la elevación de LDH a 902 UI/I con PCR de 20,4mg/l. Fue valorada por el Servicio de Oftalmología del centro, desestimándose una enfermedad ocular como causa inicial del cuadro. Tras ello, fue valorada conjuntamente con el Servicio de Neurología, ante la posibilidad de que pudiera tratarse de un evento isquémico favorecido por su enfermedad de base.
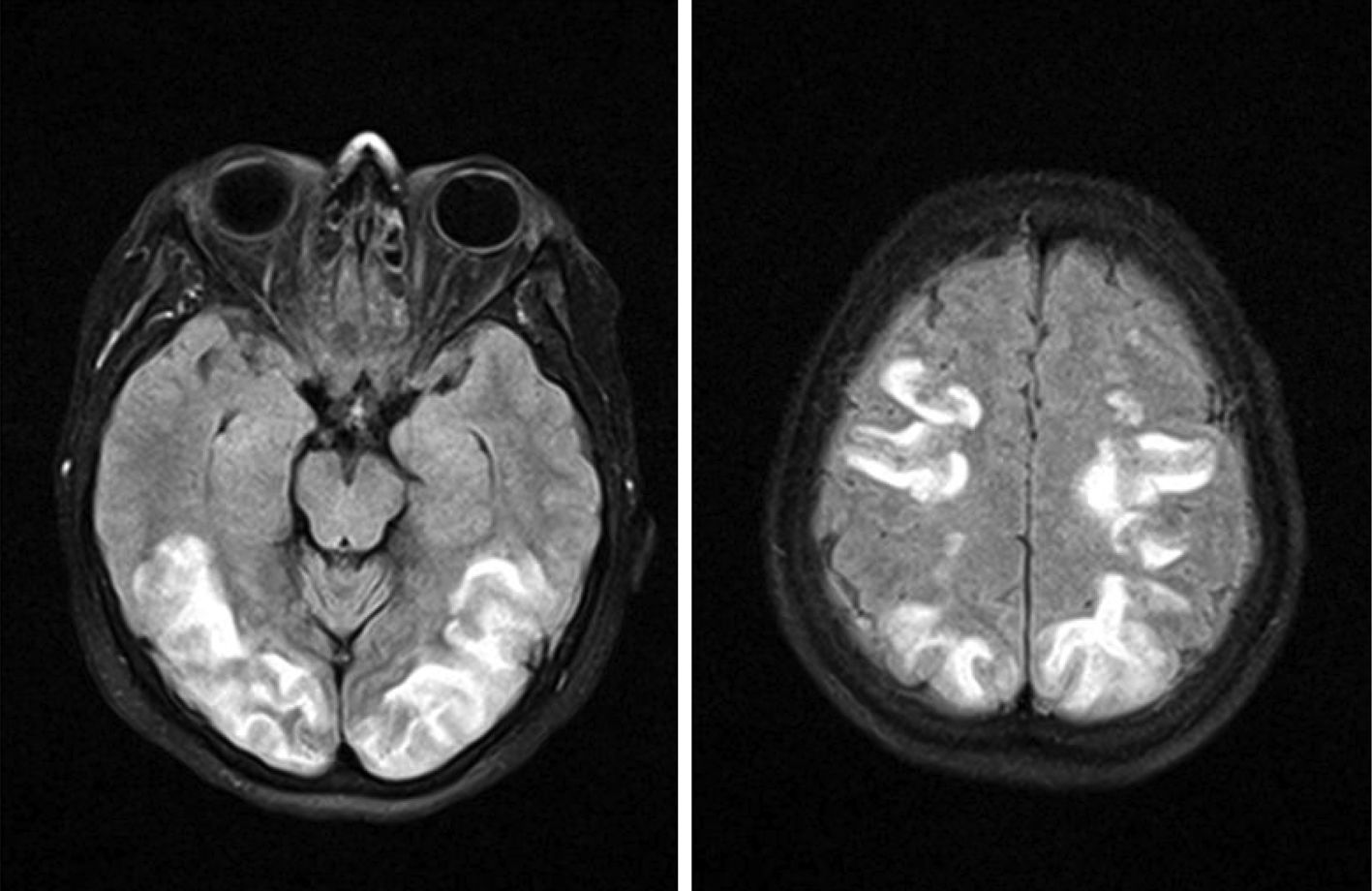
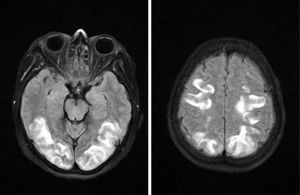
Se realizó una resonancia magnética (RM) cerebral (fig. 1A y B) en la que se identificó un «aumento de señal en sustancia blanca subcortical de ambos lóbulos occipitales y regiones superiores de lóbulos parietales de forma bilateral y más o menos simétrica, que no restringe el agua libre en el estudio de difusión, en relación a edema vasogénico» siendo esta imagen compatible con un PRES.
Ante el diagnóstico de PRES se inició el tratamiento sintomático con labetalol en perfusión para un control estricto de la tensión arterial, vitaminas del complejo B, dexametasona e hiperhidratación con suero salino fisiológico, con lo que la paciente evolucionó favorablemente recuperando por completo la agudeza visual 3 días después, en el día +24 de la posquimioterapia.
Tras el alta hospitalaria se realizó RM cerebral de control, confirmándose además de la recuperación clínica, la resolución radiológica del cuadro (tabla 1).
Resumen del caso PRES.
| Edad | 64 años |
|---|---|
| Sexo | Femenino |
| Antecedentes patológicos | Ninguno |
| Diagnóstico | Linfoma no hodgkin B difuso de células grandes, estadio IE |
| Tiempo de evolución desde el tratamiento al PRES | 21 días |
| Motivo de ingreso | Neutropenia febril y mucositis grado III |
| Signos y síntomas de PRES | HTA, pérdida de la agudeza visual bilateral |
| HTA previa al PRES | Dos días antes de iniciar la clínica |
| RM cerebral | Aumento de señal en sustancia blanca subcortical de ambos lóbulos occipitales y regiones superiores de lóbulos parietales de forma bilateral y más o menos simétrica, que no restringe el agua libre en el estudio de difusión, en relación a edema vasogénico |
| Tratamiento | Labetalol, suero salino al 0,9%, dexametasona |
| Tiempo hasta la resolución del PRES | 3 días |
| Prueba de imagen posterior al tratamiento | Normal |
El PRES es una entidad cada vez más descrita en la bibliografía médica de los últimos tiempos, probablemente debido a mayor acceso a pruebas de imagen de mayor calidad y mayor conocimiento del síndrome, es por ello que su incidencia real todavía no se ha definido por completo.
A pesar de este progresivo incremento diagnóstico, el PRES sigue siendo una entidad que raramente entra en los diagnósticos diferenciales habituales; es por ello que en el caso descrito la hipótesis diagnóstica inicial fue una isquemia cerebral de territorio posterior en el seno de la enfermedad hematológica de base que presentaba la paciente, puesto que los trastornos hematológicos se han descrito como potenciales factores de riesgo para la isquemia cerebral de etiología inusual3.
La patogenia del PRES no se conoce exactamente, aunque se han propuesto 2 teorías para justificarla: una teoría vasogénica que explicaría el síndrome como consecuencia de un aumento agudo de la presión arterial que anularía la autorregulación de la presión arterial cerebral, conduciendo a la vasodilatación y a una lesión endotelial autónoma no celular; y por otro lado una teoría citotóxica, que defendería la existencia de un efecto tóxico directo sobre las células endoteliales de la vasculatura cerebral, resultando en una disfunción endotelial autónoma de la célula. Sea cual fuere la causa inicial, en ambos casos, el resultado final es la difusión de las proteínas y de las células plasmáticas hacia el espacio extracelular con el consecuente edema cerebral secundario4,5.
Ambas teorías podrían aplicarse al desarrollo del PRES en la paciente que describimos, ya que como se puede apreciar en la figura 2, existe una clara asociación del inicio de los síntomas con el aumento de la presión arterial, pero también con otro factor etiológico importante, la toxicidad causada por el tratamiento quimioterápico.
Desde que fuera descrito por primera vez en el año 1996 por Hinchey et al., se han reportado diversos casos y series de casos tratando de identificar las características clínicas que pudieran condicionar a la aparición del mismo, siendo la hipertensión arterial (HTA) el factor de riesgo más descrito, seguido de la medicación citotóxica e inmunodepresora, la pre(eclampsia), la sepsis, la enfermedad renal, las enfermedades autoinmunes y el trasplante de órgano sólido y médula ósea1. También se ha asociado a la disfunción endocrina, la hipercalcemia, la hipomagnesemia y el hiperparatiroidismo, entre otras6. Recientemente también se ha descrito en los pacientes con COVID-197. Así, el PRES parece ser una vía común final a diferentes enfermedades.
Existen cada vez más reportes que relacionan el PRES con enfermedades hematológicas como el linfoma B difuso de células grandes y el linfoma Hodgkin, entre otras8 y además con algunos tratamientos como GCSF o quimioterapia tanto en monoterapia como en combinación, aunque no se ha logrado una clara asociación con un agente quimioterápico específico4.
En nuestro caso, se utilizó el esquema de tratamiento con hyper-CVAD, un esquema con el que no se ha descrito hasta el momento la aparición de ese síndrome, aunque sí se ha relacionado con otros regímenes con los que comparte componentes, como el esquema CHOP/R-CHOP,9 DA-EPOCH+-R9, gemcitabina4 y los tratamientos con metotrexato intratecal10. Como se puede observar en la mayoría de estos esquemas el denominador común es la ciclofosfamida, la cual se ha relacionado con varios casos de PRES, así como la gemcitabina.
En esta línea, se expone un caso de una paciente con múltiples factores de riesgo para desarrollar un PRES, enfermedad hematológica, tratamiento quimioterápico y una elevación abrupta de la presión arterial durante el ingreso, por lo que resulta complicado definir una única causa como factor precipitante del mismo. Como ya se ha mencionado, el PRES se ha relacionado con alteraciones electrolíticas como hipomagnesemia o hipercalcemia y alteraciones en la función renal, y algunas más inespecíficas como la elevación del LDH y el PCR5, en este caso las primeras se encontraban en sus valores normales, mientras que las últimas, a pesar de presentar cifras elevadas no se podrían asociar directamente al síndrome, dado el antecedente de quimioterapia y la complicación previa.
El manejo del PRES se basará fundamentalmente en el control de los múltiples factores de riesgo y la suspensión del tratamiento que puede estarlo causando5. La paciente que se describe ya había finalizado el primer bloque del ciclo de quimioterapia que contenía ciclofosfamida, vincristina, adriamicina, dexametasona y la TIT, por lo que el manejo se basó en el control estricto de la presión arterial, la administración de dexametasona para disminuir el edema vasogénico, la hiperhidratación y vitaminas del complejo B, consiguiendo una mejoría clínica y radiológica completa. Así, como ya se ha comentado previamente, podríamos atribuir a ambos factores (tanto HTA como quimioterapia) la etiología del cuadro.
Aunque existe consenso sobre la eliminación del factor etiológico desencadenante, algo relativamente sencillo cuando nos encontramos en un contexto de hipertensión arterial, esto puede resultar más complicado en el PRES inducido por medicamentos citotóxicos, inmunodepresores o quimioterapia, en los que su retirada sigue siendo un tema desafiante, y que precisa una decisión de manera individual valorando riesgos beneficios de su retirada, pues existen casos en los que los síntomas se resuelven mientras se mantiene la medicación. En caso de retirar dichos fármacos, se desconoce si debe de hacerse de forma permanente o únicamente durante un periodo de tiempo, en cuyo caso tampoco estaría definida la duración de la interrupción, es por ello que resulta útil el reporte de casos y el seguimiento de los mismos3.
ConclusiónEl síndrome de PRES constituye una entidad relativamente poco descrita, aunque progresivamente más conocida en los últimos años. Se expone un caso de PRES en una paciente en tratamiento con esquema hyper-CVAD, que hasta el momento no había sido descrito en la bibliografía médica, asociado a otros factores de riesgo, sin poder filiar la causa exacta precipitante del mismo: hipertensión, quimioterapia o ambos, pero cuya eliminación permitió la resolución del cuadro; un cuadro cada vez más descrito en los últimos años y que precisa de continuar reportando y estudiando para conseguir más conocimientos acerca del mismo y de su manejo.