El bloqueo interatrial avanzado (BIA-a) es considerado un factor de riesgo independiente para infarto cerebral (IC). Nuestro objetivo fue analizar si el BIA-a predice recurrencia de IC en pacientes con infarto cerebral embólico de origen no determinado (ESUS).
MétodosCiento cuatro pacientes con diagnóstico confirmado de ESUS fueron seguidos durante una mediana de 15 meses (RIQ 10-48). Los datos clínicos, las características de la onda P y presencia de BIA en electrocardiograma realizado durante el evento índice, fueron registrados. La interpretación de los electrocardiogramas se realizó de forma centralizada y ciega en (XXXX2). La recurrencia de ESUS fue el desenlace primario.
ResultadosLa mediana de edad de los casos fue de 47 años (rango 19-85); 50% fueron mujeres. Se encontró BIA en 36 casos (34,6%); parcial (BIA-p) en 29 (27,9%) y BIA-a en 7(6,7%). Dieciséis pacientes (15,4%) presentaron IC recurrente; de los cuales 5 tenían BIA-p y 4 BIA-a (p=0,01;OR 9,44:IC 95% 1,88-47,46). La mediana de duración de la onda P fue mayor en pacientes con recurrencia (p=0,009). En el análisis multivariado de regresión logística, los factores de riesgo independientes para recurrencia de IC fueron: el BIA-a (p<0,001; OR 10,86:IC 95% 3,07-38,46), género masculino (p=0,028; OR 4,6:IC 95% 1,18-17,96) y la edad mayor a 50 años (p=0,039; OR 3,84:IC 95% 1,06-13,88); en riesgos proporcionales de Cox fueron: edad mayor a 50 años (p=0,002; HR 7,04:IC 95% 2,06–23,8) y duración de la onda P (por ms) p=0,007 (HR 1,02:IC 95% 1,01-1,04).
ConclusionesEl BIA-a y edad mayor a 50 años predicen recurrencia de ESUS.
Advanced interatrial block (IAB) is an independent risk factor for ischaemic stroke. This study aimed to analyse whether advanced IAB predicts recurrence of embolic stroke of undetermined source (ESUS).
Methods104 patients with a confirmed diagnosis of ESUS were followed up for a median period of 15 months (interquartile range, 10-48). We recorded data on clinical variables, P-wave characteristics, and presence of IAB on the electrocardiogram. Electrocardiogram findings were interpreted by a blinded, centralised rater at (XXXX2). ESUS recurrence was the primary outcome variable.
ResultsMedian age was 47 years (range, 19-85); 50% of patients were women. IAB was detected in 36 patients (34.6%); IAB was partial in 29 cases (27.9%) and advanced in 7 (6.7%). Sixteen patients (15.4%) presented stroke recurrence; of these, 5 had partial and 4 had advanced IAB (P = .01; odds ratio [OR] = 9.44; 95% confidence interval [CI], 1.88-47.46; relative risk [RR] = 4.62; 95% CI, 2.01-10.61). Median P-wave duration was longer in patients with stroke recurrence (P = .009). The multivariate logistic regression analysis identified the following independent risk factors for stroke recurrence: advanced IAB (P < .001; OR = 10.86; 95% CI, 3.07-38.46), male sex (P = .028; OR = 4.6; 95% CI, 1.18-17.96), and age older than 50 years (P = .039; OR = 3.84; 95% CI, 1.06-13.88). In the Cox proportional hazards model, the risk variables identified were age older than 50 years (P = .002; hazard ratio, 7.04; 95% CI, 2.06-23.8) and P-wave duration (per ms) (P = .007; hazard ratio, 1.02; 95% CI, 1.01-1.04).
ConclusionsAdvanced IAB and age older than 50 years predict ESUS recurrence.
El bloqueo interatrial (BIA), fácilmente identificable en el electrocardiograma (ECG) de superficie, es un potente predictor de taquiarritmias auriculares, y se ha asociado con un riesgo incrementado de fibrilación auricular (FA) e infarto cerebral (IC)1–10.
En pacientes con IC y alto riesgo clínico de recurrencia, las medidas farmacológicas, como el uso de antiarrítmicos y anticoagulación podrían ser de utilidad y el BIA podría ayudar a guiar su terapéutica11–16.
El término «infarto cerebral embólico de origen no determinado» (ESUS por sus siglas en inglés) fue recientemente introducido por un grupo internacional de trabajo sobre infarto cerebral criptogénico, con la finalidad de identificar a pacientes con características clínicas y radiológicas sugestivas de IC embólico, en los cuales la fuente de embolismo permanece no identificada, a pesar de una investigación adecuada17.
Los pacientes con ESUS representan un grupo heterogéneo con alta probabilidad de tener una fuente embólica cardiaca oculta y con mayor riesgo de recurrencia de IC17–19. Estudios recientes apoyan una emergente conceptualización del papel de la aurícula izquierda en el riesgo de IC y de su prevención, sugiriendo una mayor relevancia de la disfunción auricular en el riesgo de IC20–24.
El objetivo del estudio fue analizar si el BIA predice mayor recurrencia IC en pacientes con ESUS.
MétodosAnalizamos los datos de 104 pacientes con diagnóstico confirmado de ESUS, atendidos en Insituto Nacional de Neurologia y Neurocirugia de la Ciuad de México entre enero del 2000 y abril de 2018. Usamos los datos prospectivamente incluidos en nuestro registro institucional de ictus, siguiendo un protocolo estandarizado. Nuestro registro de pacientes incluye los datos demográficos, factores de riesgo vascular, subtipo de evento vascular cerebral, tratamiento, hallazgos de laboratorio e imagen y evolución funcional al egreso y en la evolución.
Utilizamos los criterios diagnósticos propuestos por el grupo internacional (Cryptogenic Stroke/ESUS International working group), que define como ESUS a un IC no lacunar, con ausencia de ateroesclerosis intra- o extracraneal (estenosis > 50% en la arteria que irriga la zona de infarto), sin fuentes embolígenas cardiacas detectadas por ecocardiograma transtorácico y al menos monitorización Holter de frecuencia cardiaca de 24 horas y sin otras causas definidas de IC17. En todos los casos se calculó la escala de CHA2DS2VASc.
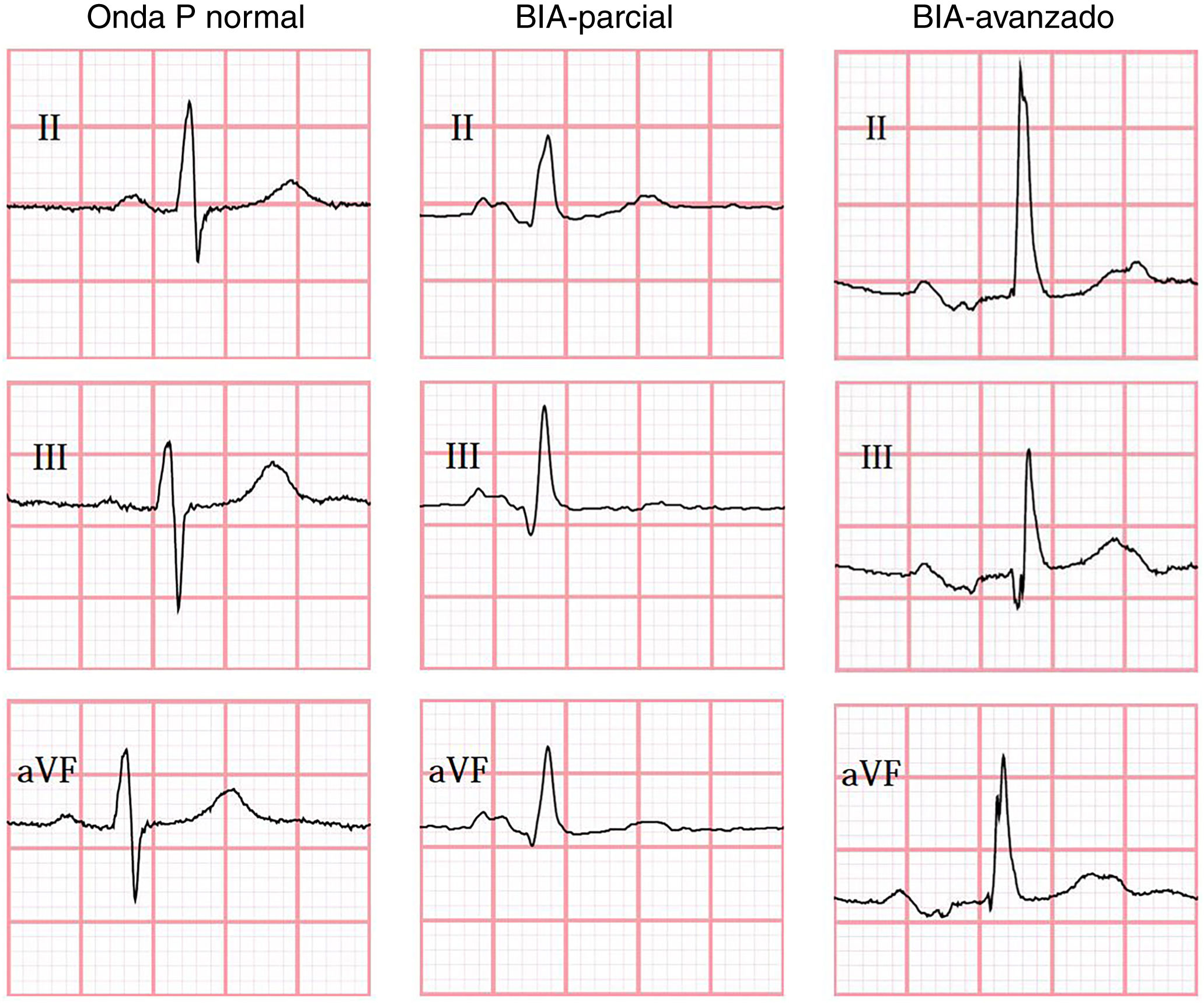
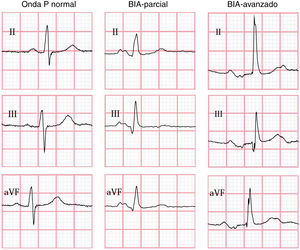
Los criterios del consenso de Electrocardiología 2012 para el diagnóstico de BIA fueron utilizados; donde BIA parcial (BIA-p) se define como prolongación de la onda P > 120ms y el BIA avanzado (BIA-a) como la prolongación de la onda P > 120ms, más la presencia de la morfología bifásica de la onda P con una fase negativa como fase terminal en derivaciones D-II, D-III y aVF1.
En todos los casos el ECG realizado durante el evento índice fue evaluado e interpretado de forma centralizada y ciega en Queeńs University, Canadá, utilizando el programa semiautomatizado Cardio Calipers 3.3. Se registró la frecuencia cardiaca, duración de onda P, intervalo PR y voltaje de la onda P en derivación I. De acuerdo con los hallazgos del ECG; se subdividió a la población en 3 grupos (fig. 1); sin BIA, con BIA-p y BIA-a. Se excluyeron pacientes con ECG con otro ritmo diferente al sinusal, con múltiples complejos auriculares o ventriculares y/o con bloqueo auriculoventricular de segundo o tercer grado.
El desenlace primario fue la recurrencia de IC en pacientes con ESUS, definido como un nuevo IC, con nuevo déficit neurológico o incremento de la sintomatología neurológica previa, de al menos 24 horas de duración y con confirmación por medio de estudios de imagen cerebral.
El periodo de seguimiento incluyó evaluaciones neurológicas en nuestra clínica al ingreso, alta hospitalaria, 3 y 6 meses del egreso y final de seguimiento.
La evolución funcional se evaluó con la escala modificada de Rankin (emR); se consideró buen pronóstico funcional a la emR entre 0 y 2; y mal pronóstico emR 3 a 5.
El comité de ética e investigación de nuestro hospital aprobó la realización del estudio y no se requirió de consentimiento informado por su naturaleza.
Análisis estadísticoEl análisis estadístico fue realizado utilizando el programa IBM SPSS para Macintosh, versión 22. Las variables categóricas fueron expresadas en frecuencias y porcentajes. Las variables continuas como medias y desviación estándar (DE) o medianas con rango intercuartilar (RIQ), de acuerdo a la prueba de normalidad de Kolmogorov-Smirnov. Las variables categóricas fueron comparadas con prueba chi-cuadrado o exacta de Fisher. Se comparó la media de variables continuas con prueba t Student o U Mann Whitney y la varianza de estas con ANOVA o Kruskal Wallis según corresponda a su distribución. Se realizó análisis multivariado con modelo de regresión logística binaria y modelo de riesgos proporcionales de Cox.
ResultadosNuestra base de datos del Insituto Nacional de Neurologia y Neurocirugia de la Ciuad de México incluye un total de 1.673 pacientes con IC; 104 (6,2%) cumplieron con los criterios de inclusión de IC tipo ESUS. La mediana de edad de la población estudiada (n=104) fue de 47 años (rango 19-85); 57 (54%) pacientes eran menores de 50 años y 52 (50%) mujeres. Los factores de riesgo más frecuentemente encontrados fueron hipertensión arterial en 46 casos (44%), diabetes mellitus 19 (18%), tabaquismo 34 (33%), dislipidemia 35 (34%) y uso de drogas 6 (5,8%).
Se documentó la presencia de BIA en 36 pacientes (34,6%); 29 con BIA-p (27,9%) y 7 con BIA-a (6,7%). En la tabla 1 se muestran las características demográficas y clínicas de los pacientes de acuerdo al hallazgo de BIA. La presencia de BIA-p y BIA-a fue más frecuente en mayores de 50 años.
Caractacterísticas demográficas y clínicas de pacientes con ESUS
| Sin BIA, n=68 | BIA-parcial n=29 | BIA-avanzado n=7 | Exacta de FisherValor p | |
|---|---|---|---|---|
| Edad, mediana (IQR) | 47(31,5-66) | 53(34-68) | 66(49-73) | 0,03a |
| Género masculino, n (%) | 30(44) | 19(65,5) | 3(43) | 0,16 |
| Hipertensión arterial, n (%) | 27(40) | 15(52) | 4(57) | 0,44 |
| Diabetes mellitus II, n (%) | 9(13) | 8(27,6) | 2(28,6) | 0,14 |
| Tabaquismo, n (%) | 20(29,4) | 12(41) | 2(28,6) | 0,96 |
| Dislipidemia, n (%) | 27(31) | 7(24) | 1(14) | 0,71 |
| Cardiopatía isquémica, n (%) | 1(1,5) | 0(0) | 1(14,3) | 0,21 |
| Toxicomanía previa, n (%) | 6(8,8) | 0(0) | 0(0) | 0,25 |
| CHA2 DS2 VASc ≥3, n (%) | 52(76,5) | 23(79) | 6(86) | 1,0 |
| Recurrencia de IC, n (%) | 7(10) | 5(17) | 4(57) | 0,01 |
Prueba X2 exacta de Fisher, valor p de hemogeneidad.
BIA: bloqueo interatrial; ESUS: infarto cerebral embólico de origen no determinado (por sus siglas en inglés; embolic stroke of undetermined source); RIQ: rango intercuartilar.
Al final del seguimiento (mediana 15 meses, RIQ 10-48) la evolución funcional fue buena (mRs de 0 a 2) en 82% (n=85) de los pacientes y mala (mRs 3 a 5) en 18% (n= 19). No se observó mortalidad en esta cohorte.
La recurrencia de IC ocurrió en 16 pacientes (15,4%), 14 de ellos en territorio de arteria cerebral media y 2 en territorio vascular cerebral posterior; 4 pacientes menores de 50 años y 12 pacientes mayores de 50 años (p=0,008) OR 4,76 (IC 95% 1,42-15,98), RR 3,78 (IC 95% 1,31-10,96); de los cuales 7 no tenían BIA, 5 pacientes con BIA-p (p=0,76) y en 4 pacientes con BIA-a (p=0,010) OR 9,44 (IC 95% 1,88-47,46), RR 4,62 (IC 95% 2,01-10,61). La densidad de incidencia para recurrencia de IC en esta serie fue de 0,046; es decir, 4,6 casos de recurrencia de IC por cada 100 años persona de seguimiento en pacientes con ESUS.
La duración de la onda P fue mayor en pacientes con recurrencia, mediana de 123ms (milisegundo) vs. 113ms (p=0,009); mientras que no se encontraron diferencias en el intervalo PR o voltaje de la onda P en derivación I (tabla 2).
Características electrocardiográficas de los pacientes con y sin recurrencia de IC
| Recurrencia, n=16 | Sin recurrencia, n=88 | Valor p | |
|---|---|---|---|
| Edad en años, n (mediana)RIQ | 16 (62) 49-72 | 88 (44,5) 31-63 | 0,023 |
| Frecuencia cardiaca, n (media)DE | 16 (70,6) ±14 | 88 (72,6) ±15 | 0,63a |
| Duración (ms) de onda P, n (mediana)RIQ | 16 (123) 114-134 | 88 (113) 102,6-120,7 | 0,009 |
| Intervalo PR duración (ms), n (mediana)RIQ | 16 (162,5) 150-179,5 | 88 (157) 144-171 | 0,14 |
| Voltaje (mV) Onda P en D-I,n (mediana)RIQ | 15 (0,10) 0,08-0,12 | 86 (0,09) 0,07-0,12 | 0,35 |
| CHA2 DS2 VASc ≥ 3, n | 12 | 69 | 0,75b |
Kolmogorov-Smirnov con distribución no paramétrica, prueba U Mann Whitney (significación bilateral), prueba Kruskal Wallis con igualdad de varianza.
DE: desviación estandar; IC: infarto cerebral; ms: milisegundo; mV: milivoltio; RIQ: rango intercuartilar.
En el análisis multivariado con modelo de regresión logística binaria (tabla 3), los factores de riesgo independientes para recurrencia de IC fueron: BIA-a p<0,001, OR 10,86 (IC 95% 3,07-38,46), género masculino p=0,028, OR 4,60 (IC 95% 1,18–17,96) y edad mayor a 50 años p=0,039, OR 3,84 (IC 95% 1,06-13,88); mientras que en modelo de riesgos proporcionales de Cox (tabla 3) lo fueron: edad mayor a 50 años p=0,002 HR 7,04 (IC 95% 2,06 – 23,8) y duración de la onda P (por ms) p=0,007 HR 1,02 (IC 95% 1,01 -1,04).
Análisis multivarido con modelo de regresión logística y riesgos proporcionales de Cox, para recurrencia de infarto cerebral
| Factor de riesgoa | Valor p | OR (IC 95%) |
|---|---|---|
| BIA avanzado | <0,001 | 10,86 (3,07 - 38,46) |
| Género masculino | 0,028 | 4,60 (1,18 – 17,96) |
| Edad mayor a 50 años | 0,039 | 3,84 (1,06-13,88) |
| Factor de riesgob | Valor p | HR (IC 95%) |
|---|---|---|
| Edad mayor a 50 años | 0,002 | 7,04 (2,06 – 23,8) |
| Duracion de la onda P(por milisegundo) | 0,007 | 1,02 (1,01 -1,04) |
BIA: bloqueo interatrial; ESUS: infarto cerebral embólico de causa no determinada (por sus siglas en inglés, embolic stroke of undetermined source); IC: intervalo de confianza.
El paciente con IC de origen no determinado, debe ser estudiado adecuadamente y descartarse enfermedades hematológicas ante alto índice de sospecha25.
El BIA-a se asocia con un riesgo incrementado de IC2,8,12,13. Esta asociación parece estar limitada a infartos no lacunares y se mantiene, independientemente de la documentación de FA. En nuestro estudio, el BIA-a se asoció con mayor recurrencia de IC en pacientes con ESUS.
Nuestros hallazgos refuerzan el argumento de que la enfermedad auricular (atriopatía) debe considerarse como un factor de riesgo independiente para ictus isquémico y sugieren también que el tromboembolismo auricular izquierdo puede ocurrir independiente de la documentación de FA. Aunque nuestros pacientes pudieron haber presentado FA subclínica, el aspecto importante de nuestros hallazgos es que el riesgo de recurrencia existe con la documentación única de BIA en el ECG de superficie; el cual es un método sencillo, accesible y altamente reproducible.
ÓNeal et al., examinaron la asociación entre BIA-a e incidencia de IC en el estudio Atheroesclerosis Risk in Communities Study8. De manera similar a nuestros resultados, encontraron que el BIA-a fue un factor de riesgo independiente para IC8. Sin embargo, nuestro estudio incluye una población altamente seleccionada de pacientes con IC, en los que se descartó FA (de manera clínica y con un registro Holter) y enfermedad carotídea ateroesclerótica, pero sus características clínicas y de imagen, sugieren fuertemente un mecanismo embolígeno.
Se estima que en los Estados Unidos, ocurren aproximadamente 700.000 nuevos casos de IC por año, de los cuales un tercio corresponde a este tipo de IC y hasta ahora no se ha determinado cuál es el mejor tratamiento de prevención secundaria26,27. Algunos estudios en curso evalúan si el tratamiento con anticoagulantes orales directos (ACD), reduce el riesgo de recurrencia28–30. A la fecha, se han dado a conocer los resultados de dos estudios en pacientes con IC ESUS tratados con ACD; el estudio ESUS NAVIGATE, que comparó 15mg de rivaroxaban contra 100mg de aspirina; y el estudio RESPECT ESUS, que comparó dos dosis de dabigatrán (100 y 150 mgs dos veces por día) contra aspirina. Ambos ensayos clínicos fallaron en demostrar la eficacia de los ACD en la prevención de recurrencia de IC en este grupo de pacientes y en el caso de rivaroxaban, se asoció con mayor riesgo de hemorragia28,31. Sin embargo, un aspecto de importancia es que en el estudio ESUS NAVIGATE, ambos grupos de tratamiento mostraron una tasa elevada de recurrencia, lo que confirma la necesidad de una mejor selección de pacientes y mejor opción terapéutica. Queda por demostrar si una selección de pacientes usando el mismo método de nuestro trabajo y randomización de estos incluyendo solo el grupo con BIA-a hubiera podido segregar una población de mayor riesgo.
El estudio AtRial Cardiopathy and Antithrombotic Drugs In Prevention After Cryptogenic Stroke, se encuentra actualmente en curso e incluye pacientes con ESUS y cardiopatía auricular aleatorizados a recibir apixaban o aspirina32. Sus resultados podrían aclarar si el alto riesgo de recurrencia de IC en pacientes con ESUS, y marcadores de disfunción auricular, puede ser reducido con otras alternativas de anticoagulación.
Nuestros hallazgos sugieren que la detección de BIA-a, en pacientes con ESUS; permite identificar a pacientes de alto riesgo de recurrencia, en los que algunas terapias farmacológicas podrían ser beneficiosas.
LimitacionesAlgunas limitaciones de nuestro estudio debieran ser resaltadas. Se trata de un análisis retrospectivo de una serie de pacientes incluidos prospectivamente y podría existir sesgo inherente a este tipo de diseño. Para fortalecer los hallazgos vale aclarar que el análisis de los ECG se realizó de manera ciega respecto a los eventos finales. En segundo lugar, se trata de un estudio de un solo centro neurológico. Finalmente, el número acotado de pacientes, con promedio de edad menor a la reportada en otras series, no permite extrapolar estos hallazgos de manera conclusiva, y un estudio prospectivo con mayor número de pacientes sería altamente deseable; así como uno donde se comparare la recurrencia de IC en pacientes con BIAa con y sin hipertensión arterial, puesto que su pronóstico puede diferir33. Existen otras interrogantes que tendrán que ser respondidas en futuros ensayos clínicos; como si el uso de antiarrítmicos y/o anticoagulantes deberían usarse en este subgrupo de pacientes, para prevenir fibrilación auricular y recurrencia de infarto cerebral.
ConclusionesEl bloqueo interatrial avanzado y la edad mayor de 50 años predicen recurrencia de infarto cerebral embólico de causa no determinada (ESUS).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La autora Karina Carrillo Loza agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT) el apoyo otorgado durante la realización de este proyecto en el programa de maestría y doctorado en ciencias médicas, odontológicas y de la salud de la Universidad Nacional Autónoma de México.