La catarata representa una de las principales causas de discapacidad visual moderada a severa reversible en el mundo, siendo un problema importante de salud pública en Chile. La única solución es extraer la catarata e implantar un lente intraocular (LIO). Su principal factor de riesgo es la edad, por lo que se estima un aumento progresivo de su prevalencia por el incremento de la expectativa de vida. Hay varios factores de riesgo modificables donde podemos intervenir: diabetes, hipertensión arterial, tabaquismo, uso sin control de corticoides sistémicos o tópicos, entre otros. Aunque el diagnóstico es clínico, siempre debemos realizar un estudio detallado para descartar afección de otras estructuras oculares que pueden estar contribuyendo a la mala visión. Este estudio nos permite también elegir de mejor manera el LIO más adecuado para el paciente. Debemos conocer las expectativas del paciente, sobre todo si pensamos utilizar LIOs tóricos, de profundidad de foco extendido o LIOs multifocales, que entregan más independencia de anteojos que los lentes monofocales regulares. En esta revisión se describirá la preparación preoperatoria, la tecnología usada en una cirugía con facoemulsificador ultrasónico y el seguimiento post operatorio del paciente. Esta cirugía es una de las más seguras, efectivas y de mayor costo-beneficio de la medicina moderna. Más del 90% de los ojos logran agudezas visuales mejor corregidas de 20/25, y con las nuevas tecnologías de mayor precisión más del 80% de los pacientes queda con +/- 0,5 dioptrías residuales, de forma que hoy podemos ofrecer resultados visuales personalizados de acuerdo con las necesidades de cada paciente.
Cataracts represents one of the main causes of moderate to severe reversible vision impairment in the world, being an important public health problem in Chile. The only solution is to remove the cataract and implant an intraocular lens (IOL). The main risk factor for cataracts is age, which will lead to a progressive increase in prevalence due to the increase in life expectancy. There are several modifiable risk factors that can be intervened such as diabetes, arterial hypertension, smoking, uncontrolled use of systemic or topical corticosteroids, among others. Although the diagnosis is clinical, we must always perform a detailed study to rule out problems in other ocular structures that may be contributing to poor vision. This study will also allow us to better choose the most appropriate IOL for the patient. We must know the patient's needs and expectations after the surgery, especially if we plan to use toric IOLs, extended depth of focus or multifocal IOLs, which provide more spectacle independence than regular monofocal lenses. This review will describe the preoperative preparation, the technology used in an ultrasonic phacoemulsification surgery and the postoperative follow-up of the patient. Cataract surgery is one of the safest and cost-effective surgeries in modern medicine. More than 90% of the eyes achieve best corrected visual acuity of 20/25, and with the greater precision incorporated in new technologies more than 80% of the patients are left with +/- 0,5 residual diopters, so that today we can offer personalized visual results according to specific patient needs.
La catarata y los vicios de refracción no corregidos representan las principales causas de discapacidad visual moderada a severa en el mundo1, siendo ambas patologías tratables con cirugía y anteojos respectivamente. La catarata es un importante problema de salud pública en Chile, razón que llevó a la inclusión de la cirugía de catarata entre las Garantías Explícitas de Salud (GES) de nuestro país2. Su principal causa y factor de riesgo es la edad, por lo que se estima un aumento progresivo en la medida que aumente la expectativa de vida de la población de un país1.
La catarata es una condición, ya sea natural o adquirida, en donde el cristalino transparente se vuelve progresivamente más opaco y provoca una pérdida progresiva de la agudeza visual y sensibilidad al contraste. La afección suele ser bilateral.
La única solución al problema es la cirugía, que consiste en extraer la catarata e implantar un lente intraocular (LIO). En las primeras cirugías no existían los LIOs, por lo que un resultado exitoso era simplemente curativo, al extraer la catarata y tratar la afaquia con anteojos gruesos. Posteriormente, se suma el implante de un LIO esférico con el objeto de dejar un anteojo más delgado. Los progresivos y continuos avances en diferentes áreas, como los nuevos lentes intraoculares, las modernas fórmulas para calcular en forma más precisa los lentes intraoculares, las nuevas tecnologías para la evaluación pre-operatoria como para la realización de la cirugía propiamente tal, han hecho que actualmente esta cirugía tenga además una función refractiva, o sea, busca minimizar la dependencia de anteojos de lejos y/o cerca para mejorar la calidad de vida de los pacientes.
Anatomía y fisiopatologíaEl cristalino es una estructura transparente biconvexa cuya función es enfocar la luz emitida por objetos a diferentes distancias sobre la retina. Tiene un diámetro aproximado de 10mm y una longitud axial aproximada de 4mm. Está formado por fibras derivadas del epitelio del cristalino, una fina cápsula circundante que corresponde a la membrana basal del epitelio y posee fibras zonulares conectadas al músculo ciliar que permiten que cambie su curvatura para ejercer la acomodación3. Para mantener su transparencia cuenta con una vía de microcirculación extracelular impulsada por canales de sodio que aportan nutrientes a las fibras más profundas del núcleo y elimina sus residuos por flujo intracelular que guía los desechos por uniones estrechas. Cuenta también con uno de los mejores sistemas antioxidantes del cuerpo gracias a sus altas concentraciones de glutatión reducido (GSH). Este sistema contrarresta los efectos de las especies reactivas del oxígeno y es un cofactor para las enzimas reparadoras. El cristalino sirve además como filtro para proteger la retina de los rayos ultravioleta. Con la edad el cristalino sufre dos procesos degenerativos característicos: por un lado, se vuelve más rígido y pierde progresivamente su capacidad de cambiar de forma para enfocar de cerca, causando la presbicia; y por otro lado se opacifica debido al daño oxidativo acumulado, causando la catarata4.
Prevalencia y epidemiologíaLa catarata asociada a la edad es el tipo de catarata más frecuente. En todo el mundo hay 94 millones de personas con discapacidad visual de lejos moderada, grave o ceguera secundaria a cataratas1. Varios estudios poblacionales confirman que la prevalencia de las cataratas aumenta con la edad en diferentes grupos raciales, desde el 3,9% a los 55-64 años hasta el 92,6% en mayores de 80 años5,6, y que el bajo nivel socioeconómico es también un factor de riesgo para desarrollarlas7. La presencia de cataratas se asocia a un aumento de la mortalidad del individuo, no sólo por su asociación con enfermedades sistémicas como la diabetes tipo-2 o el tabaquismo8, sino también por el riesgo de caídas y sus consecuencias9.
La cirugía de cataratas es un procedimiento altamente costo-efectivo si se compara con otras cirugías oftalmológicas y no oftalmológicas. Por lo mismo, es importante tener políticas públicas que permitan resolver en forma oportuna el problema, ya que la pérdida de visión tiene un impacto económico y social notorio10. El número de operaciones anuales de cataratas varía de un país a otro debido a las diferencias en la accesibilidad para el diagnóstico y la cirugía, la derivación y los sistemas sanitarios11,12.
Clasificación de las cataratasA pesar del impacto visual mundial que producen las cataratas no existe un sistema de clasificación único que permita definir con exactitud la incidencia y prevalencia de esta patología.
Según la ubicación y características morfológicasDependiendo de la ubicación y características morfológicas de la opacificación se separan principalmente en tres formas: cataratas nucleares, corticales y subcapsulares posteriores13, que pueden existir por separado o en diversas combinaciones. Cada tipo tiene su propia localización anatómica, patología y factores de riesgo para su desarrollo. Menos frecuentes son las formas polar anterior, polar posterior y capsular anterior. Dentro de los sistemas para clasificar y graduar las opacidades del cristalino se usa extensamente el Lens Opacities Classification System (LOCS III)14, aunque también hay otros como el Wisconsin. Lamentablemente estos sistemas no son comparables entre sí15.
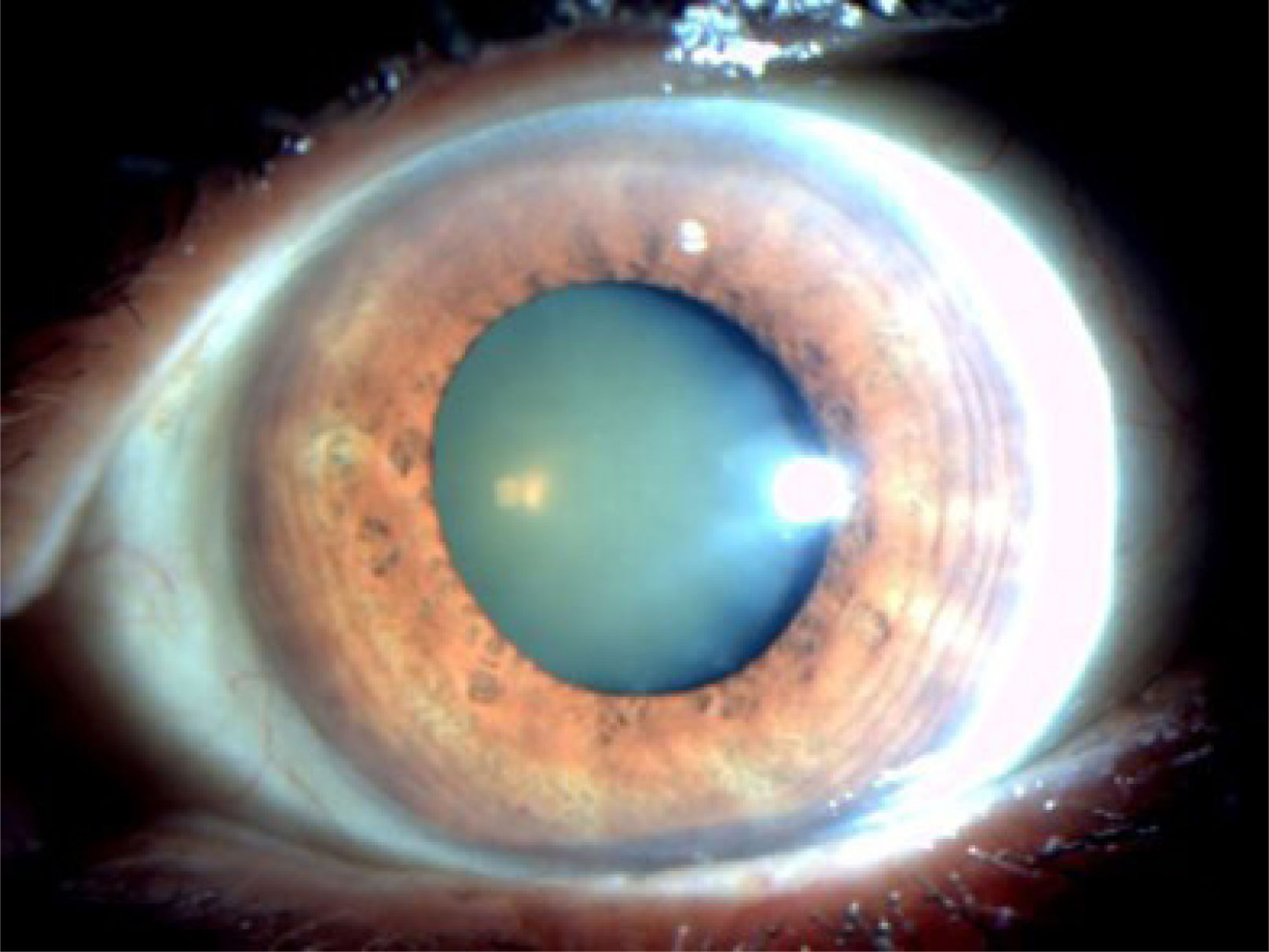
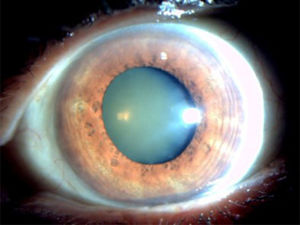
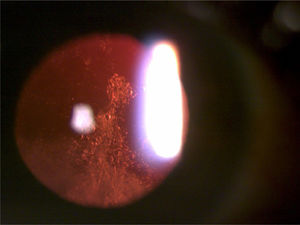
La catarata nuclear (figura 1) consiste en una opacificación o decoloración central del cristalino. Se produce por la sostenida migración de las células epiteliales del ecuador hacia el centro, donde se comprimen y acumulan progresivamente. Lo anterior, sumado al stress oxidativo, provoca la esclerosis y opacidad nuclear del cristalino16. Existen diferentes tipos de cataratas nucleares: brunescente, opalescente o ambas.
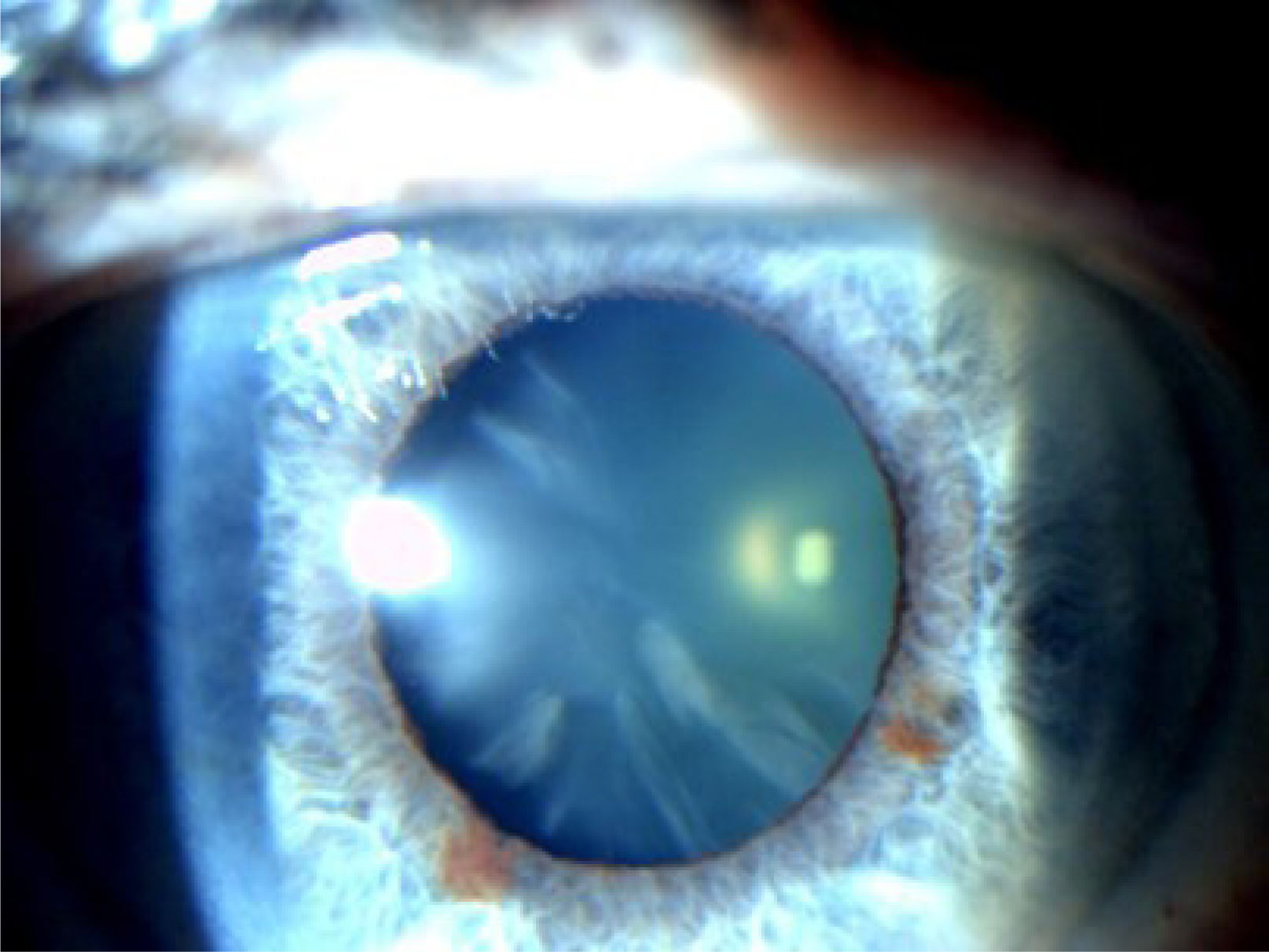
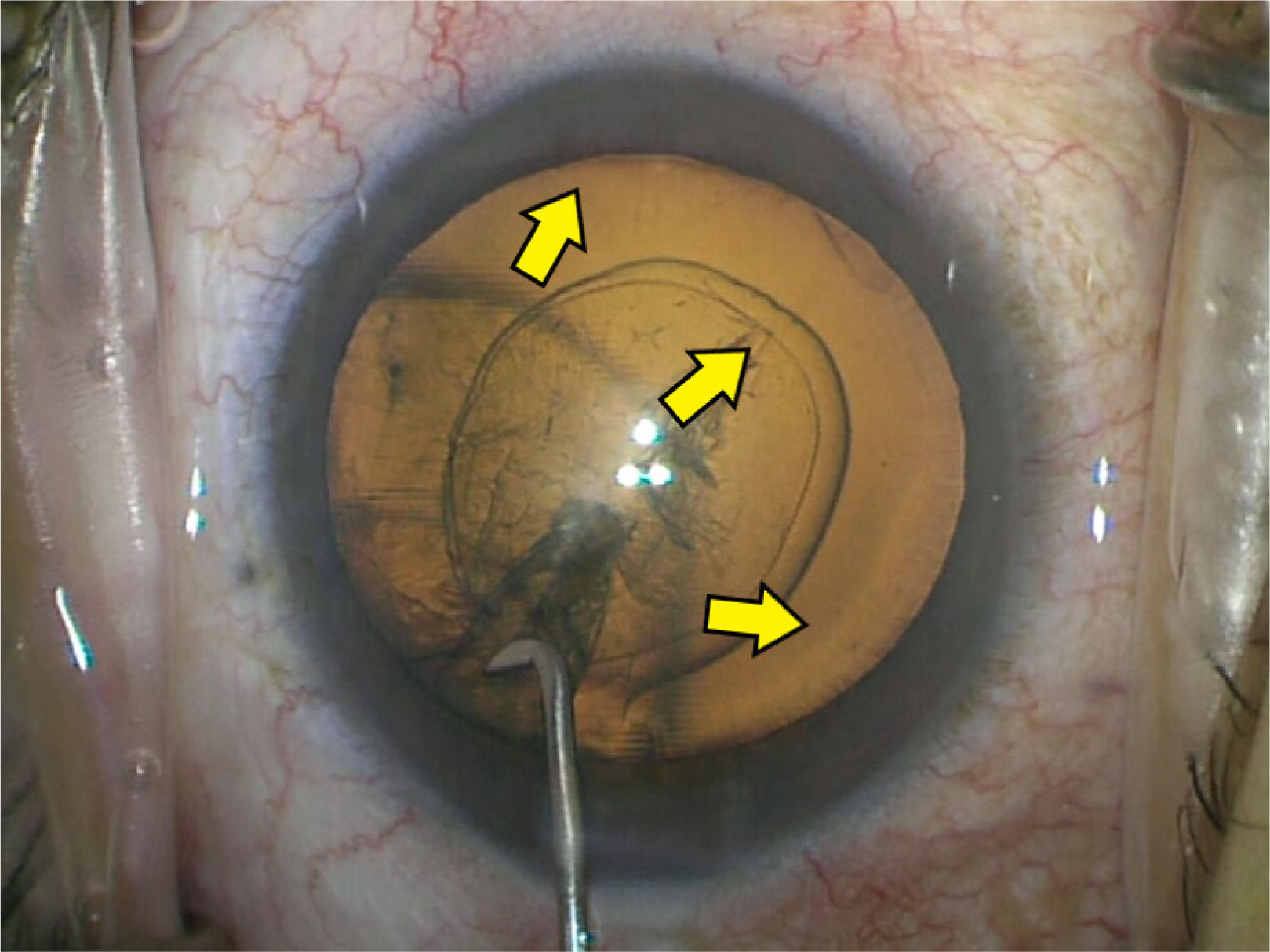
La catarata cortical (figura 2) es una opacidad en forma de cuña que comienza en la corteza y se extiende hacia el centro del cristalino17. Afecta más la periferia del cristalino, por lo que clínicamente producen encandilamiento, sobre todo al conducir de noche cuando la pupila es más grande. Al progresar toda la corteza se vuelve blanca y opaca, lo que se denomina catarata cortical madura.
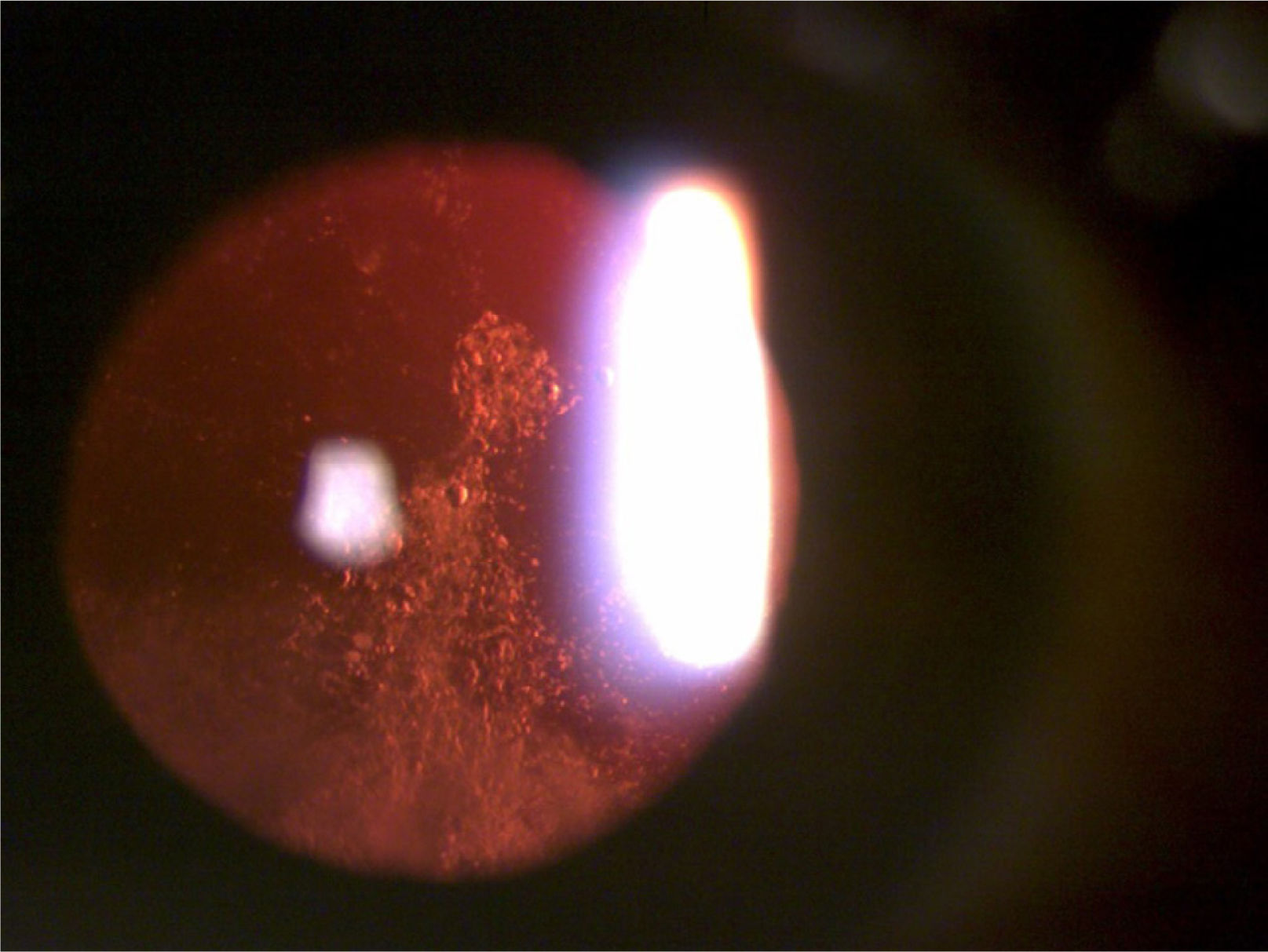
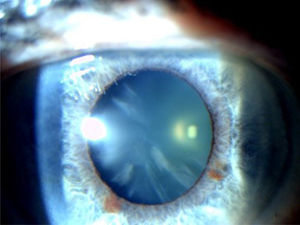
La catarata subcapsular posterior (figura 3) es una opacidad en forma de placa por dentro de la cápsula posterior, justo al centro del eje visual17 y muy cerca de los puntos nodales ópticos del ojo. Estos pacientes suelen tener deslumbramiento y mala visión con luz brillante, además su visión de cerca suele estar más afectada que la de lejos debido a la miosis por acomodación. En adultos jovenes es más frecuente que la catarata nuclear y cortical.
Según su etiologíaDel punto de vista etiológico podemos dividirlas en cataratas congénitas, cataratas del desarrollo (pediátricas o infantiles y juveniles), cataratas relacionadas con la edad y cataratas secundarias a agentes externos o a patologías sistémicas. La catarata relacionada con la edad es el tipo más frecuente y suele aparecer como esclerosis nuclear entre los 45 y los 50 años sin generar gran impacto clínico, sin embargo, el riesgo de hacerse clínicamente significativa aumenta progresivamente con cada década de vida16 por ser resultado directo del estrés oxidativo17. Las cataratas congénitas son aquellas que se presentan al nacer y las cataratas infantiles o pediátricas se refieren a una opacidad del cristalino que se desarrolla durante el primer año de vida. Las cataratas congénitas o pediátricas pueden ser unilaterales o bilaterales dependiendo de la causa. Estos pacientes siempre deben ser evaluados por un equipo multidisciplinario, dado que un tercio de estas cataratas son hereditarias, un tercio están asociadas a otras anomalías oculares, y el otro tercio forman parte de un síndrome multisistémico como el TORCH (grupo de enfermedades infecciosas que se transmiten de la madre al recién nacido). Las cataratas secundarias pueden ser por traumatismos, radiación (ionizante, infrarroja, ultravioleta), shock eléctrico, enfermedades metabólicas (ej. galactosemia, distrofia miotónica), uveítis crónica (ej. uveítis heterocrómica de Fuchs), síndrome de pseudoexfoliación, drogas etc.18. El uso prolongado de corticosteroides administrados de forma tópica o sistémica se asocia fuertemente con la formación de cataratas subcapsulares posteriores. Otros medicamentos que usados en forma crónica inusualmente pueden producir cataratas incluyen amiodarona, mióticos como la pilocarpina, busulfán (agente alquilante usado en quimioterapia) y fenotiazinas como la clorpromazina y el haloperidol19.
Factores de riesgoEn la génesis de la catarata existen factores de riesgo modificables y no modificables. El principal factor de riesgo no modificable es la edad. Identificar e intervenir estos factores de riesgo modificables es la única forma de prevenir su aparición precoz20. La mayoría de los estudios sobre factores de riesgo en cataratas son observacionales y, aunque sugieren claramente una asociación, no siempre consiguen demostrar la causalidad21. Los diferentes factores de riesgo se asocian a tipos específicos de cataratas.
Como ejemplos de asociaciones podemos destacar:
- •
Historia familiar con cataratas corticales y nucleares21
- •
Diabetes con cualquier subtipo de catarata22
- •
Hipertensión y obesidad con cataratas nucleares y corticales23
- •
Radiación ionizante con cataratas corticales y subcapsulares posteriores24
- •
Exposición a luz UVB con cataratas nucleares y corticales25
- •
Corticoides sistémicos con cataratas corticales y subcapsulares posteriores26
- •
Corticoides inhalatorios y tópicos con cataratas subcapsulares posteriores26
- •
Trauma con cataratas corticales y subcapsulares posteriores27
- •
Miopía con cataratas nucleares y subcapsulares posteriores28
- •
Vitrectomía por pars plana previa con cataratas nucleares29
- •
Fumar principalmente con cataratas nucleares y menos con las subcapsulares posteriores30
La catarata suele progresar con el tiempo, aunque la severidad y el ritmo varían considerablemente de un paciente a otro. Aunque es difícil predecir la velocidad de progresión, las cataratas subcapsulares posteriores tienden a progresar más rápido que las corticales y nucleares31.
Una catarata clínicamente significativa o que genera discapacidad visual es aquella en que los pacientes comienzan a tener dificultades para realizar sus actividades cotidianas. La afección de las funciones visuales son la base de sus manifestaciones clínicas. Estas funciones visuales alteradas incluyen la agudeza visual32, la visión periférica33, la percepción de profundidad34, la baja en la sensibilidad al contraste, la alteración de la percepción del color33, la dificultad en la adaptación a la oscuridad35 y el deterioro de la velocidad de procesamiento visual34. Una de las actividades que más impacta a los pacientes con cataratas es la dificultad en la lectura y las dificultades para conducir. Es característica la queja sobre halos en las luces de los vehículos al conducir de noche o la dificultad para adaptarse a los cambios de iluminación bruscos (ej. entrar a un túnel). Estos pacientes tienen 2,5 veces más accidentes de tráfico a 5 años en comparación con los conductores sin cataratas36. Otra manifestación clínica es la diplopía monocular debido a variaciones localizadas del índice de refracción de las zonas opacas del cristalino. Además de lo anterior, los distintos tipos de cataratas tienen efectos visuales. A modo de referencia, las cataratas nucleares suelen afectar más la visión de lejos que a la de cerca. En algunas ocasiones pueden provocar un aumento del índice de refracción del cristalino miopizando el ojo, de manera que pacientes previamente emétropes - e incluso los hipermétropes - refieren cierta mejoría de la visión de cerca por un corto período de tiempo. Las cataratas subcapsulares posteriores impactan más la visión de cerca y la visión nocturna para conducir por el deslumbramiento que producen.
DiagnósticoEvaluación oftalmológica inicialEl objetivo es confirmar que la catarata sea un factor significativo en el déficit visual y además identificar otras afecciones oculares o sistémicas que podrían estar contribuyendo. Es relevante interrogar dirigídamente al paciente sobre posibles factores causales como uso previo de corticoides, antecedente de traumas, historia familiar, etc. cómo tambien sobre factores de riesgo para complicaciones durante y post cirugía, tales como el consumo actual o previo de bloqueadores alfa-1 adrenérgicos (ej. tamsulosina) o la presencia de cirugía refractiva láser previa que puede determinar errores importantes en el cálculo y/o elección del LIO. La evaluación básica debe incluir la agudeza visual mejor corregida, la presión intraocular y los reflejos pupilares. Al biomicroscopio debemos evaluar la superficie ocular y la córnea con especial énfasis en ojo seco y estado del endotelio, evaluar profundidad de cámara anterior, además evaluar fenómeno Tyndall y el estado del iris buscando signos de uveítis previas (sinequias posteriores, zonas de atrofia) o presencia de pseudoexfoliación que sería factor predisponente para complicaciones zonulares en el intraoperatorio. En cámaras anteriores estrechas grado II de Van Herick se debe además realizar gonioscopía para evaluar sospecha de cierre angular. Con pupila dilatada deberemos describir la catarata, idealmente usando LOCS III14 u otro método estandarizado, y describir el fondo de ojo buscando signos de desprendimiento del vítreo posterior (DVP) con especial énfasis en buscar lesiones periféricas predisponentes para desprendimiento de retina. Además de lo anterior, es importante explicar al paciente su diagnóstico, las diferentes etapas de la cirugía y las características de los diferentes lentes intraoculares al que puede ser candidato37.
Evaluación de la discapacidad visualNo existe una única prueba o medida que describa adecuadamente el efecto de la catarata sobre el estado visual o la capacidad funcional de un paciente38, pero es la agudeza visual con tablero Snellen a 6 metros la prueba más utilizada. Tampoco existe una prueba que pueda definir adecuadamente un umbral para realizar una cirugía de cataratas. En Chile, se ha definido arbitrariamente una agudeza visual mejor corregida (AVMC) de 0,3 o menos para ingresar al programa GES, pero es un concepto basado en criterios económicos y de salud pública39. La población más vulnerable atendida en el sistema público tendrá acceso a la cirugía de cataratas en forma gratuita antes de 6 meses de su diagnóstico si cumple con dicho criterio.
La medición de agudeza visual con tablero Snellen puede subestimar los problemas funcionales que experimentan los pacientes en situaciones comunes de la vida real. Dado que la agudeza visual por sí sola puede ser un mal indicador del impacto de una catarata, la decisión de recomendar la cirugía de cataratas no debe tomarse únicamente sobre la base de la agudeza visual de Snellen40. Los tests de sensibilidad al contraste son un buen complemento, pero no están ampliamente disponibles. El impacto de la catarata en la función visual puede evaluarse subjetivamente mediante la historia clínica y cuestionarios especialmente diseñados. Indicadores clínicos importantes de deterioro de la visión pueden ser el glare o deslumbramiento, los halos y destellos al conducir por la noche y la diplopía monocular o imágenes fantasma. También debe considerarse el impacto sobre la realización de otras actividades básicas de la vida diaria aparte de la conducción, tales como hacer las compras, comer, vestirse, tomar sus medicamentos, etc.41.
Estudio sistémico preoperatorioLa evidencia disponible permite concluir que no es necesario solicitar exámenes generales preoperatorios de regla para este tipo de cirugía. En un estudio publicado en la revista New England Journal of Medicine se evaluaron aleatoriamente más de 9 000 cirugías con estudio preoperatorio consistente en electrocardiograma, hemograma, electrolitos plasmáticos, nitrógeno ureico, creatinina y glucosa, y se compararon con más de 9 000 cirugías sin exámenes generales. Los eventos intraoperatorios más frecuentes ocurridos en ambos grupos fue el manejo de la hipertensión y el manejo de alguna arritmia, principalmente bradicardia. No hubo diferencias estadísticamente significativas en la tasa de eventos intraoperatorios entre ambos grupos. Tampoco se encontró beneficio al analizar los grupos separando por edad, sexo, raza ni estado físico, de acuerdo con la clasificación de la Sociedad Americana de Anestesia (ASA)42. Según el juicio clínico podrá definirse junto al médico de cabecera alguna evaluación específica orientada a alguna condición especial del paciente, pero es innecesario solicitar estudios generales incluso a pacientes con patologías de base conocidas.
Estudio oftalmológico preoperatorioLos exámenes oftalmológicos preoperatorios ayudan a confirmar el diagnóstico y evaluar el resto de las estructuras oculares en busca de otras causas de deterioro de la AVMC. Además permiten evaluar varias características del ojo que son relevantes para definir la potencia de los diferentes lentes intraoculares y el modelo más adecuado.
BiometríaLa determinación del poder del lente intraocular es fundamental, por lo cual debemos tener una medición biométrica confiable. El primer dispositivo de biometría óptica para medir la longitud axial fue el IOL Master 500 (Carl Zeiss Meditec, Inc) lanzado el año 1999. Este equipo utilizaba interferometría de coherencia parcial (PCI) y demostró rápidamente ser más preciso, rápido y menos operador dependiente que la ecografía A-scan de inmersión43. Esta misma tecnología es usada hoy por Pentacam AXL (Oculus). El año 2009 aparece la tecnología de reflectometría óptica de baja coherencia (OLCR) con el lanzamiento del biómetro Lenstar LS900 (Haag-Streit USA, Inc). La tecnología más reciente de biometría óptica es la OCT de fuente de barrido o Swept Source (SS-OCT) que aparece el año 2014 al lanzarse IOL Master 700 (Carl Zeiss Meditec, Inc), siendo tambien utilizada por Argos (Alcon, Fort Worth, TX, USA) y Anterion (Heidelberg Engineering). Aunque los biómetros con tecnología PCI son comparables en precisión de cálculo del poder esférico del LIO con los biómetros OCT-OLCR o incluso con los SS-OCT más modernos, los OCT-PCI presentan un porcentaje alto de pacientes que no son capaces de medir. Se estima que los OCT-PCI no pueden medir el 15% de los pacientes versus 5,3% los OCT-OLCR y 2,7% los SS-OCT. Estas diferencias se acentúan más en las cataratas densas LOCS III grado 4 o mayor, donde el OCT-PCI falla en medir el 25,6% de los casos versus 10% de fallas del OCT-OLCR y 5,6% de fallas en SS-OCT44. Con cataratas subcapsulares posteriores los OCT-PCI tienen el mismo problema, no pudiendo medir el 25,7% de los pacientes versus 0% en SS-OCT45 (figura 4).
En aquellos casos en que no sea posible tener una biometría confiable por densidad de la catarata o por imposibilidad del paciente de fijar correctamente la mirada, debe solicitarse una ecografía A-Scan de inmersión para medir el largo axial46 y una ecografía B-Scan para evaluar el estado del segmento posterior.
Evaluación de la córneaLa ventaja que ofrecen los tomógrafos actuales Pentacam HR (Oculus, USA), Oculyzer II (Alcon, USA), Galilei (Ziemer Ophthalmic Systems AG, Switzerland) y Cassini (i-Optics BV, The Netherlands) es que además de evaluar el astigmatismo de la cara anterior permiten evaluar la cara posterior de la córnea tanto en sus curvaturas como en las aberraciones de alto orden (HOA). Así podremos pesquisar pacientes con queratocono clínico, subclínico y/o con aberraciones de alto orden importantes (astigmatismo irregular) donde la selección de un lente tórico, multifocal o profundidad de foco extendido (EDOF, por sus siglas en inglés) pueda ser una mala decisión47.
La evaluación de la función lagrimal también es importante. La reducción del menisco lagrimal, un Tear Break Up Time (TBUT) <10 segundos, un test de Schirmer <10mm o la atrofia de glándulas de Meibomio medida con meibografía (ej. Keratograph) pueden comprometer las queratometrías preoperatorias y/o las aberraciones ópticas corneales afectando el resultado postoperatorio por una mala elección o mal cálculo del lente48,49.
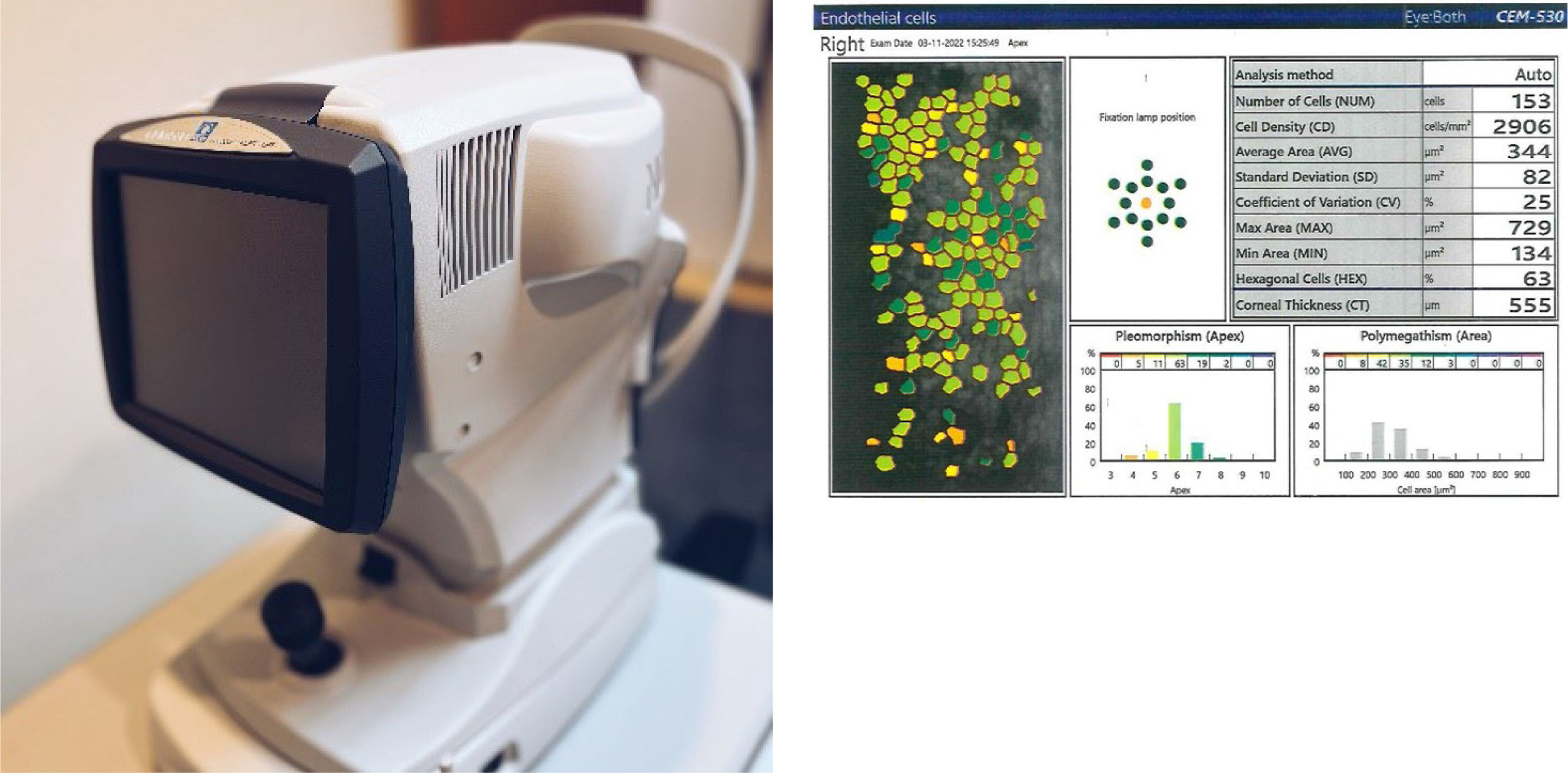
La microscopía especular se utiliza para detectar pacientes con enfermedad endotelial corneal previa y así determinar el riesgo de descompensación corneal post cirugía50. Es sobre todo importante en pacientes diabéticos ya que tienden a perder más células endoteliales que el resto de la población51 (figura 5).
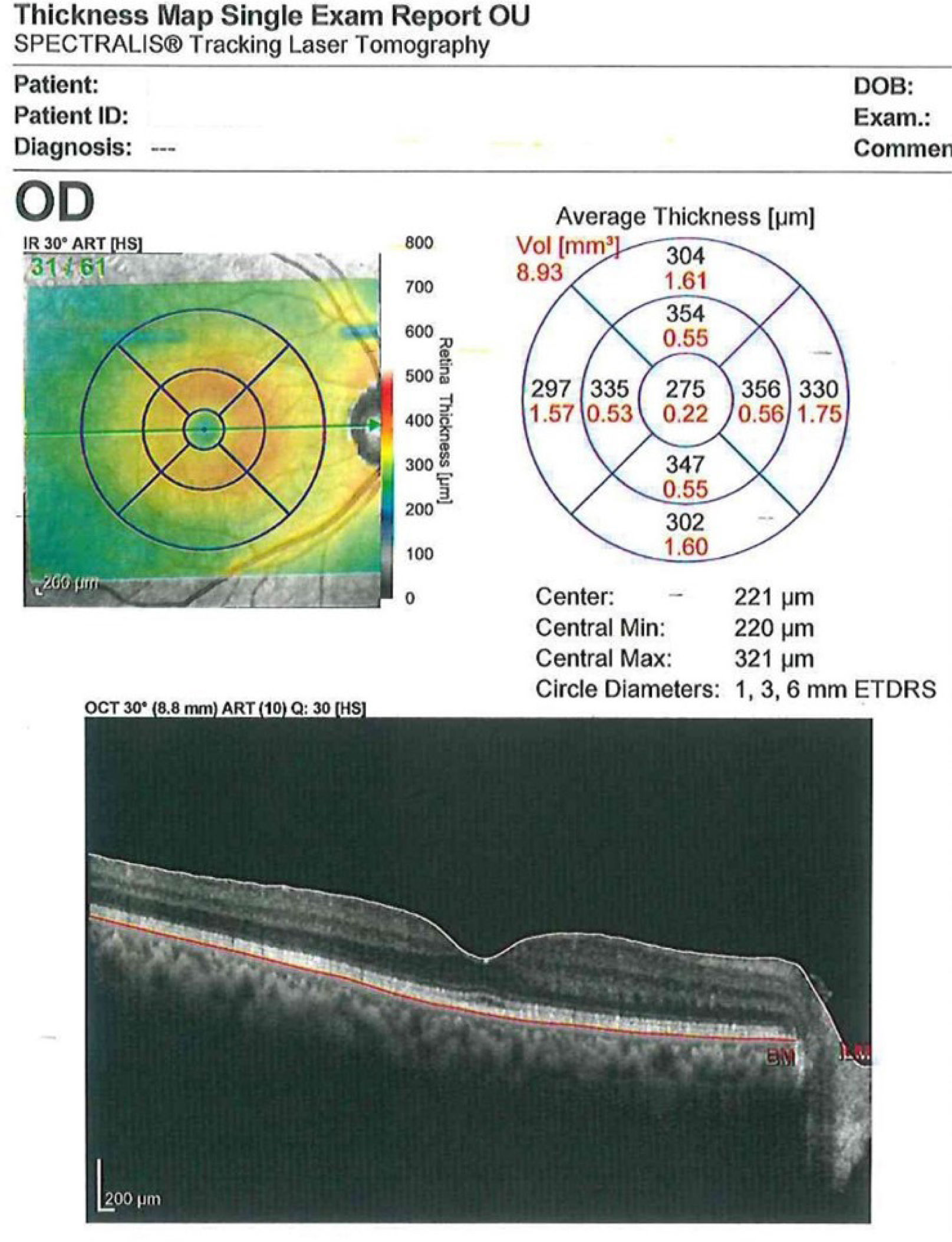
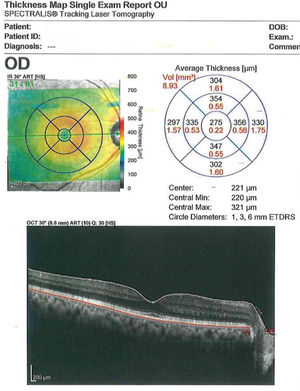
Exámenes del segmento posteriorLa tomografía de coherencia óptica (OCT) es parte fundamental de la evaluación previa ya que permite evaluar la arquitectura foveal e identificar la presencia de enfermedad retiniana concomitante incluso en presencia de un fondo de ojo detallado normal. El OCT es capaz de detectar patologías maculares entre un 4,6 a un 25% de los casos52. Detectar con OCT enfermedades maculares clínicamente insospechadas puede afectar la elección del lente, cambiar el plan quirúrgico inicial, modificar el consentimiento informado y/o cambiar las expectativas del paciente (figura 6).
En caso de cataratas densas u otra opacidad de medios que impida una adecuada visualización del segmento posterior se debe realizar previamente una ecografía B-scan para evaluar la presencia de desprendimiento del vítreo posterior, detectar posibles desgarros, descartar un desprendimiento de retina, detectar un estafiloma posterior o para tener una estimación de algún eventual daño glaucomatoso del nervio óptico al encontrarse una excavación acústicamente visible.
Exámenes de calidad ópticaSon especialmente importantes al considerar lentes multifocales o EDOF. Existen diversas formas de evaluar con detalle la calidad óptica del ojo y/o la calidad de la visión de un paciente.
Las pruebas subjetivas miden la calidad de la visión del paciente: pruebas de agudeza visual en presencia de una fuente de deslumbramiento como el Brightness Acuity Test (BAT) y/o pruebas de sensibilidad al contraste. Pacientes con catarata y aparente buena AVMC pueden verse muy afectados en presencia de brillo o disminución del contraste53.
Las pruebas objetivas buscan medir la calidad óptica del ojo midiendo las aberraciones de alto orden totales del ojo, corneales e internas, por lo que permiten estimar si el problema visual se encuentra en la córnea o en sus estructuras internas (ej. catarata). Los nuevos aberrómetros ray-tracing iTrace (Tracey) y de frente de onda OPD Scan III (Nidek Co., Ltd. Japón) combinan las mediciones aberrométricas totales con las mediciones aberrométricas derivadas de topografía corneal. Esto les permite separar las aberraciones de alto orden (HOA) totales, corneales y calcular por diferencia las HOA internas del ojo, que corresponden a las del cristalino y vítreo. Gracias a esta capacidad se puede estimar el grado de cataratas de acuerdo con la combinación de aberraciones de alto orden y scattering interno del ojo. El equipo iTrace entrega el reporte de Disfunction Lens Index (DLI) para tal efecto54 y en el OPD Scan III se puede estimar el modulation transfer function (MTF) entregado en el reporte de calidad óptica de Gatinel (figura 7).
Manejo preoperatorioIndicaciones al paciente para el día de su cirugíaAyuno preoperatorio. Aunque la ASA no hace recomendaciones específicas sobre cirugía de catarata con anestesia tópica y sedación, en términos generales recomienda suspender líquidos 2 horas antes, alimentos ligeros 6 horas antes, y alimentos pesados 8 horas antes. No obstante lo anterior, dos estudios retrospectivos que en conjunto suman más de 35 000 cirugías con sedación en pacientes sin ayuno no reportan ningún caso de neumonía por aspiración. La Sociedad Canadiense de Oftalmología y el Real Colegio de Oftalmólogos del Reino Unido indican que no es necesario ayuno si el paciente será intervenido únicamente con anestesia tópica55. Considerando el bajo riesgo de una neumonía por aspiración en cirugías sin ayuno con sedación, pero su potencial riesgo de mortalidad, se sugiere respetar las normas de ayuno preoperatorio de la ASA en caso de planificarse sedación y dejar a criterio del médico tratante y del anestesista la decisión especial de dar sedación sin ayuno preoperatorio56.
Anticoagulantes y antiagregantes plaquetarios. El cirujano y el anestesista deben conocer los antecedentes médicos generales del paciente y los medicamentos que utiliza. No es necesario suspender los anticoagulantes ni los antiagregantes plaquetarios en pacientes que recibirán anestesia retrobulbar, peribulbar, subtenoniana ni en anestesia tópica, ya que no se ha demostrado que estos fármacos aumenten las complicaciones hemorrágicas que ponen en peligro la visión, tales como hemorragia peribulbar o retrobulbar ni complicaciones intraoculares como hifema ni hemorragia supracoroidea57.
Antagonistas selectivo alfa1A/Inhibidores de la 5-alfa reductasa. Suspender medicamentos para tratar la hiperplasia prostática benigna, tales como como la tamsulosina o el finasteride, por aumentar el riesgo de causar síndrome de iris flácido intraoperatorio (IFIS, por sus siglas en inglés) es objeto de controversia, pero parece ser razonable. Existe fuerte asociación entre IFIS y el uso de antagonistas selectivo alfa1A (Ej. tamsulosina, silodosin) y en menor asociación con el uso de inhibidores de la 5-alfa reductasa (ej. finasteride). Existen muchos reportes de IFIS incluso en pacientes que han tomado tamsulosina en forma crónica y la han suspendido hace años. Uno de los principales mecanismos propuestos es la atrofia irreversible del músculo dilatador de la pupila que se genera con el uso crónico. Existen otros mecanismos sobre el iris que podrían ser reversibles si los medicamentos se suspenden transitoriamente, por lo que parece ser razonable que no se consuman antes de la cirugía58.
Ingreso y preparación preoperatoriaEl paciente se prepara previamente con fenilefrina 2,5% (Mydfrin, Alcon) y tropicamida 1% (Mydriacyl, Alcon) para lograr buena dilatación pupilar; y también con AINES como ketorolaco 0,4% (Acular-LS, Allergan) o nepafenaco 0,1% (Nevanac, Novartis) para evitar miosis durante la cirugía59.
Los esquemas de aplicación son variables, pero comúnmente se usa 1 gota cada 5 a 10 minutos por 4 veces. Todavía es práctica frecuente utilizar antibióticos tópicos preoperatorios como quinolonas de 4ta generación para prevenir endoftalmitis, sin embargo, el uso mandatorio de povidona periocular y fondos de saco hace que esta medida sea innecesaria60.
En los casos que se requiera corrección astigmatismo con un LIO tórico y no se disponga de tecnología para tal efecto en el pabellón se debe marcar previamente el eje 0-180 grados con el paciente sentado, ya que la ciclotorsión que ocurre con el paciente acostado puede llegar a más de 10 grados, lo hace imposible predecir el eje real donde debe ser implantado el LIO61.
Cirugía y consideraciones dentro del pabellónEl tratamiento actual de una catarata es su extracción quirúrgica con ultrasonido y el reemplazo de la función del cristalino con un LIO. El uso de láseres de femtosegundo no tendría ventajas sobre la actual facoemulsificación y sería la opción menos costo efectiva62.
En décadas pasadas el objetivo principal de la cirugía era curativo, de tal forma de finalizar el procedimiento sin complicaciones. Con los nuevos avances el objetivo refractivo se ha vuelto igual de importante, por lo que el implante de lentes intraoculares de mayor tecnología es una de las principales ramas de la cirugía refractiva moderna.
En relación con la anestesia existen varias alternativas que se evalúan según el paciente, el cirujano, y los riesgos y beneficios de cada una de ellas. Se ha evolucionado desde la anestesia general, luego las formas de anestesia local (retrobulbar, peribulbar, subtenoniana) hasta la anestesia tópica con proparacaína o tetracaína. La anestesia retrobulbar no se utiliza en la práctica, ya que la técnica peribulbar utiliza una aguja más corta y respeta el espacio retrobulbar, bajando el riesgo de hemorragia retrobulbar, lesión del nervio óptico y lesión del globo ocular. La anestesia tópica tiene la ventaja de ser rápida y efectiva evitando los riesgos anteriores, pero debe usarse - idealmente - bajo alguna forma de sedación ya que no es tan efectiva en el manejo del dolor como la anestesia local.
Como en cualquier cirugía, la técnica debe ser aséptica para prevenir la endoftalmitis o infección intraocular, que es una de las complicaciones más peligrosas. La principal fuente de infección es la flora de la piel y sacos conjuntivales del mismo paciente. La medida aislada más importante para prevenir una endoftalmitis es la aplicación de povidona iodada al 5 o 10% en la piel y en los fondos de saco por 1 a 3 minutos. Dado que en Chile no siempre es fácil encontrar povidona al 5% es razonable utilizar povidona al 10%, aunque es más molesta para el paciente63. Nunca se debe diluir la povidona al 10% para dejarla al 5%, ya que esto diluye los iones, cambia la osmolaridad y el pH que mantienen estable la molécula en la solución, perdiendo actividad antiséptica64. En pacientes con alergia a la povidona no se recomienda aplicar clorhexidina a los fondos de saco, sólo a la piel. En estos casos es de gran utilidad usar antibióticos intracamerales.
Sobre las técnicas para extraer la catarata debemos recordar que en las primeras cirugías se extraía la catarata junto a la cápsula que la rodea, dejando al paciente afáquico. Esta técnica en desuso era llamada cirugía intracapsular o Intra Capsular Cataract Extraction (ICCE) en la literatura anglosajona. En los años 80 se modificó la técnica de forma de respetar esta cápsula, por lo que se le llamó cirugía extracapsular o Extra Capsular Cataract Extraction (ECCE). Esta nueva técnica permitió mantener la integridad de la cápsula posterior aislando el vítreo y permitiendo el implante del LIO alejado del endotelio corneal, ya sea en el surco de la cámara posterior o incluso en el mismo saco capsular. Actualmente la ECCE manual no es la técnica de elección ya que requiere incisiones grandes (12 a 14mm) para extraer la catarata, lo que ralentiza la cirugía misma y la recuperación visual. Sin perjuicio de lo anterior, todavía hay casos donde tiene ventajas, por ejemplo, en cataratas extremadamente duras donde se requieren grandes cantidades de energía ultrasónica para extraer la catarata, situación que - a diferencia de la ECCE manual - daña en exceso y de forma irreversible el endotelio. Una variante usada en países en vías de desarrollo es Manual Smaller Incision Cataract Surgery (MSICS), donde se realiza un túnel escleral de 6,6 a 7,5mm, luego una capsulorexis circular continua (CCC), se luxa la catarata a cámara anterior para luego sacarla por la incisión entera o por fragmentos. Finalmente se aspira la corteza residual y se implanta un LIO de 3 piezas65.
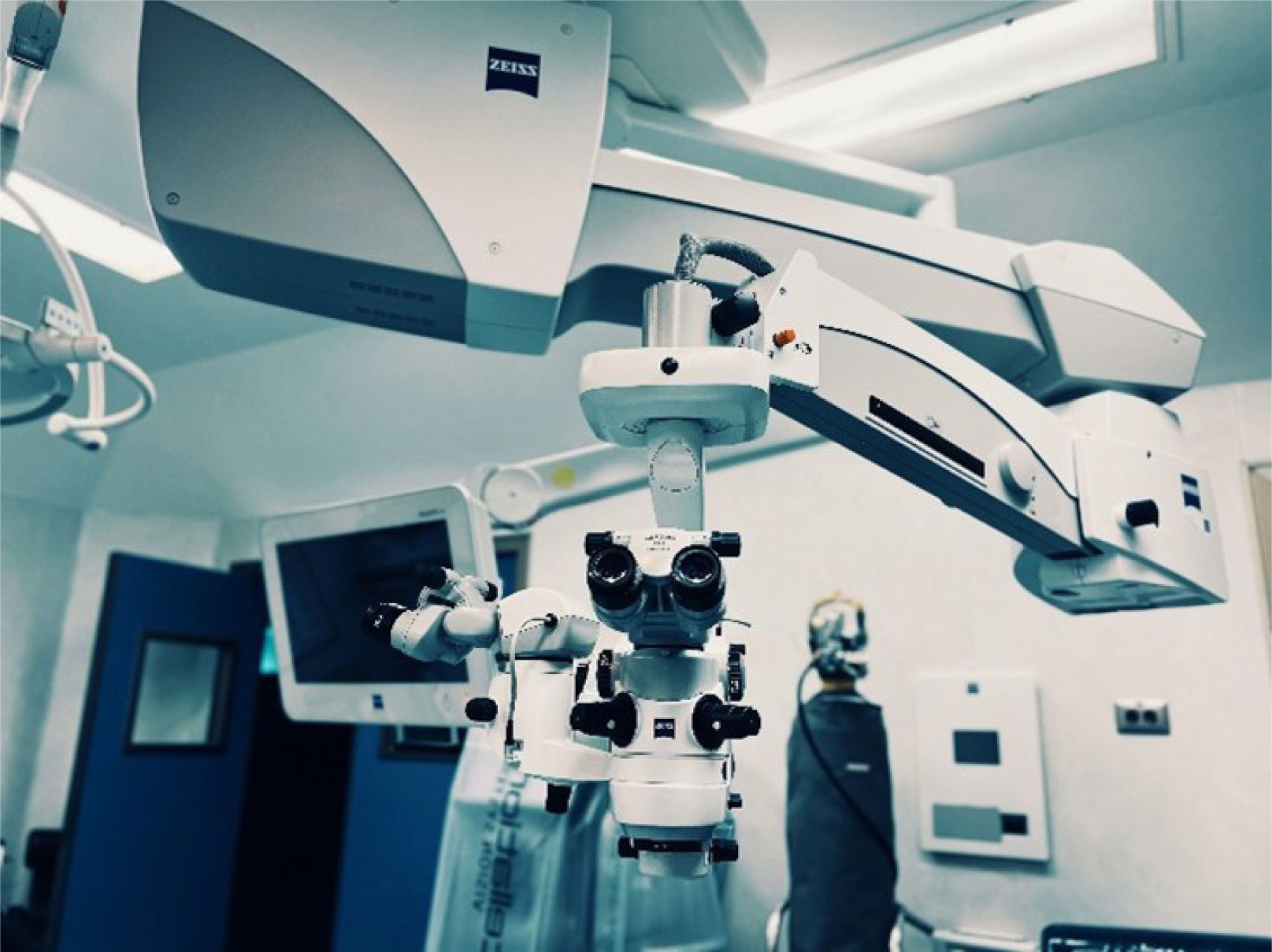
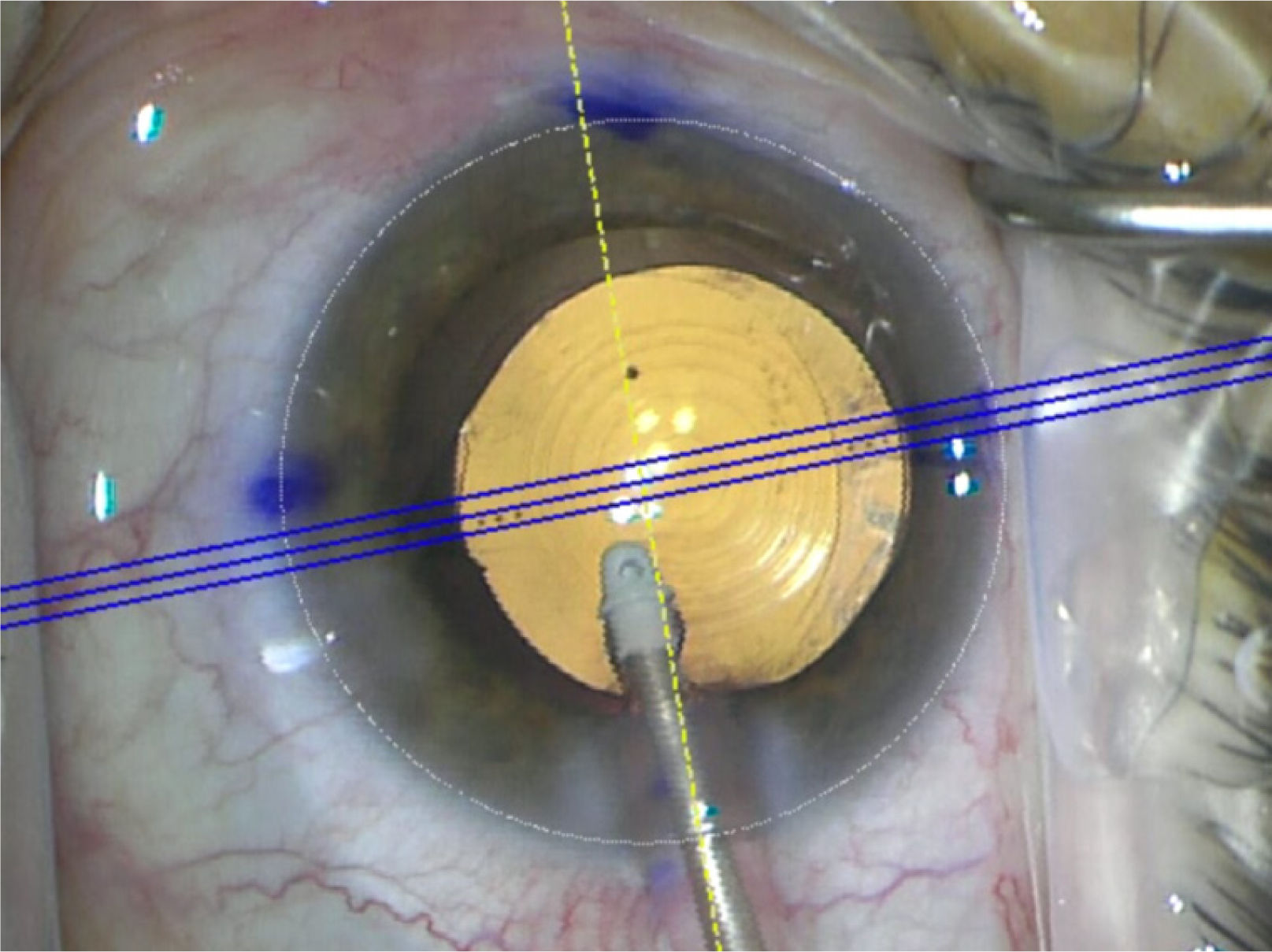
La técnica moderna de elección es la cirugía extracapsular con facoemulsificación ultrasónica o facoemulsificación, donde se extrae la catarata emulsificando el contenido con ultrasonido sin dañar la cápsula. Es una técnica ambulatoria que tarda menos de 20 minutos y tiene una muy rápida recuperación visual. Esta técnica requiere un microscopio con óptica de gran aumento y luz coaxial que permita tener rojo pupilar durante la cirugía. Usualmente lo controla el cirujano con un pedal que permite enfocar y disponer de diferentes aumentos (zoom) (figura 8).
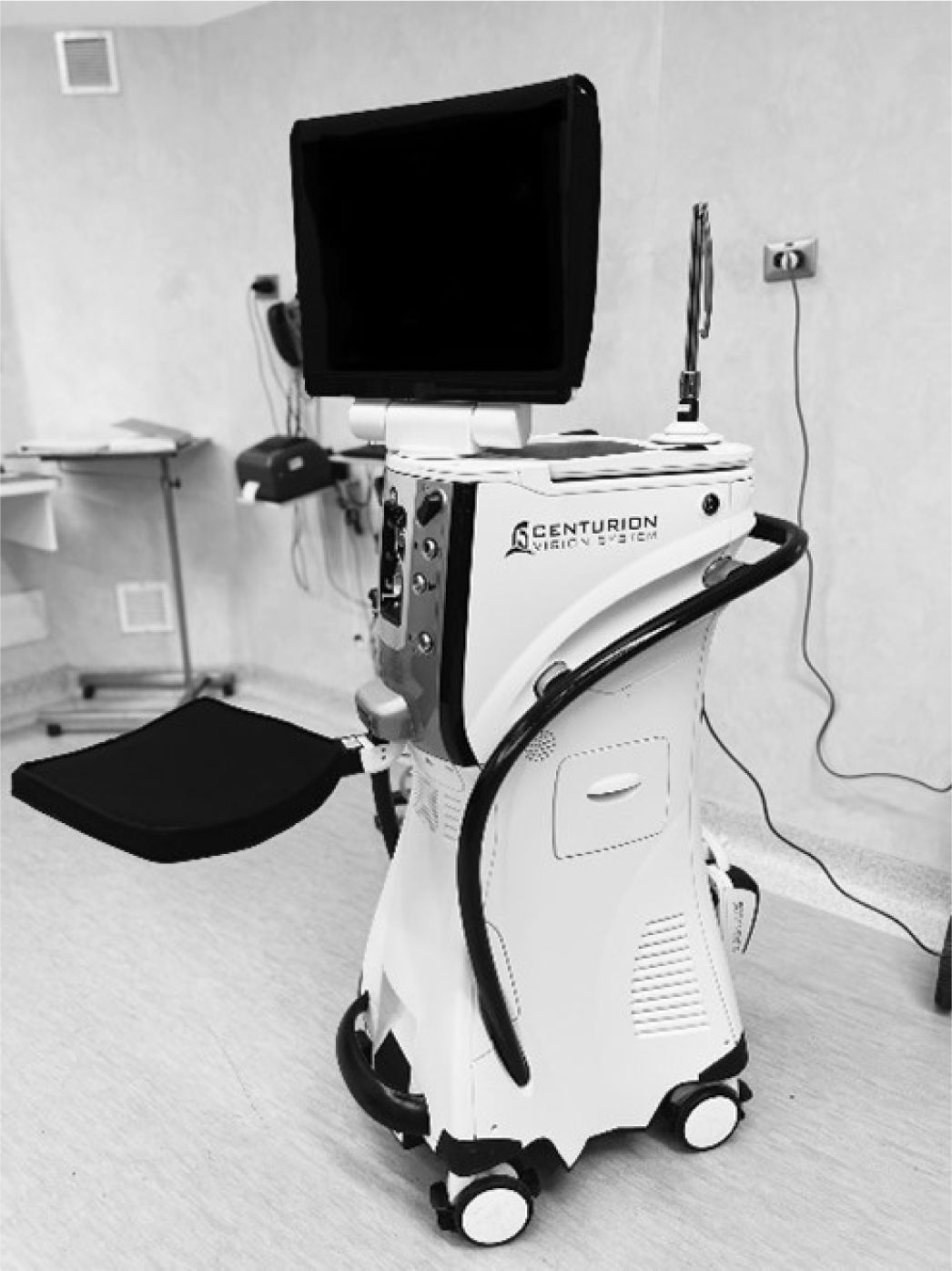
También se requiere de un equipo especial llamado facoemulsificador que consta de tres partes principales: consola central donde se programan los parámetros, pieza de mano y pedal (figura 9).
La pieza de mano es el instrumento que ingresará al ojo. En su extremo distal tiene una punta o tip con características especiales. Son cilindros metálicos (ej. titanio) con un lumen de aspiración, pudiendo ser rectos o angulados (tipKelman). Son capaces de oscilar a velocidad ultrasónica (30 000Hz) en forma longitudinal y/o torsional cuando el cirujano presiona el pedal. La punta de la sonda está cubierta por una banda de plástico llamada camisa por donde se inyecta solución salina balanceada (BSS) que mantiene la cámara anterior presurizada y enfría la punta de la sonda que genera calor al vibrar. Los residuos emulsificados con ultrasonido son aspirados a través del lumen del mismo tip, de manera que la solución de BSS que aspira es similar a la que el sistema irriga por la camisa que lo rodea, manteniendo una cámara anterior estable durante la cirugía. El equipo permite modificar algunos parámetros a modo de poder realizar en forma eficiente y segura las diferentes etapas de la cirugía:
- -
Poder: Define la cantidad de energía entregada como ultrasonido para emulsificar la catarata. Mayor poder es más eficiente pero más dañino para las estructuras intraoculares.
- -
Vacío: Determina la “fuerza de agarre” del tip al empalarnos en el núcleo cataratoso. Tener un vacío alto es especialmente útil para fijar el núcleo cuando queramos “chopearlo” con otro instrumento.
- -
Flujo de aspiración o rate: Es la velocidad con que aspira fluido el equipo. Permite el efecto de atracción de los trozos de la catarata. Tener un rate alto es útil en la etapa de remoción de cuadrantes, ya que atrae estos a la punta del faco sin tener que ir a buscarlos a la periferia cerca de la cápsula con el riesgo de romperla.
- -
Irrigación o altura de la botella. Define la velocidad con que se inyecta fluido a la cámara anterior. La relación entre la irrigación y la aspiración debe ser balanceada para mantener una cámara anterior amplia y estable mientras se aspira.
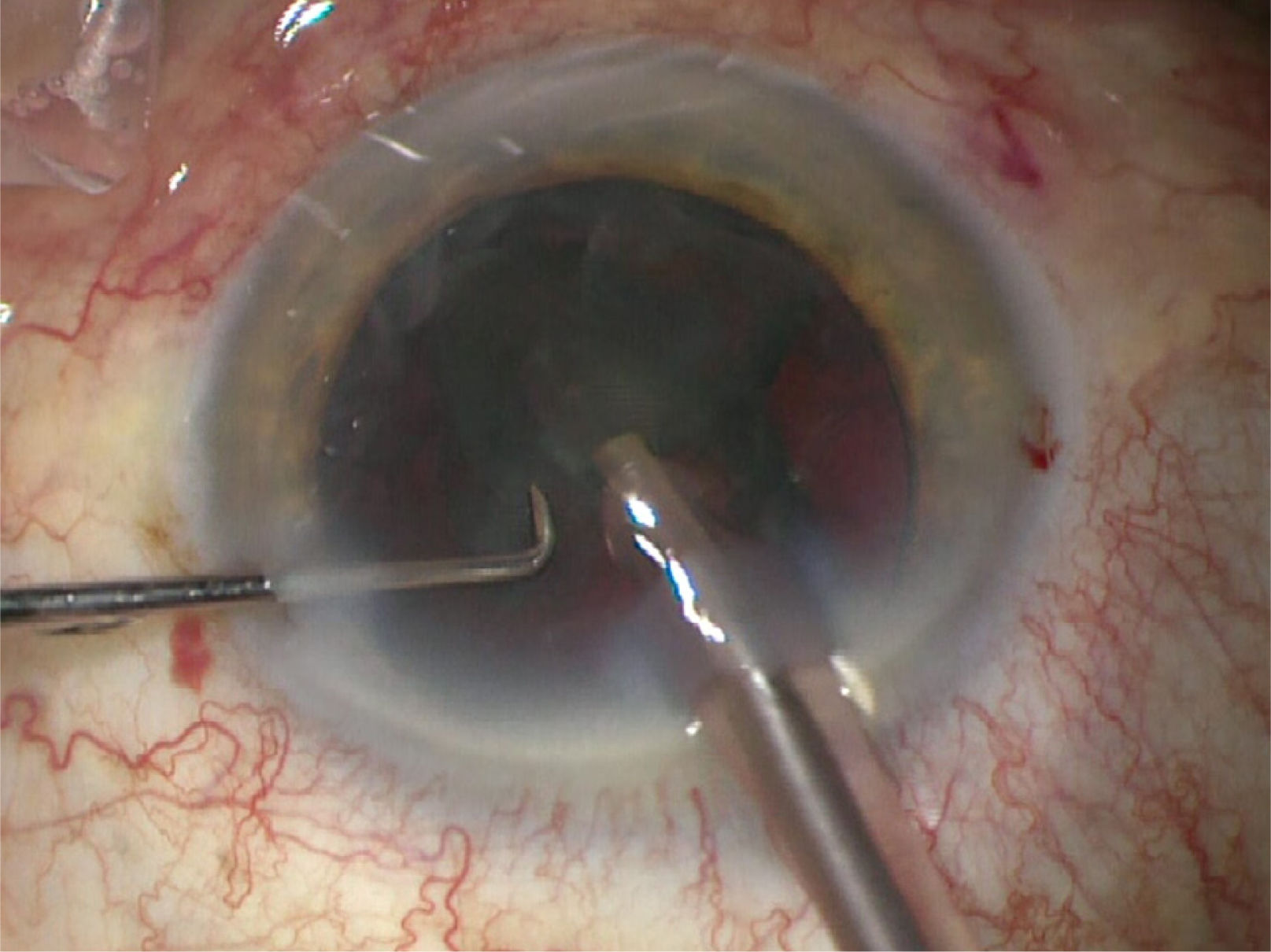
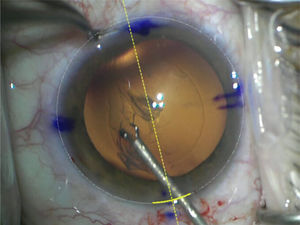
En términos breves la facoemulsificación se inicia aplicando la anestesia de preferencia. Con técnica estéril se instala un blefarostato o espéculo palpebral. Según preferencia y comodidad del cirujano se realiza una incisión por córnea clara superior o temporal de 1,8 a 3,2mm y una o dos paracentesis auxiliares. Para mejorar la dilatación pupilar puede usarse en forma intracameral “shugarcaína”, una mezcla de lidocaína al 4%, epinefrina sin bisulfitos 0,1% (1:1 000) y BSS. Fue descrita el año 2006 por el Dr. Joel Shugar y es especialmente útil en pacientes con antecedente de consumo actual o previo de bloqueadores alpha-1 adrenérgicos (ej. tamsulosina) en riesgo de síndrome de iris flácido66. Se inyecta viscoelástico dispersivo para proteger el endotelio y viscoelástico cohesivo para formar la cámara anterior o “soft shell”. Se realiza una CCC con quistótomo, pinza Utrata o con microfórceps de 4,5 a 5mm, luego se realiza hidrodisección para separar la cápsula de la corteza; y en ocasiones hidrodelaminación para separar el núcleo del epinúcleo en cataratas blandas (figuras 10 y 11).
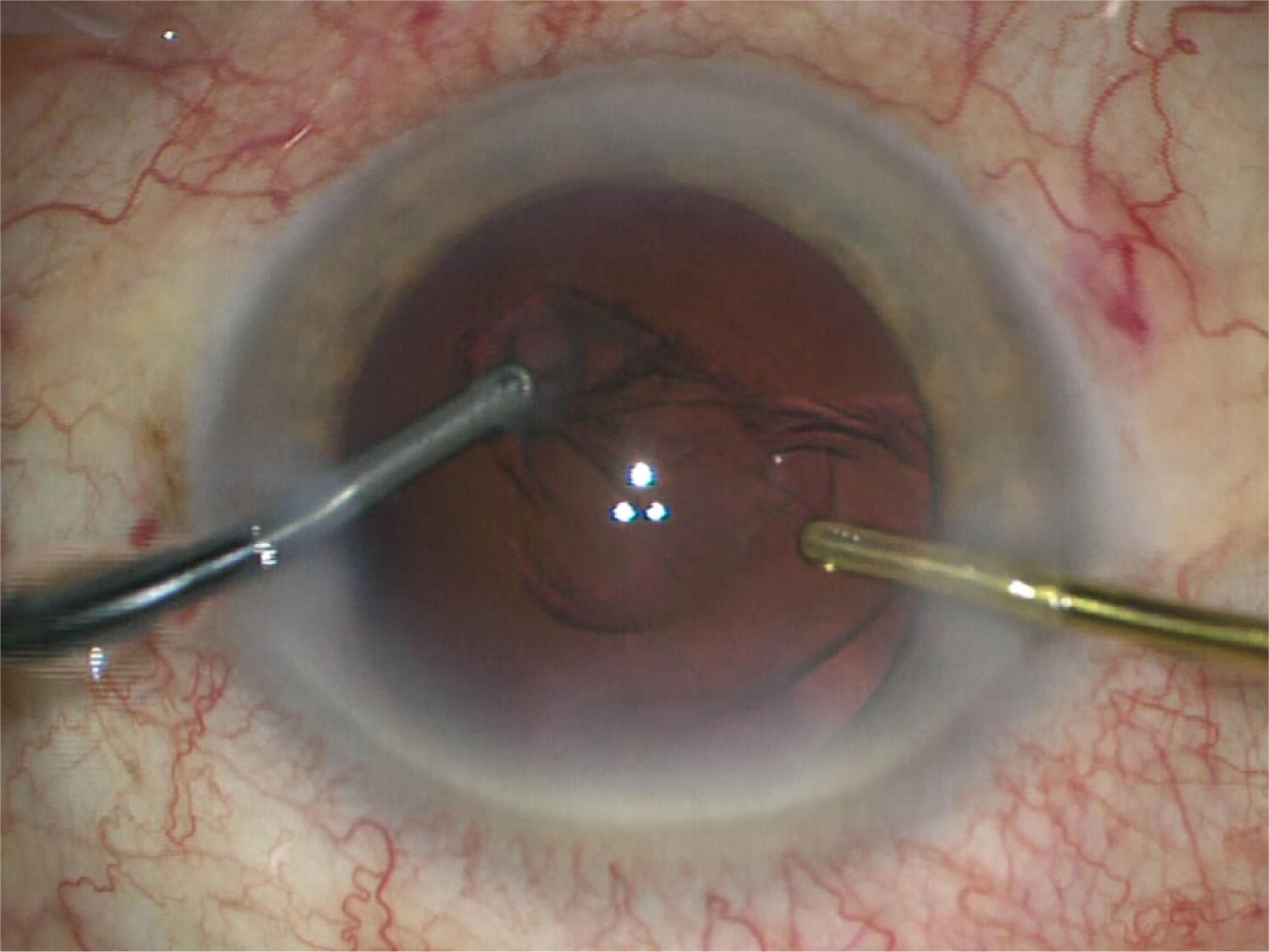
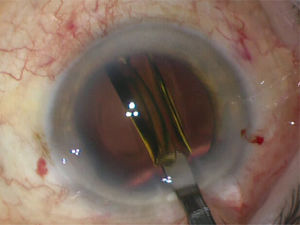
La punta de la pieza de mano se introduce por la incisión principal y el chopper por la paracentesis auxiliar para proceder a la extracción del núcleo y epinúcleo. Existen varias técnicas para realizar esta maniobra dependiendo de la destreza del cirujano y/o de la dureza de la catarata. Las tradicionales son:
- -
Dividir y conquistar o “4 cuadrantes”: Se realizan dos surcos centrales en forma de cruz con bajo vacío y baja aspiración (rate). Luego se rompe o “crackea” el núcleo con ayuda del chopper para generar 4 trozos que se emulsificarán posteriormente con bajo vacío y moderado o alta aspiración (rate) para facilitar la atracción de los trozos.
- -
Chop: Consiste en empalar o enterrar el tip del facoemulsificador con baja o moderada aspiración (rate) y alto vacío para fijar el núcleo. Con el núcleo empalado, firme y estable se procede a trozar la catarata con un segundo instrumento llamado chopper, que se introduce por la paracentesis auxiliar. Se puede “choppear” en forma horizontal o vertical. Luego se emulsifican estos trozos por separado con aspiración (rate) moderada o alta y vacío bajo.
- -
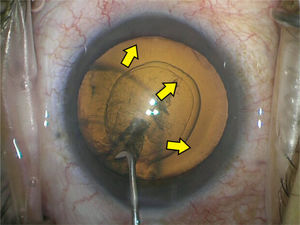
Stop and chop: Es una combinación de las anteriores. Primero se realiza un surco central con vacío y aspiración (rate) bajos. Se troza o “crackea” el núcleo en 2 usando un segundo instrumento. Luego se procede a empalar cada trozo con vacío alto para mantenerlo firme y trozarlo con el chopper. Finalmente, los 4 o más trozos generados se emulsifican (figura 12).
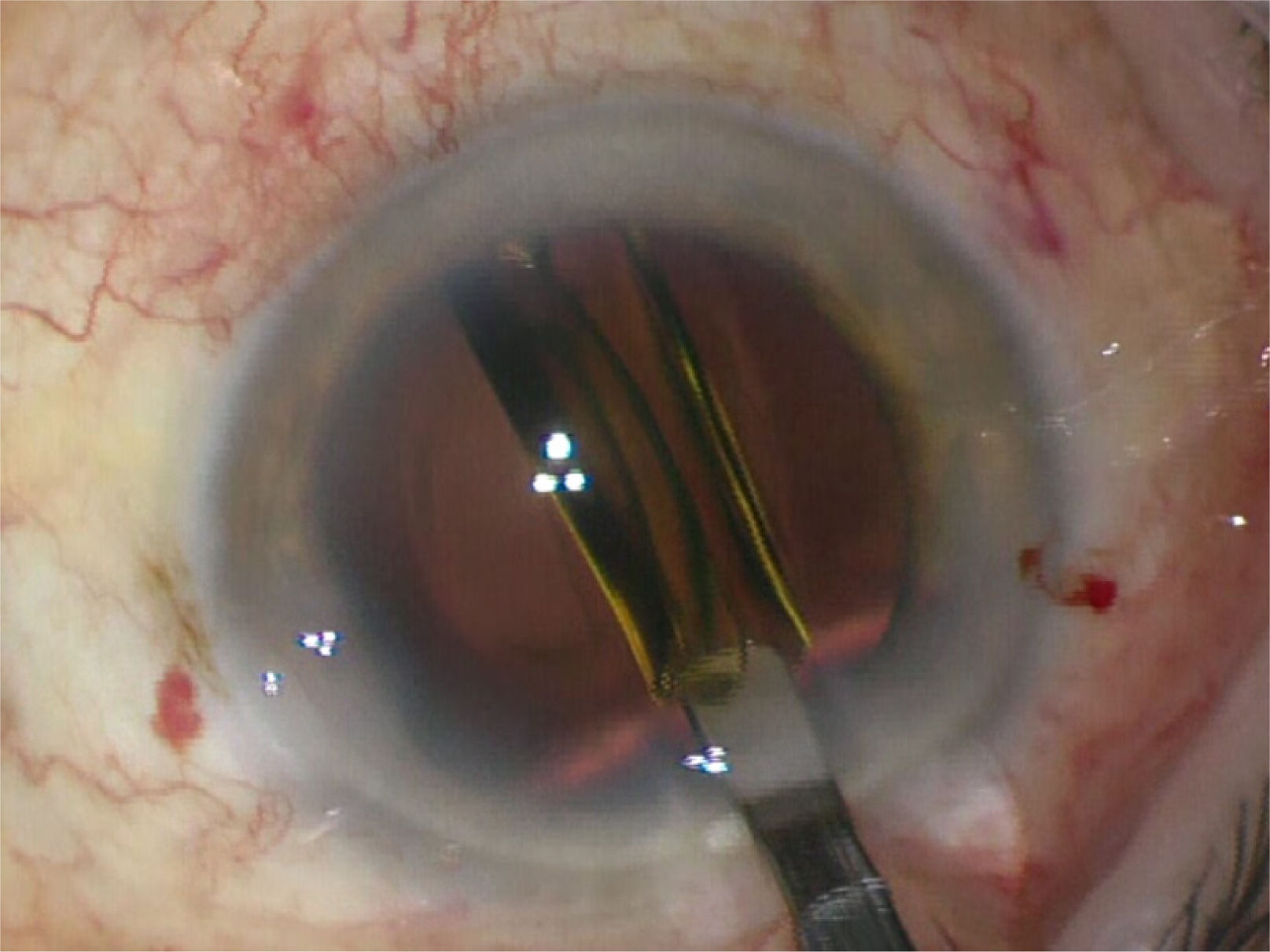
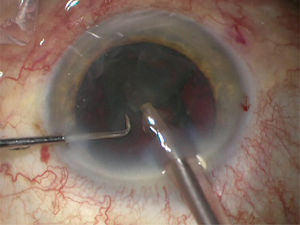
Una vez emulsificado y aspirado el núcleo y epinucleo se extrae la corteza residual adherida al saco capsular con una sonda especial de irrigación aspiración a través de la incisión principal, con cánula de Simcoe o en forma bimanual por las dos paracentesis auxiliares (figura 13).
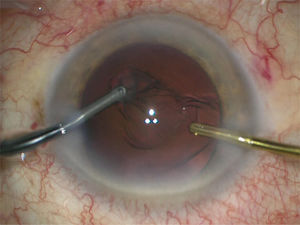
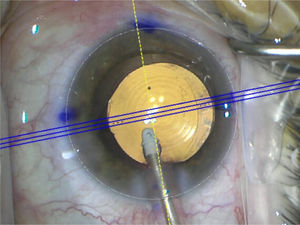
Se inyecta viscoelástico cohesivo para abrir el saco capsular y se procede a inyectar el lente intraocular plegable en el saco (figura 14).
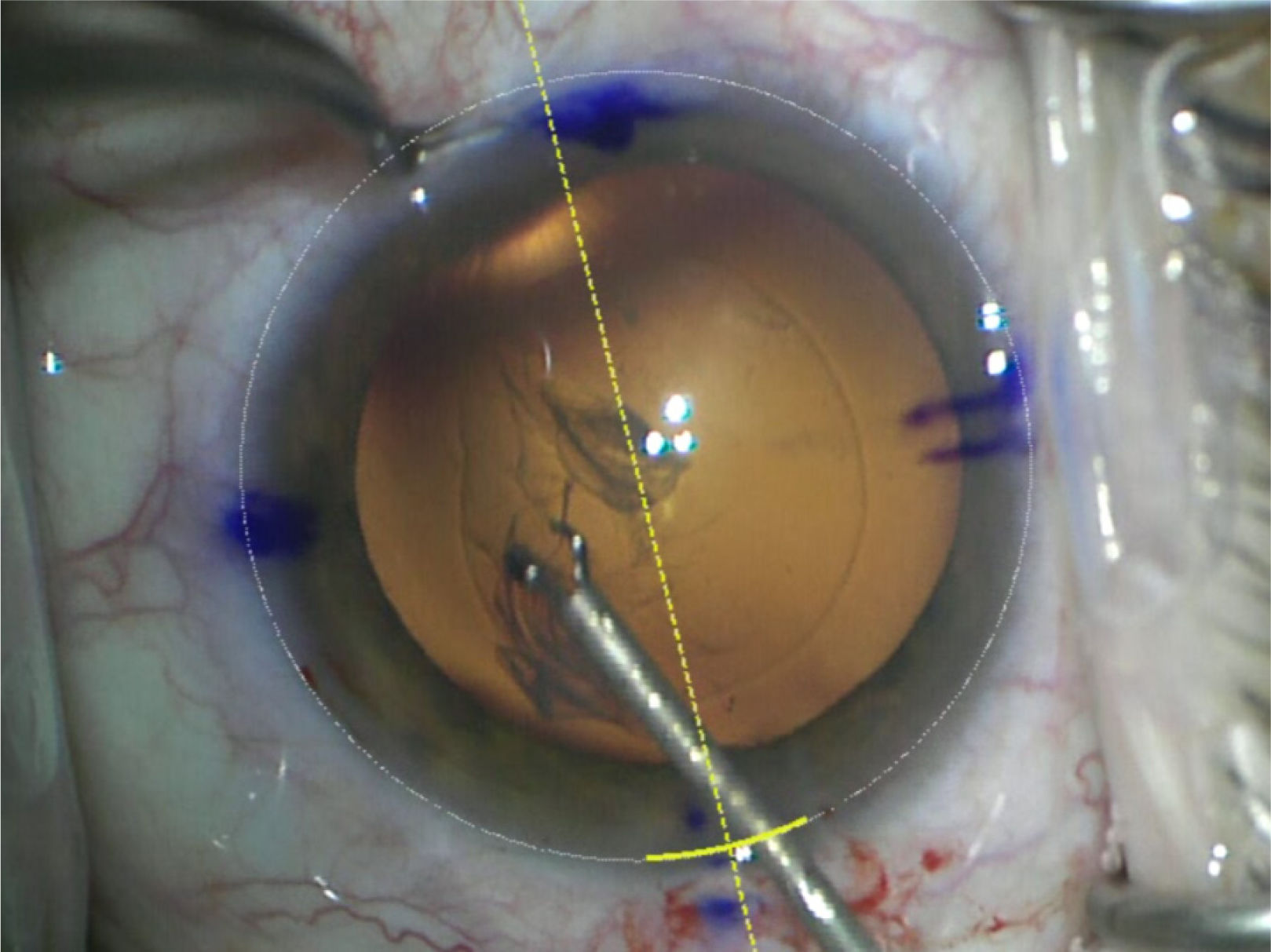
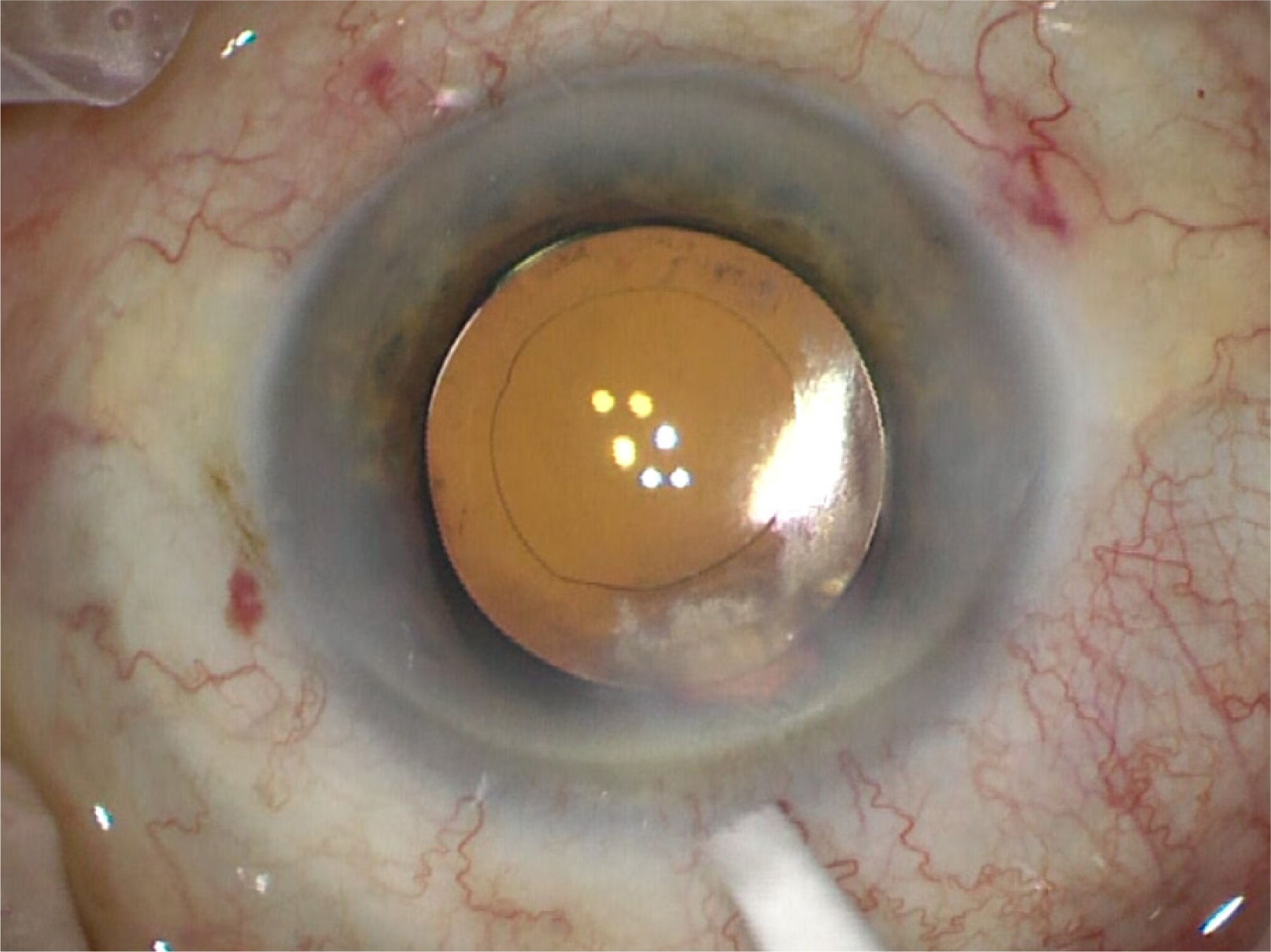
En caso de un lente tórico este se alinea de acuerdo con las marcas realizadas previamente en el biomicroscopio o idealmente se registra con marcación digital (figura 15).
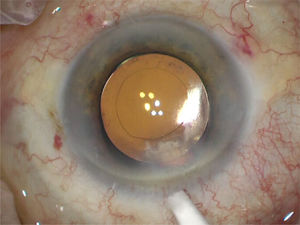
Esta última requiere una medición fotográfica digital previa (ej. IOL Master 700, Zeiss) que se carga al microscopio de pabellón (ej. Callisto de Lumera, Zeiss) y muestra el eje correcto de implantación del lente por realidad aumentada en el ocular del cirujano. Esta opción hace eficiente el flujo en pabellón y es igual de precisa que la marcación bajo biomicroscopio con el paciente sentado. Tiene el inconveniente del costo de los equipos. Los marcadores de péndulo y de burbuja son menos precisos para alinear un lente tórico67. Una vez alineado el lente en su eje se extrae todo el material viscoelástico por detrás y delante del LIO y se procede a cerrar la incisión principal y paracentesis edematizando con cánula 30-G. Si filtran las incisiones a pesar del cierre por edema se debe colocar sutura de Nylon 10/0 que se retira 1 semana después en la consulta (figura 16).
En relación al uso de antibióticos intracamerales profilácticos al finalizar la cirugía, un estudio observacional controlado con más de 300 000 pacientes68 donde se utilizó siempre preparación con povidona iodada en fondos de saco, mostró que el grupo de pacientes donde no se utilizaron antibióticos intracamerales ni tópicos en el postoperatorio tienen un riesgo de endoftalmitis de 0,14% (1,4 cada 1 000 cirugías) y el grupo sin antibióticos intracamerales pero tratado con tobramicina tópica en postoperatorio un 0,15% de endoftalmitis (1,5 cada 1 000 cirugías). Su primera conclusión es que la tobramicina no tiene ninguna utilidad como profilaxis antibiótica post cirugía de catarata. Este estudio también evaluó un grupo de pacientes sin antibióticos intracamerales, pero con gatifloxacino tópico en el postoperatorio, donde el riesgo fue 0,060% (0,6 cada 1 000 cirugías) y lo comparó con el grupo donde se usó moxifloxacino o cefuroxima intracameral con gatifloxacino tópico en el postoperatorio, donde el riesgo fue de 0,044% (0,4 cada 1 000 cirugías). El mismo estudio refiere que pacientes con rotura de cápsula posterior (RCP) tienen un riesgo de endoftalmitis de 0,24% (2,4 cada 1 000 cirugías) independiente de la forma de administración del antibiótico: tópico sólo vs tópico más intracameral. En Chile se ha utilizado moxifloxacino intracameral como preparado magistral 1mg/0,1ml o extraído directamente del frasco de antibiótico tópico moxifloxacino sin preservantes (Vigamox, Novartis). A pesar de su amplio uso off label a nivel mundial existe siempre el riesgo de una mala manipulación, mala preparación y/o contaminación, por lo que debiera preferirse la formulación comercial de cefuroxima aprobada por el Instituto de Salud Pública para uso intracameral (Aprokam, Thea). En la actualidad su costo parece ser un factor limitante en su uso masivo, por lo que muchas veces se reserva para casos de alto riesgo.
Existen situaciones en que necesitaremos manejar algunas técnicas y dispositivos especiales. En caso de cataratas maduras, blancas, o con mala visualización de la cápsula anterior es una excelente opción teñirla con azul tripán. En pacientes con cataratas traumáticas, dehiscencia zonular, pseudoexfoliación, o cualquier condición que debilite el complejo capsular/zonular, debemos contar con dispositivos que permitan estabilizar el complejo: anillos endocapsulares, ganchos de cápsula y/o segmentos capsulares. Para los pacientes con mala dilatación (ej. iris flácido) debemos contar con ganchos de iris u otros dispositivos que permitan mantener una buena midriasis durante la cirugía (anillos de Malyugin, Canabrava, etc.)
En comparación con la ECCE manual, la facoemulsificación reduce el tiempo quirúrgico y la prevalencia de complicaciones intraoperatorias y postoperatorias. Además, se asocia a un menor astigmatismo inducido quirúrgicamente, por lo que se puede ofrecer resultados mucho más predecibles. Las nuevas técnicas y tecnologías siguen mejorado progresivamente la eficiencia del proceso. Menos tiempo operatorio también significa reducir riesgo de infección.
Manejo postoperatorio y seguimientoEl paciente se da de alta acompañado entre 30 a 60 minutos después de la intervención. Se le deben indicar antibióticos, corticoides y AINES tópicos. Los antibióticos de preferencia son las quinolonas de 4ta generación como gatifloxacino o moxifloxacino, aunque hay cada vez más evidencia que no sería necesario usar antibióticos tópicos en los pacientes que fueron tratados con antibióticos intracamerales durante la cirugía. La tobramicina tópica no disminuiría el riesgo de endoftalmitis por lo que su indicación en el post operatorio es discutible68.
De regla deben indicarse colirios de esteroides como prednisolona 1% (de elección) o dexametasona 0,1% como segunda opción más AINES tópicos para disminuir riesgo de síndrome tóxico del segmento anterior (TASS), del segmento posterior (TPSS) y de edema macular cistoide69.
Respecto al régimen de uso de estos medicamentos tópicos y su duración hay una gran diversidad de esquemas, pero en la mayoría de los centros los esquemas de antibióticos, corticoides y AINES se utilizan por al menos 2 semanas. Varía también según la evolución clínica y el criterio médico.
Es importante el seguimiento por un oftalmólogo capacitado para detectar precozmente complicaciones potencialmente devastadoras si no son manejadas a tiempo. En evoluciones típicas el primer control se realiza al día siguiente; luego a la semana; y finalmente al mes para prescribir anteojos. Este esquema de seguimiento se adecua según los hallazgos clínicos encontrados en cada control. Especial atención se debe poner a la presión intraocular y a descartar síndromes tóxicos, endoftalmitis, desprendimiento de retina, etc. Por los riesgos antes descritos este cuidado es parte fundamental del proceso y nunca debe dejarse en manos de otros profesionales, ya que el examen detallado del segmento anterior y posterior y la interpretación de estos hallazgos constituye un acto médico no delegable. En general, la recuperación visual de una cirugía sin complicaciones es muy rápida. Al día siguiente los pacientes recuperan mucha visión y pueden realizar gran parte de sus actividades cotidianas. De acuerdo al contexto el médico pondrá algunas restricciones relacionadas al esfuerzo físico y al uso de dispositivos electrónicos, pero en pocos días el paciente podrá realizar todas sus actividades cotidianas con mínimas restricciones.
Resultados de la cirugíaLa cirugía de cataratas es una de las cirugías más seguras, efectivas y de mayor costo beneficio de la medicina moderna, mejorando significativamente la función visual, la movilidad, disminuyendo caídas70 y fracturas de cadera71, mejorando la capacidad cognitiva72, las relaciones sociales y el estado de ánimo. Todo lo anterior se traduce en una mejor calidad de vida y aumento de expectativa de vida, ya que reduce significativamente la mortalidad en estos pacientes73. La cirugía de cataratas del segundo ojo aumenta la sensación de independencia y produce aún más mejoría del estado de ánimo y capacidad para relacionarse socialmente74.
Todos los avances descritos en esta revisión hacen que la actual cirugía de cataratas no sólo tenga un carácter curativo, donde logra que en promedio más del 90% de los ojos logren AVMC de 20/25 o más a los 12 meses75, sino también un carácter refractivo, donde logra que más del 96% de los pacientes queden con refracción final de +/- 1 dioptría y más del 80% de +/- 0,5 dioptrías76. Estos increíbles niveles de precisión nos permiten hoy ofrecer resultados visuales personalizados de acuerdo con las necesidades de cada paciente.
Consideraciones EticasLas imágenes incluidas en este artículo han sido anonimizadas para mantener la confidencialidad de los pacientes.
Declaración de conflictos de interesesEl autor declara no tener conflictos de interés con las técnicas, medicamentos ni dispositivos médicos mencionados en esta revisión.