Un porcentaje no despreciable de pacientes incluidos en programas de vigilancia activa (VA) para el cáncer de próstata (CaP) de bajo y muy bajo riesgo son reclasificados en la biopsia confirmatoria o desarrollan progresión de la enfermedad durante el seguimiento. Nuestro objetivo es evaluar el papel del PCA3 y el SelectMDx, de manera individual y combinada, para predecir la progresión patológica (PP) en un programa habitual de VA.
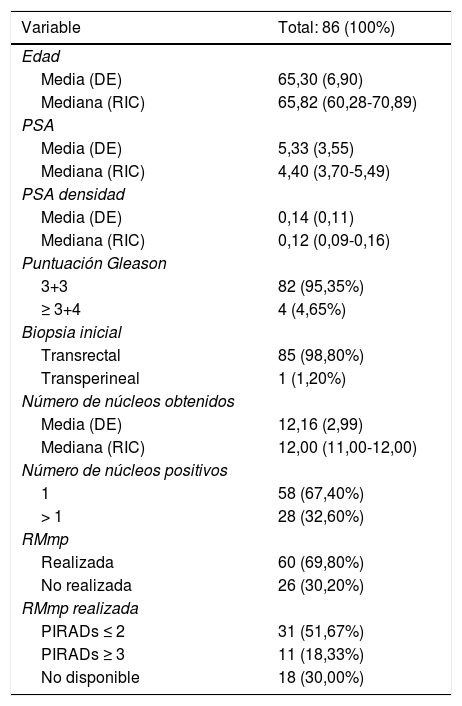
Materiales y métodosEstudio prospectivo y observacional que incluyó 86 pacientes inscritos en un protocolo de VA desde 2009 hasta 2019, con resultados de PCA3 y SelectMDx previos al diagnóstico de CaP o durante su periodo de confirmación. Se realizaron análisis univariantes y multivariantes para la correlación de las puntuaciones de PCA3 y SelectMDx, así como de las variables clinicopatológicas con la supervivencia libre de progresión patológica (SLPP). Se definieron los puntos de corte más fiables para ambos biomarcadores en el contexto de VA.
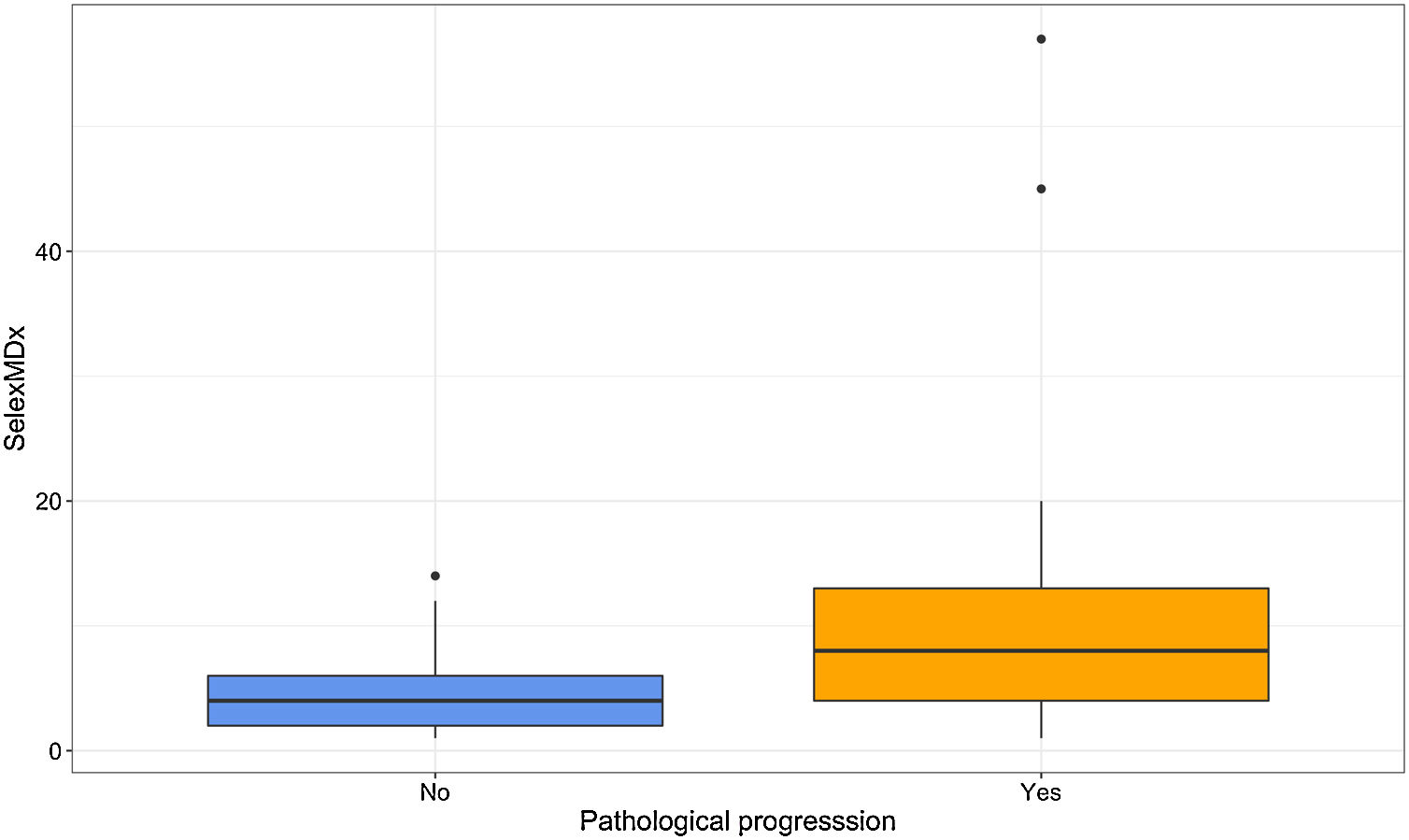
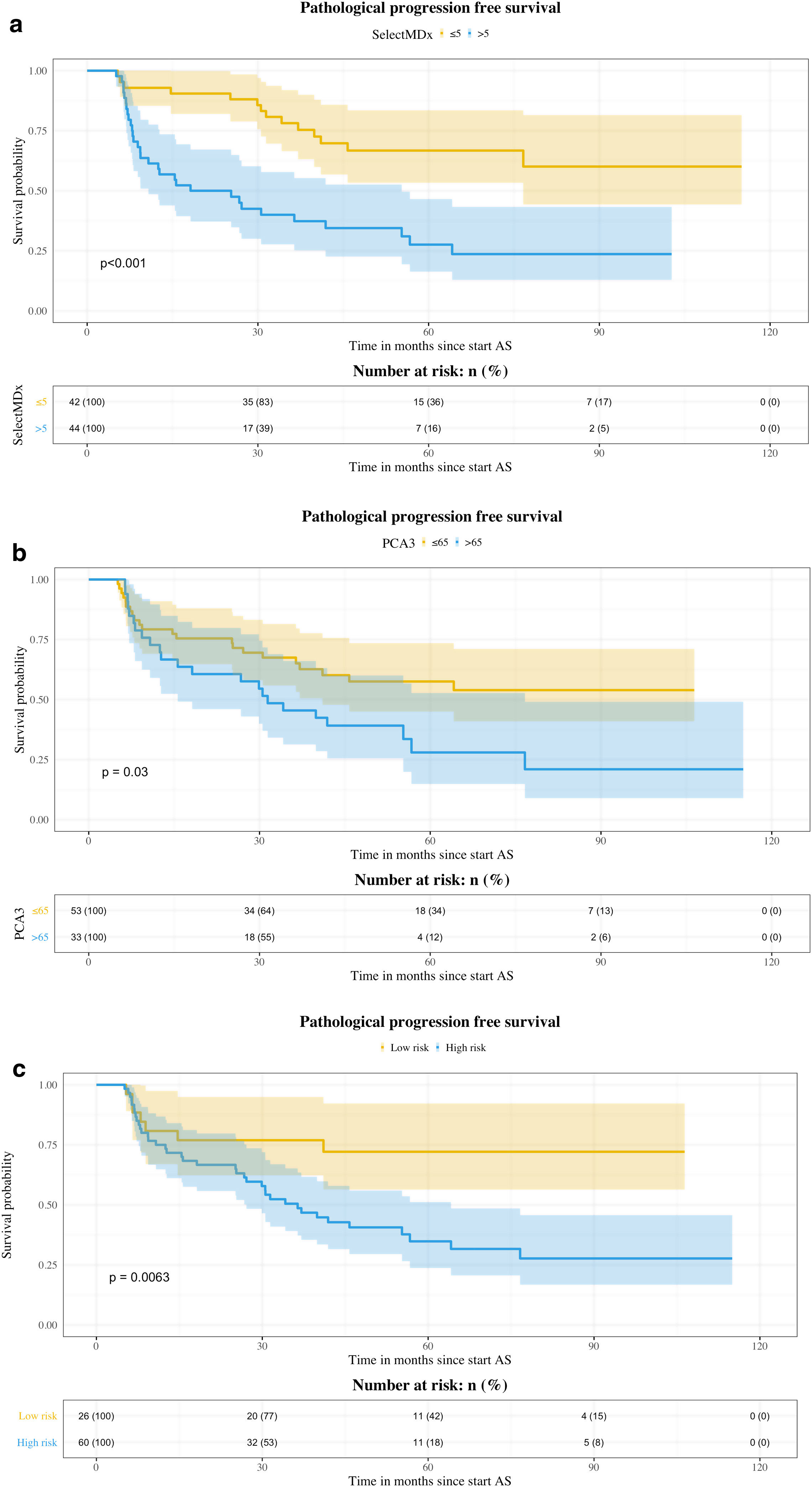
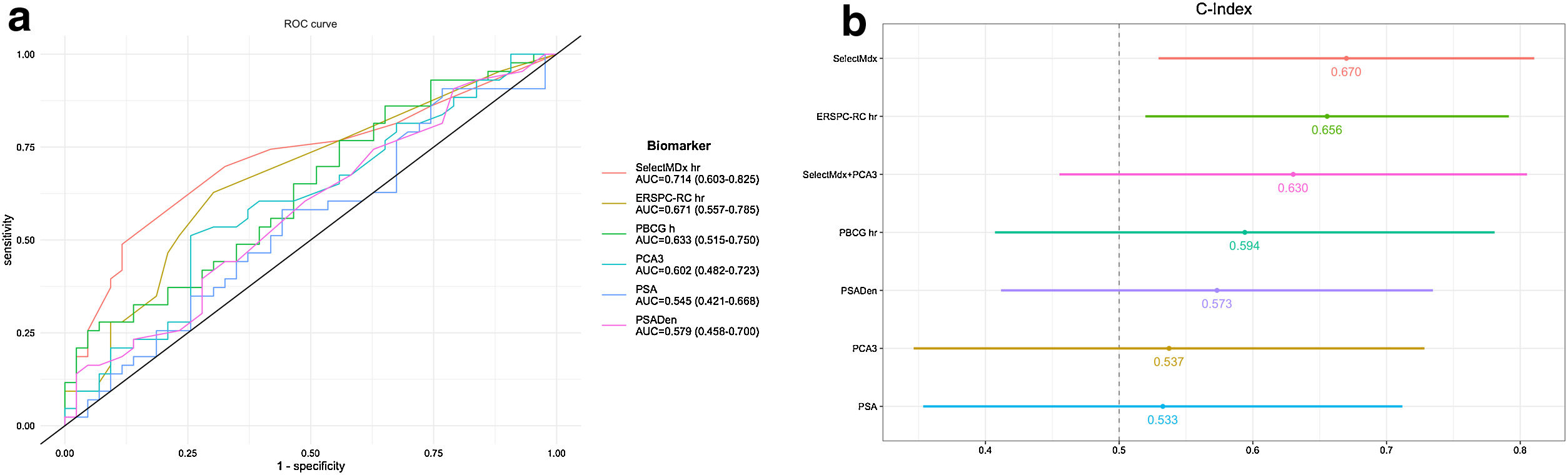
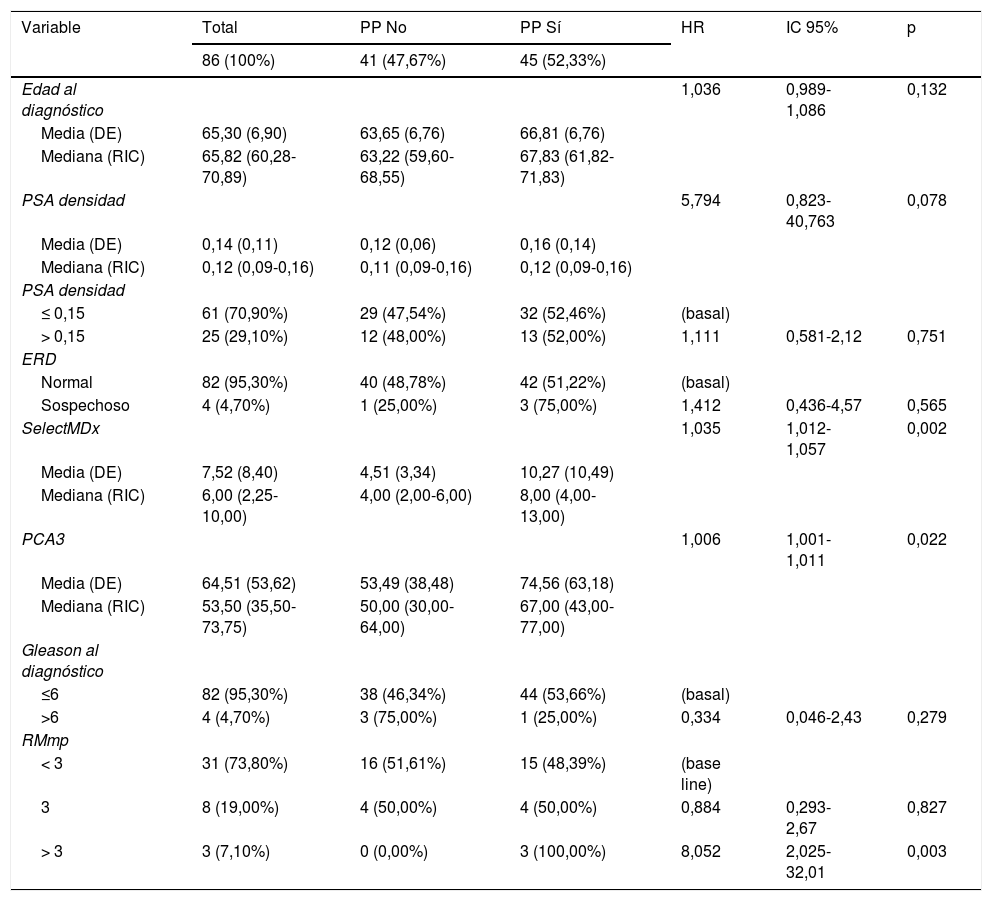
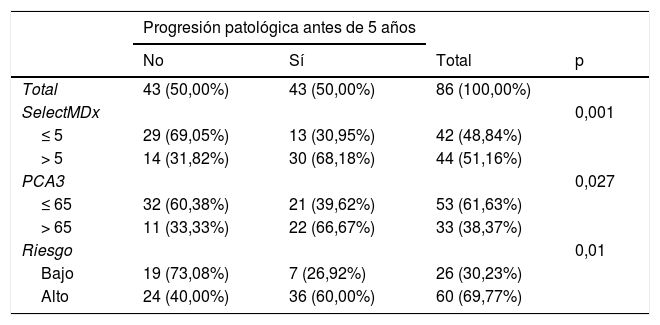
ResultadosSelectMDx mostró diferencias estadísticamente significativas en relación con la SLPP (HR: 1,035; IC95%: 1,012-1,057) (p=0,002) con un índiceC de 0,670 (IC95%: 0,529-0,810) y un AUC de 0,714 (IC95%: 0,603-0,825) a 5años. En nuestra serie, el punto de corte más fiable para el SelectMDx fue 5, con una sensibilidad y una especificidad para la PP del 69,8 y del 67,4%, respectivamente. El punto de corte del test PCA3 fue de 65, con una sensibilidad y una especificidad para la PP del 51,16 y del 74,42%, respectivamente. La combinación de ambos biomarcadores no mejoró la predicción de la PP, con un índiceC de 0,630 (IC95%: 0,455-0,805).
ConclusionesEn el contexto del CaP de bajo o muy bajo riesgo, SelectMDx >5 predijo una supervivencia libre de PP de 5años con una capacidad de discriminación moderada, superando al PCA3. La combinación de ambos no mejoró los resultados.
A not negligible percentage of patients included in active surveillance (AS) for low and very low risk prostate cancer (PCa) are reclassified in the confirmatory biopsy or have disease progression during follow-up. Our aim is to evaluate the role of PCA3 and SelectMDx, in an individual and combined way, in the prediction of pathological progression (PP) in a standard AS program.
Materials and methodsProspective and observational study comprised of 86 patients enrolled in an AS program from 2009 to 2019, with results for PCA3 and SelectMDx previous to PCa diagnosis or during their confirmatory period. Univariate and multivariate analysis were performed to correlate PCA3 and SelectMDx scores as well as clinical and pathological variables with PP-free survival (PPFS). The most reliable cut-offs for both biomarkers in the context of AS were defined.
ResultsSelectMDx showed statistically significant differences related to PPFS (HR: 1.035; 95%CI: 1.012-1.057) (P=.002) with a C-index of 0.670 (95%CI: 0.529-0.810) and AUC of 0.714 (95%CI: 0.603-0.825) at 5years. In our series, the most reliable cut-off point for SelectMDx was 5, with a sensitivity and specificity for PP of 69.8% and 67.4%, respectively. Same figure for PCA3 was 65, with a sensitivity and specificity for PP of 51.16% and 74.42%, respectively. The combination of both biomarkers did not improve the prediction of PP, C-index 0.630 (95%CI: 0.455-0.805).
ConclusionsIn the context of low or very low risk PCa, SelectMDx >5 predicted 5years PP free survival with a moderate discrimination ability outperforming PCA3. The combination of both tests did not improved outcomes.