Analizar si la presencia de anemia incrementa el riesgo de mortalidad a largo plazo asociado al estado de fragilidad y discapacidad en adultos mayores.
DiseñoSubestudio de la cohorte concurrente de base poblacional FRADEA (Fragilidad y Dependencia en Albacete), con 10 años de seguimiento (2007-2017), en mayores de 69años.
EmplazamientoAlbacete capital, España.
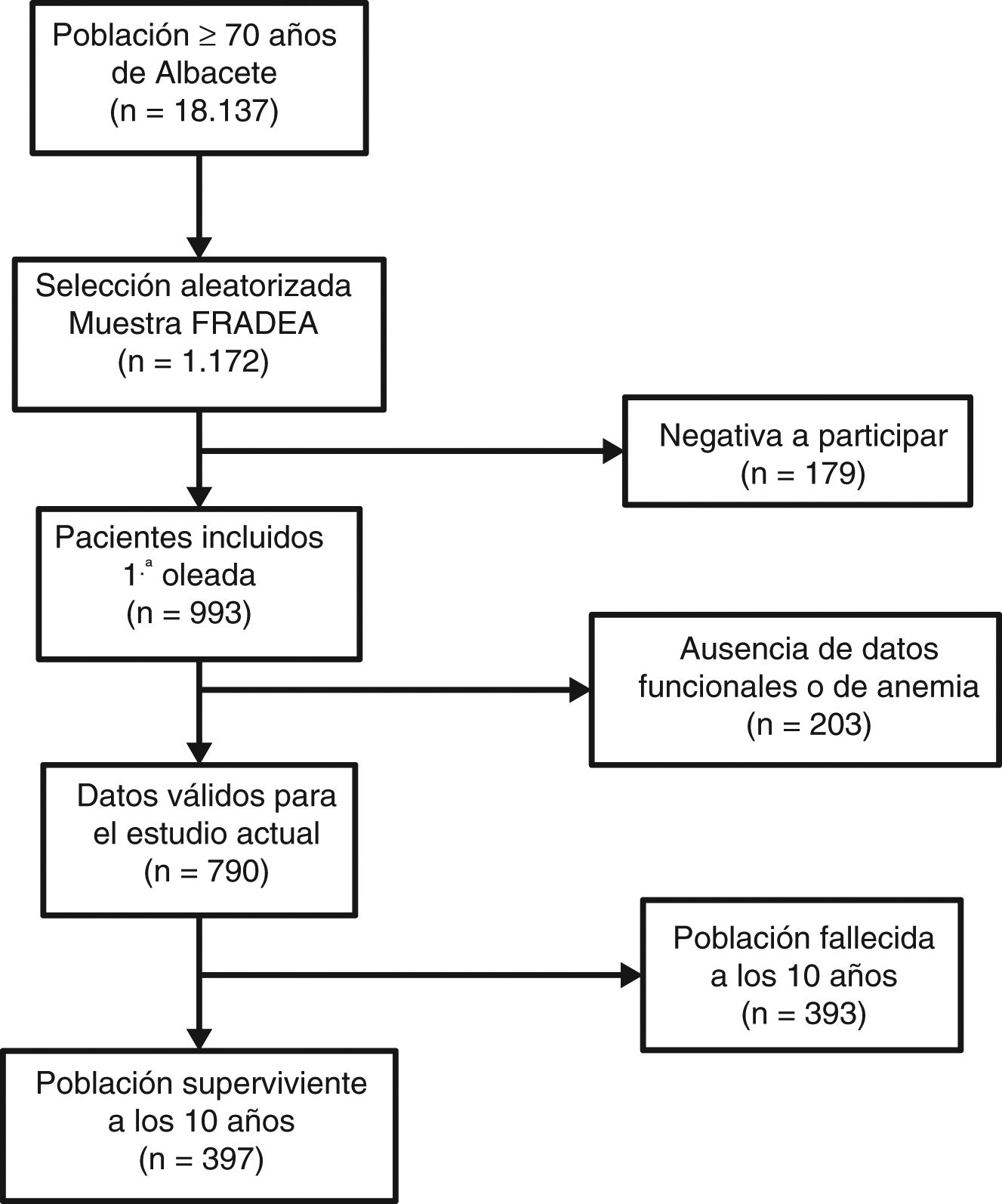
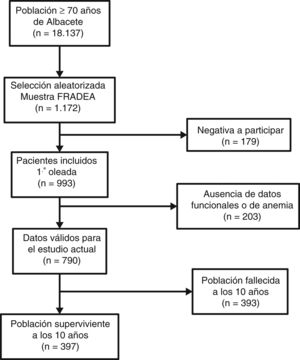
ParticipantesDe los 993 participantes incluidos en la primera oleada se seleccionaron 790 sujetos con datos válidos de función (fragilidad y discapacidad), anemia y estado vital a los 10años.
Mediciones principalesLa anemia se definió según los criterios de la Organización Mundial de la Salud (hemoglobina <13g/dl en hombres y <12g/dl en mujeres). Se creó la variable «clasificación funcional» incluyendo fragilidad y discapacidad, e identificando cuatro niveles progresivos: robusto, prefrágil, frágil y con discapacidad en actividades básicas de la vida diaria, empleando el fenotipo de fragilidad e índice de Barthel, respectivamente. Se construyó una nueva variable de ocho categorías combinando las cuatro funcionales con la presencia o ausencia de anemia. La asociación con mortalidad se determinó mediante Kaplan-Meier y análisis de riesgos proporcionales de Cox ajustado por edad, sexo, comorbilidad, polifarmacia, institucionalización y creatinina.
ResultadosEdad media 79años, siendo el 59,6% mujeres. Un total de 393 participantes (49,7%) fallecieron durante el periodo de seguimiento. La mediana de supervivencia fue de 98,4meses (rango intercuartil 61). El riesgo de mortalidad aumentó desde los niveles con mejor clasificación funcional hasta aquellos con peor, y para cada subgrupo fue mayor en los participantes con anemia. Prefrágiles sin anemia hazard ratio (HR): 1,59, IC95%: 1,07-2,36, y con anemia HR: 2,37, IC95%: 1,38-4,05. Frágiles sin anemia HR: 3,18, IC95%: 1,68-6,02, y con anemia HR: 4,42, IC95%: 1,99-9,84. Discapacitados sin anemia HR: 3,81, IC95%: 2,45-5,84, y con anemia HR: 5,48, IC95%: 3,43-8,76.
ConclusiónLa anemia incrementa el riesgo de mortalidad asociado a la fragilidad y discapacidad en adultos mayores.
To analyze if anemia increases 10-year mortality risk associated to frailty and disability in older adults.
DesignSubstudy of the FRADEA population-based concurrent cohort study (Frailty and dependence in Albacete), with a 10-year follow-up (2007-2017) in people older than 69years.
SettingAlbacete city, Spain.
ParticipantsOf the 993 participants included in the first wave, 790 were selected with valid data on function (frailty and disability), anemia and vital status at 10years.
Main measurementsAnemia was defined according to the criteria of the World Health Organization (hemoglobin <13g/dL in men and <12g/dL in women). A functional classification variable was created, including frailty and disability, identifying four progressive functional levels: robust, prefrail, frail and disabled in basic activities of daily life, using frailty phenotype and Barthel index respectively. A new eight categories variable was constructed combining the four functional groups with the presence or absence of anemia. The association with mortality was determined by Kaplan-Meier and Cox proportional hazards analysis adjusted for age, sex, comorbidity, polypharmacy, institutionalization and creatinine.
ResultsMean age was 79years and 59.6% were women. 393 participants (49.7%) died during the follow-up period. The median survival was 98.4months (interquartile range 61). The risk of mortality increased from the levels with better functionality to those with worse functionality, and for each subgroup it was higher in the participants with anemia. Prefrail without anemia HR [hazard ratio] 1.59 (95%CI 1.07-2.36) and with anemia HR 2.37 (95%CI 1.38-4.05). Frail without anemia HR 3.18 (95%CI 1.68-6.02) and with anemia HR 4.42 (95%CI 1.99-9.84). Disabled without anemia HR 3.81 (95%CI 2.45-5.84) and with anemia HR 5.48 (95%CI 3.43-8.76).
ConclusionAnemia increases the risk of mortality associated with frailty and disability in older adults.
La anemia se ha convertido en una entidad de gran importancia en los mayores por su elevada prevalencia y por las consecuencias clínicas negativas en términos de mortalidad, funcionalidad y calidad de vida1-7. La definición de anemia en el anciano más utilizada y aceptada a nivel internacional por la sociedad científica es la establecida por la Organización Mundial de la Salud (OMS)8. La anemia por sí misma es capaz de interferir en el funcionamiento de órganos y sistemas vitales favoreciendo una situación de vulnerabilidad en el adulto mayor9, y al mismo tiempo podría interaccionar con comorbilidades comunes aumentando de forma sinérgica el riesgo de resultados graves como discapacidad o muerte10. Sin embargo, los mecanismos específicos que justifican la asociación de la anemia con eventos adversos de salud en esta población son todavía desconocidos11.
Se define fragilidad como un estado caracterizado por un declinar progresivo de los sistemas fisiológicos relacionado con el envejecimiento, que resulta en una reducción de la capacidad intrínseca y que confiere una extrema vulnerabilidad a estresores, aumentando el riesgo de presentar diversos eventos adversos de salud12,13. La fragilidad es un estado prediscapacidad que, dentro del continuum funcional en ancianos —el que va desde la máxima capacidad intrínseca o situación de robustez hasta la menor capacidad intrínseca posible o discapacidad máxima—, se sitúa en un estado intermedio entre la robustez y la discapacidad leve13,14. Con una prevalencia cercana al 10% en mayores de 65años independientes de la comunidad, la fragilidad se describe actualmente como uno de los principales factores independientes asociados a eventos adversos de salud en esta población15,16. Aunque se conocen algunos mecanismos patogénicos asociados con este síndrome17, la anemia no ha sido claramente identificada como elemento causal.
La asociación entre anemia y fragilidad parece estar bien descrita en estudios transversales18,19 y se han propuesto diferentes hipótesis biológicamente plausibles para relacionar ambos problemas de salud, incluyendo la inflamación crónica de bajo grado20,21, la hipoxia11 o la sarcopenia7,22-24, aunque son necesarios estudios longitudinales para analizar esta posible causalidad. Así mismo y a nivel de causalidad, tampoco es bien conocido si la anemia se asocia a eventos adversos de salud a través de la producción de fragilidad o discapacidad. Por todo ello, el objetivo del presente trabajo fue analizar si la existencia de anemia aumenta la mortalidad a largo plazo como evento adverso grave asociado a la fragilidad y discapacidad en adultos mayores.
Material y métodosDiseñoNuestro trabajo presenta datos del último corte tras seguimiento de 10años (2007-2017) de la cohorte del estudio FRADEA, un estudio de cohortes concurrente de base poblacional. El razonamiento, diseño, metodología, selección y características basales han sido publicados previamente25.
Sujetos y ámbito de estudioSe seleccionó mediante un muestreo aleatorio estratificado por edad y sexo a partir de la base de datos de tarjeta sanitaria (n=18.137), una muestra representativa de personas de 70 o más años (n=1.172) residentes en la ciudad de Albacete durante al menos 3meses al año. Se obtuvo así una muestra aleatoria de personas mayores en cada uno de los siguientes cuatro estratos: hombres y mujeres con edades inferiores o superiores a 80años, a partir de 70, manteniendo las proporciones de la población de referencia. De ellos, aceptaron participar 993 (84,7%) y rechazaron hacerlo 179 (15,3%). El único criterio de exclusión fue la negativa a participar en el estudio o no firmar el consentimiento informado por escrito. De los 993 participantes incluidos en la primera oleada se seleccionaron 790 sujetos con datos válidos de función (fragilidad y discapacidad), anemia y estado vital a los 10años. El esquema general del estudio se muestra en la figura 1.
Variables del estudioAnemiaSe definió anemia como una concentración de Hb inferior a 13g/dl en los hombres y a 12g/dl en mujeres, siendo los puntos de corte de Hb reconocidos por la OMS8, y se analizó como variable cualitativa. Los valores de Hb (g/dl) se midieron mediante un analizador hematológico ADVIA automatizado 2120i (Siemens).
Clasificación funcionalPara la clasificación funcional de los participantes se empleó el constructo de continuum funcional, que comprende todo el espectro de la función de las personas desde la máxima capacidad intrínseca o situación de robustez hasta la menor capacidad intrínseca posible o discapacidad máxima12-14. El continuum funcional incluye la fragilidad, un estado prediscapacidad en un lugar intermedio entre la robustez y la discapacidad leve y a la discapacidad en las fases avanzadas, categorías continuas pero excluyentes, ya que su caracterización diagnóstica y su manejo son diferentes26. Se clasificó a los participantes según metodología previamente descrita y validada14 en cuatro niveles funcionales progresivos: robustos, prefrágiles, frágiles y con discapacidad para actividades básicas de la vida diaria (ABVD).
El estado de fragilidad se evaluó según los criterios propuestos por Fried27, aunque con algunas modificaciones. Estos son:
- 1.
Pérdida de peso no intencionada igual o superior a 4,6kg o igual o superior al 5% del peso corporal en el último año.
- 2.
Cansancio autorreferido en base a la respuesta a dos preguntas de la escala CES-D, según original de Fried.
- 3.
Nivel de actividad física bajo, utilizando como instrumento Calcumed® en lugar del Minnesota Leisure Time Physical Activity Questionnaire (MLTAQ) utilizado por Fried, pero también utilizando los mismos puntos de corte originales.
- 4.
Lentitud, mediante velocidad para caminar 4m, inferior al percentil 20 y ajustado para sexo y altura, según los valores originales de Fried.
- 5.
Debilidad, según medición de la fuerza prensora de mano dominante con dinamómetro de JAMAR, por debajo del percentil 20 ajustado por sexo e índice de masa corporal, según valores originales de Fried.
Se consideró que los sujetos eran frágiles cuando presentaban 3 o más de los 5 criterios referidos, prefrágiles si presentaban 1 o 2 criterios y robustos si no presentaban ninguno.
La discapacidad para ABVD se evaluó mediante el índice de Barthel28. Este instrumento evalúa 10 ABVD (alimentación, baño, vestido, aseo, continencia fecal, continencia urinaria, uso del retrete, transferencias, deambulación y escalones) y puntúa la dependencia o independencia total o parcial desde 0 a 5, 10 o 15 puntos en cada una según la actividad; el rango de puntuación total se encuentra entre 0-100 puntos, de forma que a menor puntuación, mayor dependencia. En este trabajo se consideró discapacidad para ABVD cuando los sujetos puntuaron por debajo del máximo en alguno de los siguientes 5ítems: baño, aseo, alimentación, uso del retrete o vestido.
Clasificación funcional con/sin anemiaPara alcanzar el objetivo principal y conocer la influencia de la anemia sobre la asociación entre cada uno de los subgrupos de población establecidos y mortalidad como evento adverso grave se definieron ocho categorías combinando las cuatro de función con la presencia o ausencia de anemia:
- 1.
Robusto sin anemia.
- 2.
Prefrágil sin anemia.
- 3.
Frágil sin anemia.
- 4.
Discapacidad ABVD sin anemia.
- 5.
Robusto con anemia.
- 6.
Prefrágil con anemia.
- 7.
Frágil con anemia.
- 8.
Discapacidad ABVD con anemia.
Se identificó la mortalidad a través de la información del estado del sujeto en la fecha de última observación, confirmándose la fecha exacta con la historia clínica de atención primaria y del hospital del paciente. Cuando existió discordancia o los datos eran desconocidos se consultó el registro municipal de la ciudad de Albacete. Por ello se consiguió la fecha exacta de mortalidad de todos los participantes incluidos en este subestudio.
CovariablesSe recogieron la edad, el sexo y la institucionalización. La discapacidad para actividades instrumentales de la vida diaria (AIVD) se registró utilizando el índice de Lawton, que evalúa 8 ítems: cocinar, comprar, lavar, limpiar, uso del teléfono, manejo de la medicación, uso de transporte y manejo de finanza, y se consideró sujeto dependiente para AIVD el que presentaba discapacidad en al menos uno de los 8 ítems referidos.
Las enfermedades crónicas de los sujetos se obtuvieron de sus informes médicos y fueron codificadas a través del CIE-10 y posteriormente clasificadas en grandes grupos homogéneos para su posterior análisis. Se analizó la comorbilidad a través del índice de comorbilidad de Charlson, definiendo como alta comorbilidad una puntuación igual o superior a 3.
Se registró el número de fármacos prescritos y se construyó la variable polifarmacia definida como el consumo de 5 o más fármacos, siendo el punto de corte encontrado en la literatura para definir este concepto29.
Los niveles de creatinina (mg/dl) en suero se midieron por ensayo cinético colorimétrico usando el equipo Cobas 8000 (Roche Diagnostic).
Se incluyeron otros parámetros analíticos tales como el recuento total de leucocitos, que se realizó mediante un analizador hematológico ADVIA automatizado 2120i (Siemens), y la concentración de glucosa (mg/dl), que se medió mediante el analizador Hitachi de Roche Diagnostic®.
La metodología de aplicación de los diferentes test utilizados y las referencias bibliográficas de los mismos para este trabajo se han descrito en el estudio original25.
Fuentes de informaciónLa entrevista basal se llevó a cabo entre 2007 y 2009 de forma presencial en las consultas externas del Servicio de Geriatría del Complejo Hospitalario Universitario de Albacete por 4 enfermeras entrenadas. Cuando el sujeto participante no podía trasladarse al hospital, se acudía al domicilio o institución para la obtención de los datos. El seguimiento posterior se realizó durante 10años mediante visitas periódicas presenciales o telefónicas, recogiendo el estado vital del participante. La información fue facilitada por el propio participante o por el cuidador principal cuando el primero no podía. El proceso de la entrevista fue estandarizado para aumentar su fiabilidad. La información clínica de las enfermedades crónicas se obtuvo del historial médico de los sujetos. A todos los participantes que dieron su consentimiento se les realizó una extracción sanguínea para la realización de una analítica que incluía hemograma y perfil bioquímico. Las muestras de sangre se obtuvieron por punción venosa después de un ayuno durante la noche y se determinaron en el laboratorio del Hospital General Universitario de Albacete.
Aspectos éticosLa investigación realizada ha cumplido con la normativa de Helsinki referente al estudio con humanos. El proyecto FRADEA fue aprobado por el comité de investigación clínica del Área Sanitaria de Albacete y la comisión de investigación clínica del Complejo Hospitalario Universitario de Albacete. Todos los participantes firmaron consentimiento informado previo a su inclusión en el estudio.
Análisis estadísticoSe realizó un análisis descriptivo de las características basales de los sujetos de la muestra mediante frecuencias, medidas de tendencia central y medidas de dispersión según la naturaleza de las variables, y un análisis bivariante entre anemia y la situación funcional, las diferentes covariables y mortalidad como evento adverso mediante pruebas de chi cuadrado y t de Student o ANOVA, según la naturaleza de las mismas.
La asociación entre el estado de anemia y la situación funcional con la mortalidad a 10años, en función de los 8 subgrupos establecidos de manera conjunta y por grupos de categorías funcionales, se analizó mediante el análisis de riesgos proporcionales de Cox ajustado a edad, sexo, comorbilidad, polifarmacia, institucionalización y creatinina. Estos resultados se presentan como hazard ratio (HR) con su intervalo de confianza del 95% (IC95%). De igual manera, se realizó un análisis de supervivencia Kaplan Meier con comparaciones bivariantes utilizando el test estadístico Log Rank (Mantel-Cox), expresando las medianas de supervivencia con su rango intercuartil (RI). La supervivencia se determinó en meses.
Por otra parte, se procedió a realizar un análisis factorial por componentes para la identificación del porcentaje de variabilidad explicada por la mortalidad como evento adverso y relativo a las variables y covariables incluidas en el modelo. Se aplicó la prueba de contraste de Kaiser Meyer y Olkin (KMO), así como la prueba de esfericidad de Bartlett. Igualmente se procedió a valorar la bondad de ajuste del modelo mediante el método Varimax.
Todos los datos se analizaron utilizando el paquete de software estadístico SPSS Statistics 22.0 para Windows.
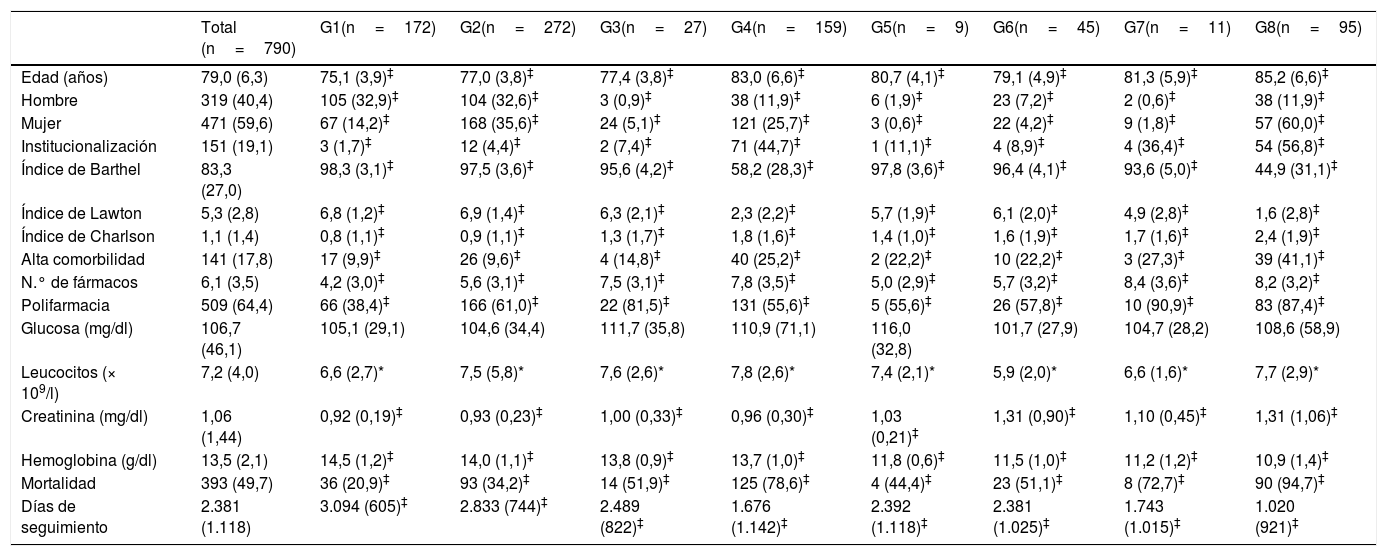
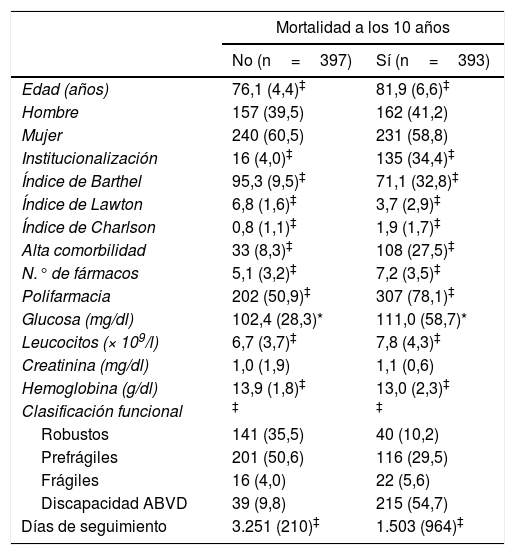
ResultadosSe incluyeron un total de 790 sujetos de 70 o más años. Las características de la muestra basal analizada y de los diferentes grupos quedan recogidas en la tabla 1. La edad media fue de 79años, siendo la mayoría mujeres (59,6%); el 19,1% de la muestra estaba institucionalizada. Los participantes que fallecieron presentaron una edad más elevada, mayor tasa de institucionalización, peor estado funcional, mayor comorbilidad y polifarmacia, así como cifras más bajas de Hb, valores más elevados de glucemia plasmática y de leucocitos totales que los que permanecieron vivos tras 10años de seguimiento (tabla 2).
Características basales de la muestra
| Total (n=790) | G1(n=172) | G2(n=272) | G3(n=27) | G4(n=159) | G5(n=9) | G6(n=45) | G7(n=11) | G8(n=95) | |
|---|---|---|---|---|---|---|---|---|---|
| Edad (años) | 79,0 (6,3) | 75,1 (3,9)‡ | 77,0 (3,8)‡ | 77,4 (3,8)‡ | 83,0 (6,6)‡ | 80,7 (4,1)‡ | 79,1 (4,9)‡ | 81,3 (5,9)‡ | 85,2 (6,6)‡ |
| Hombre | 319 (40,4) | 105 (32,9)‡ | 104 (32,6)‡ | 3 (0,9)‡ | 38 (11,9)‡ | 6 (1,9)‡ | 23 (7,2)‡ | 2 (0,6)‡ | 38 (11,9)‡ |
| Mujer | 471 (59,6) | 67 (14,2)‡ | 168 (35,6)‡ | 24 (5,1)‡ | 121 (25,7)‡ | 3 (0,6)‡ | 22 (4,2)‡ | 9 (1,8)‡ | 57 (60,0)‡ |
| Institucionalización | 151 (19,1) | 3 (1,7)‡ | 12 (4,4)‡ | 2 (7,4)‡ | 71 (44,7)‡ | 1 (11,1)‡ | 4 (8,9)‡ | 4 (36,4)‡ | 54 (56,8)‡ |
| Índice de Barthel | 83,3 (27,0) | 98,3 (3,1)‡ | 97,5 (3,6)‡ | 95,6 (4,2)‡ | 58,2 (28,3)‡ | 97,8 (3,6)‡ | 96,4 (4,1)‡ | 93,6 (5,0)‡ | 44,9 (31,1)‡ |
| Índice de Lawton | 5,3 (2,8) | 6,8 (1,2)‡ | 6,9 (1,4)‡ | 6,3 (2,1)‡ | 2,3 (2,2)‡ | 5,7 (1,9)‡ | 6,1 (2,0)‡ | 4,9 (2,8)‡ | 1,6 (2,8)‡ |
| Índice de Charlson | 1,1 (1,4) | 0,8 (1,1)‡ | 0,9 (1,1)‡ | 1,3 (1,7)‡ | 1,8 (1,6)‡ | 1,4 (1,0)‡ | 1,6 (1,9)‡ | 1,7 (1,6)‡ | 2,4 (1,9)‡ |
| Alta comorbilidad | 141 (17,8) | 17 (9,9)‡ | 26 (9,6)‡ | 4 (14,8)‡ | 40 (25,2)‡ | 2 (22,2)‡ | 10 (22,2)‡ | 3 (27,3)‡ | 39 (41,1)‡ |
| N.° de fármacos | 6,1 (3,5) | 4,2 (3,0)‡ | 5,6 (3,1)‡ | 7,5 (3,1)‡ | 7,8 (3,5)‡ | 5,0 (2,9)‡ | 5,7 (3,2)‡ | 8,4 (3,6)‡ | 8,2 (3,2)‡ |
| Polifarmacia | 509 (64,4) | 66 (38,4)‡ | 166 (61,0)‡ | 22 (81,5)‡ | 131 (55,6)‡ | 5 (55,6)‡ | 26 (57,8)‡ | 10 (90,9)‡ | 83 (87,4)‡ |
| Glucosa (mg/dl) | 106,7 (46,1) | 105,1 (29,1) | 104,6 (34,4) | 111,7 (35,8) | 110,9 (71,1) | 116,0 (32,8) | 101,7 (27,9) | 104,7 (28,2) | 108,6 (58,9) |
| Leucocitos (× 109/l) | 7,2 (4,0) | 6,6 (2,7)* | 7,5 (5,8)* | 7,6 (2,6)* | 7,8 (2,6)* | 7,4 (2,1)* | 5,9 (2,0)* | 6,6 (1,6)* | 7,7 (2,9)* |
| Creatinina (mg/dl) | 1,06 (1,44) | 0,92 (0,19)‡ | 0,93 (0,23)‡ | 1,00 (0,33)‡ | 0,96 (0,30)‡ | 1,03 (0,21)‡ | 1,31 (0,90)‡ | 1,10 (0,45)‡ | 1,31 (1,06)‡ |
| Hemoglobina (g/dl) | 13,5 (2,1) | 14,5 (1,2)‡ | 14,0 (1,1)‡ | 13,8 (0,9)‡ | 13,7 (1,0)‡ | 11,8 (0,6)‡ | 11,5 (1,0)‡ | 11,2 (1,2)‡ | 10,9 (1,4)‡ |
| Mortalidad | 393 (49,7) | 36 (20,9)‡ | 93 (34,2)‡ | 14 (51,9)‡ | 125 (78,6)‡ | 4 (44,4)‡ | 23 (51,1)‡ | 8 (72,7)‡ | 90 (94,7)‡ |
| Días de seguimiento | 2.381 (1.118) | 3.094 (605)‡ | 2.833 (744)‡ | 2.489 (822)‡ | 1.676 (1.142)‡ | 2.392 (1.118)‡ | 2.381 (1.025)‡ | 1.743 (1.015)‡ | 1.020 (921)‡ |
G1: Robustos sin anemia. G2: Prefrágiles sin anemia. G3: Frágiles sin anemia. G4: Discapacidad para actividades básicas de la vida diaria sin anemia. G5: Robustos con anemia. G6: Prefrágiles con anemia. G7: Frágiles con anemia. G8: Discapacidad para actividades básicas de la vida diaria con anemia.
Todos los datos son medias, con la desviación estándar o número de sujetos con los porcentajes entre paréntesis.
Características de los participantes según supervivencia a los 10 años
| Mortalidad a los 10 años | ||
|---|---|---|
| No (n=397) | Sí (n=393) | |
| Edad (años) | 76,1 (4,4)‡ | 81,9 (6,6)‡ |
| Hombre | 157 (39,5) | 162 (41,2) |
| Mujer | 240 (60,5) | 231 (58,8) |
| Institucionalización | 16 (4,0)‡ | 135 (34,4)‡ |
| Índice de Barthel | 95,3 (9,5)‡ | 71,1 (32,8)‡ |
| Índice de Lawton | 6,8 (1,6)‡ | 3,7 (2,9)‡ |
| Índice de Charlson | 0,8 (1,1)‡ | 1,9 (1,7)‡ |
| Alta comorbilidad | 33 (8,3)‡ | 108 (27,5)‡ |
| N.° de fármacos | 5,1 (3,2)‡ | 7,2 (3,5)‡ |
| Polifarmacia | 202 (50,9)‡ | 307 (78,1)‡ |
| Glucosa (mg/dl) | 102,4 (28,3)* | 111,0 (58,7)* |
| Leucocitos (× 109/l) | 6,7 (3,7)‡ | 7,8 (4,3)‡ |
| Creatinina (mg/dl) | 1,0 (1,9) | 1,1 (0,6) |
| Hemoglobina (g/dl) | 13,9 (1,8)‡ | 13,0 (2,3)‡ |
| Clasificación funcional | ‡ | ‡ |
| Robustos | 141 (35,5) | 40 (10,2) |
| Prefrágiles | 201 (50,6) | 116 (29,5) |
| Frágiles | 16 (4,0) | 22 (5,6) |
| Discapacidad ABVD | 39 (9,8) | 215 (54,7) |
| Días de seguimiento | 3.251 (210)‡ | 1.503 (964)‡ |
ABVD: actividades básicas de la vida diaria.
Todos los datos son medias, con la desviación estándar o número de sujetos con los porcentajes entre paréntesis.
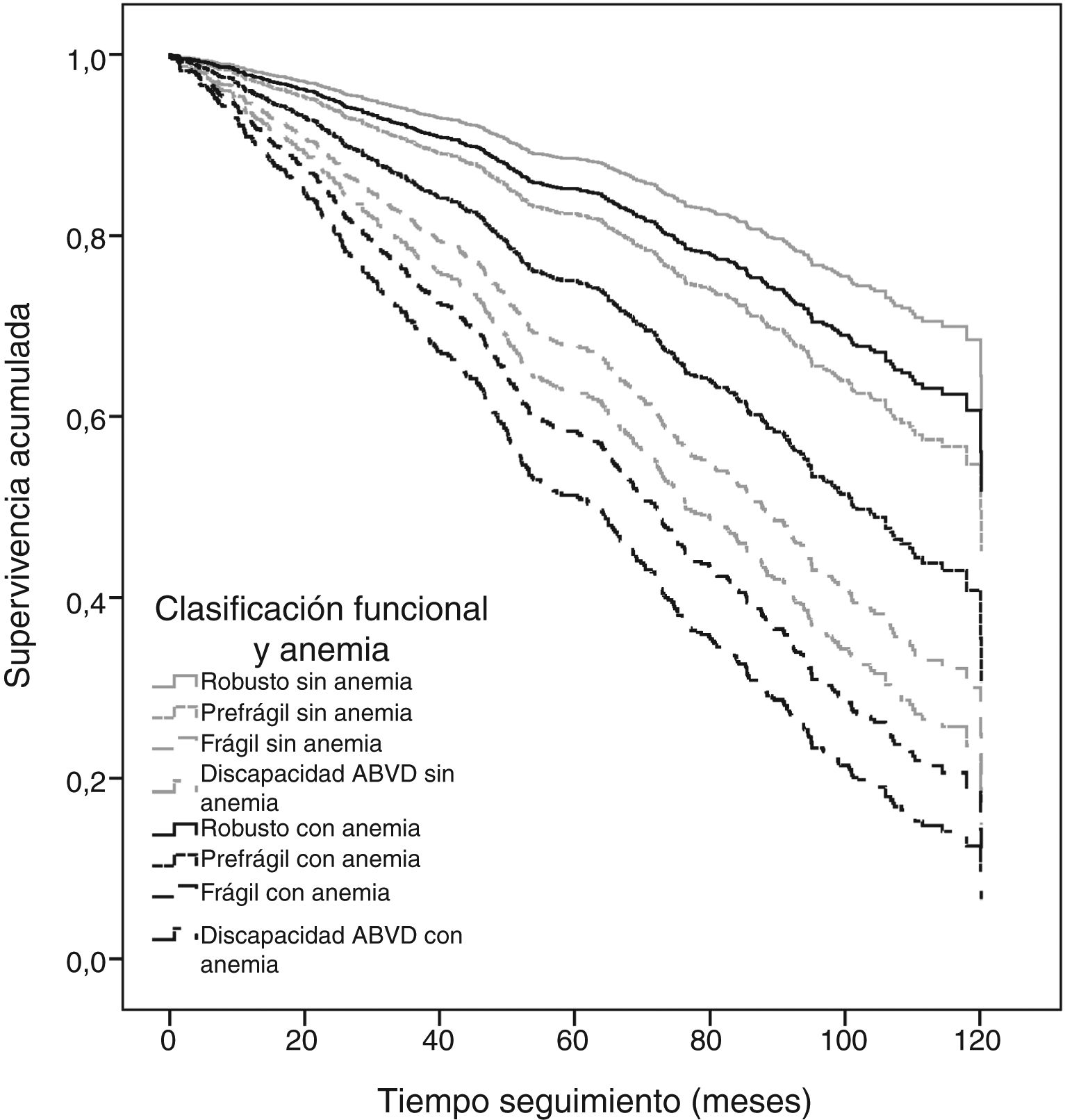
Un total de 393 (49,7%) participantes fallecieron durante el periodo de seguimiento. La media y la mediana de supervivencia fueron 78,8meses (DE: 1,2) y 98,4 meses (RI: 61), respectivamente. Las tasas de mortalidad aumentaron a medida que aumentó el deterioro funcional, y dentro de estos grupos fue mayor en participantes con anemia que en aquellos sin anemia (tabla 2). Mediante análisis de la supervivencia de Kaplan Meier, las medianas de supervivencia de los ocho grupos fueron las siguientes: robustos sin anemia 107,1meses (RI: 14); prefrágiles sin anemia 102,8meses (RI: 22); frágiles sin anemia 95,9meses (RI: 47); discapacidad en ABVD sin anemia 48,6meses (RI: 76); robustos con anemia 98,0meses (RI: 68); prefrágiles con anemia 97,5meses (RI: 59); frágiles con anemia 52,0meses (RI: 62); discapacidad ABVD con anemia 24,2meses (RI: 118). Log Rank (Mantel-Cox) 437,549 (p<0,001). El análisis factorial demostró que cuatro variables explicaron el 75,2% de la varianza de la mortalidad. La variable situación funcional incluyendo el estado de anemia explicó el 28,7%, la comorbilidad el 20,0%, la polifarmacia el 14,9% y la función renal el 11,6% (test de esfericidad de Bartlett p<0,001).
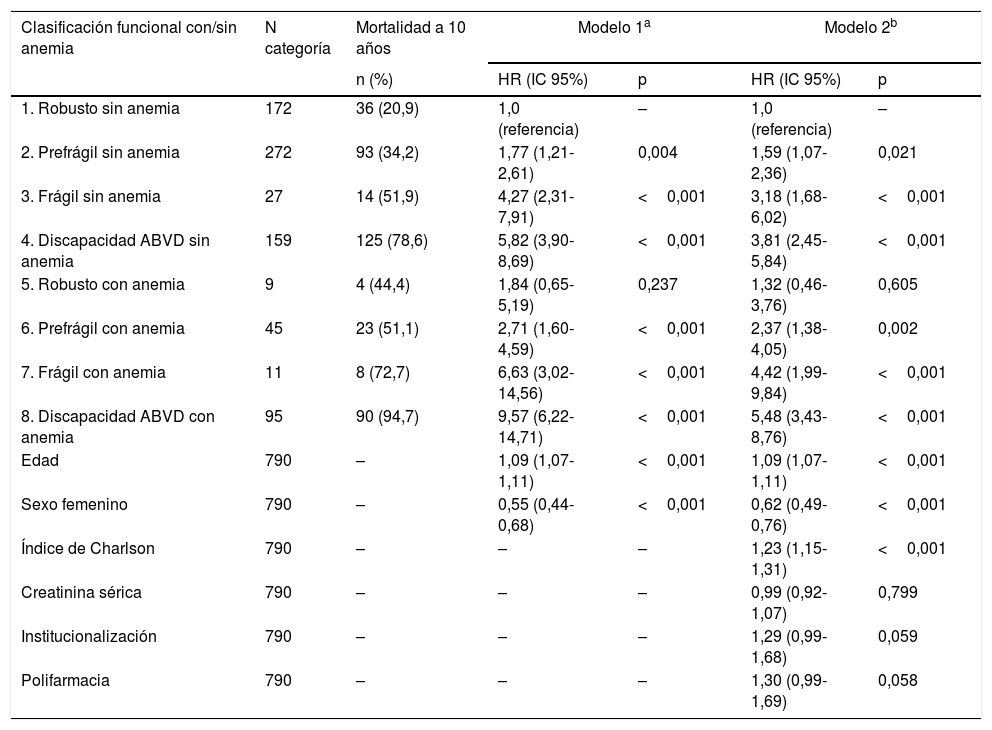
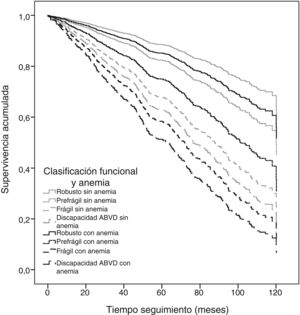
El análisis de riesgos proporcionales de Cox con todas las categorías mostró que a medida que aumenta el deterioro funcional de los pacientes aumenta la mortalidad a los 10años, y que la adición de la anemia a las categorías funcionales casi multiplica por dos el riesgo de mortalidad (tabla 3). Los participantes prefrágiles sin anemia presentaron un HR de 1,59 (IC95%: 1,07-2,36) de mortalidad, mientras que en aquellos con anemia el HR fue de 2,37 (IC95%: 1,38-4,05). Los participantes frágiles sin anemia presentaron un HR de 3,18 (IC95%: 1,68-6,02) de mortalidad, mientras que en aquellos con anemia el HR fue de 4,42 (IC95%: 1,99-9,84). Por último, los participantes con discapacidad en ABVD sin anemia presentaron un HR de 3,81 (IC95%: 2,45-5,84) de mortalidad, mientras que en aquellos con anemia el HR fue de 5,48 (IC95%: 3,43-8,76) (modelo 2 en la tabla 2). Las curvas de supervivencia acumulada de la figura 2 muestran esta asociación, ajustada por edad, sexo, comorbilidad, polifarmacia, institucionalización y creatinina sérica.
Análisis de riesgos proporcionales de Cox para mortalidad a 10 años
| Clasificación funcional con/sin anemia | N categoría | Mortalidad a 10 años | Modelo 1a | Modelo 2b | ||
|---|---|---|---|---|---|---|
| n (%) | HR (IC 95%) | p | HR (IC 95%) | p | ||
| 1. Robusto sin anemia | 172 | 36 (20,9) | 1,0 (referencia) | – | 1,0 (referencia) | – |
| 2. Prefrágil sin anemia | 272 | 93 (34,2) | 1,77 (1,21-2,61) | 0,004 | 1,59 (1,07-2,36) | 0,021 |
| 3. Frágil sin anemia | 27 | 14 (51,9) | 4,27 (2,31-7,91) | <0,001 | 3,18 (1,68-6,02) | <0,001 |
| 4. Discapacidad ABVD sin anemia | 159 | 125 (78,6) | 5,82 (3,90-8,69) | <0,001 | 3,81 (2,45-5,84) | <0,001 |
| 5. Robusto con anemia | 9 | 4 (44,4) | 1,84 (0,65-5,19) | 0,237 | 1,32 (0,46-3,76) | 0,605 |
| 6. Prefrágil con anemia | 45 | 23 (51,1) | 2,71 (1,60-4,59) | <0,001 | 2,37 (1,38-4,05) | 0,002 |
| 7. Frágil con anemia | 11 | 8 (72,7) | 6,63 (3,02-14,56) | <0,001 | 4,42 (1,99-9,84) | <0,001 |
| 8. Discapacidad ABVD con anemia | 95 | 90 (94,7) | 9,57 (6,22-14,71) | <0,001 | 5,48 (3,43-8,76) | <0,001 |
| Edad | 790 | – | 1,09 (1,07-1,11) | <0,001 | 1,09 (1,07-1,11) | <0,001 |
| Sexo femenino | 790 | – | 0,55 (0,44-0,68) | <0,001 | 0,62 (0,49-0,76) | <0,001 |
| Índice de Charlson | 790 | – | – | – | 1,23 (1,15-1,31) | <0,001 |
| Creatinina sérica | 790 | – | – | – | 0,99 (0,92-1,07) | 0,799 |
| Institucionalización | 790 | – | – | – | 1,29 (0,99-1,68) | 0,059 |
| Polifarmacia | 790 | – | – | – | 1,30 (0,99-1,69) | 0,058 |
ABVD: actividades básicas de la vida diaria; HR: hazard ratio; IC: intervalo de confianza.
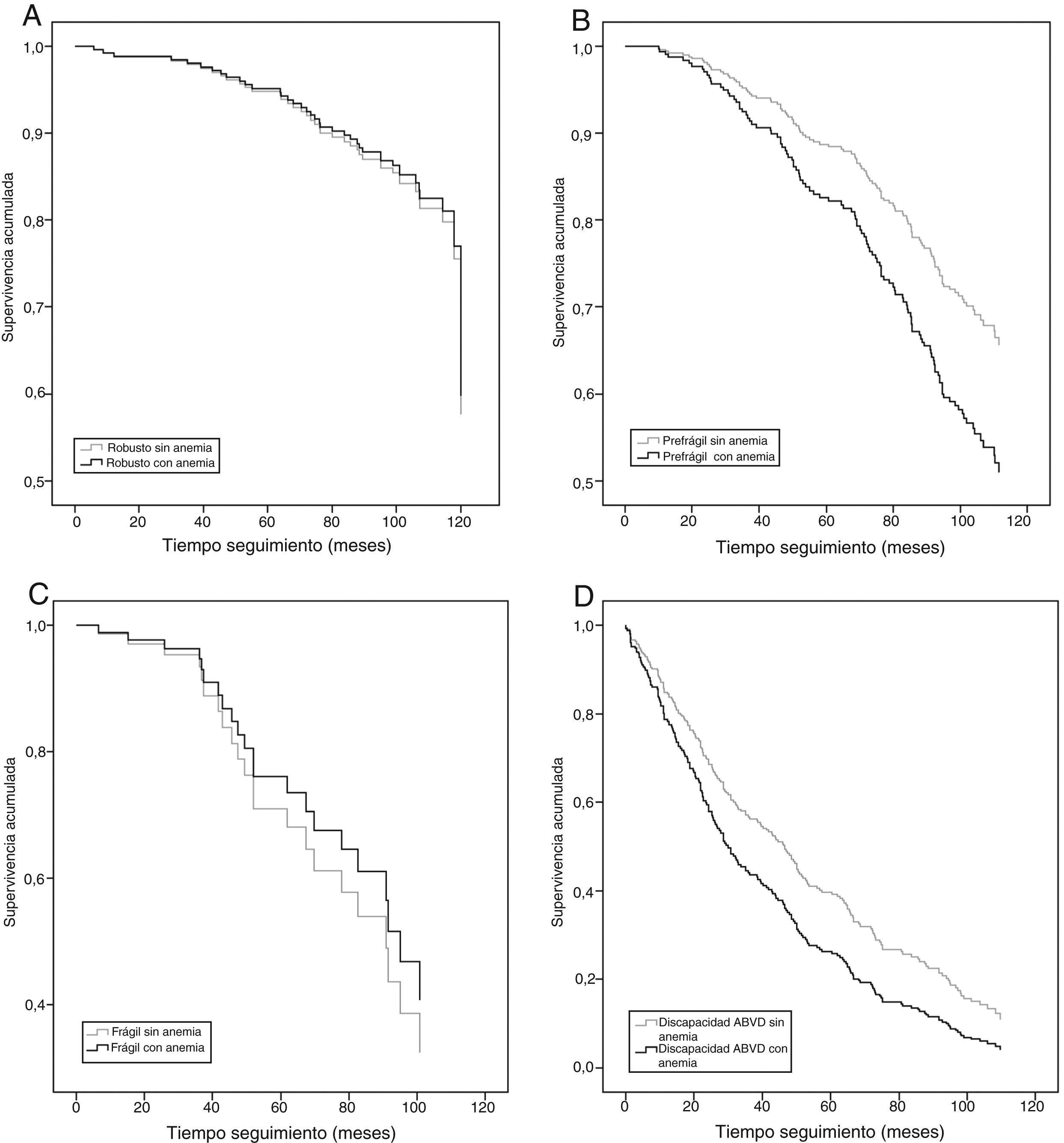
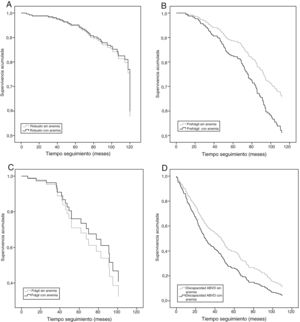
Por último, y en un análisis por categorías funcionales separadas, aquellos con anemia presentaron una menor mediana de supervivencia en todos los grupos con anemia, aunque solo con significación estadística en el grupo de prefrágiles y de discapacitados (fig. 3). Las medianas de supervivencia para los cuatro grupos funcionales según tuvieran o no anemia fueron respectivamente: robustos 98,0 y 107,1meses (HR: 0,93; IC95%: 0,28-3,11); prefrágiles 97,5 y 102,8meses (HR: 1,60; IC95%: 1,00-2,57); frágiles 52,0 y 95,9meses (HR: 0,80; IC95%: 0,22-2,89); con discapacidad en ABVD 24,2 y 48,6meses (HR: 1,45; IC95%: 1,08-1,94).
Supervivencia a los 10 años según categorías de funcionalidad y anemia.
A: Participantes robustos. Ómnibus de coeficientes de modelo: -2log verosimilitud 363,759 (p<0,001). B: Participantes prefrágiles. Ómnibus de coeficientes de modelo: -2log verosimilitud 1202,853 (p<0,001). C: Participantes frágiles. Ómnibus de coeficientes de modelo: -2log verosimilitud 118,929 (p<0,001). D: Participantes con discapacidad en actividades básicas de la vida diaria. Ómnibus de coeficientes de modelo: -2log verosimilitud 2012,473 (p<0,001).
La principal conclusión del presente trabajo es que la anemia en el adulto mayor, definida por los criterios de la OMS, incrementa el riesgo de mortalidad a 10años en una población de sujetos con edad igual o mayor de 70años de Albacete capital asociado a fragilidad y discapacidad para ABVD.
En los últimos años, numerosos trabajos han constatado que la anemia en la población anciana se relaciona con un mayor riesgo de mortalidad1-4, al igual que existe evidencia de que tanto la fragilidad como la discapacidad por sí mismas son predictores de mortalidad15,16,30,31. Sin embargo, no existen estudios que hayan abordado directamente el impacto de la anemia en la supervivencia ajustada al nivel de función de manera semejante a como se ha llevado a cabo el presente estudio. Solo el estudio Women's Health and Aging StudyI detectó una asociación entre anemia y mortalidad a 5años en mujeres mayores con discapacidad moderada-severa, pero sin analizar el efecto sobre la fragilidad2.
Por otra parte, diferentes estudios han documentado claras asociaciones entre anemia y resultados adversos relacionados con la función tales como fragilidad18,19 o discapacidad4,7,11. Sin embargo, si estas asociaciones son verdaderamente causales o no es un hecho que todavía no se ha establecido, siendo uno de los principales motivos la escasez de trabajos longitudinales y de estudios de intervención al respecto. En apoyo a la hipótesis de que la anemia fuera un elemento causal capaz por sí misma de contribuir a estos resultados funcionales adversos se han propuestos diferentes mecanismos biológicamente plausibles. Uno de estos mecanismos estaría vinculado principalmente a la condición de hipoxia tisular resultante. Así, en el músculo esta situación podría limitar la capacidad aeróbica máxima y submáxima provocando síntomas de mala tolerancia a la actividad física que se traducirían en la aparición de fatiga11,32 y debilidad muscular7. Además, estos síntomas, también limitarían la actividad física diaria y las ABVD favoreciendo el desuso. El resultado final sería la sarcopenia, entrando de esta forma en el ciclo de la fragilidad hacia la cascada de la discapacidad. Otros autores han planteado la hipótesis de que la propia inflamación crónica de bajo grado contribuiría al desarrollo de la anemia en el anciano, que a su vez favorecería la fragilidad20,21. Sin embargo, hasta el momento no se ha podido establecer una relación de causa y efecto entre anemia, fragilidad e inflamación crónica21.
Nuestros hallazgos tienen varias implicaciones. La anemia en el anciano es un problema de salud potencialmente reversible y susceptible de tratamiento, añadiendo a esta consideración su fácil detección mediante la medición de la concentración plasmática de Hb como parámetro de laboratorio sencillo, barato y accesible a cualquier ámbito asistencial, y en especial en atención primaria. Así, el hecho de que la anemia se asocie con un mayor riesgo de mortalidad en sujetos mayores con prefragilidad, fragilidad y discapacidad para ABVD, pero no en robustos, identifica a un subgrupo importante de ancianos de alto riesgo en donde la detección, el diagnóstico y el abordaje de la anemia pudieran ayudar a aumentar su supervivencia. Sin embargo, los riesgos y los beneficios de la intervención de la anemia entre los adultos mayores, y en especial en este subgrupo, siguen siendo desconocidos en la actualidad.
La principal fortaleza del presente trabajo es que la cohorte analizada es de base poblacional, seleccionada mediante muestreo aleatorio estratificado, incluyendo tanto a sujetos de la comunidad como institucionalizados, lo que dota de mayor validez a los resultados obtenidos. Otra fortaleza relevante fue la alta tasa de participación, del 84,7%, probablemente debido al medio urbano en que nos encontramos, una capital de provincia mediana con mayoritaria afiliación a la seguridad social y fácil acceso a los dispositivos asistenciales sanitarios, además de un alto grado de conocimiento del Servicio de Geriatría del Complejo Hospitalario. Otro posible factor adicional pudo ser el método de reclutamiento (carta informativa y posterior llamada telefónica personalizada). En último lugar, resaltar que el equipo investigador y los entrevistadores se mantuvieron estables a lo largo de todo el estudio, lo que garantiza exactitud y rigor en todo el proceso. En cuanto a las posibles debilidades, nuestro estudio no incluye un análisis real de la etiología de la anemia en los sujetos participantes, ni datos sobre marcadores inflamatorios, por lo que no podemos especular sobre la magnitud de este efecto.
En conclusión, nuestros resultados podrían sugerir que la identificación de la anemia, su estudio y su corrección en ancianos con alto riesgo pudiera ser un elemento pronóstico para tener en cuenta como parte de las intervenciones actuales para revertir fragilidad, por su relación con la supervivencia. La posibilidad de que la corrección de anemia pudiera ser una de las pocas causas potencialmente reversibles de fragilidad es una idea particularmente atractiva. Por todo ello, sería de interés poder disponer de un mayor número de estudios que permitiesen esclarecer la relación tan compleja que existe entre anemia y fragilidad, y de estudios de intervención para evaluar la seguridad y la eficacia de los diferentes tratamientos según la etiología de la anemia en la población anciana y, en concreto, en sujetos frágiles, en términos de calidad de vida, funcionalidad y mortalidad.
- •
La anemia en el adulto mayor se relaciona con un mayor riesgo de mortalidad, y de igual manera, tanto la fragilidad como la discapacidad por sí mismas son predictores de mortalidad.
- •
La anemia incrementa el riesgo de mortalidad a largo plazo asociado a la fragilidad y discapacidad en adultos mayores, actuando como factor modulador en esta asociación.
- •
Los resultados del presente trabajo sugieren que la identificación de la anemia, su estudio y su corrección en ancianos con alto riesgo podría ser un elemento pronóstico para tener en cuenta como parte de las intervenciones actuales para revertir fragilidad, por su relación con supervivencia.
Este trabajo ha sido financiado por CIBERFES (CB16/10/00408), Instituto de Salud Carlos III, Ministerio de Economía y Competitividad, España. Ayuda cofinanciada por el Fondo Europeo de Desarrollo Regional FEDER Una Manera de hacer Europa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los participantes en el estudio FRADEA.