La insuficiencia cardíaca congestiva aparece en cardiopatías congénitas (CC) tras agotar los tratamientos convencionales médico-quirúrgicos. En adecuados candidatos, el trasplante cardíaco mejora su calidad y cantidad de vida.
Presentamos los resultados a corto-medio plazo de nuestros trasplantes cardíacos en CC durante los últimos 20 años, centrándonos en las modificaciones técnicas que requiere el trasplante.
Material y métodosRevisión retrospectiva de 44 pacientes con CC trasplantados durante 2001-2021 en nuestro centro especializado en CC. Estudio estadístico: SPSS-15.0.
ResultadosEdad mediana, 17,5 años (RIC: 3,2-40,6); 22 niños y 22 adultos. Tienen cirugías previas el 93% y asistencia ventricular previa el 25%. Diagnósticos iniciales más frecuentes: ventrículo único (45%) y trasposición de grandes vasos (20%).
Trasplante bicavo 43 (98%), biatrial 1 (2%). Técnicas quirúrgicas adicionales requeridas con más frecuencia: retirada de material protésico (marcapasos-desfibriladores-asistencia ventricular-stents) y reconstrucción de ramas pulmonares. Mediana de tiempos de circulación extracorpórea 208min (RIC: 160-245), e isquemia del órgano 271min (RIC: 220-302).Mortalidad hospitalaria, 9 (20%). Las cirugías previas (p=0,01), el ECMO (p=0,007) y hemofiltro por fallo renal postoperatorios (p=0,003) asocian mayor mortalidad hospitalaria.Seguimiento mediano 21 meses (RIC: 9-72), 4 fallecimientos tardíos. La supervivencia tras el alta hospitalaria es del 93% al año, 87% a los 3 años y 80% a partir de los 5 años.
ConclusionesEl trasplante de pacientes con CC en nuestro entorno especializado tiene buenos resultados. Frecuentemente son reintervenciones que prolongan los tiempos quirúrgicos y requieren modificaciones técnicas.
Las cirugías previas y la necesidad de ECMO o hemofiltro en el postoperatorio inmediato asocian significativamente una mayor mortalidad al trasplante de CC. La supervivencia tras el alta hospitalaria es favorable.
Congestive heart failure develops in congenital heart disease (CHD) after failure of conventional medical-surgical treatments. In suitable candidates, heart transplantation improves their quality and quantity of life.
We present our heart transplants in CHD performed in the last 20 years, focusing on technical modifications required, and transplant short-medium-term results.
Material and methodsRetrospective analysis of 44 patients with CHD transplanted during 2001-2021 in our specialized CHD hospital. Statistical study: SPSS-15.0.
ResultsMedian age 17.5 years (IQR: 3.2-40.6), 22 children and 22 adults. Previous surgeries: 93% and mechanical circulatory support: 25%. Most frequent initial diagnoses: single ventricle-45%, and transposition of the great vessels-20%.
Transplant was bicaval: 43 (98%), biatrial: 1 (2%). Additional surgical techniques needed more frequently: removal of prosthetic material (pacemakers-defibrillators-ventricular assist-stents) and reconstruction of pulmonary arteries. Median cardiopulmonary bypass time: 208min (IQR: 160-245), and heart ischemia 271min (IQR: 220-302).
Inhospital mortality: 9 (20%). Previous surgeries (p=0.01), postoperative ECMO (p=0.007) and hemofiltration for acute renal failure (p=0.003) are statistically associated with inhospital mortality.
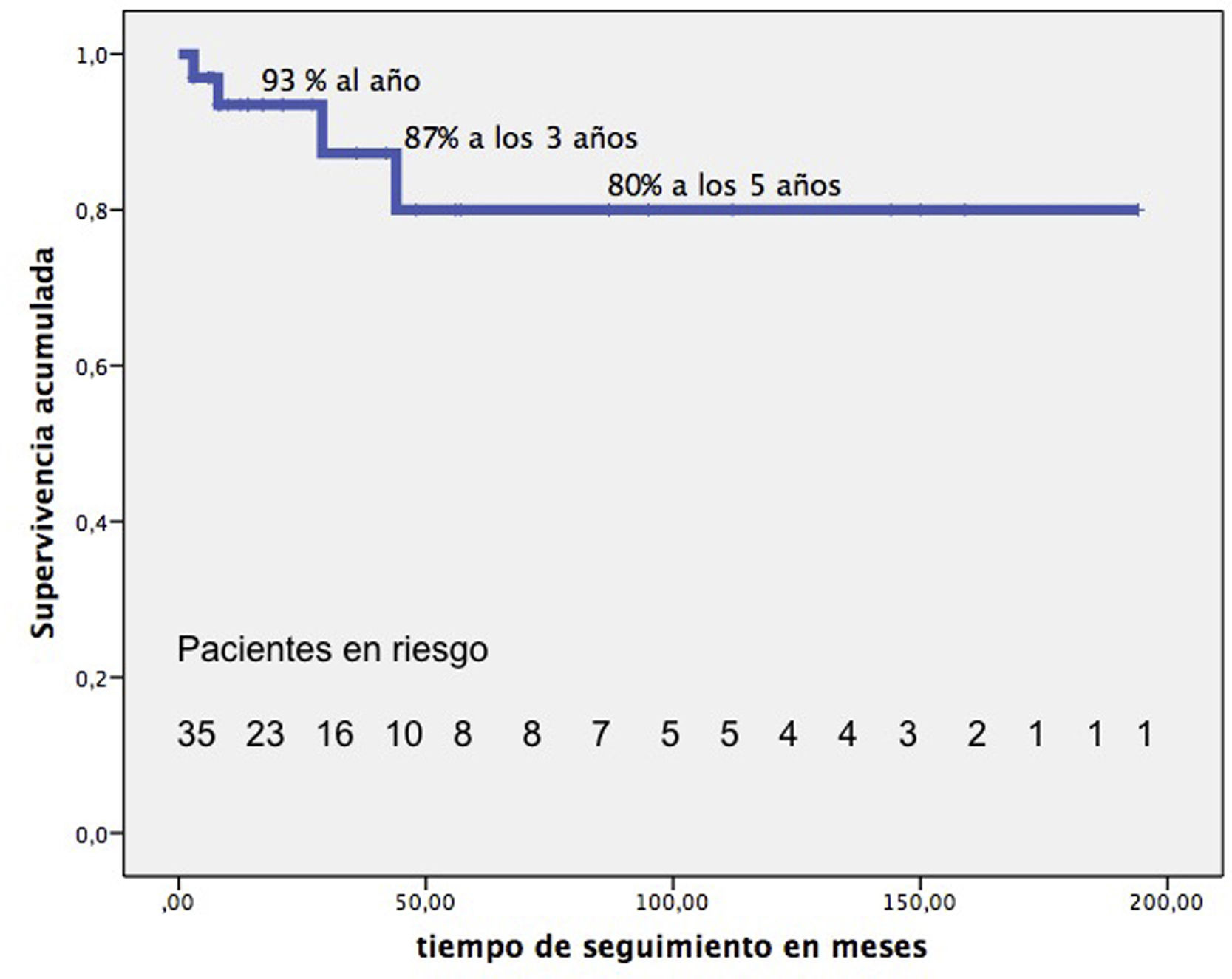
Median follow-up: 21 months (IQR: 9-72), 4 late deaths. Survival after hospital discharge is 93% at 1 year, 87% at 3 years, and 80% after 5 years.
ConclusionsTransplantation of patients with CHD with our multidisciplinary approach in a specialized setting has good results. Reoperations that prolong surgical times and transplant with technical modifications are frequent.
Previous surgeries, postoperative need of ECMO or hemofiltration are significantly associated with higher inhospital mortality in these patients. Survival after hospital discharge is favourable.
Las mejoras médico-quirúrgicas de las últimas décadas han permitido aumentar la calidad de vida de los pacientes con cardiopatía congénita (CC) y prolongar su esperanza de vida. Actualmente más del 90% de los nacidos con CC alcanzan la vida adulta, y con el tiempo aparecen nuevas complicaciones, siendo común en fases finales la insuficiencia cardíaca refractaria al tratamiento convencional. Un porcentaje de estos pacientes serán candidatos a trasplante cardíaco.
El trasplante de CC supone una pequeña parte (3%) del total de trasplantes cardíacos de adultos y más de la mitad de los trasplantes pediátricos, según las últimas cifras publicadas por la Sociedad Internacional de Trasplantes1. Los adultos con CC, a pesar de ser jóvenes y asociar menos comorbilidad, habitualmente tienen mayores tiempos de espera y más morbimortalidad en lista de espera de trasplante respecto a los portadores de cardiopatía adquirida. También tienen descrita mayor morbimortalidad hospitalaria en el trasplante comparados con la cardiopatía adquirida, pero una vez dados de alta hospitalaria, la evolución a medio-largo plazo es buena e incluso mejor que los pacientes con cardiopatía adquirida. La supervivencia tardía del trasplante pediátrico es mejor que la del trasplante adulto en general, y la CC condiciona una menor supervivencia respecto a las miocardiopatías, sobre todo por el mayor riesgo quirúrgico y del postoperatorio inmediato.
Revisamos en este trabajo nuestra experiencia de trasplante cardíaco en pacientes con CC durante los últimos 20 años, para analizar nuestros resultados a corto y medio plazo. Nos centraremos en los aspectos quirúrgicos del trasplante, especificando las modificaciones técnicas que requieren estos pacientes. No obstante, igualmente importante para el éxito del trasplante en pacientes con CC es el correcto y adecuado manejo por parte de cardiología, anestesia, perfusión, cuidados intensivos y enfermería especializada a lo largo del ingreso hospitalario, que no son objeto de este trabajo.
MétodosNuestro Hospital es centro de referencia de CC, de edad pediátrica y adulta. Durante el período temporal comprendido entre los años 2001-2021, hemos trasplantado a 95 pacientes, diagnosticados 51 de miocardiopatía y 44 de CC (suponen el 46% de trasplantes de estas dos últimas décadas). En este manuscrito revisamos retrospectivamente las historias clínicas del trasplante de estos 44 pacientes con CC. Los datos del seguimiento se obtienen de la última visita ambulatoria en la consulta de cardiología o de su último ingreso hospitalario.
Todos los pacientes y/o sus tutores legales fueron informados previamente a la inclusión en lista de trasplante, asimismo firmaron el consentimiento autorizando el uso de datos e imágenes con fines docentes y de investigación. La recogida de datos se ha hecho de forma anónima, respetando la ley de protección de datos vigente en nuestro país y siguiendo los protocolos de nuestro Hospital para la realización de estudios clínicos.
El estudio estadístico descriptivo se ha llevado a cabo con el programa SPSS-15.0. Presentamos las variables cuantitativas con distribución normal como media±desviación típica, y las de distribución no normal como mediana y rango intercuartílico (RIC). Las variables cualitativas se presentan como valor absoluto y porcentajes. Se utiliza la prueba t de Student para comparación de medias y la Chi-cuadrado o test exacto de Fisher para comparar porcentajes. Consideramos significativo un valor de p inferior a 0,05. La supervivencia se representa gráficamente con una curva de Kaplan-Meyer.
Definimos la mortalidad hospitalaria (MH) como la muerte por cualquier causa durante o después de la intervención y hasta el alta hospitalaria, o dentro de un período de 30 días después de la intervención. Las muertes posteriores a estos intervalos temporales las definimos como tardías.
Describimos someramente la evaluación multidisciplinar y estudio cardiológico pre-trasplante en nuestra unidad de CC:
Además de la historia clínica tradicional se objetiva el grado funcional con ergometría de consumo de oxígeno si es posible. Se valoran los procedimientos previos tanto percutáneos como quirúrgicos, y se estudia una posible hipersensibilización asociada a transfusiones previas.
Las pruebas de imagen (ecocardiograma, resonancia magnética y tomografía computarizada) nos muestran la anatomía intracardíaca y las posibles anomalías del drenaje venoso sistémico y/o pulmonar, así como la posición de los grandes vasos al salir del corazón. Estas imágenes tridimensionales ayudan a planificar preoperatoriamente las complejas reconstrucciones quirúrgicas que ocasionalmente requieren estos pacientes, así como los accesos para canulación central o periférica.
El cateterismo se realiza para medir las presiones y resistencias del árbol pulmonar; definimos hipertensión pulmonar si la presión media pulmonar es mayor de 25mmHg. Los pacientes con CC tienen con frecuencia presiones y resistencias pulmonares elevadas, siendo importante en estos casos obtener un buen órgano donante sobredimensionado en peso al del receptor.
En pacientes con ventrículo único y circulación de Fontan también es necesario evaluar la función y anatomía hepáticas que habitualmente están deterioradas, la función renal, así como descartar enteropatía pierde-proteínas, para decidir si el paciente es candidato a trasplante cardíaco aislado, trasplante combinado cardio-hepático, o no subsidiario de incluir en lista por riesgo quirúrgico prohibitivo.
Se evalúan los accesos vasculares periféricos para descartar trombosis vascular previa y planificar la canulación percutánea en caso de ser necesario.
Una vez incluidos en lista de trasplante cardíaco, los pacientes se discuten en sesión médico-quirúrgica planeando la estrategia a seguir el día del trasplante. Consensuamos con el servicio de Anestesiología los sitios idóneos para colocar los catéteres de monitorización. Por ejemplo, con antecedentes de una fístula sistémico-pulmonar previa, la canalización arterial se deberá hacer en el lado contralateral (sin fístula previa) para evitar errores de medición en la presión arterial.
Respecto al equipo extractor, según haya necesidad de reconstruir arterias pulmonares, grandes vasos, u otras anastomosis a la hora del trasplante, es conveniente traer un trozo de pericardio anterior y extraer el corazón donante con la mayor parte de tejido posible (arco aórtico completo, vena innominada y vena cava superior, e idealmente arterias pulmonares disecadas hasta los hilios) para utilizar el tejido del donante en las anastomosis del trasplante. Paramos el corazón antes de extraerlo con medio Celsior® administrado de forma anterógrada desde la raíz de aorta, además de hielo tópico. En los casos con previsible tiempo de isquemia prolongado, repetiremos la dosis de Celsior® en nuestro hospital tras realizar la cirugía de banco.
Hacemos el trasplante con técnica bicava, generalmente canulando la aorta ascendente distal y venas cavas superior e inferior.
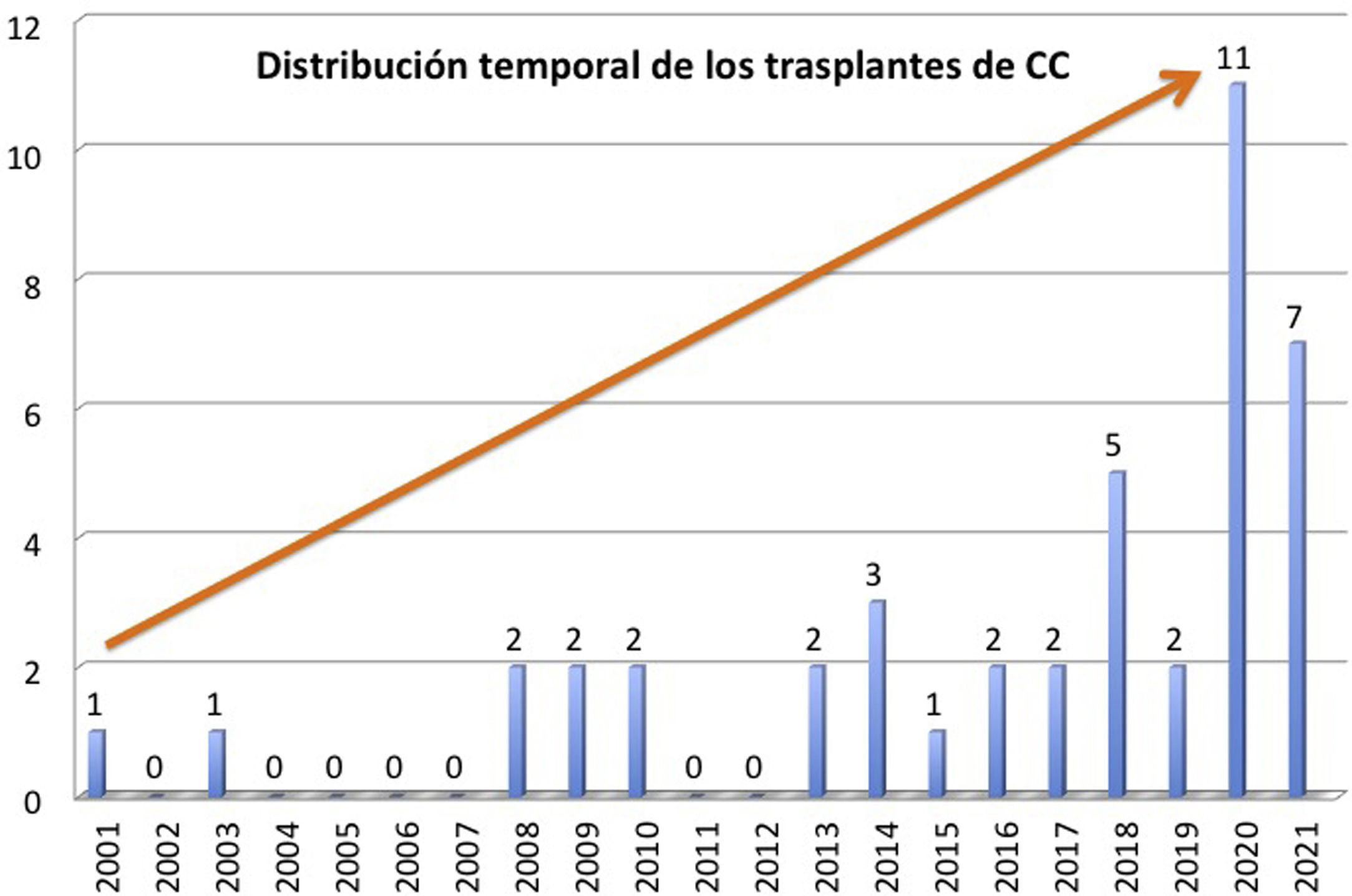
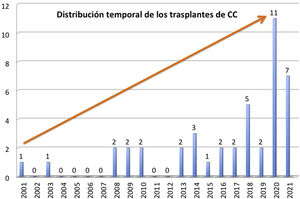
ResultadosNuestros pacientes son 22 niños y 22 adultos, con mediana de edad de 17,5 años (RIC: 3,2-40,6), distribuidos en un amplio rango desde el neonato hasta los 55 años; el 48% son mujeres. En la figura 1 se observa la distribución temporal de los trasplantes, que tienden a aumentar en los últimos años. Casi todos (93%) estaban multioperados, con una mediana de 3 cirugías previas (RIC: 1-4) por paciente. Tres de ellos estaban hipersensibilizados.
Respecto al diagnóstico etiológico de CC (tabla 1) observamos una variada patología, predominando el ventrículo único, seguida de trasposiciones de grandes vasos, complicaciones tardías del Fallot y la displasia de válvulas cardíacas de distinto origen.
Pacientes trasplantados con cardiopatía congénita: diagnóstico inicial de cardiopatía
| Diagnóstico | N | Información adicional |
|---|---|---|
| Ventrículo único | 20 | Fístula (3), Cerclaje arteria pulmonar (2), Glenn (3), Fontan (12) |
| Fallot (tetralogía/doble salida) | 5 | |
| Displasia valvular congénita | 5 | Tricúspide/Ebstein (2), Pulmonar-Sd Noonan (2), Mitro-aórtica Sd Marfan (1) |
| D-TGA | 5 | Mustard (3), Senning (2) |
| L-TGA | 4 | |
| Anomalías coronarias | 2 | |
| Ostium primum | 1 | |
| Sd Shone | 1 | |
| Drenaje pulmonar anómalo parcial | 1 |
N: número; Sd: síndrome; TGA: trasposición de grandes arterias.
El grado funcional de nuestros pacientes era IV en 28 (64%) y III en 16 (36%); tenían antecedentes de arritmias 25 (57%) e hipertensión pulmonar 12 (27%).
El 25% de los pacientes (11) precisaron asistencia ventricular (AV) antes del trasplante: AV extracorpórea con oxigenador de membrana (ECMO) en 9 casos (de ellos, 1 se pudo retirar y 5 se trasplantaron en ECMO), y dispositivo pulsátil de larga duración tipo Berlin Heart EXCOR® en 6 casos (2 implante directo y 4 tras ECMO previo).
La técnica quirúrgica de trasplante realizada fue bicava en todos, excepto el primer caso trasplantado en 2001 con técnica biatrial. Habitualmente hacemos hipotermia moderada, aunque en casos de circulación colateral aumentada o fístula sistémico-pulmonar permeable, común en pacientes con fallo de cirugía univentricular, es necesario enfriar más para bajar el flujo de perfusión de manera puntual y realizar las anastomosis con precisión. Dos de nuestros trasplantes en niños de 3 y 17 meses recibieron trasplantes ABO incompatibles. Un adulto con failing Fontan se trasplantó recibiendo un corazón procedente de un donante en asistolia controlada.
Con frecuencia empleamos técnicas adicionales para solventar las peculiaridades anatómicas de los pacientes, que se resumen en la tabla 2. Explantamos el material heterólogo que portan los pacientes, como marcapasos, desfibriladores, stents y/o asistencias ventriculares definitivas para minimizar el riesgo de infección postoperatoria. Hecha la cardiectomía, colocar el corazón donante en la cavidad torácica del receptor a veces es problemático por escoliosis o por anomalías de la cicatrización esternal (p.ej., un pectum excavatum). Cuando está el corazón del receptor en dextrocardia (fig. 2), abrimos ampliamente ambas pleuras para acomodar al corazón donante en levocardia. La reparación del drenaje venoso pulmonar anómalo a vena cava superior se hace antes de iniciar la anastomosis de la aurícula izquierda, habiendo canulado electivamente la vena innominada en lugar de la cava superior2. Los casos que precisen reconstrucción de las arterias pulmonares se hacen empleando las ramas pulmonares del donante o con material protésico. La reconstrucción de la aorta se hará aprovechando el arco aórtico del donante como parche. Las anomalías en la posición de los grandes vasos (que vemos en distintas cardiopatías como las D-trasposiciones de grandes vasos con reparación previa fisiológica que tienen la aorta anterior y derecha, o la aorta anterior e izquierda frecuente en las L-trasposiciones de grandes vasos y ventrículos únicos) las suturaremos con la aorta y pulmonar del donante dejando largos los pedículos vasculares para que el corazón se acomode en su nuevo habitáculo. Las venas cavas del corazón donante se sitúan a la derecha, y si nuestro receptor tiene eje de cavas a la izquierda hay que dirigirlas hacia la derecha con material sintético (fig. 3), o tejidos del corazón donante, como por ejemplo anastomosar la vena innominada del donante con la vena cava superior izquierda del receptor (fig. 4).
Técnicas quirúrgicas adicionales al implante estándar del corazón donado empleadas en el momento del trasplante (un mismo paciente puede requerir una o varias técnicas)
| Técnica quirúrgica adicional | Número |
|---|---|
| Retirada de cánulas definitivas de AV, MP, DAI | 22 |
| Reconstrucción de ramas pulmonares | 15 |
| Retirada de stents | 12 |
| Pedículos largos de los grandes vasos | 6 |
| Reconstrucción arco aórtico | 4 |
| Reconstrucción drenaje venoso sistémico | 3 |
| Ligadura fístula sistémico-pulmonar | 3 |
| Reparación DVPAP | 2 |
| Adaptación de dextrocardia previa | 3 |
AV: asistencia ventricular; DAI: desfibrilador automático implantable; DVPAP: drenaje venoso pulmonar anómalo parcial; MP: marcapasos.
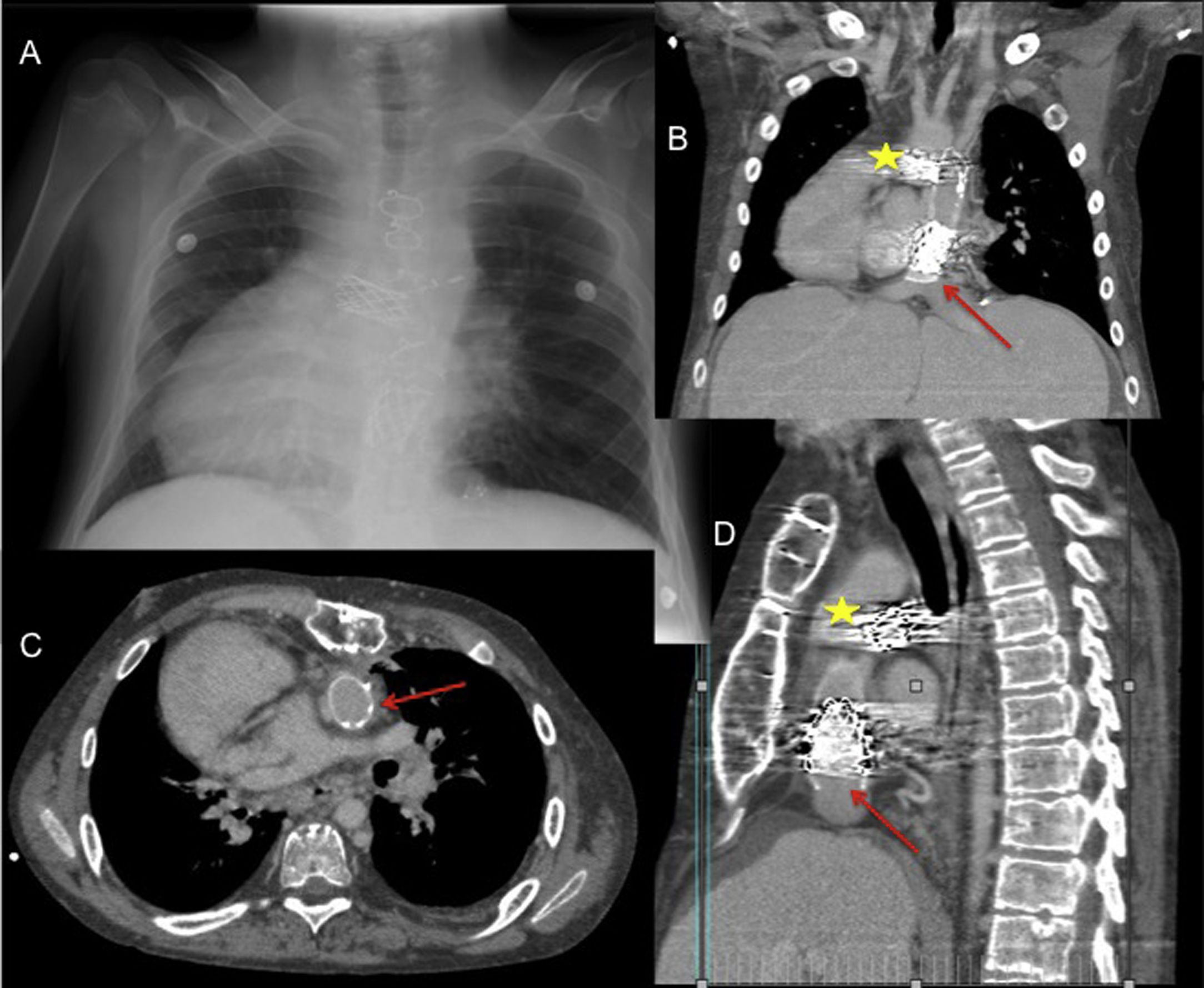
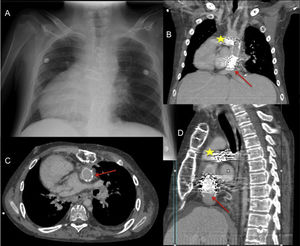
Varón de 20 años con failing Fontan en dextrocardia y con eje de cava a la izquierda. (A) Radiografía posteroanterior de tórax. Tomografía computarizada cardíaca con imágenes coronal (B), transversal (C) y sagital (D): La flecha señala el stent del conducto de Fontan a nivel de la anastomosis con la vena cava inferior, y la estrella el stent en la bifurcación pulmonar. En el trasplante, el corazón donante se acomodó en levocardia abriendo ambas pleuras longitudinalmente, se utilizó el conducto del Fontan una vez extraído el stent para conectar la cava inferior con la aurícula derecha, se desmontó el doble Glenn con anastomosis de esas venas a las venas cava superior e innominada del donante, se reconstruyeron las ramas pulmonares, los pedículos de aorta y pulmonar se dejaron largos.
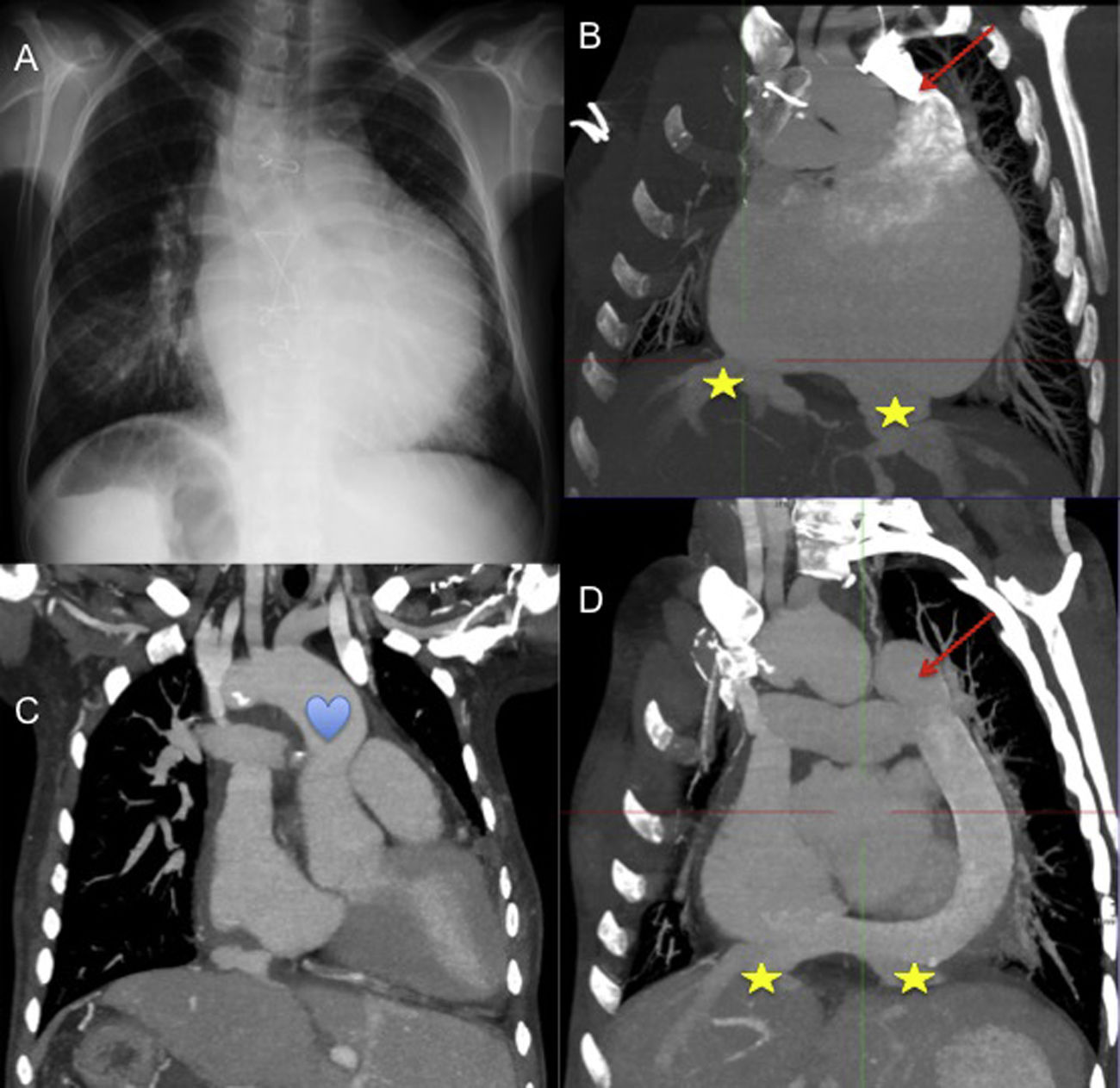
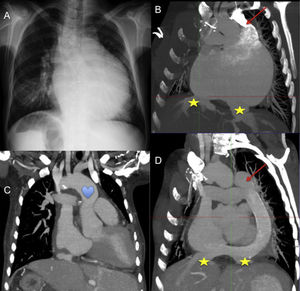
Mujer de 40 años, heterotaxia con situs inversus abdominal, y ventrículo único con doble fístula sistémico-pulmonar. Previamente al trasplante observamos en (A) la radiografía de tórax, y en (B) imagen de tomografía computarizada que muestra aurícula común con drenaje independiente de suprahepáticas (★) y ausencia de vena cava inferior con continuidad hemiácigos-vena cava superior izquierda (flecha). Imágenes de tomografía computarizada postrasplante muestran (C) pedículo largo para empatar la aorta (corazón), y reconstrucción del drenaje venoso sistémico (D) con conducto de gore-tex® desde la cava superior izquierda hasta la cava inferior del corazón donante con anastomosis latero-lateral de las suprahepáticas.
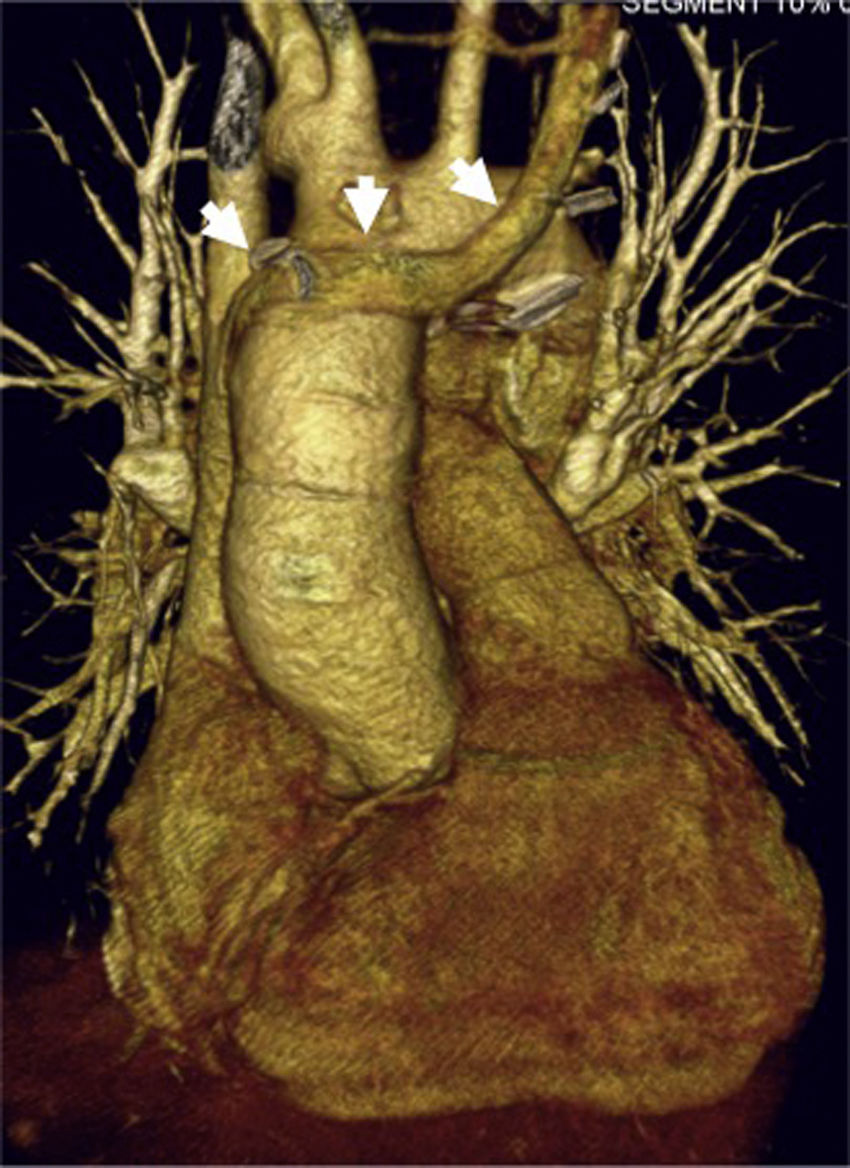
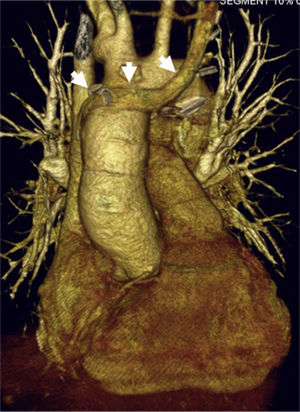
Mujer de 19 años con heterotaxia, ventrículo único con canal auriculoventricular disbalanceado y doble vena cava superior sin innominada. Imagen de tomografía computarizada que muestra reconstrucción tridimensional postoperatoria del corazón trasplantado; las flechas muestran la innominada del donante usada para suturarla con la vena cava superior izquierda de la receptora.
Frecuentemente existe un sangrado profuso que requiere hemostasia exhaustiva y prolongada además de politransfusión. Trece pacientes (29%) abandonaron el quirófano con el tórax abierto portando un empaquetado mediastínico para poder controlar el sangrado. La disfunción ventricular derecha se previene y trata con inotrópicos, diuréticos y vasodilatadores pulmonares. Nuestros tiempos medianos de circulación extracorpórea (CEC) fueron 208min (RIC: 160-245) y de isquemia del órgano 271min (RIC: 220-302).
El postoperatorio inmediato se complicó con fallo renal secundario a la politransfusión requiriendo terapia de sustitución renal hasta su resolución en 12 pacientes (28%), infección en 12 (28%), ECMO en 6 (14%) y arritmia en 6 (14%). La MH fue del 20% (9 pacientes). Identificamos el número de cirugías previas (p=0,01), el ECMO postoperatorio (p=0,007) y la necesidad de hemofiltro en el postoperatorio inmediato (p=0,003) como factores de riesgo de MH en el estudio univariable.
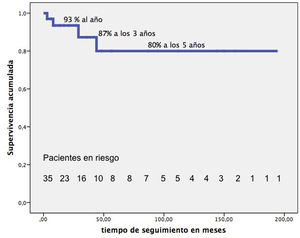
El seguimiento mediano de 21 meses (RIC: 9-72) es completo. Tardíamente fallecieron 4 pacientes más. La supervivencia de nuestros pacientes, excluida la MH, una vez dados de alta hospitalaria es del 93% al año, 87% a los 3 años, 80% a partir de los 5 años (fig. 5). En su última revisión, el 90% de los pacientes están en grado funcional-I y el 10% en grado-II.
DiscusiónLa insuficiencia cardíaca es la principal causa de morbimortalidad en adultos con CC. Es primordial que este aspecto sea evaluado en una unidad específica de CC para determinar qué pacientes son candidatos a incluirse en lista de trasplante cardíaco, y a implante de asistencia ventricular si procede. Hacer una correcta selección de pacientes con CC para incluir en lista de trasplante cardíaco es crucial para obtener buenos resultados, puesto que los donantes son limitados. Esta decisión es difícil porque a la heterogeneidad de la CC en sí se añaden las diferentes formas de manifestación del fallo cardíaco y la insuficiencia cardíaca en estos pacientes que no están reflejadas en las guías clínicas actuales, y de igual manera no es infrecuente que tengan una escasa respuesta a los tratamientos médicos convencionales3.
En los pacientes con CC es esencial conocer, además de la cardiopatía de base, sus procedimientos percutáneos y quirúrgicos previos. Los pacientes congénitos en lista de trasplante cardíaco presentan peculiaridades anatómicas que obligan a modificar la técnica tradicional del trasplante4,5. Una de las claves del éxito al trasplantar a estos pacientes es que la cirugía la lleven a cabo cirujanos especialistas en cardiopatías congénitas que estén familiarizados con las modificaciones técnicas y el manejo de la hemostasia prolongada6.
La reesternotomía es habitual en los pacientes con CC, que tienen operaciones previas. Nuestra serie tiene una proporción elevada de reintervenciones comparada con la reportada por otros grupos7. En casos de gran dilatación de cavidades derechas o pacientes con Fontan atriopulmonar con previsible rotura cardíaca con la esternotomía convencional, recomendamos canulación periférica y entrada en CEC con hipotermia moderada previamente a la reesternotomía. También se pueden utilizar las cánulas de los pacientes portadores de AV definitiva como acceso periférico para CEC8.
La canalización de vías por anestesia, la disección y liberación de adherencias además de las técnicas quirúrgicas adicionales por nuestra parte, aumentan los tiempos quirúrgicos. Es primordial considerar estos aspectos a la hora de organizar el tiempo de entrada de nuestro paciente a quirófano para coordinar al máximo las actuaciones con el equipo extractor.
En línea con la experiencia referida por otros grupos9, el ventrículo único como diagnóstico primario es nuestra patología más frecuente al trasplantar CC. Estos pacientes asocian múltiples intervenciones previas, daño multisistémico por la cianosis y congestión venosa crónicas, y con más frecuencia están hipersensibilizados, comparados con la CC biventricular. Estos factores aumentan el riesgo quirúrgico asociado al trasplante y hacen que este sea un verdadero desafío técnico10.
En nuestra serie, el mayor número de cirugías previas, la necesidad de ECMO y de hemofiltro postoperatorio se asocian a mayor MH. No hemos encontrado asociación significativa con otros factores recogidos en la literatura, como diagnóstico de ventrículo único11, hipertensión pulmonar, asistencia ventricular previa o tiempos quirúrgicos prolongados, probablemente por insuficiente tamaño muestral.
Una vez dados de alta hospitalaria, la evolución de los pacientes con CC es buena y a medio-largo plazo incluso mejor que los pacientes con cardiopatía adquirida, lo cual justifica el trasplante cardíaco como una buena terapia para estos pacientes con CC en etapas finales de su enfermedad12. El trasplante de CC supone un pequeño porcentaje respecto al total de trasplantes13, pero está en actual crecimiento ya que la población de adultos con CC va aumentando; en consecuencia, llegará el momento en que el tratamiento convencional no sea eficaz y el trasplante sí ofrece mejoría tanto de la cantidad como de la calidad de vida a estos pacientes jóvenes. El perfil de paciente con CC que requiere trasplante cada vez es más complejo y supone un importante reto técnico14. Creemos firmemente que los mejores resultados con estos pacientes se logran cuando son atendidos en unidades multidisciplinares de CC con experiencia en trasplante.
En el año 2018 se hizo realidad el trasplante ABO incompatible que incrementa las posibilidades de recibir un órgano a los receptores más pequeños (neonatos y lactantes) que aún no han desarrollado anticuerpos frente al grupo sanguíneo y tienen su sistema inmune inmaduro, además son los que tienen mayor dificultad para encontrar un órgano compatible15. Dos de nuestros pacientes recibieron este tipo de trasplante.
El trasplante cardíaco en asistolia controlada y perfusión toraco-abdominal normotérmica se inició en España en 2020, siendo adultos el donante y el receptor que presentaba cardiopatía adquirida16. En 2021, el primer caso mundial de trasplante ABO incompatible con donante neonatal en asistolia controlada se realiza con éxito en nuestro país17.
Estos casos demuestran que los donantes procedentes de asistolia controlada son válidos para aumentar el pool de donantes y así las posibilidades de trasplante de los pacientes en lista de espera. A pesar de la pandemia covid-19 que ocasionó una gran disminución de nuestra actividad en cirugía cardiovascular durante la primera ola del 202018, se preservó al máximo la actividad de donación y trasplante, pudiendo remontar las cifras para terminar el año con números similares al 2019 pre-pandemia. El trasplante cardíaco fue el que menos descendió en esos meses respecto a los trasplantes de otros órganos19.
Como plan de futuro, participamos junto al resto de grupos españoles en la elaboración de un registro multicéntrico de pacientes adultos con CC que se listan para trasplante20, con el objeto de estudiar su evolución en dicha lista de espera, analizar los resultados y establecer estrategias de mejora de los mismos.
ConclusionesLa clave del éxito del trasplante de CC comienza con una adecuada selección de los pacientes realizada de forma multidisciplinar en un entorno hospitalario especializado.
Son frecuentes en estos pacientes las reintervenciones y alteraciones anatómicas que requieren planificación y modificaciones quirúrgicas respecto a la técnica bicava tradicional. Es importante contar con tiempos quirúrgicos prolongados y un sangrado profuso para poder planificar actuaciones y obtener los mejores resultados posibles.
Las cirugías previas, la necesidad de ECMO y de hemofiltro en el postoperatorio inmediato asocian significativamente una mayor mortalidad al trasplante de CC.
Una vez dados de alta hospitalaria, la supervivencia tras el trasplante de CC es buena a corto y medio plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.