Desde los primeros trabajos en Canadá, el trasplante cardiaco infantil con incompatibilidad de grupo sanguíneo ABO se ha afianzado globalmente. El escaso título de isohemaglutininas anti-A y anti-B en menores de 12-14 meses permite dicha estrategia. Los resultados publicados confirman la validez a corto y medio plazo. Presentamos nuestra experiencia inicial.
MétodosEstudio retrospectivo entre septiembre de 2017 y agosto de 2021. Realizamos 31 trasplantes cardiacos infantiles (<18 años), de los que 16 cumplen criterios de inclusión: títulos de isohemaglutininas<1/8 y edad inferior a 12 meses. Se define un protocolo de exanguinotransfusión intraoperatoria, en caso necesario. Analizamos los días en lista de espera, el número de episodios de rechazo y la mortalidad en el primer año postrasplante, comparando grupos ABO compatible con no compatible.
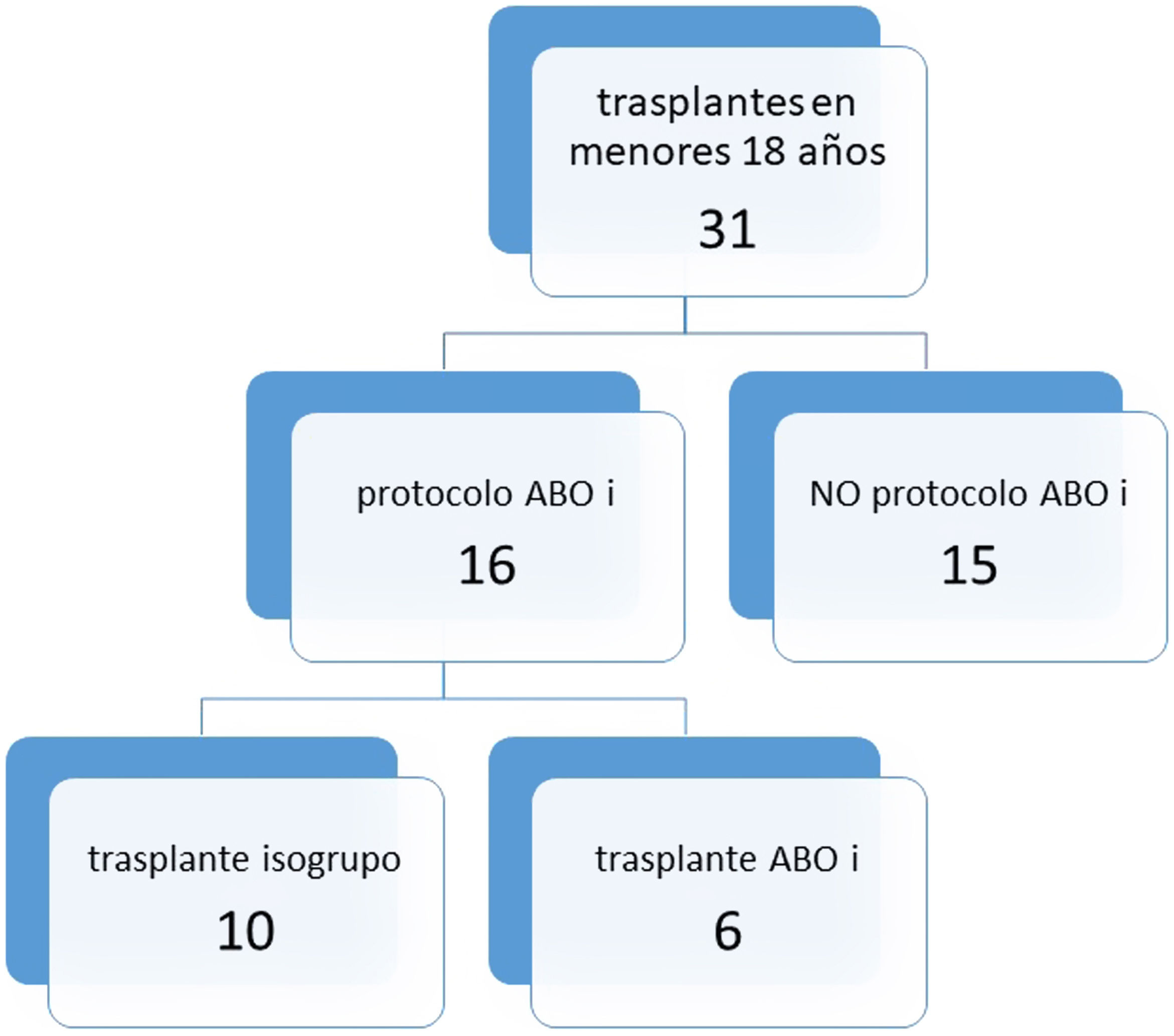
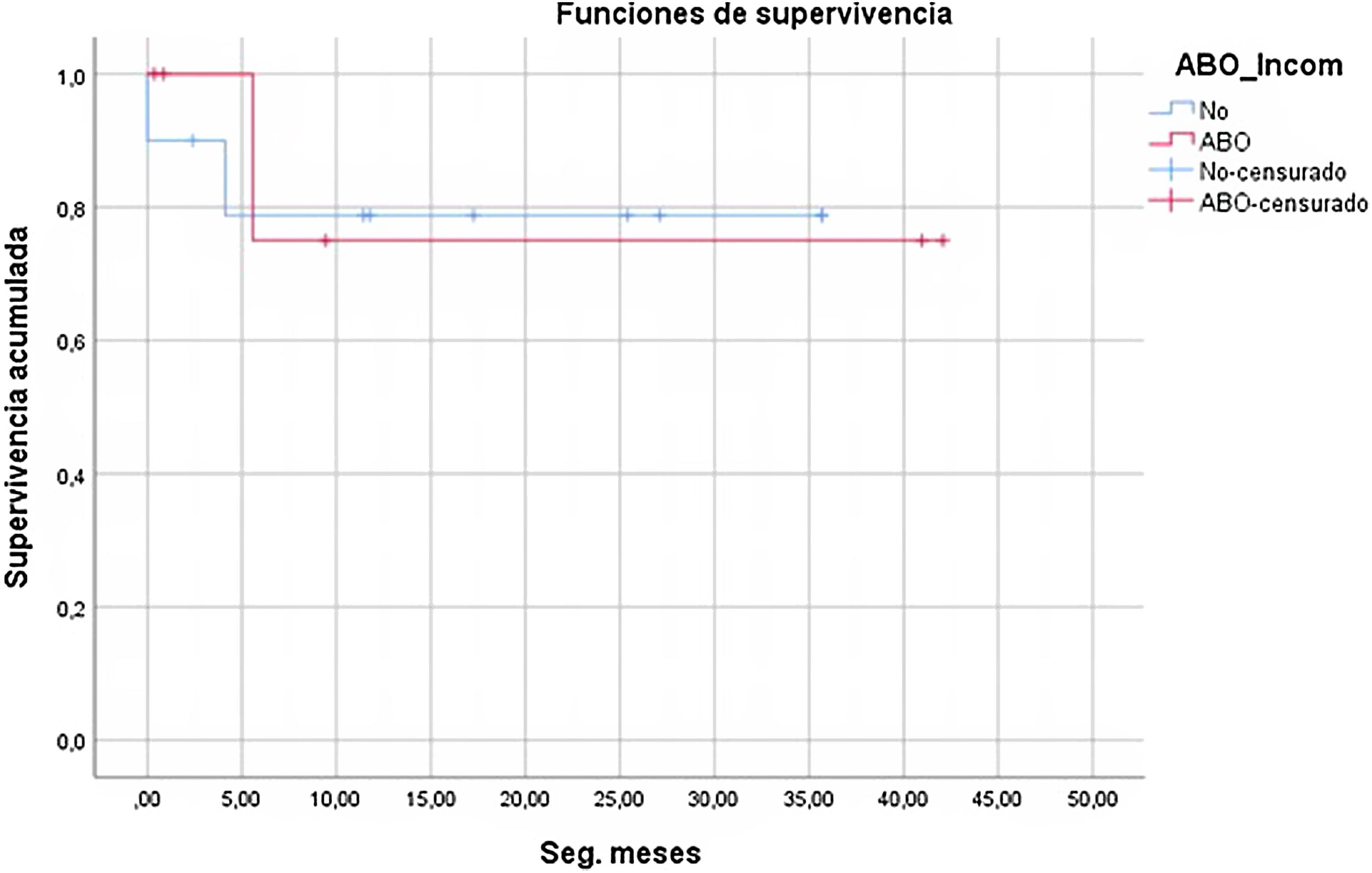
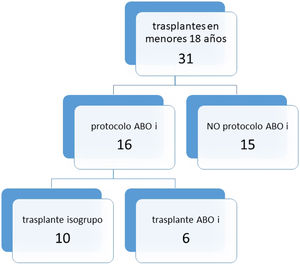
ResultadosDe los 16 niños, 6 recibieron un corazón de donante no compatible. La media de días en lista de espera resultó menor en el grupo no compatible (42,3 vs. 72,3), con p=0,263. Ninguno de los 6 niños precisó exanguinotransfusión durante el trasplante. Un receptor en cada grupo presentó episodios de rechazo. Falleció un paciente en el grupo no compatible (1/6) y 2 en el compatible (2/10).
ConclusionesUn tercio (6/16) de los niños incluidos en el programa recibió un órgano no compatible. Ninguno de los 6 trasplantados precisó exanguinotransfusión. La media de días en espera fue menor en el grupo no compatible. No hubo diferencias en el número de episodios de rechazo ni en la mortalidad.
Since pioneer work in Canada, non-compatible paediatric heart transplantation is gaining worldwide acceptance. Low titres of anti-A and anti-B isohaemagglutinins under 12-14 months of age warrant this strategy. Outstanding short and midterm results encourage joining new programmes. We present our preliminary scores.
MethodsWe collected retrospective data between September 2017 and August 2021. Thirty-one paediatric (<18 years) heart transplants were performed. Sixteen patients met the inclusion criteria: age below 12 months and isohaemagglutinin titres<1/8. An intraoperative blood-exchange chart was made, when required. Waiting-list days, rejection episodes and death rate in the first year are defined as endpoints, comparing ABO compatible and non-compatible transplants.
ResultsSix out of 16 recipients received a non-compatible graft. Waiting-list median was shorter in the non-compatible group (42.3 vs. 72.3 days) with P=.263. No blood-exchange was needed in any recipient. One patient in each group presented with rejection episodes. Two patients (2/10) in the compatible and one child (1/6) in the non-compatible group died in the follow-up.
ConclusionsAbove one third (6/16) of included recipients received a non-compatible graft. None of them were blood exchanged during transplantation. Waiting list was shorter in this group. No differences in rejection episodes nor death rate in the first year were recorded between compatible and non-compatible groups.
Aproximadamente 500 niños reciben un trasplante de corazón anualmente en todo el mundo. De ellos, 100 son menores de un año. Similar porcentaje (20%) se da en España, donde 10-20 menores de 18 años son trasplantados anualmente. Las listas de espera son más prolongadas en menores de 3 meses (con el consiguiente incremento de mortalidad1, hasta el 25-30%) y en el grupo sanguíneo O. Paradójicamente, la escasa oferta de donaciones en menores puede no encontrar receptores adecuados (discrepancias de grupo, peso, etc.) y algunos corazones válidos resultan desechados2. Así, entre 2011-2014, 15 órganos procedentes de donantes menores de 12kg no fueron aprovechados por discrepancia de grupo ABO, según datos de la Organización Nacional de Trasplantes.
La producción de isohemaglutininas, con títulos anti-A o anti-B, es muy baja en recién nacidos y lactantes hasta los 12-14 meses3. Además, el sistema del complemento no es totalmente funcionante en niños tan pequeños4. Estos hallazgos permiten que la compatibilidad ABO pueda ser transgredida en edades tan tempranas, facilitando así la posibilidad de incrementar el número de trasplantes cardiacos en las edades más necesitadas.
Desde la introducción de programas de trasplante ABO incompatible (ABOi) en niños a finales de 1990 por West et al. en Canadá5, se ha incrementado el número de neonatos y lactantes trasplantados de corazón. Varios estudios han demostrado que la supervivencia precoz es comparable en los niños trasplantados con protocolo ABOi o isogrupo6,7. Trabajos más recientes indican que dichas similitudes en los resultados se mantienen incluso a los 10 años8.
Nuestro grupo puso en marcha un programa de trasplante cardiaco infantil ABOi a finales de 2017, siendo pionero en España9. Presentamos nuestros resultados iniciales, con la prudencia de manejar unos números modestos y escaso seguimiento.
Material y métodosEstudio retrospectivo de pacientes menores de 18 años y sometidos a trasplante cardiaco en nuestro centro, desde septiembre de 2017 hasta agosto de 2021.
Criterios de inclusión en programa ABOi:
- 1.
Edad menor de 14 meses en el momento de inclusión en lista de espera.
- 2.
Título de hemaglutininas igual o menor de 1/8.
- 3.
Determinación quincenal de títulos, excluyendo de protocolo si superan 1/8.
- 4.
Estrategia transfusional: hematíes grupo O, plasma/plaquetas grupo AB.
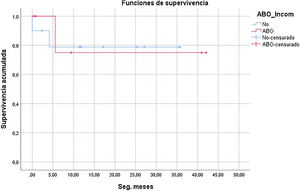
Treinta y un niños fueron trasplantados en nuestro centro en el citado intervalo de tiempo. De ellos, 16 menores de 14 meses y con títulos de hemaglutininas menores de 1/8 se incluyeron en el programa ABOi. Finalmente, 6 de ellos recibieron injertos de grupo sanguíneo diferente, frente a 10 que resultaron isogrupo (fig. 1).
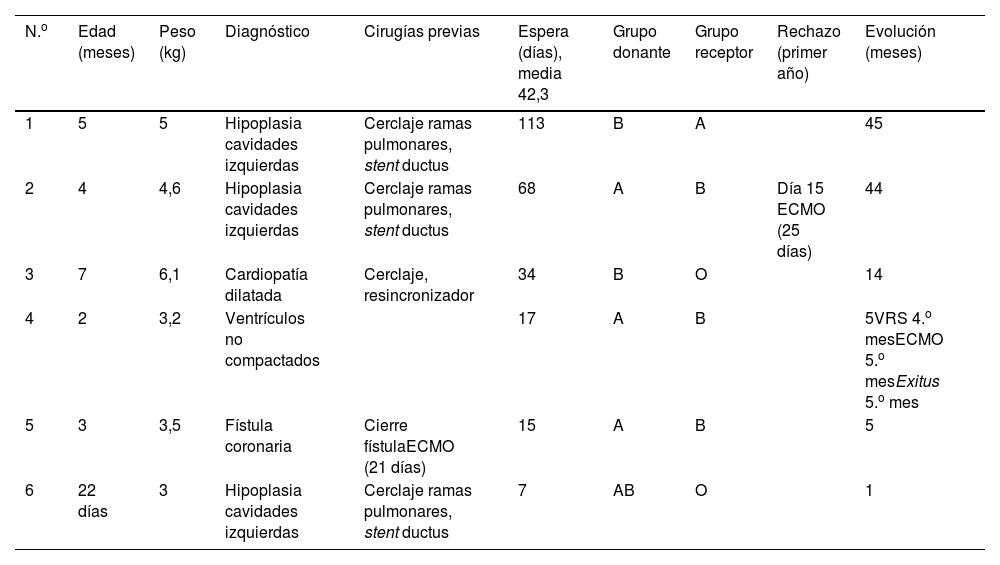
La tabla 1 recoge el diagnóstico y los procedimientos quirúrgicos previos al trasplante de los 6 pacientes ABOi (cuarta y quinta columnas).
Pacientes trasplantados con grupos incompatibles y hemaglutininas negativas
| N.o | Edad (meses) | Peso (kg) | Diagnóstico | Cirugías previas | Espera (días), media 42,3 | Grupo donante | Grupo receptor | Rechazo (primer año) | Evolución (meses) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 5 | 5 | Hipoplasia cavidades izquierdas | Cerclaje ramas pulmonares, stent ductus | 113 | B | A | 45 | |
| 2 | 4 | 4,6 | Hipoplasia cavidades izquierdas | Cerclaje ramas pulmonares, stent ductus | 68 | A | B | Día 15 ECMO (25 días) | 44 |
| 3 | 7 | 6,1 | Cardiopatía dilatada | Cerclaje, resincronizador | 34 | B | O | 14 | |
| 4 | 2 | 3,2 | Ventrículos no compactados | 17 | A | B | 5VRS 4.o mesECMO 5.o mesExitus 5.o mes | ||
| 5 | 3 | 3,5 | Fístula coronaria | Cierre fístulaECMO (21 días) | 15 | A | B | 5 | |
| 6 | 22 días | 3 | Hipoplasia cavidades izquierdas | Cerclaje ramas pulmonares, stent ductus | 7 | AB | O | 1 |
Los trasplantes se llevaron a cabo de manera convencional, siguiendo las estrategias quirúrgicas habituales en nuestro grupo10. De manera seriada, se realizan varias determinaciones de hemaglutininas:
- 1.
Antes de la entrada en el quirófano.
- 2.
Tras comenzar la circulación extracorpórea (CEC).
- 3.
Treinta minutos después de la entrada en CEC.
- 4.
Antes del despinzamiento aórtico (extracción en el momento de comenzar la sutura de aurícula izquierda, dando tiempo al procesado de la muestra).
- 5.
Al finalizar la CEC.
Cualquier título superior a 1/8 en alguna de las determinaciones obliga a una exanguinotransfusión. No se despinza la aorta hasta comprobar que los títulos son inferiores a 1/8, de ahí que la muestra n.o 4 se extraiga con antelación para evitar demoras en su lectura y la prolongación del pinzamiento aórtico. Además de la reserva habitual de hemoderivados para una cirugía con CEC, se amplía la petición en el Banco de Sangre ante la posibilidad de 3 exanguinotransfusiones.
Durante el postoperatorio se mantiene la misma política transfusional: hematíes grupo O, plasma/plaquetas grupo AB (donantes universales). La presencia de títulos superiores a 1/8 requerirá de plasmaféresis.
Analizamos la espera en lista de trasplante (en días) y los resultados quirúrgicos, así como el número de episodios de rechazo en el primer año, comparando los 6 trasplantes ABOi con los 10 isogrupo.
El análisis estadístico se realizó con el paquete SPSS® versión 25.0.
ResultadosEn enero del 2018 se realizaron los 2 primeros trasplantes ABOi de nuestra serie, que resultaron los primeros en España9. La tabla 1 recoge datos de edad (rango 1-7 meses) y peso (rango 3-6,1kg). Tres pacientes (primero, segundo y sexto de la serie) presentaban hipoplasia de cavidades izquierdas y fueron previamente paliados con cerclaje de ramas pulmonares y stent ductal. Un niño, con cardiopatía dilatada, recibió un cerclaje pulmonar (primera cirugía) y posteriormente un resincronizador (segunda intervención). El cuarto caso corresponde a una miocardiopatía no compactada biventricular. No precisó cirugías previas al trasplante. Se da la circunstancia de que el donante fue en asistolia controlada11. El quinto niño presentaba fístulas coronarias. Inicialmente ligadas quirúrgicamente, precisaron ECMO central y posterior cambio a posición cervical para cierre de tórax.
La espera en lista de trasplante osciló entre 7 y 113 días, con una media de 42,3 días. Los grupos de donante y receptor se reflejan en la tabla 1. Los títulos de hemaglutininas se mantuvieron negativos en todas las determinaciones en los 6 casos. No se precisaron exanguinotransfusiones.
El paciente 2 presentó un episodio de rechazo humoral el día 15 postrasplante en el contexto de una insuficiencia renal y reajuste de tacrolimus. Precisó ECMO durante 25 días por compromiso hemodinámico, recibiendo 4 ciclos de plasmaféresis.
El seguimiento ha oscilado entre uno y 45 meses. Debido a un episodio de bronquiolitis (positivo para virus respiratorio sincitial), el paciente 4 precisó ingreso con ventilación mecánica el cuarto mes postrasplante, seguido de asistencia tipo ECMO venoarterial y exitus eventualmente a los 5 meses.
De manera sucinta, recogemos en la tabla 2 los datos referentes al tiempo de espera en lista, grupos sanguíneos y evolución de los 10 pacientes con hemaglutininas negativas y trasplante isogrupo. La espera osciló entre 3 y 155 días, con una media de 72,3 días. Cuatro de los receptores fueron del grupo O y 3 del A. Un paciente (n.o 8) tuvo 2 episodios de rechazo (días 10 y 45). Dos niños fallecieron: uno en quirófano por hemorragia pulmonar y otro por sepsis a los 4 meses. El rango de seguimiento es de 1-38 meses.
Pacientes con trasplante isogrupo y hemaglutininas negativas
| N.o | Espera (en días), media 72,3 | Grupo donante | Grupo receptor | Rechazo (primer año) | Evolución (en meses) |
|---|---|---|---|---|---|
| 1 | 63 | A | A | 38 | |
| 2 | 89 | O | O | 37 | |
| 3 | 127 | O | O | Exitus 4.o mes | |
| 4 | 5 | B | B | 29 | |
| 5 | 29 | O | AB | 27 | |
| 6 | 134 | A | A | 19 | |
| 7 | 78 | AB | AB | Exitus quirófano | |
| 8 | 40 | A | A | Día 10Día 45 | 14 |
| 9 | 3 | O | O | 12 | |
| 10 | 155 | O | O | 5 |
A pesar de la notable diferencia en los días de espera en lista de trasplante (42,3 en el grupo ABOi frente a 72,3 en el resto), no se alcanzó significación estadística (p=0,263). La causa más probable es el pequeño tamaño de la muestra (fig. 2).
DiscusiónLas diferentes estrategias para disminuir la lista de espera de trasplante cardiaco en niños han resultado acertadas. Así, la discrepancia de peso entre donante y receptor o la introducción de programas ABOi permiten un mayor aprovechamiento de los escasos órganos ofrecidos. Esto se traduce, si no en un aumento de las donaciones, sí en un descenso en el tiempo en lista de espera (42,3 vs. 72,3 días en nuestra serie). El grupo más favorecido al respecto es el O12. Recordemos que los pacientes del grupo AB no se ven influidos por esta política, ya que resultan beneficiados por ser «receptores universales». Mientras algunos equipos comenzaron ofreciendo corazones de grupo sanguíneo incompatible a niños deteriorados tras espera infructuosa de órganos compatibles7, nuestra estrategia fue clara desde un principio: tamaño (peso/talla) como parámetro único de inclusión, obviando el grupo ABO.
Conocemos los resultados a corto y largo plazo de esta nueva táctica de distribución8. A pesar de lo breve de nuestra serie, la evolución inicial en términos de rechazo y supervivencia durante el primer año es superponible a lo publicado. Habida cuenta de que no fue precisa exanguinotransfusión durante el trasplante en ninguno de nuestros pacientes, nos planteamos la posibilidad de expandir los criterios de inclusión13 a mayores de 12-14 meses y/o títulos superiores a 1/8.
Un programa ABOi no aumenta el número de donantes, pero sí obtiene el máximo provecho de los escasos corazones obtenidos para los menores de 12-14 meses. Comenzamos nuestro protocolo de trasplante cardiaco infantil en grupos no compatibles en enero de 2018, con un buen resultado inicial. Por otro lado, la donación en asistolia sí aumenta el número de donantes14. Las estrategias ABOi y donación en asistolia controlada no son excluyentes entre sí, más bien al contrario, pueden solaparse como se demostró en nuestro paciente n.o 411. Bailey, pionero en trasplantes cardiacos neonatales, predijo un incremento de los mismos basado en la incorporación de maniobras encaminadas al mejor aprovechamiento de los pocos órganos en edades tempranas15. Sus palabras, visionarias, comienzan a hacerse realidad con programas como el ABOi y la donación en asistolia.
ConclusionesTeniendo en cuenta las limitaciones propias de una serie breve y con seguimiento escaso, podemos concluir:
- 1.
Un tercio (6/15) de nuestros pacientes incluidos en programa ABOi recibió trasplante de grupo incompatible, sin exanguinotransfusiones.
- 2.
Dicho grupo vio reducida su estancia en lista de espera, sin alcanzar significación estadística (probablemente por lo escaso de la muestra).
- 3.
No hubo incremento en los episodios de rechazo ni mortalidad atribuibles a la incompatibilidad en el primer año.
- 4.
Cabe la posibilidad de aumentar la edad (>14 meses) y/o los títulos (>1/8) en el futuro.
- 5.
Los programas ABOi y donación en asistolia son sumatorios, incrementando el número de posibles donaciones en edades tempranas.
Esta investigación fue aprobada por el Comité ético del Hospital Gregorio Marañón y se obtuvo el consentimiento informado de los progenitores de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.