La coartación de aorta primaria representa aproximadamente del 6 al 8% de los defectos cardíacos congénitos. La coartectomía es el tratamiento de elección en neonatos, con una morbimortalidad del 1-2%. Los neonatos tienen desarrollado un buen sistema de circulación colateral que actúa como mecanismo de protección frente a la isquemia medular, por lo que un pinzamiento aórtico directo sin necesidad de circulación extracorpórea suele ser lo habitual en la reparación quirúrgica.
Presentamos el caso de un neonato de 8 días de vida que fue sometido a una coartectomía a través de toracotomía lateral izquierda, se realizó un by-pass parcial izquierdo, debido a la friabilidad de los tejidos que impidió completar la anastomosis, permitiendo cambiar de estrategia quirúrgica a un avance de arco a través de una esternotomía media sin suponer un tiempo prolongado de isquemia tisular.
Primary aortic coarctation represents approximately 6% to 8% of congenital heart defects. Coartectomy is the gold standard treatment in neonates with an overall morbidity and mortality of less than 1-2%. Neonates have developed a collateral circulation system which is a possible protective mechanism in the spinal cord ischemia.
We present a neonate who underwent a coartectomy through a left lateral thoracotomy using left heart bypass due to we were unable to complete the aortic anastomosis due to the friable aortic tissues. The left heart bypass allowed us to change our surgical strategy to aortic arch advancement through a median sternotomy without assuming a prolonged ischemia time.
La coartación de aorta (CoA) es considerada parte de una arteriopatía generalizada y no solo un estrechamiento aislado de la aorta1. Si bien a menudo macroscópicamente se evidencia un estrechamiento aislado y discreto, también puede ser parte del escenario más extremo de la hipoplasia severa del arco, como ocurre en el síndrome del corazón izquierdo hipoplásico o en conjunto con muchos otros defectos cardíacos congénitos. La CoA representa aproximadamente del 6 al 8% de los defectos cardíacos congénitos2-4.
Los neonatos con CoA crítica pueden presentar signos y síntomas de bajo gasto, insuficiencia cardíaca y muerte cuando ocurre el cierre del ductus arterioso, por lo que la identificación temprana de estos pacientes es esencial para mantener el ductus arterioso permeable. En este grupo de edad la aortoplastia percutánea se asocia a elevadas tasas de recoartación, siendo la reparación quirúrgica mediante una resección extendida la opción terapéutica gold standard actualmente4. Las alternativas quirúrgicas implican un abordaje por toracotomía izquierda o esternotomía media que respectivamente evitan o requieren el uso de circulación extracorpórea (CEC). Sin embargo, el abordaje por toracotomía postero-lateral izquierda es la vía de elección en la CoA aislada5.
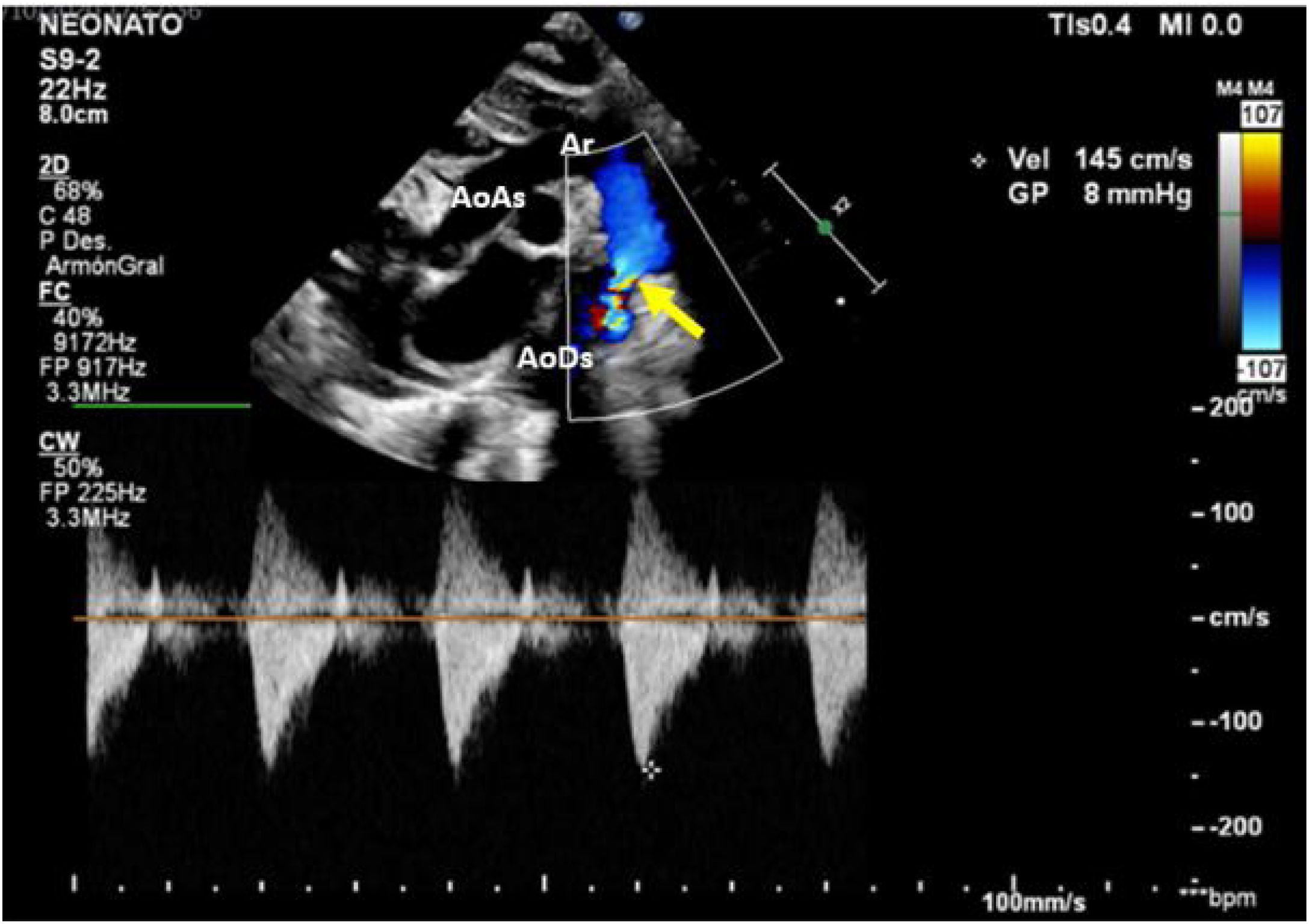
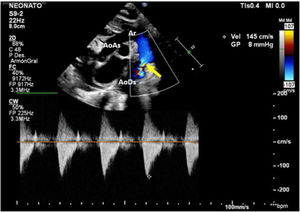
Caso clínicoPaciente masculino con diagnóstico prenatal de CoA, nacido a término por vía vaginal con Apgar 9/9. Se realiza una ecocardiografía al nacimiento en la que se confirma el diagnóstico de CoA no dependiente de ductus, con un gradiente a nivel del istmo de 8mmHg, con buena función biventricular y ductus arterioso cerrado (fig. 1). Recibe prostaglandinas por vía intravenosa durante 12 h (bolo inicial de 0,1 μg/kg/min y dosis posterior 0,03 μg/kg/min), suspendiéndose tras comprobarse la no apertura del ductus y la estabilidad del paciente.
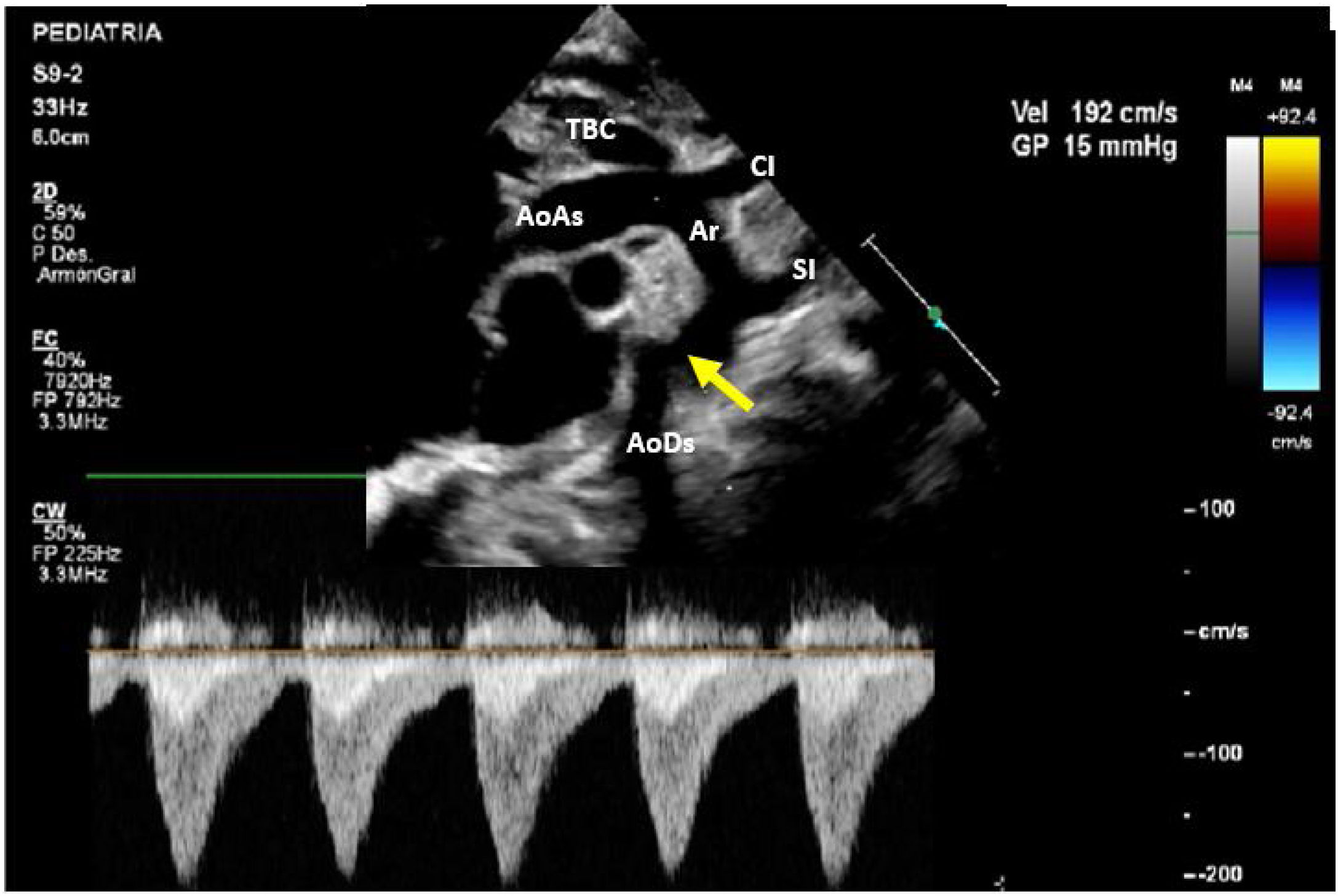
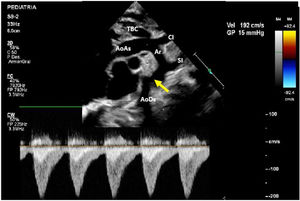
A los 8 días de vida el paciente presenta deterioro hemodinámico con bajo gasto, tras iniciar soporte inotrópico con milrinona (1 μg/kg/min) se realiza un nuevo ecocardiograma en el cual se evidencia un arco aórtico ligeramente elongado con los siguientes diámetros: 6mm en la aorta ascendente, 4mm a nivel del cayado y 3mm en el istmo con un gradiente de 15mmHg con extensión diastólica y pulsatilidad disminuida en la aorta abdominal (fig. 2). Ante la progresión de la CoA y el deterioro clínico del paciente, se decidió tratamiento quirúrgico con el diagnóstico de CoA aislada.
Muestra la ecocardiografía a los 8 días de nacimiento con progresión del gradiente a nivel de la coartación; la flecha señala la coartación de aorta.
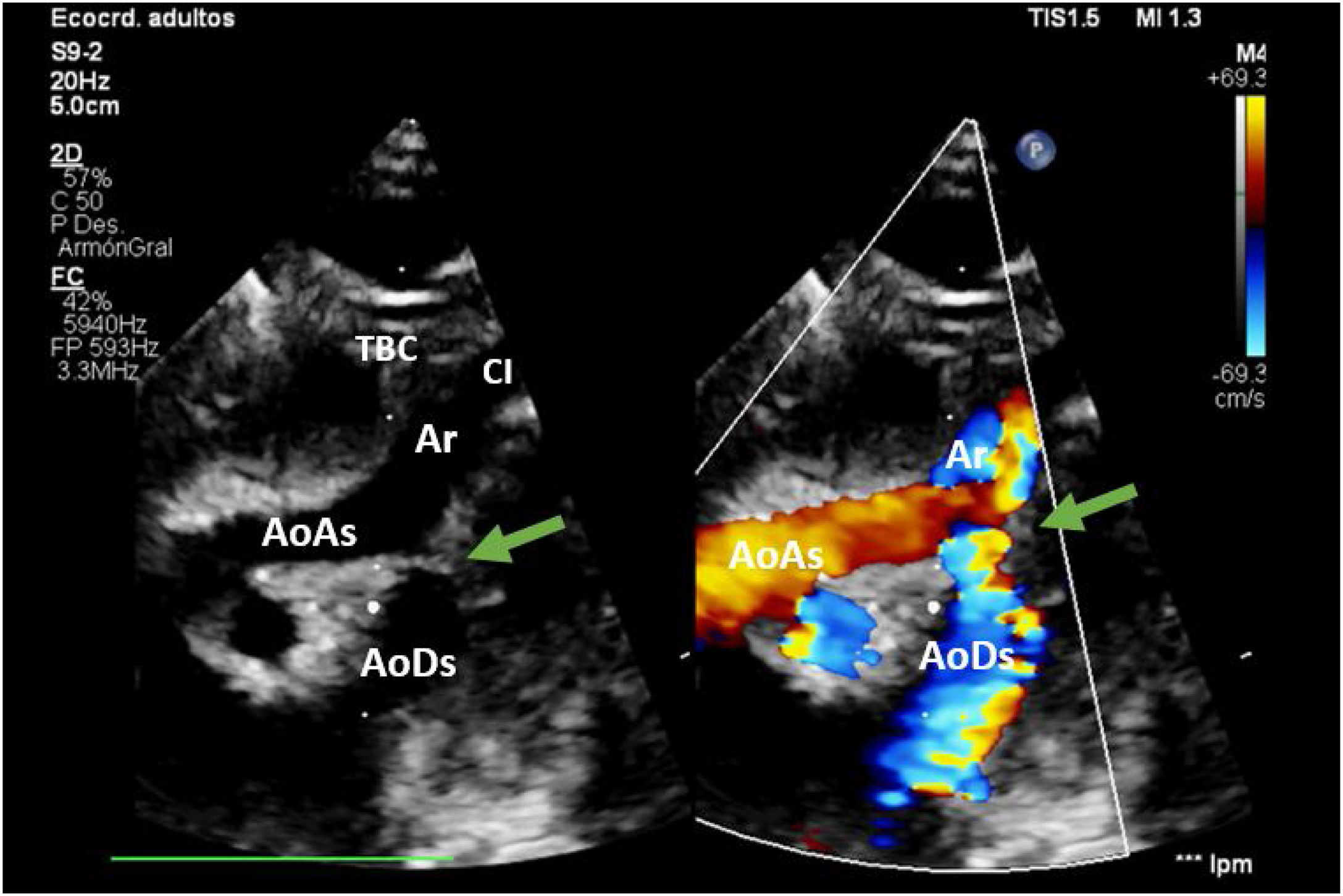
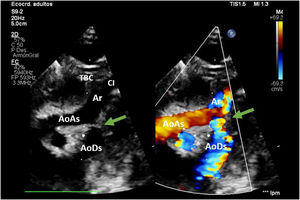
AoAs: aorta ascendente; AoDs: aorta descendente; Ar: arco aórtico; CI: arteria carótida izquierda; SI: arteria subclavia izquierda; TBC: tronco braquiocefálico.
En decúbito lateral izquierdo, a través de toracotomía posterolateral izquierda, se realizó una disección por planos hasta evidenciar las estructuras vasculares. Se evidenció una CoA yuxtaductal de 3mm de diámetro con un arco distal hipoplásico y alargado, con una distancia de 2cm entre las arterias carótida izquierda y subclavia izquierda.
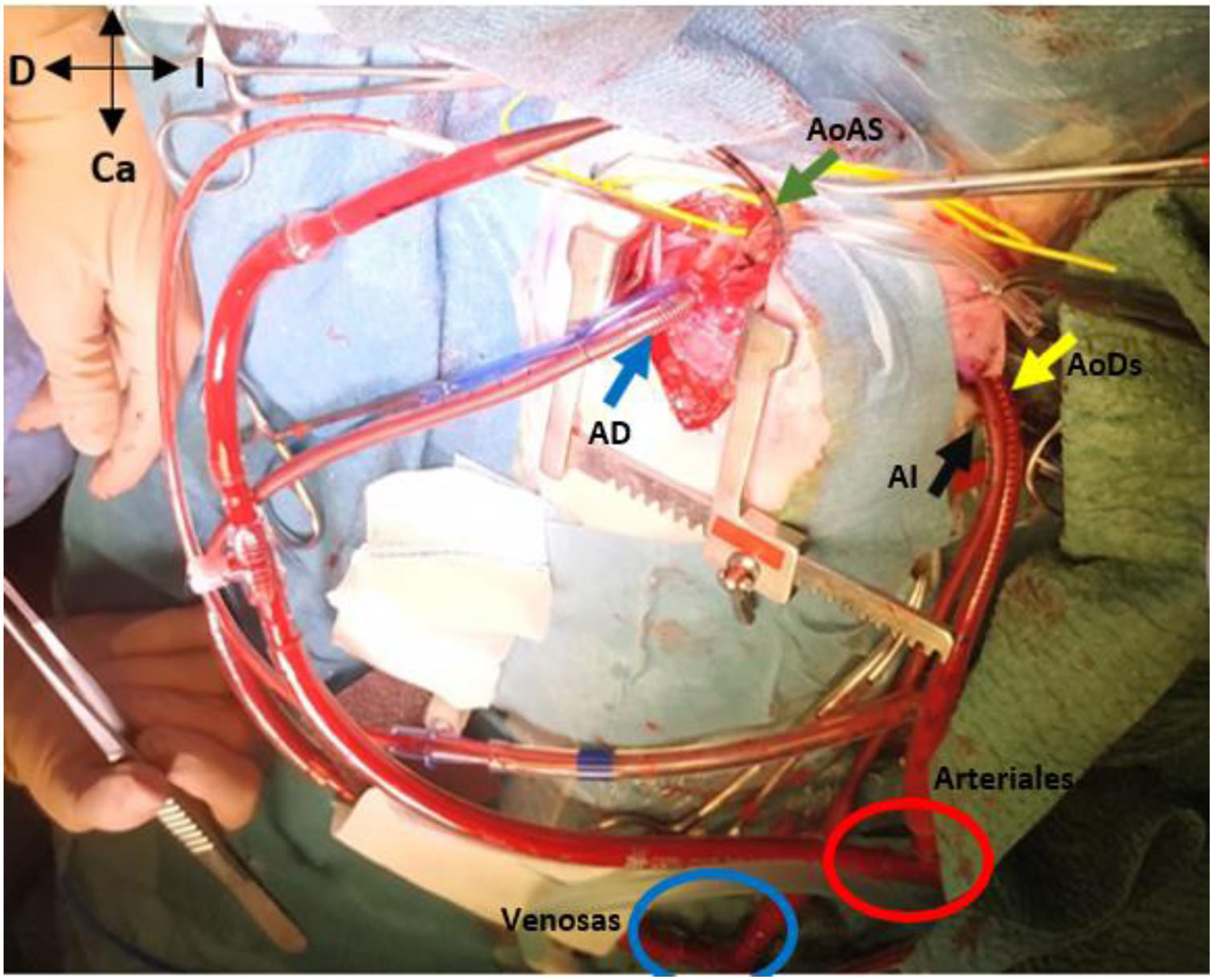
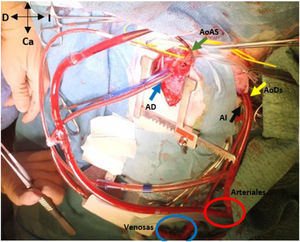
En hipotermia a 33°C se realizó coartectomía con anastomosis término-terminal ampliada; al despinzamiento de la aorta persistía un gradiente de 15mmHg, por lo que se decidió una ampliación del arco distal mediante técnica de Waldhausen invertido, con uso de la arteria subclavia izquierda. No se pudieron completar las anastomosis por la friabilidad de los tejidos, con un tiempo de pinzamiento aórtico acumulado de 68 min (18 min y 50 min en cada procedimiento indicado. respectivamente); se decidió realizar un by-pass parcial izquierdo con la canulación de la aorta torácica descendente (cánula arterial pediátrica A900-98 de 8 Fr, Sorin Group Italia SRL, Mirandola, Italia) y a través del pericardio con un abordaje retro frénico se canuló la aurícula izquierda (cánula DLP maleable 12 Fr, Medtronic, Minneapolis, EE. UU). Una vez asegurada la perfusión tisular total tanto de los troncos supraaórticos como de los órganos dependientes de la aorta descendente, se decidió cambiar de estrategia quirúrgica. Manteniendo el by-pass parcial izquierdo (tiempo de CEC 40 min), se posicionó al paciente en decúbito supino y mediante esternotomía media se procedió a la canulación de aorta ascendente (cánula BioMedicus 10 Fr, Medtronic, Minneapolis, EE. UU.) y aurícula derecha (cánula DLP maleable 12 Fr, Medtronic). Mediante una «Y», el retorno arterial de la CEC perfunde la aorta ascendente (esternotomía) y la aorta descendente (toracotomía izquierda), la cánula de la aurícula izquierda pasa a convertirse en un «vent» (aspirador de cavidades) (fig. 3). Realizamos a continuación un avance de arco aórtico. Se liberó la aorta descendente torácica ampliamente para evitar tensión en las suturas. Se realizó una incisión longitudinal en la aorta ascendente en la proximidad del arco aórtico. La aorta descendente se anastomosó en el arco aórtico proximal. El procedimiento se realizó con parada cardiocirculatoria (36 min) en hipotermia profunda (18°C), con un tiempo acumulado de CEC de 280 min, logrando una reparación completa sin presencia de gradientes residuales (hallazgo que fue corroborado mediante la ecocardiografía postoperatoria de control (fig. 4). Al alta no presentó lesiones neurológicas ni abdominales.
Muestra el abordaje de la esternotomía media (AoAS muestra la cánula de la aorta ascendente; AD la cánula de la aurícula derecha) y la toracotomía postero-lateral izquierda (AoDs la cánula de la aorta descendente; AI la cánula de la aurícula izquierda). Nótese las conexiones en «Y» de las cánulas arteriales (aorta ascendente y descendente) y de las cánulas venosas (aurícula derecha e izquierda).
Ca: caudal; Cr: craneal; D: derecha del paciente; I: izquierda del paciente.
La CoA primaria en recién nacidos, lactantes, niños y adultos jóvenes se puede reparar actualmente con una morbimortalidad inferior al 1-2%. La paraplejía inducida por la isquemia medular durante el pinzamiento aórtico sigue siendo la complicación posoperatoria más temida6. Sin embargo, los niños pequeños y neonatos con CoA usualmente tienen desarrollado un buen sistema de circulación colateral que actúa como un mecanismo de protección durante la cirugía. Aunque la incidencia de daño medular es baja (0,3-1,5%), se han reportado casos de paraplejía en niños menores de un año7.
Los factores de riesgo que pueden influir en el desarrollo de la isquemia medular son:
- 1.
Edad superior a un año, ya que en este grupo etario la circulación colateral puede ser mínima o ausente, por lo que es recomendable ampliar las pruebas prequirúrgicas como angiotomografía o resonancia magnética nuclear para plantear la estrategia quirúrgica más adecuada en cada caso.
- 2.
Tiempos largos de pinzamiento aórtico. Aunque no se sabe con certeza un tiempo exacto de seguridad, se cree que tiempos de pinzamiento superiores a 30 min pueden ser un factor de riesgo independiente. Hay reportes en adolescentes con tiempos de tan solo 15 min puede provocar daños isquémicos irreversibles8,9.
- 3.
Anatomía compleja, como la asociación de hipoplasia del arco distal o arteria subclavia derecha aberrante, está directamente relacionado con tiempos de pinzamiento más prolongados por la complejidad añadida de la cirugía, así como el riesgo de lesiones residuales que obliguen a nuevos pinzamientos durante el acto quirúrgico.
Se han propuesto algunos procedimientos para evitar la isquemia de los órganos distales a la aorta descendente y especialmente a la médula espinal. Diversos grados de hipotermia regional y global siguen siendo un pilar importante de la protección de órganos durante la cirugía aórtica. La hipotermia sistémica leve o moderada se logra fácilmente mediante enfriamiento pasivo o mediante el uso de dispositivos de enfriamiento que permite reducir la tasa metabólica basal de consumo de oxígeno. El by-pass parcial izquierdo entre aurícula izquierda (o arteria pulmonar) y aorta descendente tiene la finalidad de mantener una perfusión tisular total7,8 incluyendo la perfusión de la médula espinal a través de la arteria de Adamkiewicz que, aunque su origen es variable, nace casi en un 89% de los casos a nivel de T8-L1, sitio que queda distal a la zona de pinzamiento10. El by-pass parcial del corazón izquierdo para proteger la médula espinal en pacientes tratados mediante operaciones en la aorta torácica fue descrito por primera vez en 1957 por Cooley y Gerbode que, además de la perfusión total, informaron beneficios adicionales como la descompresión del ventrículo izquierdo y minimizar la hipertensión arterial refleja proximal7. De forma electiva, hemos utilizado el by-pass izquierdo en niños de un año con CoA8, así como en neonatos con isquemia mesentérica (datos no publicados).
En nuestro caso, se decidió el abordaje de la coartectomía aislada por toracotomía lateral izquierda con ayuda de hipotermia moderada y sin necesidad de by-pass parcial izquierdo por tratarse de un neonato en el cual se tenía previsto un tiempo de pinzamiento corto. Sin embargo, la hipoplasia del arco distal fue limitante y, aunque se intentó una ampliación de la zona con tejido de la arteria subclavia izquierda, los tejidos friables impidieron la anastomosis. Para evitar la prolongación de la isquemia, se empleó un by-pass parcial izquierdo desde la orejuela de la aurícula izquierda (se evitó la manipulación de las arterias pulmonares para evitar futuros estrechamientos de la zona de canulación) a la aorta descendente. Una vez establecido el by-pass, se pudo realizar un cambio completo de estrategia quirúrgica para realizar el avance aórtico por línea media.
ConclusionesEl by-pass parcial izquierdo es una técnica que se utiliza en niños mayores y adultos. En nuestro caso, nos permitió rescatar un neonato que técnicamente resultaba difícil de reparar a través del abordaje primario. El procedimiento es una técnica segura, reproducible y que no entraña un riesgo añadido al paciente, por lo que puede ser utilizada de forma programada en casos seleccionados o como una medida de rescate en casos complejos. La CEC «combinada» a través de esternotomía y toracotomía izquierda garantizó el retorno arterial en nuestro paciente.
Consentimiento informadoPara la publicación de este caso clínico se obtuvo el consentimiento informado de los progenitores del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.