El shunt circular es una situación en la que existe un circuito en el cual la sangre llega a la misma cámara cardíaca sin pasar por el lecho capilar pulmonar ni sistémico.
Este shunt es posible en pacientes que asocien estenosis pulmonar, insuficiencia tricuspídea, comunicación interventricular y foramen oval permeable o comunicación interauricular. También se describió en pacientes con atresia pulmonar con septo íntegro que presentan insuficiencia pulmonar tras apertura quirúrgica o percutánea de la válvula pulmonar, insuficiencia tricuspídea y presencia de un ductus arterioso persistente o una fístula sistémico pulmonar y en pacientes con anomalía de Ebstein con insuficiencia pulmonar moderada-severa.
Se presentan 3 casos clínicos de pacientes con cardiopatía congénita que desarrollaron durante su evolución un shunt circular, 2 pacientes presentaban una atresia pulmonar con septo íntegro, presentando la clínica correspondiente tras la apertura de la válvula pulmonar, y el restante una anomalía de Ebstein con insuficiencia pulmonar que presentó el shunt circular al nacimiento.
Como conclusión podemos decir que el shunt circular es una entidad poco descrita en la bibliografía, pero con una gravedad y mortalidad muy importante. La disfunción del ventrículo derecho, que genera menor flujo anterógrado a través de la arteria pulmonar, parece ser uno de los factores más importantes para su desarrollo.
Debemos tener conciencia de esta situación y acceso a un equipo quirúrgico de urgencia capaz de interrumpir este circuito mediante el cierre/banding del ductus arterioso o fístula, o mediante una cirugía paliativa de la cardiopatía de base.
The circular shunt is a situation in which there is a circuit where the blood reaches the same cardiac chamber without passing through the pulmonary or systemic capillary bed.
This shunt is possible in patients associated with pulmonary stenosis (PS), tricuspid regurgitation (TR), ventricular septal defect (VSD), and patent foramen ovale (PFO) or atrial septal defect (ASD). It has also been described in patients with pulmonary atresia with intact septum (PAIS) who present with pulmonary insufficiency (PI) after surgical or percutaneous opening of the pulmonary valve (PV), TI and presence of a ductus (PDA) or a systemic pulmonary fistula (PSF) and in patients with Ebstein's anomaly with moderate-severe PI.
We present three clinical cases of patients with congenital heart disease who developed a circular shunt during their evolution, two patients presented an PAIS, presenting the corresponding symptoms after opening the PV, and the remaining one an Ebstein's anomaly with pulmonary insufficiency that presented the shunt circular at birth.
In conclusion we can say that the circular shunt is an entity little described in the bibliography, but with a very important severity and mortality. Right ventricular (RV) dysfunction, which generates less antegrade flow through the pulmonary artery, appears to be one of the most important factors for its development.
We must be aware of this situation and have access to an emergency surgical team capable of interrupting this surgery by closing/banding the ductus arteriosus or fistula, or by means of palliative surgery for underlying heart disease.
El término shunt circular fue primero acuñado por Shone et al. en 1962, describiendo una fisiopatología en la que existía un circuito en el que la sangre llega a la misma cámara cardíaca sin pasar por el lecho capilar pulmonar ni sistémico1.
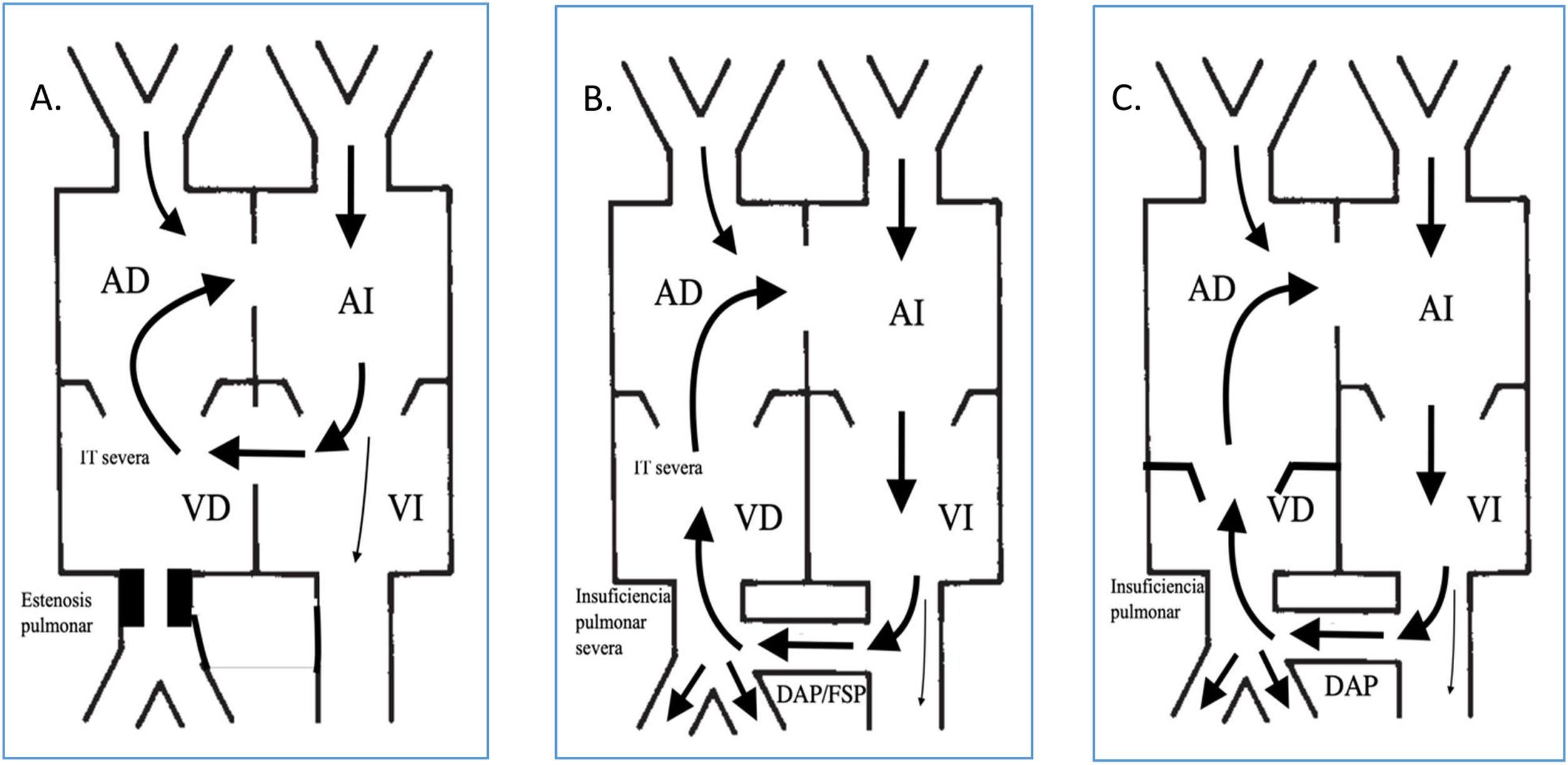
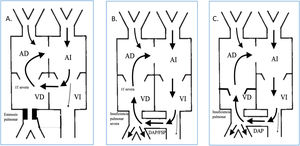
Este shunt es posible en pacientes que asocien estenosis pulmonar, insuficiencia tricuspídea (IT), comunicación interventricular y foramen oval permeable (FOP) o comunicación interauricular (CIA), también se describió en pacientes con atresia pulmonar con septo íntegro (APSI) que presentan insuficiencia pulmonar (IP) tras apertura quirúrgica o percutánea de la válvula pulmonar (VP), IT y presencia de un ductus arterioso persistente (DAP) o una fístula sistémico pulmonar (FSP) y en pacientes con anomalía de Ebstein con IP moderada-severa (fig. 1).
Representación de las principales cardiopatías congénitas que pueden provocar la presencia de un shunt circular. A. CIV+EP+IT+FOP. B. AP+SI e IP tras apertura de VP en presencia de DAP/FSP. C. Anomalía de Ebstein con IP moderada-severa.
AD: aurícula derecha; AI: aurícula izquierda; DAP: ductus arterioso persistente; FOP: foramen oval permeable; IT: insuficiencia tricuspídea; VD: ventrículo derecho; VI: ventrículo izquierdo.
Esta entidad está poco descrita en la literatura, por lo que hemos encontrado muy pocos artículos o revisiones que traten exclusivamente sobre la misma, sino que se menciona en en ellos de manera secundaria y su contenido principal es el de la afección que puede producirlo, sobre todo la APSI.
No obstante, y pese a esta escasa cantidad de artículos referentes a esta entidad, se conoce ampliamente en las unidades de cirugía cardiovascular y cardiología infantil, con una morbilidad y una mortalidad nada despreciables.
Existe la posibilidad de desarrollar un shunt circular en pacientes que presentan un Glenn y fisiología de ventrículo y medio, en los que existe una apertura de la vena cava superior izquierda que drena en la AD a través del seno coronario, pero en este caso la clínica del paciente será diferente, predominando un cuadro de hipoxemia y cianosis, con menor compromiso hemodinámico2.
Factores de riesgoEn el desarrollo del shunt circular intervienen diferentes variables, principalmente anatómicas, que permiten la existencia de esta circulación intracardíaca, pero parece ser que una disfunción ventricular derecha puede ser una de las variables más determinantes3. En el caso de la APSI una opción para intentar mejorar la situación del VD y evitar su disfunción sería intentar retrasar la apertura de la VP para disminuir las resistencias vasculares pulmonares, y además intentar cerrar el DAP o no generar una FSP que pueda dar lugar al comienzo del circuito intracardíaco que provocaría la clínica de shunt circular.
DiagnósticoEl diagnóstico de esta enfermedad se basa tanto en la clínica del paciente como en la ecocardiografía. Su sospecha clínica es crucial para poder obtener el diagnóstico. Estos pacientes presentarán una situación de bajo gasto con hipoperfusión e hipotensión con aumento del ácido láctico, que puede llevar a un fallo multiorgánico además de una hipoxemia y desaturación.
La ecocardiografía puede dar información muy útil en estos pacientes, en un primer lugar por su capacidad para determinar la presencia de las anomalías anatómicas congénitas cardíacas necesarias para presentar el shunt circular, puede dar información sobre la dirección de los distintos cortocircuitos intracardíacos y si son compatibles con la presencia del shunt circular, así como de informarnos de la función del VD, parte muy importante en el desarrollo de esta entidad.
TratamientoEl tratamiento de esta entidad se basa en el cierre del circuito, sin importar el nivel al que se produce dicho cierre, por lo que el tratamiento definitivo del mismo será quirúrgico3,4, aunque el apoyo vasoactivo y mediante ventilación mecánica invasiva para mejorar la función ventricular y la oxigenación forman parte del tratamiento médico de esta entidad. En el caso de la APSI, en la que se realiza una apertura de la VP y además se deja un DAP o se realiza una FSP para aumentar el flujo pulmonar, el tratamiento consistiría en el banding o cierre del DAP o la FSP3,5. En el caso de producirse en el seno de una anomalía de Ebstein el tratamiento del shunt será el de la corrección de la cardiopatía de base, en estos casos generalmente se basa en la cirugía paliativa de Starnes, en la cual se realiza una ligadura de la AP, cierre de la válvula tricúspide para disminuir la porción atrializada del VD y creación de una FSP para mantener el flujo pulmonar4.
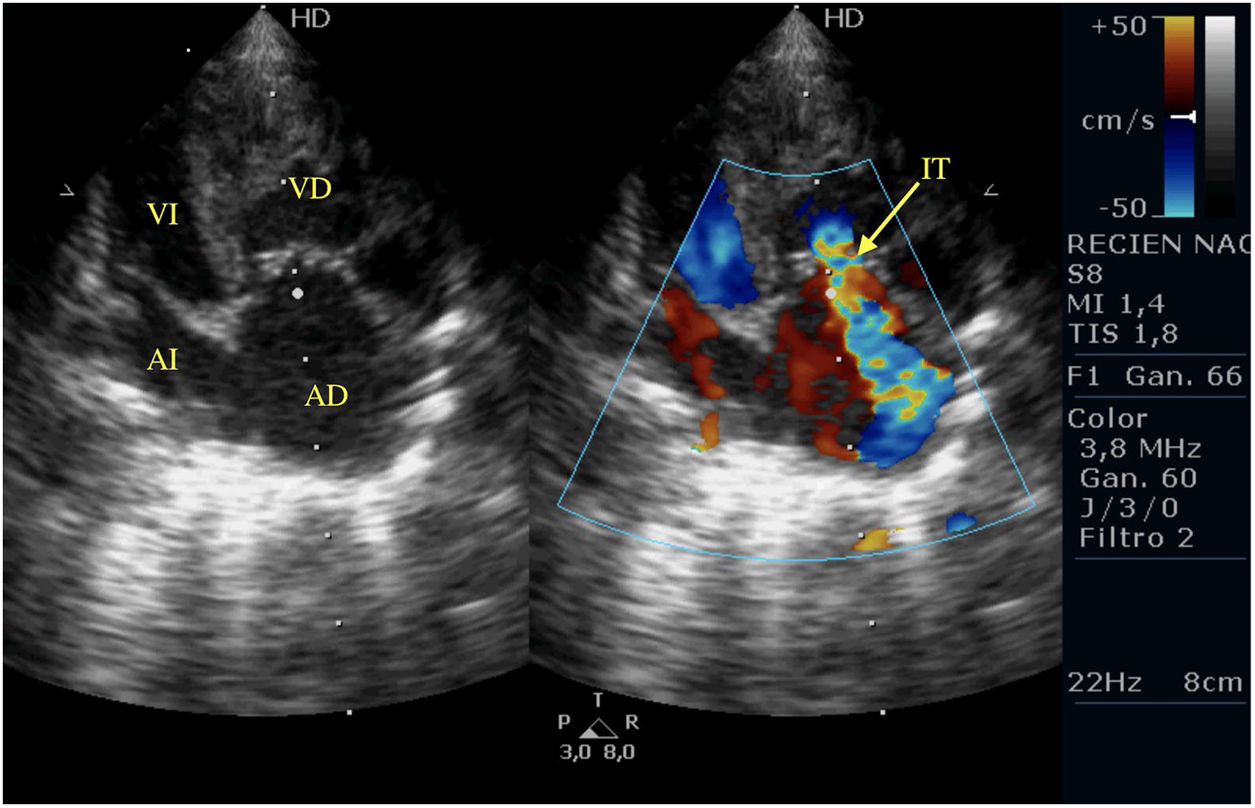
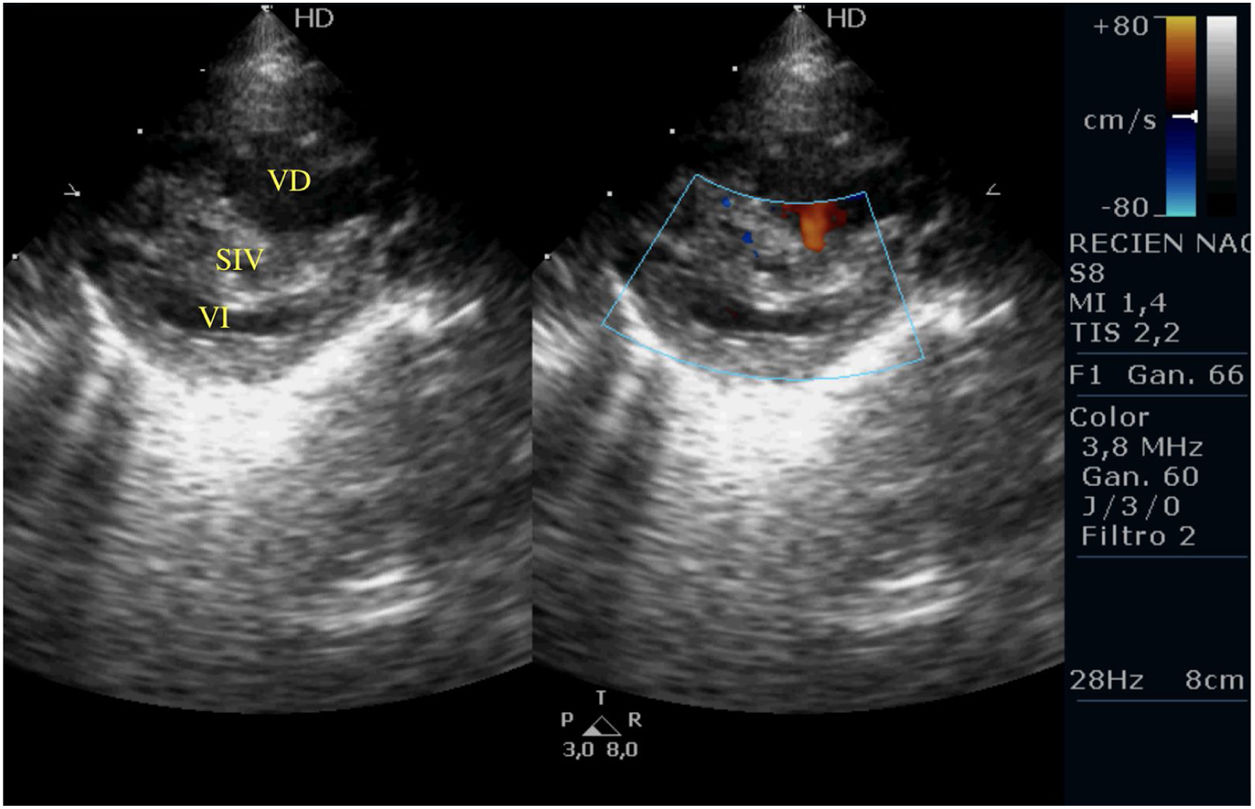
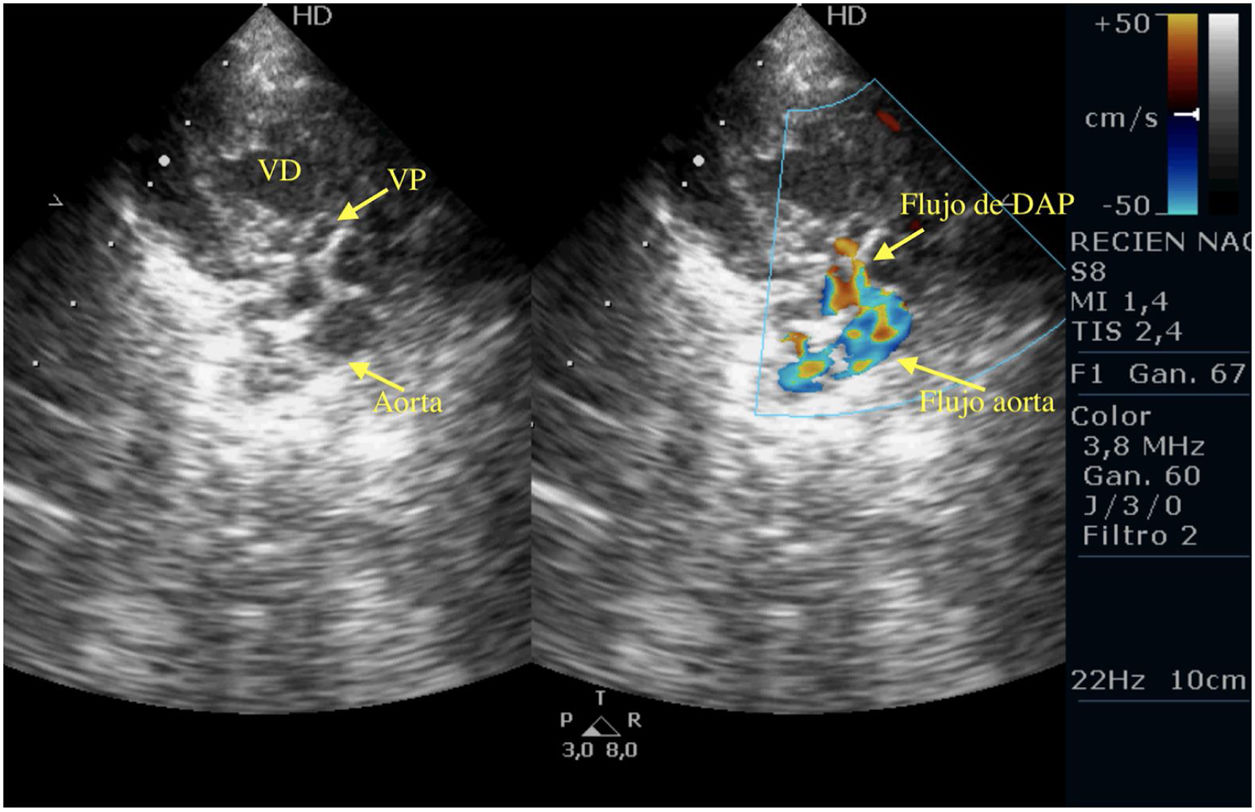
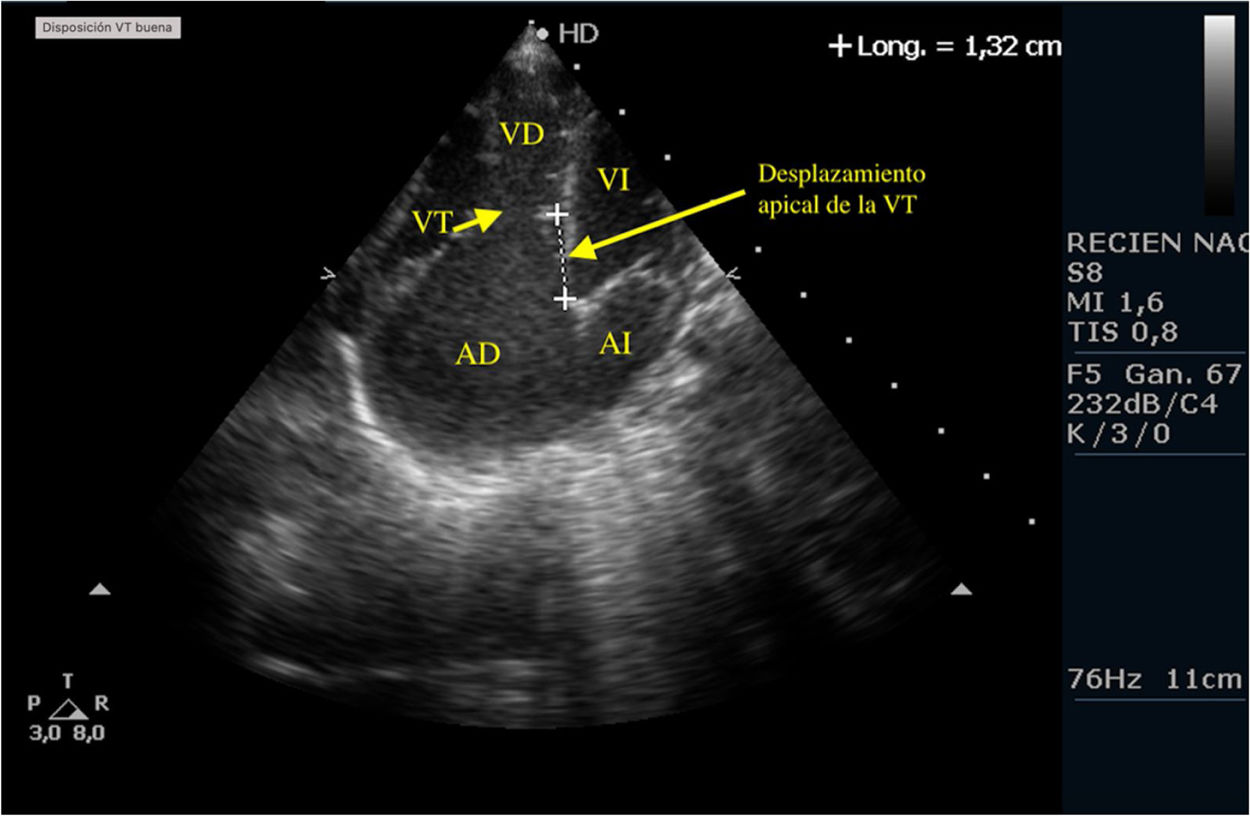
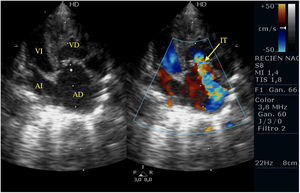
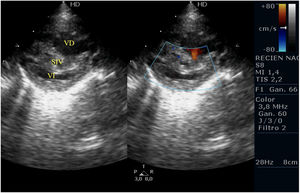
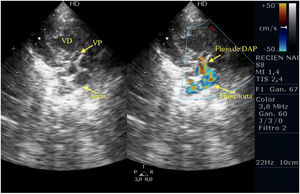
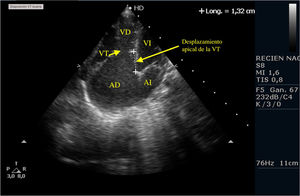
Casos clínicosPrimer caso clínicoSe trata de un recién nacido varón a término (38+4SEG), con diagnóstico prenatal de estenosis pulmonar leve-moderada que ingresa en la unidad de cuidados intensivos por distrés respiratorio e hipoxemia; en las primeras horas de ingreso se diagnostica de APSI (figs. 2-4).
Ante la situación de desaturación progresiva, pese a prostaglandinas para mantener el DAP, se decide intervención urgente para apertura de la válvula pulmonar, implante de una FSP para asegurar el flujo pulmonar y ampliación de la CIA.
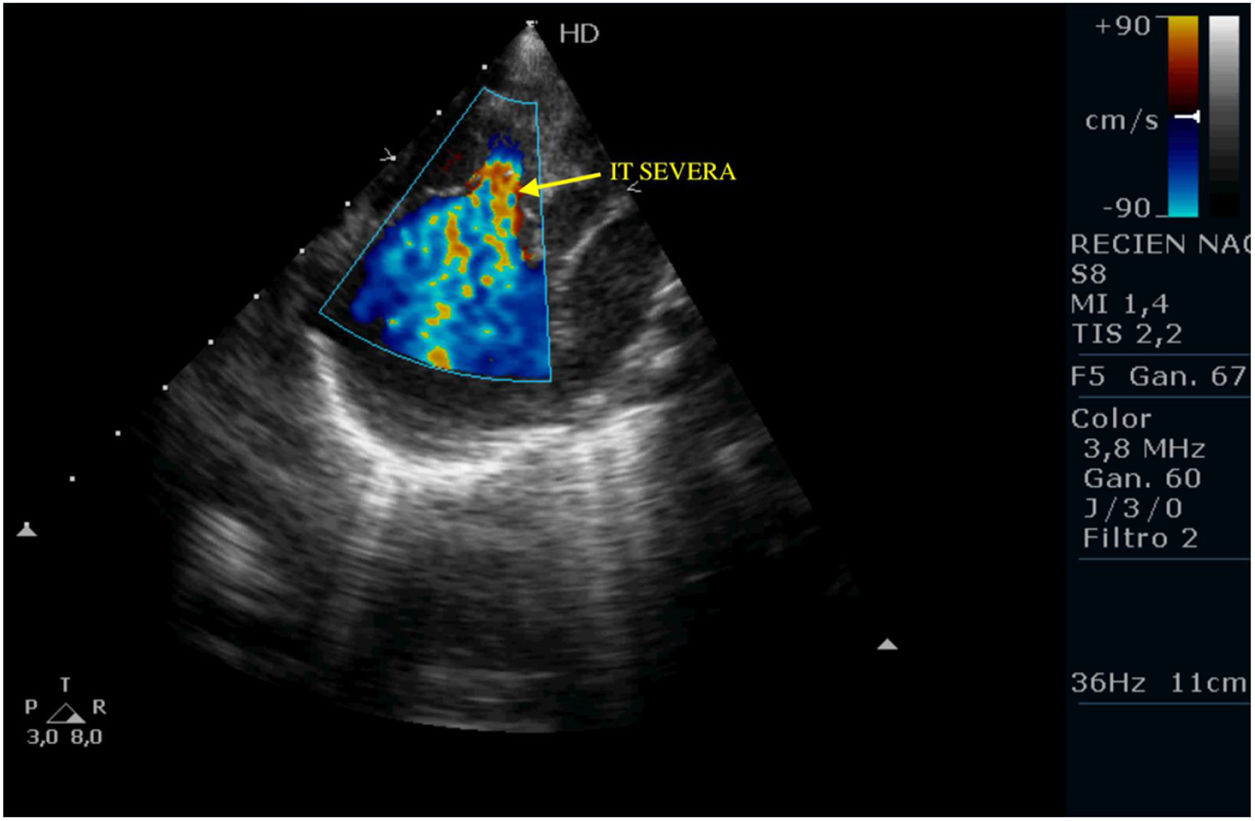
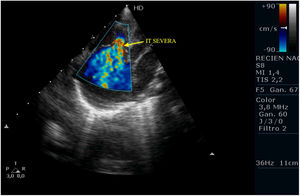
Tras la intervención y a su llegada a la unidad de cuidados intensivos el paciente comienza con clínica de bajo gasto, hipotensión, hipoxemia y lactacidemia, que no es posible revertir mediante fármacos vasoactivos y modificación de la ventilación mecánica, mostrando a nivel ecocardiográfico una IT severa, una IP moderada-severa, un FOP con shunt derecha izquierda y una disfunción del VD con un TAPSE de 2mm, pese a las medidas de manejo médico no se consigue la reversión de esta situación y se plantea implantar ECMO, pero se realiza ecografía cerebral donde se aprecian lesiones isquémicas cerebrales importantes, por lo que se desestima implante de ECMO y se limita el esfuerzo terapéutico.
Segundo caso clínicoRecién nacido varón a término (39+3SEG), con embarazo que cursa sin incidencias y con ecografías fetales descritas como normales. Ingresa en la unidad de cuidados intensivos neonatales por presentar cuadro de distrés respiratorio precoz acompañado con cuadro de hipoxemia refractaria a oxigenoterapia, por lo que se realiza ecocardiografía ante la sospecha de cardiopatía congénita y se visualiza una APSI, además de una displasia de la válvula tricúspide con IT moderada. Ante la situación del paciente se decide valvuloplastia pulmonar percutánea, y se mantiene el DAP mediante prostaglandinas. A los 6 días de vida, y dada la incapacidad para retirar el tratamiento con prostaglandinas, se decide la implantación de una FSP.
A su llegada a la unidad de cuidados intensivos, tras la realización de la FSP, se constata una situación de bajo gasto, con hipotensión, aumento del ácido láctico y mala perfusión acompañado de hipoxemia, apreciándose a nivel ecocardiográfico una IT y una IP severa, con una FSP permeable, una CIA que presentaba un shunt derecha izquierda y una función del VD aceptable (TAPSE 5mm). En este caso la adecuación del tratamiento médico, con aumento de la dosis de fármacos vasoactivos y el apoyo de la VMI permiten una mejoría progresiva del paciente, sin necesidad en ese momento de cirugía para cerrar el circuito.
El paciente tiene 11 meses de edad y se sometió a una cirugía de anastomosis cavopulmonar, manteniendo flujo pulsátil desde el VD a la arteria pulmonar (AP), consiguiendo una fisiología de ventrículo y medio, siguiendo revisiones en nuestras consultas con buena evolución.
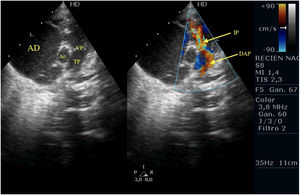
Tercer caso clínicoSe trata de un paciente recién nacido varón pretérmino (35SEG) con diagnóstico prenatal de anomalía de Ebstein (figs. 5-7). A su nacimiento se traslada a la unidad de cuidados intensivos y se comienza perfusión con prostaglandinas para mantener el DAP. Durante sus primeras horas de ingreso se confirma mediante ecocardiografía el diagnóstico prenatal de anomalía de Ebstein severo, con VD pequeño que se acompaña de IT severa e IP moderada, FOP que presenta shunt derecha izquierda y buena función del VD. A pesar de lo cual, durante sus primeras horas de vida, comienza a presentar una clínica de hipotensión, acidosis láctica y mala perfusión que se acompañaba de hipoxemia, sin cambios a nivel ecocardiográfico.
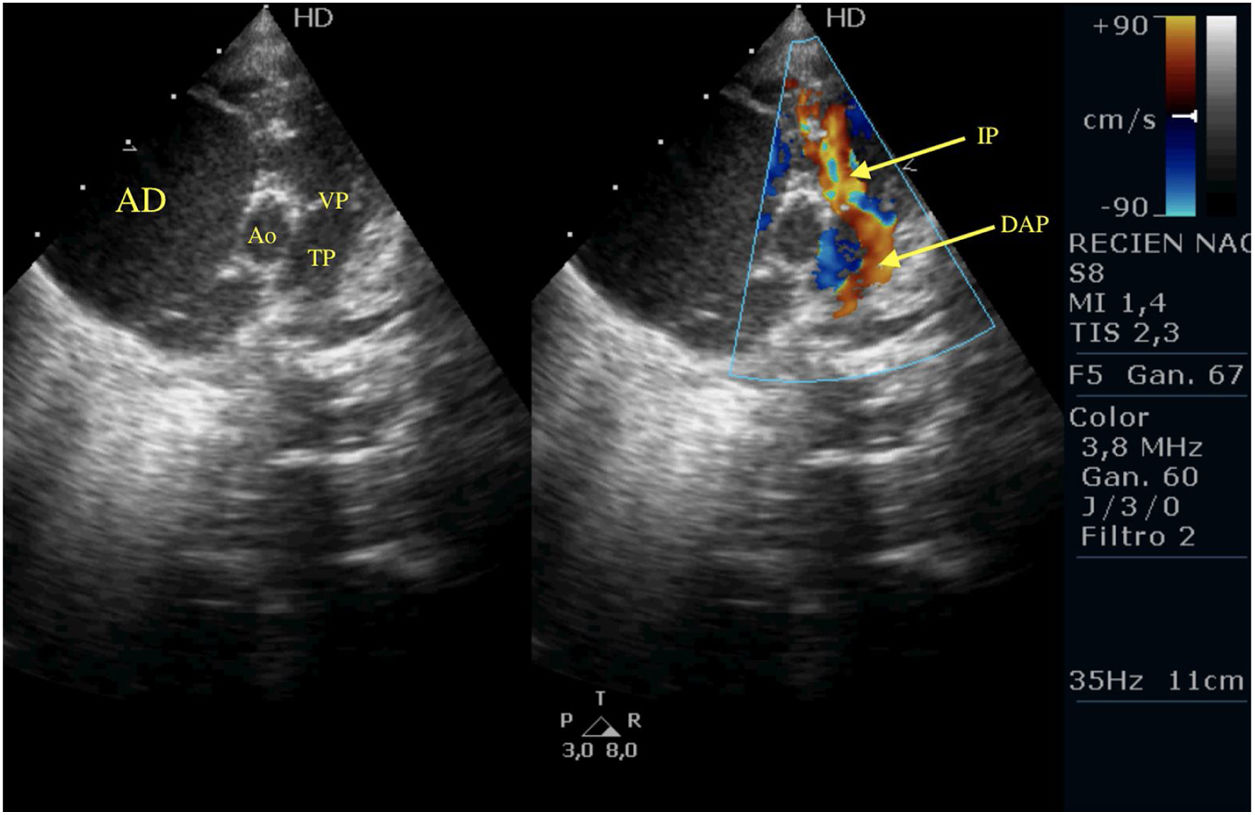
Plano paraesternal; eje corto de la anomalía de Ebstein. Se observa el DAP llegando al tronco pulmonar y la IP moderada. Se puede apreciar la AD dilatada.
AD: aurícula derecha; Ao: aorta; DAP: ductus arterioso persistente; IP: insuficiencia pulmonar; TP: tronco pulmonar; VP: válvula pulmonar.
Se intentan maniobras médicas para el tratamiento del shunt circular de este paciente sin ser exitosas, por lo que se realiza el 2.° día de vida la cirugía de Starnes, tratamiento paliativo de esta anomalía cardíaca y que produciría el cese del shunt circular, con buena evolución desde el punto de vista hemodinámico y respiratorio, pero a nivel neurológico en la ecografía cerebral de control se apreciaron focos isquémicos y edema cerebral. Durante su evolución presentó cuadro de hipotensión que presenta refractariedad al tratamiento con volumen e inotrópicos, descartándose la implantación de ECMO debido a las lesiones cerebrales descritas, falleciendo finalmente.
ConclusiónEl shunt circular es una entidad poco descrita en la bibliografía, pero con una gravedad y mortalidad muy importantes. La disfunción del ventrículo derecho, que genera menor flujo anterógrado a través de la arteria pulmonar, parece ser uno de los factores más importantes para su desarrollo. En el caso de la APSI la apertura tardía de la VP, así como la implantación de una FSP en un segundo tiempo, puede disminuir la probabilidad de presentar esta enfermedad.
Debemos tener conciencia de esta enfermedad y acceso a un equipo quirúrgico de urgencia capaz de interrumpir este circuito mediante el cierre/banding del ductus arterioso o fístula, o de realizar una cirugía correctora o paliativa de la cardiopatía de base que pueda estar generando el shunt circular.
Consideraciones éticasPara la exposición de estos casos clínicos se obtuvo el consentimiento informado de los responsables civiles de los pacientes comentados; además se obtuvo la aprobación por parte del comité ético de nuestro centro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.