La cirugía del arco aórtico en neonatos ha pasado de la hipotermia profunda con paro circulatorio a la perfusión cerebral en 25°C. Un paso más supone la perfusión cerebral y miocárdica simultánea, facilitando la cirugía a corazón latiendo.
MétodosUna cánula en «Y» desde la línea arterial proporciona sangre oxigenada al cerebro y al corazón. El arco es reparado latiendo. A continuación se administra cardioplejía por raíz para la corrección intracardíaca. Sesenta y ocho pacientes son distribuidos en 3 grupos: a) Norwood (9 neonatos); b) arco aórtico (20 niños); y c) arco más afectación intracardíaca (39 pacientes). Cardiopatía asociada en el grupo c): comunicación interventricular (15), switch arterial (9), comunicación interauricular (6), cor triatriatum (3), comisurotomía aórtica (2), comprehensive repair (2), ostium primum (1) y Yasui (1). Catorce de los últimos pacientes recibieron una canulación adicional en la aorta descendente, alcanzando una perfusión corporal total.
ResultadosEl tiempo medio de circulación extracorpórea fue de 155minutos (63-353). La perfusión cerebral-miocárdica duró 36 minutos (18-60) y la isquemia miocárdica alcanzó 34 minutos (0-160), siendo de cero en el grupo «b». El seguimiento fue completo con una media de 52 meses (2-78). Cinco pacientes fallecieron y 3 precisaron angioplastia por recoartación.
ConclusionesLa perfusión cerebral-miocárdica selectiva es factible y fácil de reconvertir a protección cardiopléjica convencional. Notablemente se reduce la isquemia miocárdica, siendo nula en casos de cirugía aislada del arco. Mediante la perfusión corporal total puede reducirse la morbilidad en cirugía neonatal del arco.
Aortic arch repair has shifted from deep hypothermia plus circulatory arrest to cerebral perfusion at tepid temperatures. A step forward is simultaneous brain-coronary perfusion, allowing beating-heart arch surgery.
MethodsA “Y” cannula from the arterial line delivers oxigenated blood to brain and heart. The arch is repaired on a beating heart at 25°C. Intracardiac repair is performed after running cardioplegia through the root line. 68 patients are classified into three groups. A: Norwood (9 neonates); B: aortic arch (20 children); C: aortic arch plus intracardiac repair (39 patients). Associated anomalies in group C: ventricular septal defect (15), arterial switch (9), atrial septal defect (6), cor triatriatum (3), aortic commissurotomy (2), comprehensive repair (2), ostium primum (1), Yasui (1). Fourteen lately patients had their descending aorta additionally cannulated to achieve a total body perfusion strategy.
ResultsMean by-pass time was 155minutes (range 63-353). Mean brain-coronary perfusion was 36minutes (18-60). Mean coronary ischemia was 34minutes (0-160). The heart was not arrested in group B patients. Follow-up was complete for a mean of 52 months (2-78). Five patients died in the postop. Three requiered angioplasty for recoarctation.
ConclusionsSelective brain-coronary perfusion is feasible and easy to switch to conventional cardioplegia delivery. Coronary ischemia can be notably reduced, being even zero minutes in isolated arch surgery. Total body perfusion may reduce morbidity in neonatal arch surgery.
Durante décadas la hipotermia profunda con parada circulatoria ha sido la estrategia más utilizada para la cirugía de arco aórtico1,2. De hecho, sigue vigente en diversos centros y programas neonatales, amparándose en un descenso de las necesidades metabólicas y de oxígeno para la protección cerebral. Sin embargo, periodos prolongados de paro circulatorio empleados en corrección neonatal del arco aórtico se han visto asociados con episodios de convulsiones y coreoatetosis, además de afectación neurológica tardía.
La perfusión cerebral anterógrada (PCA) surgió como coadyuvante de la protección del encéfalo3, facilitando sangre por la línea de retorno arterial y a través del primer tronco supraaórtico. Merced a la circulación colateral (subclavias, intercostales), y con ayuda de cierta hipotermia, se supone garantizado el flujo somático. Varios trabajos han sido publicados comparando ambas estrategias4–6: hipotermia profunda con paro circulatorio frente a PCA, estudiando la perfusión cerebral y daños neurológicos a diferentes temperaturas7. La experiencia acumulada ha permitido estudiar la circulación entre ambos hemisferios cerebrales, garantizando una correcta perfusión mediante la canulación de una sola arteria carótida (y vertebral)8,9.
Un paso más en la estrategia quirúrgica consiste en la perfusión coronaria durante la cirugía del arco aórtico10. De esta forma se pueden acometer reparaciones del arco en hipotermia moderada7 y a corazón latiendo (beating heart), incluso es posible perfundir la aorta descendente a la vez que el cerebro y el corazón, estableciendo un circuito donde solo el arco aórtico queda excluido. Dicha estrategia, bautizada por un grupo alemán11 como total body perfusion (TBP) garantiza la perfusión incluso en hipotermia ligera.
Describimos nuestra serie inicial de cirugía de arco aórtico con perfusión cerebral selectiva e hipotermia moderada (25°C), así como los primeros casos de TBP.
MétodosIncluimos datos de todos los pacientes intervenidos de cirugía de arco aórtico desde enero de 2013 hasta julio de 2020. La mayoría corresponden a cirugía en periodo neonatal, con circulación extracorpórea (CEC) en hipotermia de 25°C y perfusión cerebral (vía arteria innominada) con flujos de 50ml/kg/min.
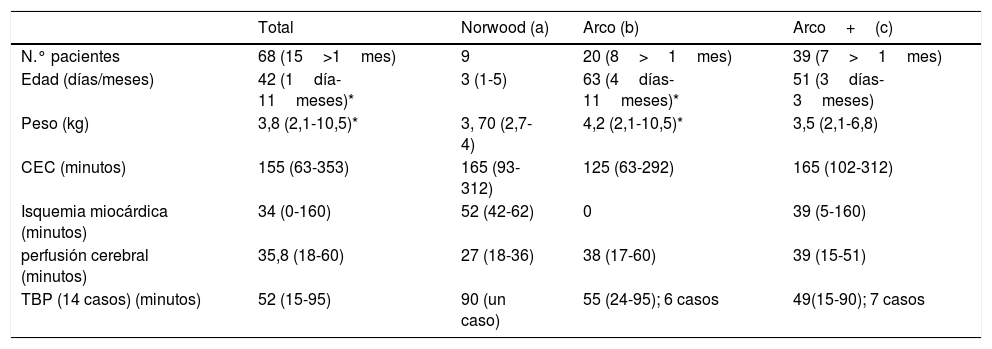
Los datos se reflejan en la tabla 1. Se incluyen 68 pacientes (15 mayores de un mes). La media de edad fue de 42 días (rango: un día-11 meses) y de peso 3,8kg (rango: 2,1-10,5).
Distribución de pacientes
| Total | Norwood (a) | Arco (b) | Arco+(c) | |
|---|---|---|---|---|
| N.° pacientes | 68 (15>1mes) | 9 | 20 (8>1mes) | 39 (7>1mes) |
| Edad (días/meses) | 42 (1día-11meses)* | 3 (1-5) | 63 (4días-11meses)* | 51 (3días-3meses) |
| Peso (kg) | 3,8 (2,1-10,5)* | 3, 70 (2,7-4) | 4,2 (2,1-10,5)* | 3,5 (2,1-6,8) |
| CEC (minutos) | 155 (63-353) | 165 (93-312) | 125 (63-292) | 165 (102-312) |
| Isquemia miocárdica (minutos) | 34 (0-160) | 52 (42-62) | 0 | 39 (5-160) |
| perfusión cerebral (minutos) | 35,8 (18-60) | 27 (18-36) | 38 (17-60) | 39 (15-51) |
| TBP (14 casos) (minutos) | 52 (15-95) | 90 (un caso) | 55 (24-95); 6 casos | 49(15-90); 7 casos |
Datos presentados como media y rango (mínimo/máximo).
Arco: cirugía de arco; Arco+: cirugía de arco más corrección intracardíaca; CEC: circulación extracorpórea; TBP: total body perfussion (perfusión adicional con cánula en aorta descendente)
Distribuimos a los pacientes en 3 grupos:
- a)
Norwood (9 neonatos).
- b)
Cirugía de arco aórtico, aislada (20 pacientes, 8 mayores de un mes).
- c)
Cirugía de arco más corrección intracardíaca (39 niños, 7 mayores de un mes).
La línea de retorno de la CEC se conecta a la arteria innominada (primer tronco supraaórtico) mediante la interposición de un conducto de 3,5mm de diámetro de PTFE (Gore-Tex®, Flagstaff, AZ, EE. UU.). Iniciamos la CEC con un flujo estimado de 3l/min/m2 (175-200ml/kg/min), con estrategia alfa-stat y evitando la vasodilatación cerebral (y consecuente hiperperfusión). Una vez alcanzada la temperatura de 25°C los flujos se ajustan al 30% (40-60ml/kg/min) manteniendo una presión arterial media adecuada a la edad (25-55mmHg). Durante la PCA, los troncos supraaórticos son controlados mediante la aplicación de torniquetes o bull-dogs finos y la aorta descendente es pinzada. La oxigenación regional (cerebral y somática) se monitoriza con INVOS® (Somanetics Corporation, Troy, MI, EE. UU.).
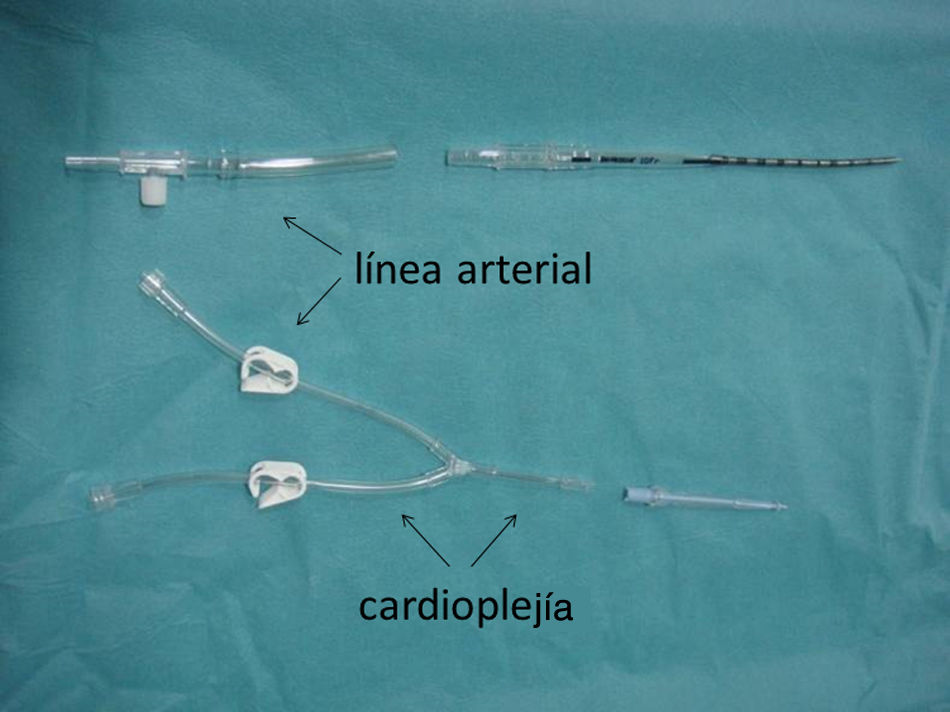
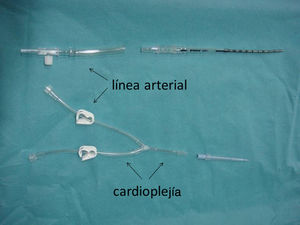
Una línea en «Y» conecta la cánula arterial (conexión luer-lock) con la cánula de raíz aórtica, de manera que a su través pueda administrarse sangre del retorno arterial o cardioplejía alternativamente (fig. 1). De esta forma, y una vez pinzada la aorta ascendente, sin modificar las cánulas, se puede realizar cirugía a corazón latiendo (sangre a través de la cánula en raíz) o corazón parado (cardioplejía por dicha cánula) simplemente modificando las llaves de la línea en «Y».
Para la cirugía de Norwood un clamp es interpuesto entre el primer y segundo tronco supraaórtico, mientras se controlan el 2.° y 3.° vaso. Esto garantiza una perfusión cerebral y miocárdica mientras se realiza la reconstrucción distal del arco. Finalizada esta parte el clamp es recolocado en la base del primer tronco y una oliva de punta blanda se introduce retrógradamente desde el arco hasta la aorta ascendente (asegurada por un torniquete externo) para administrar cardioplejía.
La reconstrucción del arco (coartación más hipoplasia de arco) se realizó mediante resección del segmento coartado más anastomosis ampliada (avance de arco o sliding technique) o, más frecuentemente, con resección y anastomosis ampliada con parche de pericardio autólogo (tratado con glutaraldehído). Excepcionalmente se amplió el arco con pericardio sin resección previa de tejido (en ausencia de ridge ductal). Una vez finalizada la reparación del arco a corazón latiendo se procede a la salida reglada de CEC (grupo b), o se administra cardioplejía para corregir la afectación intracardíaca (grupos a y c).
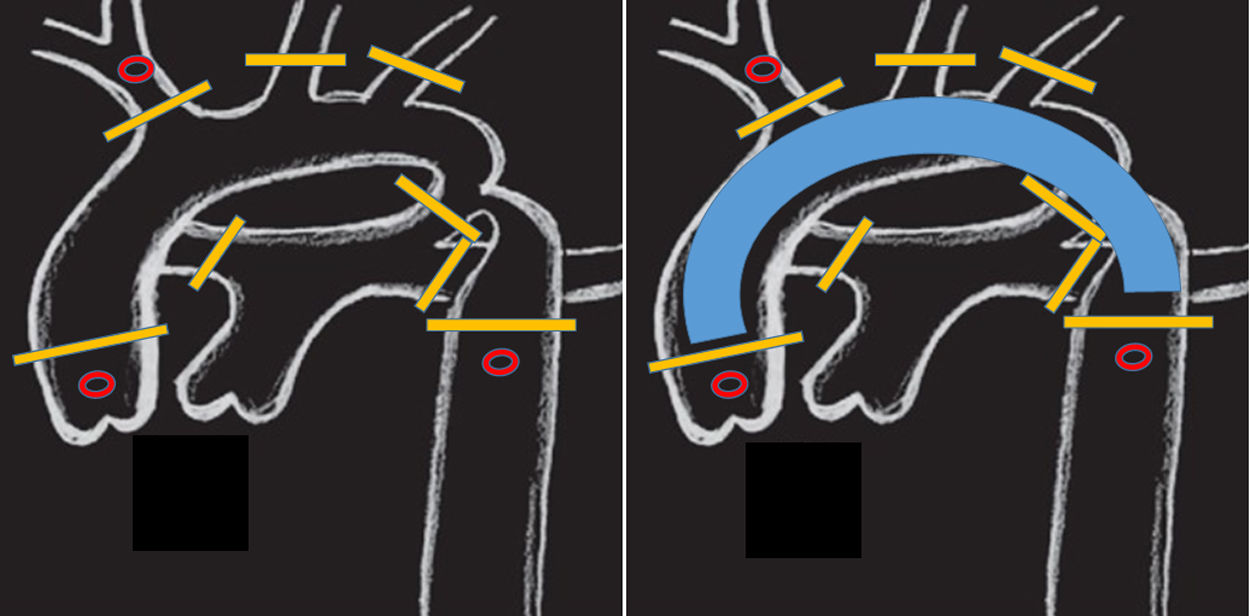
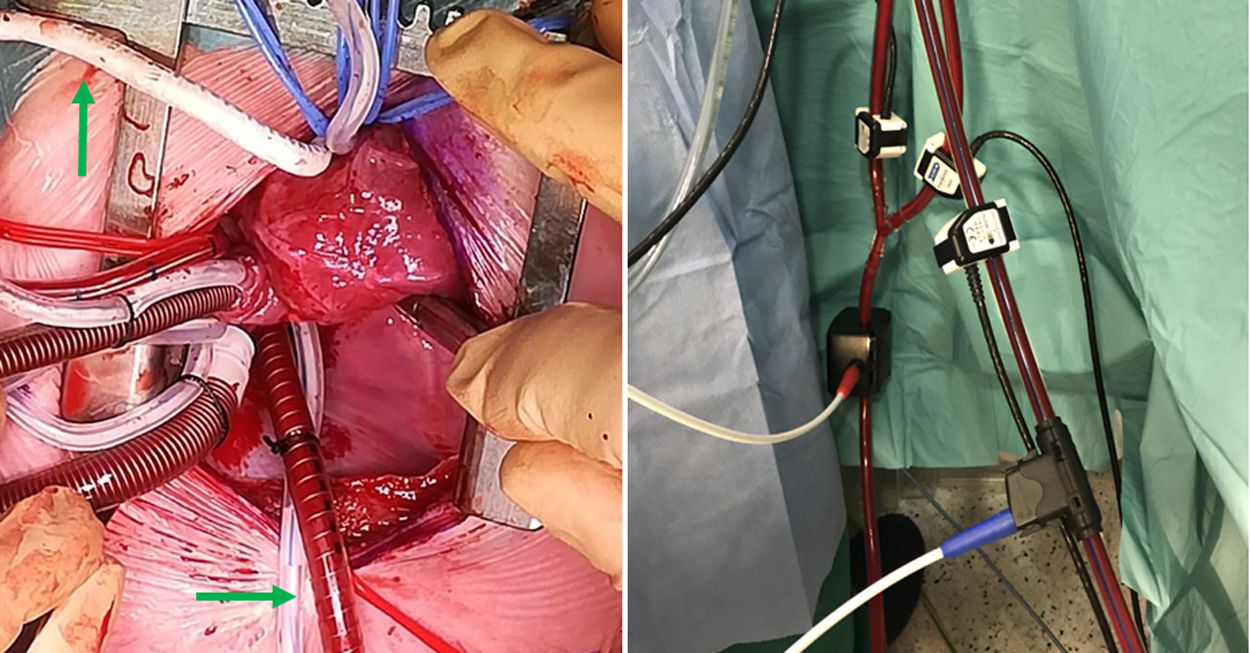
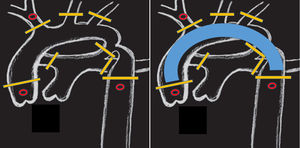
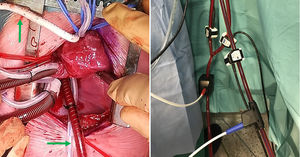
Utilizamos una estrategia similar a la de interrupción de arco aórtico para la canulación de aorta descendente en el TBP. El retorno arterial de la CEC se divide en 2 cánulas, dispuestas en «Y». La primera se conecta a la arteria innominada, como se describe en el párrafo anterior. La segunda (fig. 2) irá alojada en la aorta descendente (a diferencia de la interrupción de arco, donde se dirige a la arteria pulmonar). Para ello, una vez en CEC y con el corazón descargado, separamos la cara diafragmática y accedemos al pericardio posterior. En la línea media lo abrimos longitudinalmente y disecamos con bisturí eléctrico el ligamento pulmonar inferior y linfáticos adyacentes. La aorta descendente es fácilmente accesible12, rodeada con un vessel-loop y canulada previa bolsa de tabaco (estrecha y alargada). Habitualmente utilizamos cánulas de punta biselada del calibre n.° 6 (Stockert®, Muenchen, Alemania). Previamente, el perfusionista instala medidores (flow-meter) en ambas ramas de la línea arterial (fig. 3), pudiendo retomar flujos de CEC totales (3l/min/m2).
Posición de pinzas y/o torniquetes en (barras amarillas): aorta ascendente y descendente, base de los 3 troncos supraaórticos, ductus y ramas pulmonares. La canulación selectiva de la raíz aórtica, arteria innominada y aorta descendente (círculos en rojo) permite una perfusión corporal total. Solo el arco aórtico permanence exangüe (imagen derecha).
A: Imagen de campo mostrando canulación selectiva de la arteria innominada a través de PTFE (flecha vertical) y aorta descendente (flecha horizontal) junto a vena cava inferior. B: Medidores de flujo en drenaje venoso (manguito azul) y ambas ramas de la línea de retorno arterial (en rojo).
Se obtuvo la aprobación ética institucional para la modificación y la indicación, así como el consentimiento informado de los padres. Dado el número de pacientes y la baja incidencia de complicaciones, consideramos que el análisis estadístico no aporta ninguna información.
ResultadosPara la serie completa se registraron los siguientes tiempos (tabla 1): CEC de 155minutos (rango 63-353), isquemia miocárdica de 34minutos (0-160), perfusión cerebral selectiva de 35,8minutos (18-60). La duración media de TBP fue de 52minutos (15-95) en los 14 pacientes con canulación adicional de aorta descendente (tabla 2). Detallado por grupos:
- a)
Norwood-sano (9 neonatos): medias de edad y peso de 3 días (1-5) y 3,7kg (2,7-4), respectivamente. Duración media de CEC de 165minutos (93-312), isquemia miocárdica de 52minutos (42-62) y perfusión cerebral selectiva de 27minutos (18-36). En el último caso se introdujo la TBP, con una duración de 90minutos.
- b)
Cirugía de arco «aislado» en 20 casos, 12 neonatos y 8 niños mayores de un mes. Media de edad de 63 días (4 días-11meses) y de peso 4,2kg (2,1-10,5). La duración media de CEC fue 125minutos (63-292), isquemia miocárdica de 0minutos y perfusión cerebral selectiva de 38minutos (17-60). En 6 casos se introdujo la TBP, con 55minutos (24-95) de duración.
- c)
Cirugía de arco más procedimientos intracardíacos en 39 casos, 7 de ellos mayores de un mes. La media de edad fue de 51 días (3 días-3 meses) y de peso 3,5kg (2,1-6,8). La duración media de CEC fue 165minutos (102-312), isquemia miocárdica de 39minutos (5-160) y perfusión cerebral selectiva de 39minutos (15-51). En 7 casos se introdujo la TBP, con 49minutos (15-90) de duración.
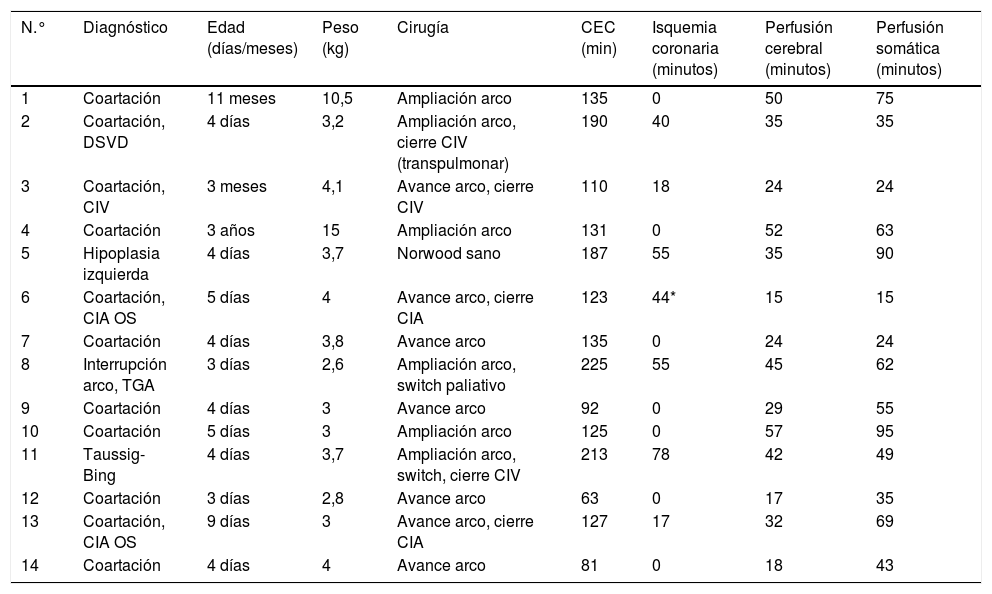
Datos de pacientes con perfusión cerebral, miocárdica y somática (total body perfusion)
| N.° | Diagnóstico | Edad (días/meses) | Peso (kg) | Cirugía | CEC (min) | Isquemia coronaria (minutos) | Perfusión cerebral (minutos) | Perfusión somática (minutos) |
|---|---|---|---|---|---|---|---|---|
| 1 | Coartación | 11 meses | 10,5 | Ampliación arco | 135 | 0 | 50 | 75 |
| 2 | Coartación, DSVD | 4 días | 3,2 | Ampliación arco, cierre CIV (transpulmonar) | 190 | 40 | 35 | 35 |
| 3 | Coartación, CIV | 3 meses | 4,1 | Avance arco, cierre CIV | 110 | 18 | 24 | 24 |
| 4 | Coartación | 3 años | 15 | Ampliación arco | 131 | 0 | 52 | 63 |
| 5 | Hipoplasia izquierda | 4 días | 3,7 | Norwood sano | 187 | 55 | 35 | 90 |
| 6 | Coartación, CIA OS | 5 días | 4 | Avance arco, cierre CIA | 123 | 44* | 15 | 15 |
| 7 | Coartación | 4 días | 3,8 | Avance arco | 135 | 0 | 24 | 24 |
| 8 | Interrupción arco, TGA | 3 días | 2,6 | Ampliación arco, switch paliativo | 225 | 55 | 45 | 62 |
| 9 | Coartación | 4 días | 3 | Avance arco | 92 | 0 | 29 | 55 |
| 10 | Coartación | 5 días | 3 | Ampliación arco | 125 | 0 | 57 | 95 |
| 11 | Taussig-Bing | 4 días | 3,7 | Ampliación arco, switch, cierre CIV | 213 | 78 | 42 | 49 |
| 12 | Coartación | 3 días | 2,8 | Avance arco | 63 | 0 | 17 | 35 |
| 13 | Coartación, CIA OS | 9 días | 3 | Avance arco, cierre CIA | 127 | 17 | 32 | 69 |
| 14 | Coartación | 4 días | 4 | Avance arco | 81 | 0 | 18 | 43 |
CEC: circulación extracorpórea. CIA OS: comunicación interauricular ostium secundum; CIV: comunicación interventricular. DSVD: doble salida de ventrículo derecho; TGA: transposición de grandes arterias.
Los procedimientos asociados en el grupo «c» fueron (tabla 3):
- -
Cierre de comunicación interventricular (CIV) en 15 niños (incluyendo 2 casos con interrupción de arco tipo B).
- -
Switch arterial en 9 ocasiones: simple (1), con CIV (1), Taussig-Bing (4) y switch paliativo (3).
- -
Comunicación interauricular (CIA) en 6 pacientes.
- -
Cor triatriatum en 3 niños.
- -
Comisurotomía valvular aórtica en 2 casos.
- -
ComprehensiveII repair (Norwood más Glenn) en 2 niños.
- -
Canal parcial (ostium primum) en un paciente.
- -
Yasui (Norwood más Rastelli) en un caso.
Cirugía intracardíaca asociada a reparación del arco aórtico (grupo «c» en la tabla 1)
| Defectos intarcardiacos asociados (c) | N.° (39) |
|---|---|
| Comunicación interventricular (CIV) | 15 |
| Switch arterial | 9 |
| Simple | 1 |
| Más CIV | 1 |
| Taussig-Bing | 4 |
| Switch paliativo | 3 |
| Comunicación interauricular tipo ostium secundum (CIA) | 6 |
| Cor triatriatum | 3 |
| Comisurotomía aórtica | 2 |
| Comprehensive (Norwood+Glenn) | 2 |
| Canal parcial (ostium primum) | 1 |
| Yasui (Norwood+Rastelli) | 1 |
Los niveles de lactato al finalizar el procedimiento fueron de 5,4mmol/l (2,5-7,3). Procedimos a cierre diferido del tórax en todos los casos de Norwood, así como en 2 pacientes del grupo «b» y 3 casos del grupo «c». No se detectaron complicaciones neurológicas ni renales.
El seguimiento ha sido completo, con una media de 52meses (rango 2-78). Cinco pacientes fallecieron: 2 Norwood (grupo a), un paciente con afectación aislada del arco días después por arritmias ventriculares (grupo b), además de una interrupción de arco y un Taussig-Bing (grupo c). Tres pacientes precisaron angioplastia por recoartación en los primeros 6 meses tras la cirugía (todos ellos presentaron gradientes<20mmHg al alta de la corrección quirúrgica).
DiscusiónLa elección de paro circulatorio (en hipotermia profunda) o PCA para corregir la hipoplasia del arco en un neonato sigue siendo motivo de debate en la actualidad. Ambas estrategias presentan defensores y detractores13,14. Como en otros ámbitos, buenos resultados con técnicas clásicas disuaden del cambio, mientras que las novedades acompañadas de éxito invitan a evolucionar en las estrategias.
En la literatura encontramos evidencia de la seguridad en la PCA1,2,4,5,15–17 durante la cirugía de arco, garantizando flujo a ambos hemisferios cerebrales. No es preciso descender a 18°C, sino que la hipotermia moderada (25-28°C) es suficiente protección7,18,19. Gracias a la circulación colateral, la perfusión somática está garantizada20, aunque no todos los autores lo suscriben21, y otros sugieren una TBP como protección definitiva11. Debemos recordar que la corrección de una coartación aislada por toracotomía izquierda se realiza en normotermia sin CEC, con apenas morbilidad cuando la isquemia es menor de 20minutos (incluso puede aplicarse la CEC por toracotomía lateral22).
Una perfusión cerebral y miocárdica simultánea, conectando el luer-lock de la cánula arterial y la raíz aórtica mediante una línea en «Y» resulta sencillo y fácil de monitorizar. El descenso de temperatura se acompaña de una bradicardia progresiva. Cualquier cambio en el ECG basal debe alertar sobre acodamientos en la línea y/o cánula de raíz (como nos ocurrió en el paciente n.° 6 [tabla 2]). Ante la duda, simplemente modificando las llaves de la línea en «Y» facilitamos el paso de cardioplejía (en lugar de sangre) a través de la cánula de la raíz aórtica (fig. 1). De hecho, este es el protocolo tras la reparación del arco y previo a la corrección intracardíaca.
Ante la heterogeneidad de procedimientos dividimos nuestra cohorte de pacientes en 3 grupos. Previsiblemente, la duración de CEC resultó menor en el grupo «b», donde solo se realizó cirugía de arco y sin isquemia coronaria (procedimiento beating-heart genuino). En el grupo «c» los tiempos de CEC resultaron más prolongados debido a la reparación intracardíaca, pero la duración de PCA fue pareja, demostrando que la fase de reparación del arco es similar independientemente del resto del procedimiento (tabla 1). Sin embargo, el grupo «a» (Norwood) presenta datos diferentes, debido a que solo la zona distal del arco es reparada a corazón latiendo (por tales motivos se diferenció del grupo «c»).
En relación con el grupo «b» se puede especular acerca de la indicación de intervenir el arco (más coartación) a través de una toracotomía izquierda o esternotomía media23. Durante la recogida de datos para el presente estudio 51 pacientes fueron intervenidos por vía lateral, frente a 20 (grupo b) por línea media con CEC. Los resultados fueron buenos en ambos grupos, mostrando una indicación correcta. Gracias a la experiencia acumulada, de ahora en adelante no dudaremos en abordar los casos límite por esternotomía y CEC con PCA.
A medida que los autores nos familiarizamos con la técnica y estrategia de PCA, procedimientos más complejos fueron acometidos. De esta forma, en el grupo «c» se incluyen cardiopatías «sencillas» tales como CIA e CIV o cor triatriatum y «complejas» como switch arterial (y otras variantes), Norwood más Glenn (comprehensive procedure) o Norwood más Rastelli (técnica de Yasui). En definitiva, una vez cómodos con la PCA, la reparación del arco a corazón latiendo resulta similar independientemente de la enfermedad intracardíaca subyacente (como lo atestiguan los tiempos de PCA en las tablas). Incluso reintervenciones fuera del periodo neonatal tras procedimientos híbridos anteriores24 (stent ducal más banding bilateral) han sido acometidas con dicha estrategia.
La innovación más reciente en nuestro grupo consiste en el TBP. Mediante la canulación de la aorta descendente se consigue una perfusión completa, dejando tan solo el arco aórtico sin circulación (fig. 2). A través de la disposición en «Y» de la línea arterial una rama perfunde el territorio superior (cerebro y miocardio) y la otra el inferior (fig. 3). Realmente, se trata de una variante de la CEC en interrupción de arco, ya conocida por cirujanos de cardiopatía congénita. NIRS similares en ambos territorios aseguran una correcta perfusión. En aras de la simplicidad, con un único rodillo y medidores de flujo en ambas ramas25 garantizamos el flujo cerebral (50ml/kg/min) y modificamos el sistémico controlando las resistencias periféricas. Otros grupos utilizan rodillos independientes11 para flujos equivalentes en las 2 ramas arteriales, o cánulas del mismo calibre26 y rodillo único buscando idéntico objetivo.
Continuando un trabajo previo en otro centro27, nuestro grupo publicó un estudio con los 50 primeros pacientes del presente artículo28. Las conclusiones fueron que la estrategia de perfusión cerebral y miocárdica durante la cirugía de arco aórtico es fácil de aplicar, monitorizar y reconvertir a cardioplejía convencional. Los tiempos de isquemia coronaria se reducen en casos complejos, siendo de cero en cirugía de arco aislado. Presentando más pacientes abundamos en las mismas conclusiones. Incorporando la estrategia TBP añadimos un sesgo en la observación y análisis de los datos. Consideramos que la heterogeneidad y número de casos no son suficientes para establecer comparaciones entre grupos con y sin TBP en términos de «protección» o daño somático (lactato intra y postoperatorio25, necesidad de diálisis, etc.), planteado como reto para futuros estudios.
ConclusionesLa experiencia acumulada con esta serie de 68 pacientes, mayoritariamente neonatos, nos permite concluir que la perfusión cerebral y miocárdica selectiva en cirugía de arco con hipotermia moderada es factible y fácil de reconvertir a cardioplejía convencional. Consecuentemente, la isquemia miocárdica puede reducirse notablemente e incluso ser de cero minutos en los casos de cirugía de arco aislada. El montaje de las líneas es reproducible y sin excesivos cambios para anestesiólogos, cirujanos y perfusionistas. No hemos registrado más complicaciones en nuestros pacientes, comparándolo con otras estrategias. Procedimientos novedosos, como la TBP pueden contribuir a mejorar la morbilidad en este grupo de pacientes.
Los autores declaran que no presentan conflicto de intereses ni han percibido financiación para la realización del presente estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.