La transposición de grandes arterias (D-TGA) es una de las cardiopatías congénitas más frecuentes. La aparición del switch arterial supuso un antes y un después en el manejo de esta patología. Hoy en día es una técnica estandarizada y con excelentes resultados. En este estudio buscamos analizar el estado actual de la cirugía de D-TGA en periodo neonatal mediante revisión de nuestra experiencia.
MétodosEstudio observacional retrospectivo. Se incluyó a los pacientes intervenidos mediante switch arterial en nuestro centro entre enero de 2007 y septiembre de 2020.
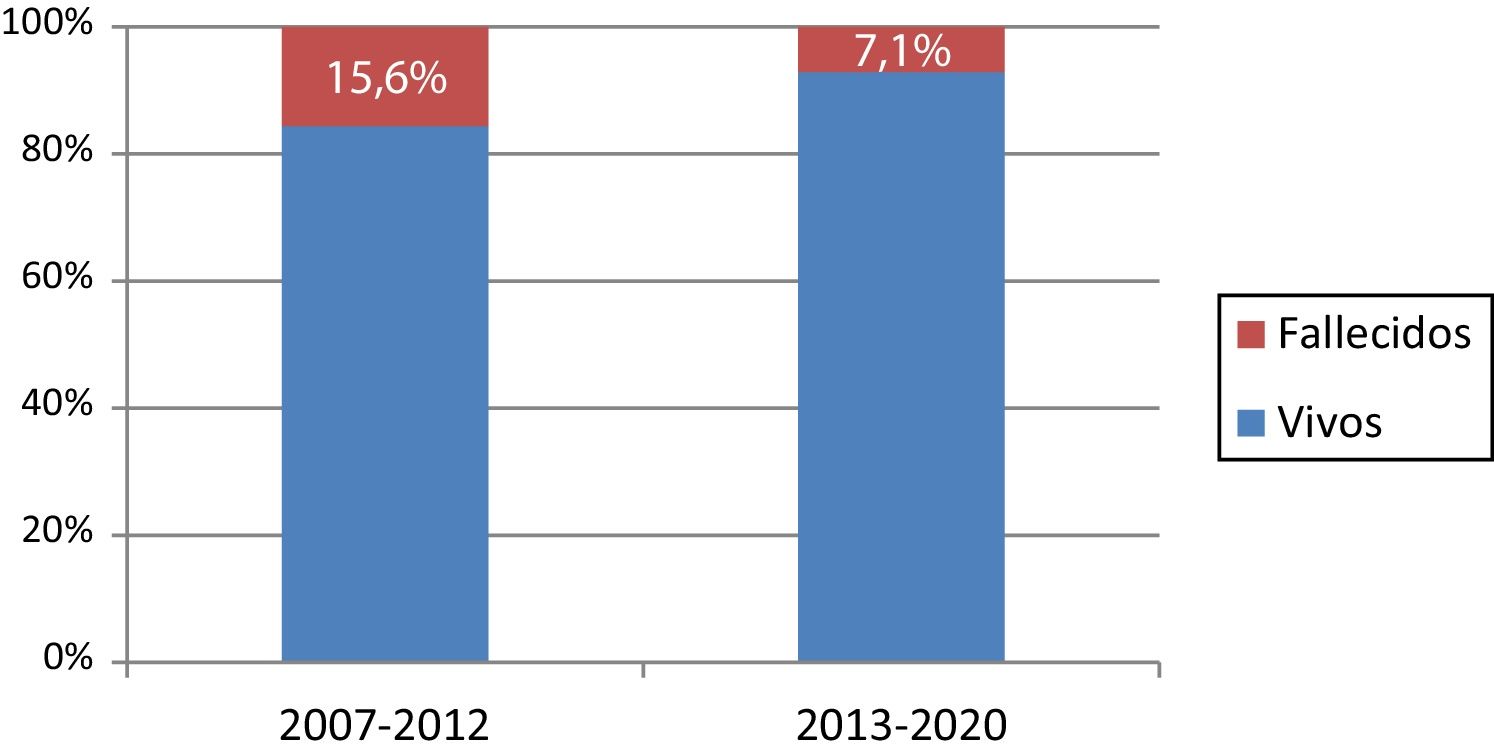
ResultadosSetenta y cuatro pacientes intervenidos. La mortalidad global fue del 10,8% (15,6% en 2007-2012 y 7,1% en 2013-2020). El 44,6% de los pacientes presentaban D-TGA compleja. La presencia de patrones coronarios anómalos, lesiones asociadas o cirugía tardía no elevó significativamente la mortalidad. El tiempo de estancia en cuidados intensivos y hospitalario (mediana + rango intercuartílico) fue de 10 (7-17) y 20 (14-30) días, respectivamente.
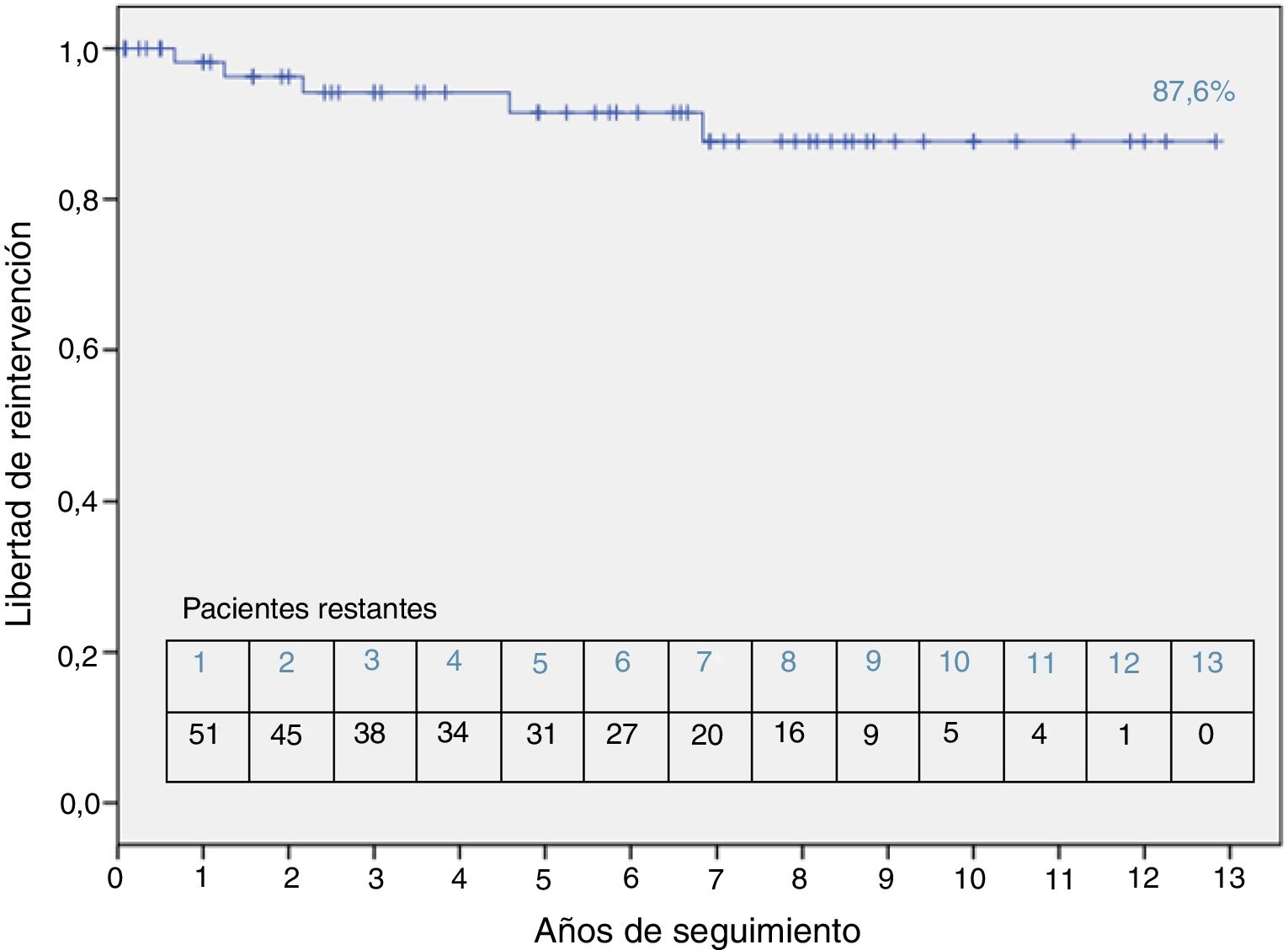
Con un seguimiento medio de 5,3 ± 3,75 años, la supervivencia fue del 100%. La supervivencia libre de reintervención fue de 87,6% a 10 años. La tasa de reintervención fue mayor (p < 0,01) en los pacientes con anomalía de Taussig-Bing o coartación de aorta.
ConclusionesEl switch arterial se considera de elección para el tratamiento de la D-TGA en periodo neonatal, por sus buenos resultados perioperatorios y a largo plazo. Los pacientes sometidos a esta técnica pueden requerir reintervenciones, fundamentalmente por obstrucción del tracto de salida de ventrículo derecho o patología de la válvula y la raíz neoaórtica.
Transposition of the great arteries (D-TGA) is one of the most common congenital heart diseases. The development of the arterial switch operation supposed a great achivement in the management of this pathology. Today it is a standardized technique with excellent results. In this study we seek to analyze the current status of the surgery for D-TGA in the neonatal period by reviewing our experience.
MethodsRetrospective observational study. We included all patients who underwent arterial switch operation in our center between January 2007 and September 2020.
Results74 patients underwent arterial switch operation. Overall mortality was 10.8% (15.6% in 2007-2012 and 7.1% in 2013-2020). 44.6% of the patients presented complex D-TGA. The presence of abnormal coronary patterns, associated malformations, or late surgery did not significantly increase mortality. The length of stay in ICU and hospital (median + interquartile range) was 10 (7-17) and 20 (14-30) days respectively.
During the follow up period (mean follow-up of 5.3 ± 3.75 years) survival rate was 100%. Reoperation-free survival was 87.6% at 10 years. Reoperation rate was higher (p < 0.01) in patients with Taussig-Bing anomaly or coarctation of the aorta.
ConclusionsThe arterial switch operation is considered of choice for the treatment of D-TGA in the neonatal period, due to its good perioperative and long-term results. These patients may require reinterventions, mainly due to right ventricular outflow tract obstruction and pathology of the neo-aortic valve and root.
La transposición de grandes arterias (D-TGA) es la cardiopatía congénita cianosante más frecuente1. Se caracteriza por una discordancia ventrículo-arterial con concordancia aurículo-ventricular. Representa el 5-7%2 de todas las cardiopatías congénitas y su incidencia en España es de 4,9: 10.000 recién nacidos vivos3. Es más frecuente en varones (2:1) y rara vez se relaciona con cromosomopatías, aunque sí está asociada a otras malformaciones cardiacas (comunicación interventricular, obstrucción del tracto de salida de ventrículo derecho y coartación de aorta)4. Hasta la aparición de la corrección anatómica5 (switch arterial), las técnicas previamente descritas6,7 corregían la cianosis a expensas de transformar el ventrículo morfológicamente derecho en el ventrículo sistémico, lo que generaba problemas de disfunción ventricular e insuficiencia cardiaca progresivas y arritmias auriculares en la evolución8. Hoy en día, el switch arterial es la técnica de elección para el tratamiento de la D-TGA, por su reproducibilidad y sus excelentes resultados postoperatorios y a largo plazo.
MétodosPacientesRealizamos un estudio retrospectivo en el que se incluyó a los pacientes portadores de D-TGA que fueron intervenidos mediante switch arterial en nuestro centro, entre enero de 2007 y septiembre de 2020. Se midieron variables preoperatorias, así como los resultados en el postoperatorio inmediato. Se evaluó el estado de los pacientes en el seguimiento mediante revisión de historias clínicas y pruebas de imagen realizadas. Los datos se trataron de forma anónima.
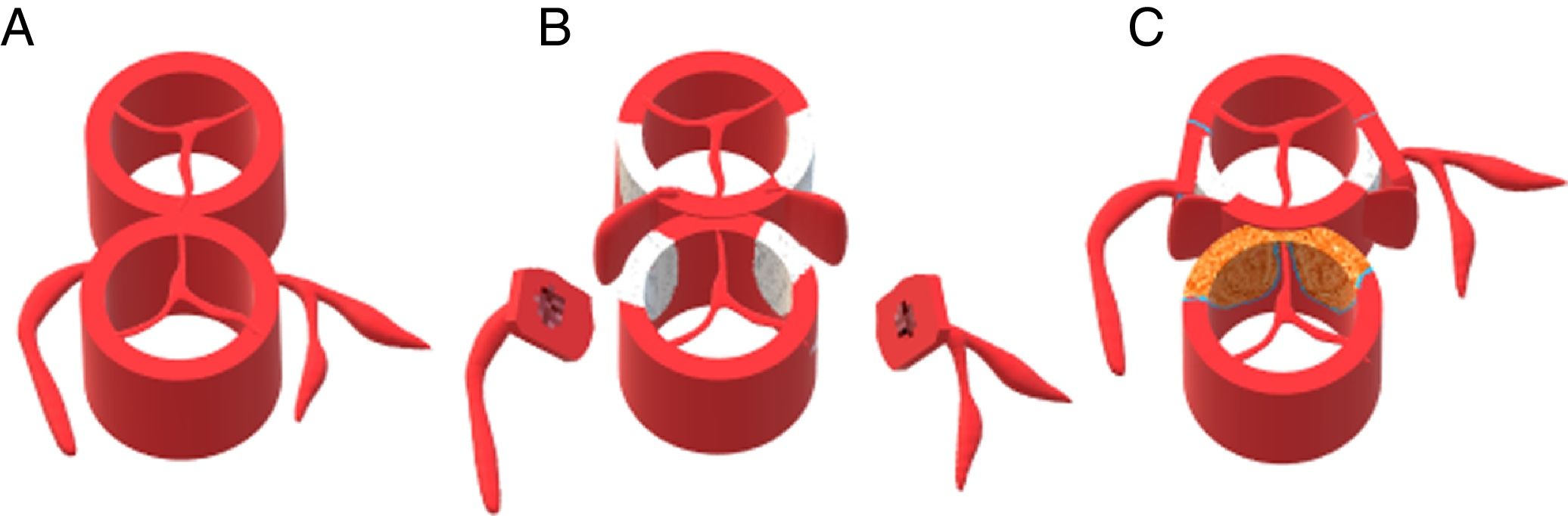
Técnica quirúrgicaTodos los pacientes se sometieron a una cirugía de switch arterial estándar4,9. La transferencia coronaria se llevó a cabo mediante «trapdoor» en ambos senos de Valsalva de la raíz neoaórtica (fig. 1), procurando situar la anastomosis coronaria derecha en una posición más craneal que la izquierda. Se empleó rutinariamente la maniobra de Lecompte10, salvo en dos pacientes con disposición de los grandes vasos «lado a lado» en los que no fue posible. Los casos de coronaria izquierda con trayecto intramural se resolvieron mediante desinserción de la comisura aórtica, separación de ambos ostium coronarios en dos botones independientes y «unroofing» del ostium coronario izquierdo11. La arteria neopulmonar se reconstruyó con pericardio autólogo fresco en el 57% de los pacientes y con pericardio autólogo tratado mediante glutaraldehído en el 43% restante.
Técnica de trapdoor. Se extraen los botones coronarios de su posición original A) y se realizan dos cortes en «J» en los senos de Valsalva neoaórticos B). A continuación, se reimplantan las coronarias en su seno correspondiente. La neoarteria pulmonar se reconstruye con pericardio autólogo C).
Para el manejo de las lesiones asociadas, se utilizó pericardio bovino, en caso de existir comunicación interventricular (CIV) y pericardio autólogo tratado con glutaraldehído en la reconstrucción de la aorta. La cirugía sobre el arco aórtico se realizó en hipotermia a 26°C y bajo perfusión cerebral selectiva a través del tronco braquiocefálico.
Análisis estadísticoEl análisis estadístico se llevó a cabo mediante el programa SPSS versión 24 (IBM Corp. Released 2016. IBM SPSS Statistics for Windows, Versión 24.0. Armonk, NY: IBM Corp). Los estadísticos descriptivos utilizados fueron la media ± desviación típica o mediana + rango intercuartílico en las variables continuas y la frecuencia y el porcentaje para las variables discretas. El contraste de hipótesis entre grupos se realizó mediante t de Student y U de Mann-Whitney en variables continuas y mediante χ2 y test exacto de Fisher para las variables categóricas. Los resultados en el seguimiento de los pacientes se analizaron mediante curvas de supervivencia de Kaplan-Meier. Para todos los test, el nivel de significación estadística se estableció a partir de una p < 0,05.
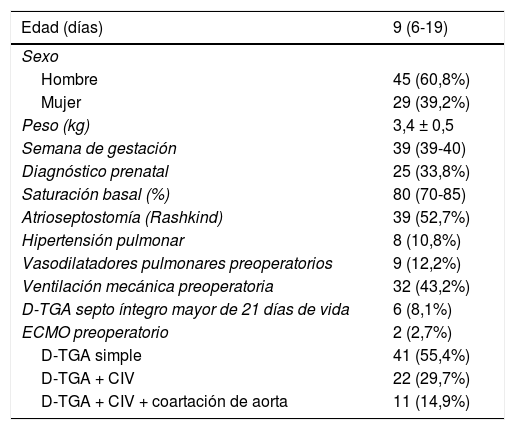
ResultadosUn total de 74 pacientes con D-TGA fueron intervenidos en nuestro centro durante el periodo del estudio. Las características basales se muestran en la tabla 1.
Características basales de los pacientes
| Edad (días) | 9 (6-19) |
|---|---|
| Sexo | |
| Hombre | 45 (60,8%) |
| Mujer | 29 (39,2%) |
| Peso (kg) | 3,4 ± 0,5 |
| Semana de gestación | 39 (39-40) |
| Diagnóstico prenatal | 25 (33,8%) |
| Saturación basal (%) | 80 (70-85) |
| Atrioseptostomía (Rashkind) | 39 (52,7%) |
| Hipertensión pulmonar | 8 (10,8%) |
| Vasodilatadores pulmonares preoperatorios | 9 (12,2%) |
| Ventilación mecánica preoperatoria | 32 (43,2%) |
| D-TGA septo íntegro mayor de 21 días de vida | 6 (8,1%) |
| ECMO preoperatorio | 2 (2,7%) |
| D-TGA simple | 41 (55,4%) |
| D-TGA + CIV | 22 (29,7%) |
| D-TGA + CIV + coartación de aorta | 11 (14,9%) |
Edad, semana de gestación al nacimiento y saturación basal: mediana (rango intercuartílico); peso: media ± desviación típica.
CIV: comunicación interventricular. D-TGA: D-transposición de grandes arterias. ECMO: oxigenador de membrana extracorpórea.
En un 33,8% de los pacientes, se había realizado diagnóstico prenatal. El 57,7% de los pacientes se sometieron a atrioseptostomía de Rashkind preoperatoria. Seis pacientes (8,1%) presentaban D-TGA con tabique interventricular íntegro y más de tres semanas de vida al diagnóstico. El 44,6% presentaba lesiones asociadas (D-TGA compleja): comunicación interventricular en el 29,7% de los casos y CIV + coartación de aorta en el 14,9% de los casos.
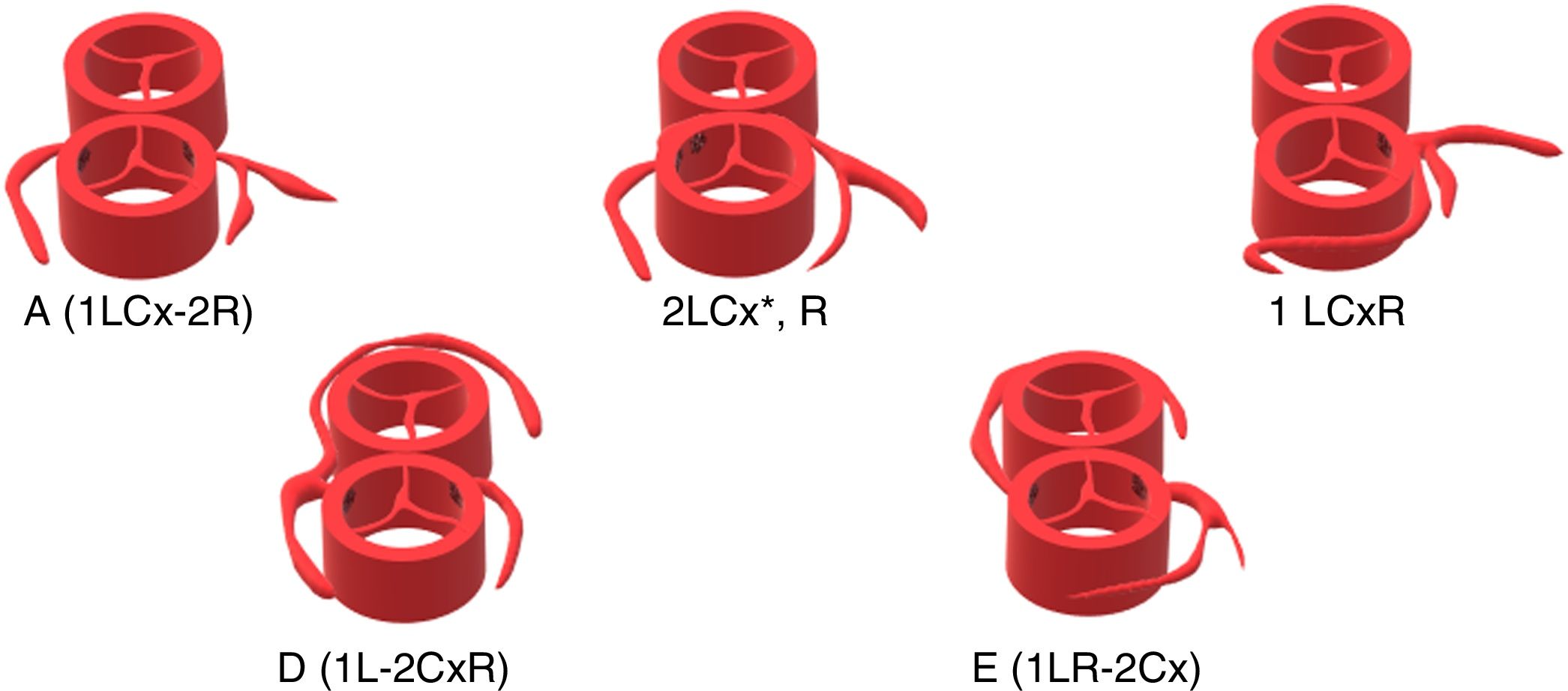
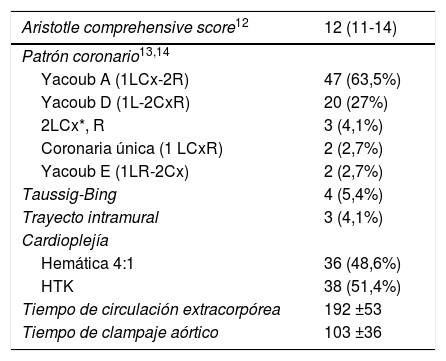
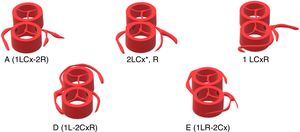
Los hallazgos intraoperatorios se resumen en la tabla 2. La fig. 2 muestra los patrones coronarios observados.
Hallazgos intraoperatorios
| Aristotle comprehensive score12 | 12 (11-14) |
|---|---|
| Patrón coronario13,14 | |
| Yacoub A (1LCx-2R) | 47 (63,5%) |
| Yacoub D (1L-2CxR) | 20 (27%) |
| 2LCx*, R | 3 (4,1%) |
| Coronaria única (1 LCxR) | 2 (2,7%) |
| Yacoub E (1LR-2Cx) | 2 (2,7%) |
| Taussig-Bing | 4 (5,4%) |
| Trayecto intramural | 3 (4,1%) |
| Cardioplejía | |
| Hemática 4:1 | 36 (48,6%) |
| HTK | 38 (51,4%) |
| Tiempo de circulación extracorpórea | 192 ±53 |
| Tiempo de clampaje aórtico | 103 ±36 |
Aristotle comprehensive score: mediana (rango intercuartílico); tiempo de circulación extracorpórea y tiempo de clampaje: media ± desviación típica.
Cx: arteria circunfleja. HTK: histidina-triptófano-cetoglutarato. L: arteria descendente anterior. R: arteria coronaria derecha.
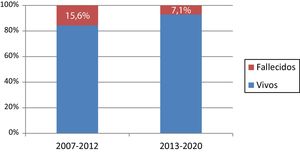
La mortalidad hospitalaria en nuestra serie fue de ocho pacientes (10,8%). La causa de la muerte fue por fenómenos isquémicos en un 50% de los pacientes y por síndrome de respuesta inflamatoria sistémica en un 25%. La fig. 3 muestra la distribución de la mortalidad durante el periodo de estudio. No se ha encontrado relación estadísticamente significativa entre ninguno de los factores preoperatorios o intraoperatorios analizados y la mortalidad (tabla 3).
Mortalidad según subgrupos
| D-TGA septo íntegro mayor de 21 días de vida | 0% |
|---|---|
| Tipo | |
| D-TGA simple | 5 (12,2%) |
| D-TGA + CIV | 2 (9,1%) |
| D-TGA + CIV + coartación de aorta | 1 (9,1%) |
| Patrón coronario | |
| Yacoub A (1LCx-2R) | 3 (6,4%) |
| Coronaria única (1 LCxR) | 1 (50%) |
| 2LCx*, R | 1 (33,3%) |
| Yacoub D (1L-2CxR) | 2 (10%) |
| Yacoub E (1LR-2Cx) | 1 (50%) |
Cx: arteria circunfleja. CIV: comunicación interventricular. D-TGA: D-transposición de grandes arterias. L: arteria descendente anterior. R: arteria coronaria derecha.
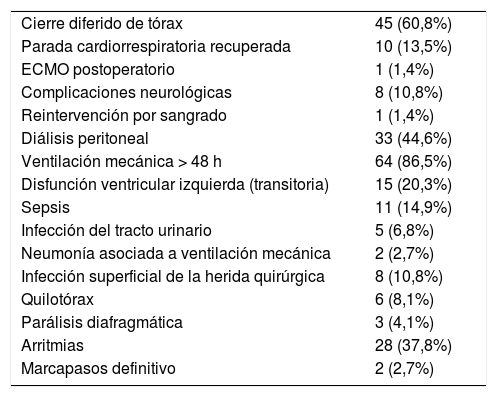
En la tabla 4 se resumen las complicaciones durante el postoperatorio inmediato.
Morbilidad postoperatoria
| Cierre diferido de tórax | 45 (60,8%) |
| Parada cardiorrespiratoria recuperada | 10 (13,5%) |
| ECMO postoperatorio | 1 (1,4%) |
| Complicaciones neurológicas | 8 (10,8%) |
| Reintervención por sangrado | 1 (1,4%) |
| Diálisis peritoneal | 33 (44,6%) |
| Ventilación mecánica > 48 h | 64 (86,5%) |
| Disfunción ventricular izquierda (transitoria) | 15 (20,3%) |
| Sepsis | 11 (14,9%) |
| Infección del tracto urinario | 5 (6,8%) |
| Neumonía asociada a ventilación mecánica | 2 (2,7%) |
| Infección superficial de la herida quirúrgica | 8 (10,8%) |
| Quilotórax | 6 (8,1%) |
| Parálisis diafragmática | 3 (4,1%) |
| Arritmias | 28 (37,8%) |
| Marcapasos definitivo | 2 (2,7%) |
ECMO: oxigenador de membrana extracorpórea.
La mediana de estancia en UCI fue de 10 días (rango intercuartílico: 7-17). La estancia hospitalaria mediana fue de 20 días (rango intercuartílico: 14-30). La mediana de tiempo de ventilación mecánica fue de cinco días (rango intercuartílico: 3-7). Ningún paciente presentó infección profunda de la herida quirúrgica.
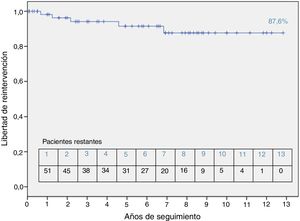
En cuanto al seguimiento a largo plazo (seguimiento completo en el 94% de los pacientes, media 5,3 ± 3,75 años), ningún paciente falleció. El 87,6% de los pacientes se encontraban libres de reintervención (quirúrgica o percutánea) a los 10 años (fig. 4). Los pacientes con CIV + coartación de aorta o anomalía de Taussig-Bing presentaron mayor necesidad de reintervención que el resto de pacientes evaluados (66,7 y 50% libres de reintervención respectivamente, p < 0,01). Los procedimientos realizados fueron: angioplastia con balón en dos pacientes con recoartación de aorta (20% de los pacientes con ampliación del arco aórtico), implante de stent en la arteria pulmonar izquierda en un paciente (1,5%), sustitución valvular aórtica en un paciente (1,5%) y reparación de estenosis subaórtica en un paciente (1,5%). El 16,7% de los pacientes tenían un gradiente máximo en el tracto de salida del ventrículo derecho (TSVD) superior a 25 mmHg. Un 7,6% de los pacientes presentaba insuficiencia aórtica, al menos moderada. El diámetro medio de la raíz neoaórtica fue de 21,6 ± 5 mm (Z score 2,24 ± 1,9). Cuatro pacientes (13,8% de los pacientes con CIV) tenían una CIV residual no significativa. Se realizó tomografía axial computarizada para valoración de las arterias pulmonares en nueve casos (13,8%) y gammagrafía de ventilación/perfusión pulmonar en dos casos (3,7%). Ningún paciente ha presentado eventos coronarios en el seguimiento.
DiscusiónActualmente, la técnica del switch arterial se encuentra muy estandarizada y la mayoría de centros con alto volumen presentan tasas muy bajas de mortalidad (2-5%)15. En nuestro estudio, la mortalidad hospitalaria es algo superior a la de otras series publicadas9. Al dividirla en dos periodos quirúrgicos, observamos una menor mortalidad en el segundo periodo (7,1%), aunque esta diferencia no ha resultado ser significativa (p = 0,24). El porcentaje de pacientes con D-TGA compleja (44,6%) es también mayor al de otras series16,17. En otros trabajos se describen factores de riesgo asociados a mortalidad hospitalaria16,17, como los patrones coronarios anómalos, la presencia de otras malformaciones cardiacas o la cirugía de switch arterial sobre D-TGA con septo íntegro transcurridas más de tres semanas desde el nacimiento18. Ninguno de estos factores ha demostrado incrementar significativamente la mortalidad en nuestra serie.
En cuanto al seguimiento, nuestro estudio muestra resultados similares a los ya publicados (87,6% de libertad de reintervención a los 10 años)19. Los pacientes que han presentado tasas de reintervención significativamente mayores han sido los que asociaban coartación de aorta + CIV (66,7% libres de reintervención) o anomalía de Taussig-Bing (50% libres de reintervención). Estos datos son concordantes con la literatura existente20.
Estenosis del TSVDLa estenosis del tracto de salida del ventrículo derecho es la causa más frecuente de reintervención en los pacientes operados de switch arterial21. La localización más habitual suele ser la anastomosis entre la neoarteria pulmonar y las ramas pulmonares. Se postulan como posibles causas el bajo potencial de crecimiento del pericardio autólogo, utilizado para la reconstrucción y la distorsión producida por la neoaorta sobre la bifurcación pulmonar secundaria a la maniobra de Lecompte22. En nuestra serie, el 16,7% de los pacientes presentaba estenosis significativa del TSVD, cifras similares a las de otros artículos23. Sin embargo, la necesidad de reintervención sobre el TSVD ha sido inferior a la de otras publicaciones (1,5%), probablemente debido al menor tiempo de seguimiento de nuestra serie, en comparación con otros estudios.
Dilatación e insuficiencia neoaórticaUno de los hallazgos más comunes en la evolución de los pacientes es la aparición de insuficiencia neoaórtica y aneurismas de aorta. Los datos de nuestra serie se corresponden con los descritos por otros autores24,25. En nuestro estudio, el 48,5% de los pacientes presentaba insuficiencia aórtica en el seguimiento, aunque sólo en cinco pacientes, el grado de insuficiencia aórtica era II/IV o mayor. Un paciente requirió cirugía sobre la válvula aórtica. El Z score de la raíz aórtica a nivel de los senos de Valsalva era superior a tres en el 32% de los pacientes. Sin embargo, la progresión de la dilatación aórtica y la necesidad de reintervención en el futuro es todavía incierta. En el estudio de Schwartz et al.26, se objetivó una tendencia a la estabilización en el aumento del diámetro aórtico a partir del décimo año postoperatorio. Se han descubierto distintos factores de riesgo que favorecen la aparición de insuficiencia neoaórtica y aneurismas de aorta, como la realización previa de banding de la arteria pulmonar (cirugía en dos tiempos, entrenamiento del ventrículo izquierdo), la asociación con CIV, la obstrucción del tracto de salida del ventrículo izquierdo y la edad mayor de un año en el momento de la cirugía. El empleo de trapdoor de manera sistemática puede tener relación con la dilatación de la neoaorta27, aunque otros estudios no confirman esa hipótesis28.
Lesiones coronarias e isquemia miocárdicaUna causa descrita de mortalidad tardía son los eventos coronarios29. La prevalencia estimada de lesiones coronarias es de un 6-8%30. En nuestra serie, no ha habido fallecimientos durante el periodo de estudio y ningún paciente ha presentado datos de isquemia miocárdica. Sin embargo, dado que estas lesiones pueden ser asintomáticas, se recomienda un seguimiento estrecho de los pacientes y la realización de pruebas de imagen para descartar estenosis coronaria, especialmente cuando existan signos clínicos, electrocardiográficos o ecocardiográficos de isquemia miocárdica o patrones coronarios desfavorables (coronaria intramural, coronaria única)4. La reintervención estará indicada cuando exista evidencia de isquemia miocárdica.
El estudio presenta limitaciones, al ser retrospectivo y unicéntrico. Un tiempo de seguimiento mayor permitiría evaluar mejor la aparición de eventos tardíos y necesidad de reintervención.
ConclusionesEl switch arterial es actualmente el tratamiento de elección para la D-TGA, por sus buenos resultados postoperatorios inmediatos y a largo plazo. La evolución futura de los pacientes es aún poco conocida, por lo que se requiere un seguimiento estricto para detectar lesiones residuales que deban ser reparadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.