El fibroelastoma papilar es un tumor cardiaco primario benigno localizado normalmente en el endocardio valvular, aunque es posible encontrarlo en otras estructuras endocárdicas. Según estudios recientes, podría ser el tumor cardiaco primario benigno más común. En un número importante de casos es asintomático, se diagnostica de manera incidental y, en caso de presentar clínica acompañante, se asocia a eventos cerebrovasculares tromboembólicos. Mostramos nuestra experiencia en el tratamiento quirúrgico del fibroelastoma papilar y se lleva a cabo una revisión bibliográfica de la literatura.
MétodosEstudio retrospectivo unicéntrico mediante le revisión de las historias clínicas de todos los pacientes diagnosticados de fibroelastoma papilar y tratados quirúrgicamente en nuestro Servicio.
ResultadosDesde enero de 2016 hasta octubre de 2022 se intervinieron 14 pacientes, predominantemente varones, con una edad media de 61±12,6 años. El diagnóstico se realizó en casi todos los casos mediante estudios previos a la cirugía. La mayoría de los tumores eran asintomáticos y se localizaron en la válvula aórtica. Ninguno precisó reemplazo o reparación valvular. En 5 casos (35,7%) se realizó crioablación concomitante del lecho tumoral. No hubo mortalidad quirúrgica. Tras 3,2±2,22 años de seguimiento dos pacientes fallecieron de causas no cardiacas. No se han objetivado recidivas.
ConclusionesEl tratamiento quirúrgico del fibroelastoma papilar es seguro y ofrece buenos resultados. La crioablación concomitante podría ser útil para conseguir una eliminación tumoral completa sin necesidad de recambio valvular, aunque es necesaria más evidencia. La realización de un registro multicéntrico permitiría un mayor conocimiento de esta patología.
Papillary fibroelastoma is a benign primary cardiac tumor normally located in the valvular endocardium, although it can be found in other endocardial structures. According to recent studies, it could be the most common benign primary cardiac tumor. In a significant number of cases it is asymptomatic, diagnosed incidentally and, in symptomatic cases, usually they present as thromboembolic neurological events. We show our experience in the surgical treatment of papillary fibroelastoma and a review of the literature is performed.
MethodsSingle-center retrospective study by reviewing the medical records of all patients diagnosed with papillary fibroelastoma and surgically treated in our department.
ResultsFrom January 2016 to October 2022, 14 patients were operated on, predominantly men, with a mean age of 61±12.6 years. The diagnosis was made mostly in almost all cases during the preoperative study for other indications. Most of the tumors were asymptomatic and were located in the aortic valve. No patient required valve replacement or repair. In 5 cases (35.7%) concomitant cryoablation was performed. There was no surgical mortality. After 3.2±2.22 years of follow-up, two patients died of non-cardiac causes. No tumoral recurrences have been found.
ConclusionsSurgical treatment of papillary fibroelastoma is safe and offers good short and mid-term results. Concomitant cryoablation might be useful to achieve complete tumor removal without the need for valve replacement, however more evidence is mandatory. The realization of a multicenter registry would allow a better knowledge of this tumors.
La primera exéresis exitosa de un tumor cardiaco primario con circulación extracorpórea fue realizada por Crafoord en 1954, que extirpó un mixoma alojado en la aurícula derecha1. Tras varios años de estudios histopatológicos sobre los tumores primarios, y con la finalidad de diferenciar unos de otros, Fishbein et al. acuñaron el término de fibroelastoma papilar (FEP) por primera vez en 19752. Desde entonces, el conocimiento de la incidencia de los tumores cardiacos primarios ha ido en aumento. Inicialmente fue estudiada a partir de series de autopsias, como la mostrada por McAllister y Fenoglio, quienes describieron una incidencia de tumores cardiacos primarios del 0,0017%-0,28%, siendo el FEP el tercero más común (9,5% del total), detrás del mixoma (26,6%) y del lipoma (10,1%)3. Otra publicación basada en 22 series de autopsias reflejó una incidencia del 0,02% para tumores cardiacos primarios, lo que correspondía a 200 tumores por un millón de autopsias4.
Aunque antiguamente se consideraba al FEP como el tercer tumor cardiaco benigno primario más frecuente, probablemente debido a que los registros de este tumor eran en su mayoría a partir de autopsias, en la actualidad esto podría cambiar debido a los recursos diagnósticos como la ecocardiografía transtorácica (ETT), la ecocardiografía transesofágica (ETE), la tomografía axial computarizada (TAC) o la resonancia magnética (RMN). Tamin et al. describen el FEP como el tumor cardiaco primario más común, por encima del mixoma, con una frecuencia de aparición de 1/1.100 ecocardiografías. Adicionalmente, durante los 15 años de este estudio se identificaron anatomopatológicamente 185 casos de FEP frente a 112 casos de mixoma5.
Del mismo modo, el FEP es considerado el tumor cardiaco primario benigno valvular más común. Gowda et al.6, en su estudio sobre 725 casos de FEP, encontraron que la válvula más afectada es la válvula aórtica. De todas formas, dado que la mayoría de los pacientes son asintomáticos y que su diagnóstico suele ser un hallazgo ecocardiográfico, resulta difícil establecer su prevalencia real.
El propósito de este artículo es mostrar la experiencia en nuestro centro del tratamiento quirúrgico del FEP y realizar una revisión bibliográfica de la literatura.
Pacientes y métodosConsideraciones éticas: todos los pacientes dieron su consentimiento informado para la revisión de las historias clínicas de manera retrospectiva. Dada la naturaleza retrospectiva y de no intervención, no se requirió de la aprobación del CEIC de nuestro centro, aunque se siguieron las recomendaciones en consonancia con el código ético de la OMS (Declaración de Helsinki).
Se recogieron retrospectivamente los datos de todos los pacientes intervenidos de resección tumoral con diagnóstico anatomopatológico de FEP en nuestro centro a partir de la base de datos de nuestro Servicio (FileMaker Pro v15, Claris, Cupertino, EE.UU.) y las historias clínicas de los pacientes. Se registraron los antecedentes personales, la clínica, los resultados del ETT y del ETE (tamaño, localización y movilidad del tumor, y alteración de la función valvular), el procedimiento quirúrgico, la mortalidad y el seguimiento del paciente.
Las variables cualitativas se presentan como porcentajes y las variables cuantitativas como media ±desviación estándar. Para la realización del análisis estadístico se usó el programa SPSS Statistics versión 20 (IBM, Nueva York, EE.UU.).
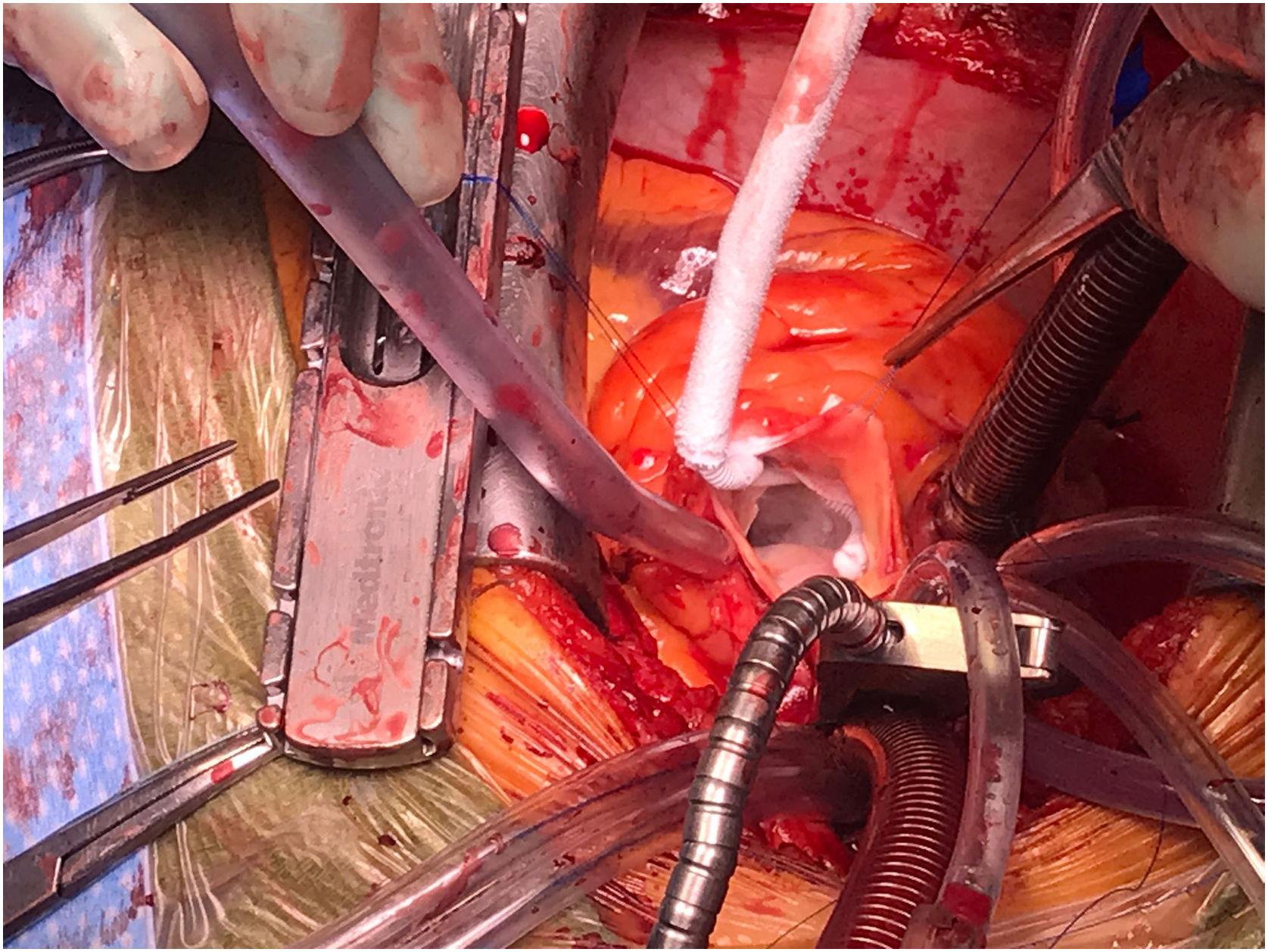
Todos los pacientes fueron intervenidos con circulación extracorpórea y clampaje aórtico por esternotomía media convencional. La protección miocárdica se realizó con cardioplejia hemática 4:1 anterógrada y retrógrada. Los FEP se resecaron mediante curetaje subendocárdico con bisturí frío de la superficie del velo valvular afectado. En los casos en los que se consideró incompleta la resección subendocárdica se realizó crioablación del lecho quirúrgico con catéter Cryocath (Medtronic, Minneapolis, EE.UU.) a la máxima potencia durante 1minuto (fig. 1). Se realizaron las secuencias necesarias para ablacionar completamente toda el área del lecho de resección.
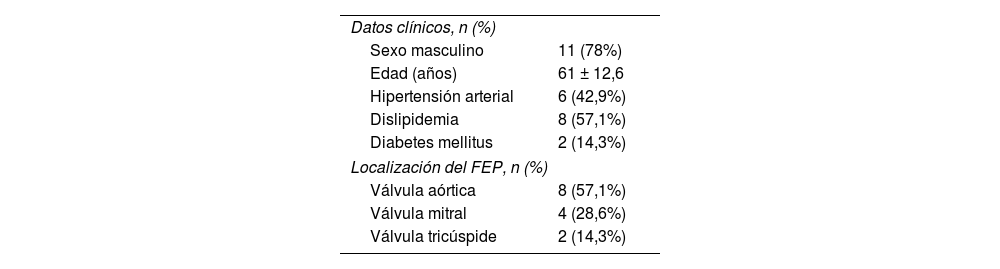
ResultadosDesde enero de 2016 hasta octubre de 2022 se intervinieron un total de 14 pacientes de resección de tumor cardiaco primario cuyo estudio anatomopatológico confirmó el diagnostico de FEP. Las características clínicas se detallan en la tabla 1.
Características clínicas de los pacientes diagnosticados de FEP
| Datos clínicos, n (%) | |
| Sexo masculino | 11 (78%) |
| Edad (años) | 61 ± 12,6 |
| Hipertensión arterial | 6 (42,9%) |
| Dislipidemia | 8 (57,1%) |
| Diabetes mellitus | 2 (14,3%) |
| Localización del FEP, n (%) | |
| Válvula aórtica | 8 (57,1%) |
| Válvula mitral | 4 (28,6%) |
| Válvula tricúspide | 2 (14,3%) |
FEP: fibroelastoma papilar.
La gran mayoría fueron varones. Solo un paciente presentaba intervenciones cardiacas previas (reparación mitral). Ningún paciente tenía antecedentes de endocarditis infecciosa. En 8 pacientes (57,1%) el diagnóstico se realizó por ETT, en 5 pacientes se requirió de ETE y en un caso el diagnóstico fue intraoperatorio durante una miectomía transaórtica extendida. La mayoría de los FEP se localizaron en la válvula aórtica (tabla 1).
Del total de válvulas aórticas afectadas en un 75% (n=6), el FEP estaba localizado en la cara ventricular, y el resto en la cara aórtica. En los casos mitrales y tricúspide todos los FEP se localizaron en la cara auricular. En cuanto al funcionamiento valvular, en 9 casos (64,3%) estaba conservada, en 4 casos (28,6%) existía insuficiencia y en uno de ellos se encontró doble lesión. En casi la totalidad de casos el FEP era móvil. En cuanto al tamaño, solo en tres pacientes (21,4%) fue mayor de 1cm., siendo el más grande de 2cm, localizado en la válvula tricúspide. En su mayoría, el FEP era único, y solo en 4 pacientes se describieron múltiples FEP, aunque en ningún caso con afectación de otra válvula de manera simultánea (tabla 2). En un caso de FEP en posición tricúspide se encontraron siembras tumorales en el septo interauricular.
Clínicamente, de los 8 pacientes (57,1%) cuya única indicación quirúrgica fue el FEP, la forma de presentación más frecuente fue neurológica en forma de accidente isquémico transitorio (n=4 [50%]). En 2 casos (25%) fue asintomático, en un caso se presentó como dolor centrotorácico atípico y en el otro con disnea de esfuerzo. En los 6 pacientes restantes la indicación quirúrgica fue por otras patologías, siendo el hallazgo del FEP parte del estudio prequirúrgico o intraoperatorio.
En 7 pacientes (50%) se realizó cirugía aislada del FEP, todos estos casos con FEP localizados en cavidades izquierdas. En la tabla 3 se describe la distribución del resto de cirugías combinadas. En 5 pacientes (35,7%) se realizó crioablación del lecho de exéresis tumoral: en 4 casos eran aórticos y en un caso, mitral. En ningún caso, sin disfunción valvular previa, hubo necesidad de realizar una reparación o reemplazo valvular por lesión valvular debida a la escisión tumoral, comprobándose el correcto funcionamiento valvular intraoperatorio por medio de ETE.
Descripción de procedimientos quirúrgicos
| Cirugía aislada del FEP | • 4 casos de FEP en válvula mitral• 3 casos de FEP en válvula aórtica |
| Cirugías combinadas | • Bypass coronario + exéresis de FEP en la válvula tricúspide• Redo (plastia mitral fallida) + implante de prótesis mitral mecánica + exéresis de FEP en la válvula aórtica• Sustitución de válvula mitral y aórtica + bypass coronario + exéresis de FEP en la válvula tricúspide• Sustitución de válvula mitral + exéresis de FEP en la válvula aórtica• Plastia mitral + exéresis de FEP en la válvula aórtica• Miectomía septal ampliada + exéresis de FEP en la válvula aórtica• Miectomía septal extendida + sustitución de válvula mitral + exéresis de FEP en la válvula aórtica |
FEP: fibroelastoma papilar.
El seguimiento clínico medio fue de 3,2±2,22 años. No hubo mortalidad a 30 días. Durante el seguimiento, dos pacientes (14,3%) fallecieron a los 320 y 390 días por causas no cardiológicas. El resto de los pacientes permanecen vivos al final del estudio. Se realizaron controles ecocardiográficos a todos los pacientes (seguimiento ecocardiográfico medio de 2,3 años, rango 1-7 años). De entre los pacientes a los que se realizó crioablación concomitante, el seguimiento medio fue de 1,40±0,54 años (rango de 12 meses). La tasa global de recidiva durante el seguimiento ha sido del 0%.
DiscusiónEl FEP es una masa avascular formada por colágeno y fibras elásticas, cubierta por tejido endotelial y con un pedículo formado por tejido conectivo7-9. Macroscópicamente es una masa con múltiples papilas de aspecto frondoso adherida a un pedículo, lo que lo asemeja a una anémona de mar cuando se sumerge en solución salina6,8-13.
Existen varias teorías acerca del origen del FEP, entre ellas que sea de origen tumoral, que pueda presentarse como un trombo organizado o que sea de origen traumático (post-radiación, cirugía o trauma hemodinámico)11,14,15. De hecho, se ha observado que los FEP tienden a crecer en zonas donde existe irritación o traumatismo endocárdico9. También se ha propuesto como origen un trombo previo que posteriormente se ve infiltrado por fibroblastos que proliferan hasta formar tejido fibroso8,15. A pesar de estas diferentes etiologías, el FEP es consistentemente considerado como un tumor cardiaco primario benigno5,10-12,14,16-19.
El diagnóstico diferencial del FEP se realiza con patologías como endocarditis, mixoma, excrecencias de Lambl, trombo aislado o fibroma6,9,13,17. Existen teorías que indican que las excrecencias de Lambl serían un paso previo al FEP, siendo ambas patologías iguales desde el punto de vista histológico e inmunohistoquímico, pudiendo diferenciarse por su tamaño y su localización. El FEP tiende a ser más grande y localizarse comúnmente en la porción media de las válvulas, mientras que las excrecencias de Lambl son pequeñas, nacen en los bordes valvulares y tienden a ser múltiples en un mayor porcentaje de casos3,6,9,20.
El FEP suele aparecer de manera particularmente frecuente entre los 40 y los 80 años, siendo la edad media de presentación alrededor de los 60 años6,8,10-12,14,18, y la incidencia es mayor en varones, similar a lo observado en nuestra serie6,8,10,11,14. También se han descrito casos en la población pediátrica6,21.
Aunque se puede localizar en cualquier parte del endocardio, el FEP afecta con más frecuencia al endocardio valvular (73% de los casos), y en el 95% de los pacientes al corazón izquierdo6. El FEP muestra especial afinidad por la válvula aórtica (44% del total de casos)5,11-14,18. La segunda válvula más afectada es la válvula mitral, siendo el ventrículo izquierdo el lugar de afectación no valvular más frecuente5,6,13. Se han descrito diferentes localizaciones del FEP, como cuerdas tendinosas de la válvula mitral, orejuela izquierda, septo interauricular, ostium coronario o red de Chiari, entre otras6,9,13,22-26. En nuestro caso, la única localización extravalvular fue el septo interauricular en un paciente con afectación tricúspide.
El tamaño promedio del FEP es de 10mm. No obstante, se han descrito especímenes de hasta 70mm, siendo los tumores de lado derecho del corazón algo más grandes, probablemente debido a que suelen ser más frecuentemente asintomáticos5,6,13,22. Puede ser único o múltiple27, aunque en el 91% de los casos es único13, como se describe en nuestra serie.
Clínicamente, la mayoría de los casos cursan asintomáticos y su diagnóstico se realiza a partir de un hallazgo ecocardiográfico. De hecho, entre el 5 y el 10% de los casos el diagnóstico de FEP es intraoperatorio5. En nuestra población, el 57% se diagnosticaron por ETT, el 35% de los casos mediante ETE, y en un caso (8% de nuestra muestra) el diagnóstico fue intraoperatorio.
La clínica más frecuente de presentación es el evento embólico neurológico, que se puede originar por desprendimiento de fragmentos de tumor o por embolismo de un trombo formado en el FEP. Otros síntomas pueden ser disnea de esfuerzo por disfunción valvular, síncope, angina por embolismos coronarios u oclusión ostial, o tromboembolismos periféricos. Se han descrito también casos de muerte súbita, probablemente por obstrucción total de un ostium coronario5,11,12,18,19,21,25.
En el caso de los FEP en cavidades derechas casi siempre son asintomáticos, aunque los de mayor tamaño pueden causar obstrucción hemodinámica y simular una estenosis tricúspide, o bien generar arritmias o tromboembolismo pulmonar.
Se ha observado relación entre los FEP en posición izquierda y los tromboembolismos retinianos y cerebrales8. No obstante, Tamin et al., en un estudio con 511 casos, no encontraron relación estadísticamente significativa entre las características ecocardiográficas (tamaño, movilidad o posición aórtica-mitral del FEP) y la presencia de un accidente cerebrovascular5. Por el contrario, otras experiencias han sugerido una correlación entre el tamaño y la movilidad del FEP con mortalidad o tromboembolismo no invalidante6.
Ecocardiográficamente el FEP constituye una masa endocárdica pequeña (<1,5cm) y móvil, con un patrón moteado homogéneo y un punteado característico en sus bordes que se ancla por medio de un pedículo a los bordes de las valvas semilunares, aunque en algunos casos se describe como una masa sésil9. Las pruebas de imagen, como la TAC y la RMN, no son tan sensibles como la ecocardiografía, sobre todo en las FEP de pequeño tamaño. El patrón oro para la detección de FEP es la ETE, sobre todo en FEP menores a 2mm13, dado que no en todos los pacientes se logra un diagnóstico certero a través de la ecocardiografía transtorácica. Funcionalmente los FEP pueden producir estenosis como insuficiencia valvular, aunque son muy pocos los casos en donde se describe una disfunción valvular, y solo excepcionalmente es severa6,9,13.
En cuanto al tratamiento, en pacientes sintomáticos se recomienda la cirugía. En caso de embolismos cerebrales se aconseja que la cirugía se retrase de 2-4 semanas con el fin de evitar la transformación hemorrágica del evento isquémico. En la actualidad no existe un consenso claro sobre la actuación en pacientes asintomáticos. En aquellos pacientes en los que se decide seguimiento o hay contraindicación quirúrgica, se aconseja la anticoagulación o la antiagregación plaquetaria, con el fin de disminuir el riesgo de tromboembolismo5,6,12, aunque la ausencia de ensayos clínicos aleatorizados impide un consenso claro acerca del tratamiento en estos casos. Tamin et al., en su extensa cohorte, no observaron una diferencia significativa en la aparición de accidente cerebrovascular en pacientes tratados con estas terapias respecto a los no tratados, aunque recomiendan el uso de antiagregantes. La incidencia de ictus en el grupo quirúrgico fue del 0% en el primer año y del 5% a los 5 años, menor que en el grupo de pacientes en donde la actitud fue conservadora (6% y 13% al año y a los 5 años, respectivamente, a pesar de tratamiento anticoagulante o antiagregante)5. En nuestra población, 3 pacientes (21,4%) tuvieron un seguimiento previo a la cirugía de entre 1 y 2 años, sin eventos neurológicos durante el periodo de seguimiento con terapia antiagregante. Por otro lado, la supervivencia a los 30 días de la resección aislada de FEP es cercana al 100%, similar a nuestra experiencia. En casos con procedimientos añadidos, la supervivencia dependerá del tipo de procedimiento que se asocia y de la morbimortalidad que pueda representar5,8,11,14. En nuestra serie la supervivencia de los procedimientos combinados a los 30 días fue del 100%.
Por tanto, se considera que en pacientes asintomáticos con un FEP en cavidades izquierdas la resección quirúrgica debe ser de elección, sobre todo con FEP móviles de gran tamaño, dado su mayor potencial embolígeno. En los FEP de cavidades derechas, sobre todo en los pequeños, el seguimiento ecocardiográfico parecería la actitud más acertada, ya que el riesgo de embolismo pulmonar sintomático o fatal es pequeño. En los FEP de cavidades derechas asociados a comunicación interauricular, el riesgo de embolismo paradójico es elevado, por lo que estos casos precisan cirugía5,6,8,12,13. En aproximadamente la mitad de los casos el FEP la indicación primaria es de cirugía, mientras que en el resto la indicación se realiza asociada a otras patologías cardiacas8, de manera similar a lo encontrado en nuestra serie.
Respecto a la técnica quirúrgica, en la serie de Gowda et al. el 81% de los casos precisaron únicamente excisión del FEP, en el 10% se requirió sustitución y en el 9%, reparación6. En nuestra serie no fue necesaria la sustitución o la reparación valvular posterior a la resección subendocárdica de FEP aislados, presentados sobre válvulas sin disfunción previa. Ciertos autores describen el uso de la crioablación en la zona de exéresis del tumor con la finalidad de disminuir el riesgo de recurrencia en caso de exéresis incompletas o subendocárdicas. La mayoría de los casos de crioablación descritos en patología cardiaca tumoral se refieren a tratamientos de mixomas, con muy pocas publicaciones en FEP, en su mayoría casos aislados con un seguimiento no mayor a 3 años26,28,29. En nuestra población, en el 35,7% de los pacientes (5 casos) se realizó crioablación concomitante a la exéresis tumoral. En este escenario, la crioablación es una técnica segura que no produce necrosis o fibrosis del tejido valvular, a diferencia de las energías que aplican hipertermia, como la radiofrecuencia.
El riesgo de recurrencia tras la cirugía es bajo y puede ocurrir por una exéresis incompleta del tumor o por la persistencia del mismo trauma que provocó el tumor primario. Se ha descrito ausencia de recurrencias en seguimientos de hasta 11 años5,6,8,13,14. Tamin et al. describen una tasa de recurrencia del 1,6%, con recidivas a 1,5 y 6 años5. En nuestra serie, el seguimiento medio fue de 3,2±2,22 años, y ninguno presentó recidiva del FEP.
Nuestro estudio tiene limitaciones. Representa una experiencia retrospectiva unicéntrica en un grupo pequeño de pacientes con un seguimiento todavía corto. Adicionalmente, no se han podido comparar los resultados con pacientes manejados conservadoramente.
ConclusiónLa ETE es el patrón oro en el diagnóstico del FEP, sobre todo en tumores de pequeño tamaño (<5mm), en los que es muy superior en términos de sensibilidad respecto a la ecocardiografía transtorácica. Aunque los FEP son tumores benignos y normalmente asintomáticos, pueden cursar con cuadros embólicos graves, sobre todo en los tumores localizados en cavidades izquierdas, tanto en su debut como en el seguimiento. Dado que su tratamiento quirúrgico, sobre todo en pacientes sin patología añadida, es de bajo riesgo, con muy buenos resultados en cuanto a mortalidad, posibilidades de preservación valvular y recurrencia, sugerimos la resección quirúrgica precoz en el momento de su detección, incluso en pacientes asintomáticos. Aun cuando el riesgo de recurrencia es bajo, la crioablación concomitante podría ser una terapia eficaz e inocua en pacientes con resecciones incompletas /subendocárdicas, aunque se requieren más estudios con mayor número de pacientes y seguimientos a más largo plazo para confirmar su eficacia. En aquellos pacientes en quienes existe una contraindicación quirúrgica o alto riesgo aconsejamos la anticoagulación y el seguimiento ecocardiográfico, aunque en la actualidad no existen estudios a largo plazo que ratifiquen esta indicación.
La realización de ensayos clínicos aleatorizados sería determinante para establecer el correcto manejo médico y quirúrgico de estos pacientes, quizás en pacientes con lesiones de pequeño tamaño asintomáticas y con riesgo quirúrgico moderado o alto. Sin embargo, debido a lo infrecuente de esta patología, esta evidencia es difícil de alcanzar, por lo que la creación de registros multicéntricos de patología tumoral cardiaca podría cubrir parcialmente esta laguna de conocimiento.
FinanciaciónNinguna.
AutoríaTodos los autores han contribuido a la elaboración de este manuscrito.
Conflicto de interesesTodos los autores declaran que no tienen ningún conflicto de intereses respecto al contenido de esta publicación.