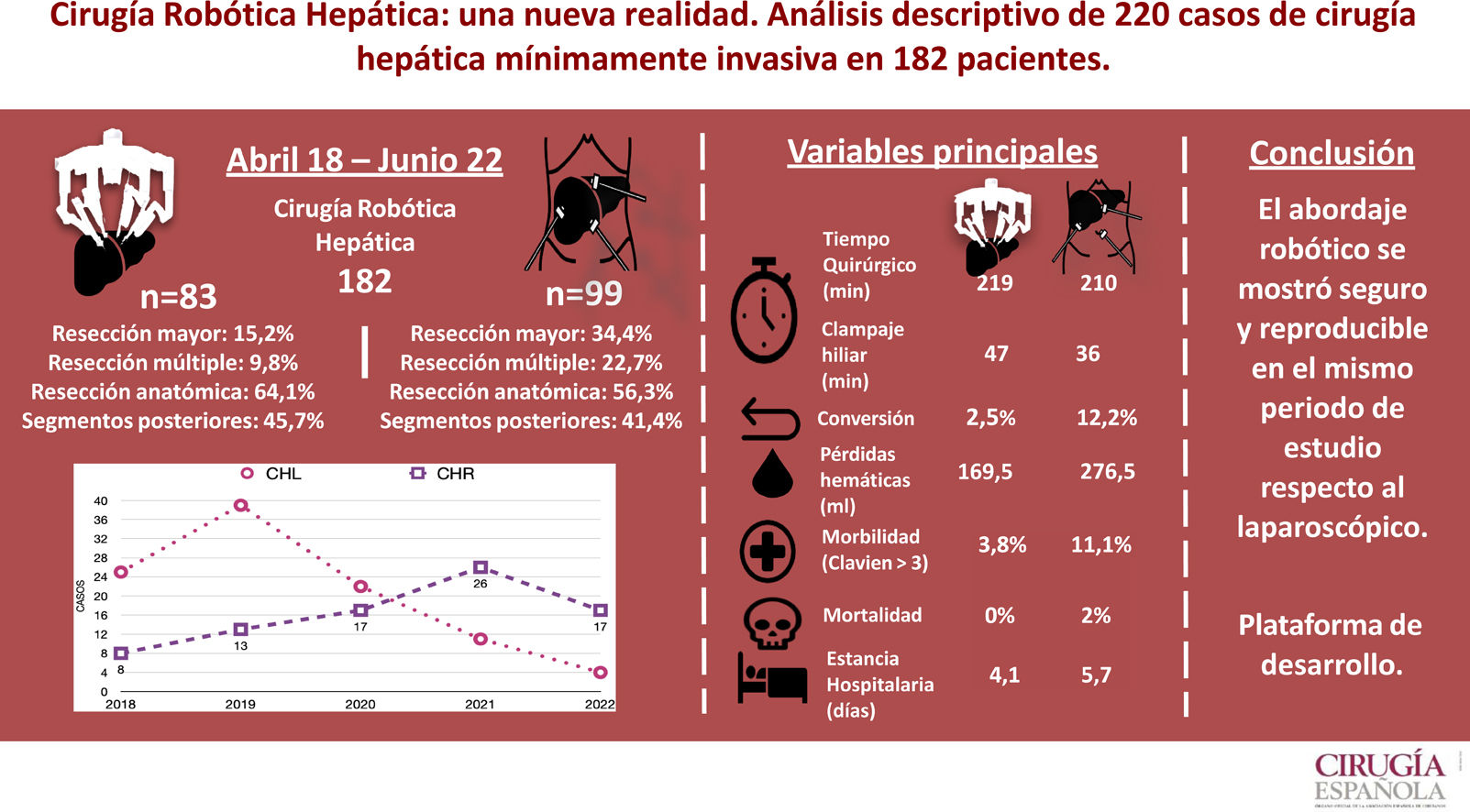
El nivel de recomendación del abordaje robótico en la cirugía hepática es controvertido. Se realiza un análisis descriptivo, retrospectivo yunicéntrico de los resultados a corto plazo de la cirugía hepática robótica y laparoscópica en un mismo periodo.
MétodosAnálisis descriptivo del abordaje robótico y laparoscópico sobre 220 resecciones en 182 pacientes sometidos a cirugía hepática mínimamente invasiva.
ResultadosEntre abril de 2018 y junio de 2022 se realizaron 92 resecciones hepáticas robóticas (RHR) en 83 pacientes y 128 laparoscópicas (RHL) en 99 pacientes. Se observaron más resecciones mayores (p<0,001) y más resecciones múltiples (p=0,002) en el grupo CHL. El porcentaje de resecciones anatómicas fue similar (RHR: 64,1 vs. RHL: 56,3%). En el grupo CHL el tiempo medio operatorio fue de 212min (DE: 52,1), las pérdidas hemáticas de 276,5ml (100-1.000) y la tasa de conversión del 12,1%. La estancia media hospitalaria fue de 5,7 días (DE: 4,9), la morbilidad fue del 27,3%, con un 2% de mortalidad. En el grupo CHR el tiempo medio operatorio fue de 217min (DE: 53,6), las pérdidas hemáticas fueron de 169,5ml (100-900) y la tasa de conversión del 2,5%. La estancia media hospitalaria fue de 4,1 días (DE: 2,1) y la morbilidad fue del 15%, con mortalidad nula.
ConclusiónLa cirugía mínimamente invasiva hepática es una técnica segura y reproducible. La CHR permite realizar resecciones hepáticas con seguridad y parece ser una técnica no inferior a la CHL, pero para determinar el abordaje mínimamente invasivo de elección en cirugía hepática se requieren estudios aleatorizados.
The level of recommendation of the robotic approach in liver surgery is controversial. The objective of the study is to carry out a single-center retrospective descriptive analysis of the short-term results of the robotic and laparoscopic approach in liver surgery during the same period.
MethodsDescriptive analysis of the short-term results of the robotic and laparoscopic approach on 220 resections in 182 patients undergoing minimally invasive liver surgery.
ResultsBetween April 2018 and June 2022, a total of 92 robotic liver resections (RLR) were performed in 83 patients and 128 laparoscopic (LLR) in 99 patients. The LLR group showed a higher proportion of major surgery (P<.001) and multiple resections (P=.002). The two groups were similar in anatomical resections (RLR 64.1% vs. LLR 56.3%). In the LLS group, the average operating time was 212min (SD 52.1). Blood loss was 276.5ml (100-1000) and conversion 12.1%. Mean hospital stay was 5.7 (SD 4.9) days. Morbidity was 27.3% and 2% mortality. In the RLS group, the mean operative time was 217min (SD 53.6), blood loss 169.5ml (100.900), and conversion 2.5%. Mean hospital stay was 4.1 (SD 2.1) days. Morbidity was 15%, with no mortality.
ConclusionMinimally invasive liver surgery is a safe technique, and in particular, RLS allows liver resections to be performed safely and reproducibly; it appears to be a non-inferior technique to LLS, but randomized studies are needed to determine the minimally invasive approach of choice in liver surgery.
La primera cirugía hepática laparoscópica (CHL) a nivel mundial fue publicada en el año 19911 y en España en el año 20002. Esta cirugía mínimamente invasiva fue validada posteriormente en varios consensos internacionales3–8, otorgando a la CHL un alto grado de aceptación y recomendación, abriendo así sus indicaciones hasta casi equipararse con la cirugía hepática abierta (CHA)9–11.
La cirugía hepática robótica (CHR) fue introducida en 200112–14 tras la aprobación del sistema quirúrgico Da Vinci®15 por la Administración de Alimentos y Medicamentos de los EE. UU, (FDA). Consiste en una consola de interfaz entre el cirujano y un robot remoto de 4 brazos articulados (aunque requiere un cirujano entrenado en laparoscopia en el campo16). Su uso actualmente es muy limitado17, pero se está incrementando en todo el mundo10,18.
A pesar de que los resultados oncológicos parecen ser similares a la CHL para pacientes seleccionados19,20, el nivel de recomendación de la CHR es aún bajo, por lo que se reclaman registros prospectivos19,21.
El objetivo principal del estudio es realizar un análisis descriptivo de las indicaciones clínicas y los resultados quirúrgicos a corto plazo de la CHR y de la CHL en un mismo periodo temporal y en un mismo centro hospitalario por el mismo equipo quirúrgico.
Material y métodosAnálisis descriptivo, retrospectivo y unicéntrico de la cirugía hepática mínimamente invasiva hepática por intención de tratamiento y con un registro prospectivo de los casos. Periodo de estudio iniciado desde la introducción de la CHR en el hospital, en abril de 2018, y finalizado en junio de 2022. Todos los pacientes fueron operados en el mismo centro y por el mismo grupo de 8 cirujanos. La mayoría de los pacientes fueron operados por el mismo cirujano, si bien otros 3 cirujanos del grupo poseen la acreditación de consola. Se incluyeron todos los casos de cirugía hepática tanto maligna como benigna a los que se realizó una resección hepática. La nomenclatura de las resecciones hepáticas se registró según la clasificación de Brisbane 200022. Las complicaciones postoperatorias se registraron según la clasificación Dindo-Clavien23 hasta 90 días tras la intervención, incluyendo las readmisiones dentro del mismo periodo. Se calculó el Comprehensive Complicacion Index (CCI)24 para todos los pacientes.
Criterios de selecciónLos criterios de inclusión fueron comunes tanto para la CHR como la CHL, sin restricción en el grado ASA, y excluyendo pacientes menores de 18 años y con 2 o más laparotomías previas.
IndicacionesLas indicaciones para la cirugía fueron similares a las de la CHA. Resección hepática por tumor benigno sólo para lesiones sintomáticas o duda razonable en la evaluación radiológica. Resección hepática por metástasis hepáticas colorrectales en ausencia de carcinomatosis peritoneal o enfermedad irresecable. En los pacientes intervenidos por colangiocarcinoma se incluyó la linfadenectomía del hilio hepático. En pacientes con carcinoma hepatocelular, se incluyó solamente pacientes con cirrosis bien compensada (Child-Pugh clase A, 5 puntos).
Técnica robóticaEl protocolo quirúrgico en la CHR con el sistema quirúrgico Da Vinci® Xi (Intuitive Surgical, Sunnyvale, CA, EE.UU.) incluyó decúbito supino sobre colchón de fijación en posición francesa, mesa en anti-Trendelenburg de 15°, neumoperitoneo cerrado a 12mmHg y trócares sobre el ombligo siguiendo una línea recta transversa con aproximación del robot por la derecha del paciente. Para lesiones en el sector posterior se posicionó al paciente en decúbito lateral izquierdo de 90° y ajuste de la inclinación de la mesa a demanda mediante sincronización de los brazos robóticos con la mesa quirúrgica. Acoplamiento (docking) por la derecha del paciente con pinza bipolar (T1), cámara de 30° (T2), tijera monopolar (T3), y pinza de agarre «tip up» (T4), más un trocar accesorio de 12mm entre T2 y T3. Transección parenquimatosa robótica «pura» sin usar vessel sealer, mediante sistemática de «microfractura-coagulación» con pinza bipolar (puerto 1) y tijera monopolar (puerto 3), definida por la microdislaceración del parénquima y el uso selectivo de la energía bipolar y monopolar, que permite el aislamiento selectivo de los pedículos vasculares, obteniendo un plano exangüe y equivalente al obtenido por laparoscopia (fig. 1). Sección de radicales portales de segundo orden con Hem-o-locks® robóticos y endostapler (Endowrist®; Intuitive), con carga blanca de 45mm para las venas suprahepáticas (o vena porta en abordaje intraglissoniano) y con carga azul de 60mm para los radicales portales de primer orden (en abordaje extraglissoniano).
Transección parénquima hepático mediante «microfractura-coagulación» por vía robótica.
Leyenda: Transección parénquima hepático mediante «microfractura-coagulación» por vía robótica mediante la aplicación combinada de energía monopolar y bipolar. a) Posición inicial de las herramientas pinza bipolar y tijera monopolar. b) Acción de microfractura sobre la superficie parenquimatosa para profundizar en la transección. c) Acción de coagulación selectiva tras la profundización.
Para la CHL se usó decúbito supino sobre colchón de vacío en posición francesa, la mesa en anti-Trendelenburg de 15°, neumoperitoneo cerrado a 12mmHg y 5 trócares en ángulos de trabajo de 60°. Transección parenquimatosa mediante disector-aspirador ultrasonico (CUSA; Integra®), para el aislamiento selectivo de los elementos vasculares y pediculares, y uso selectivo de coagulación por radiofrecuencia (Aquamantys®; Medtronic), obteniendo un plano de transección parenquimatosa exangüe. Sección de radicales portales de tercer orden por sellado bipolar (Ligasure® Bluntip; Covidien), segundo orden con Hem-o-locks® robóticos y endograpadora articulada (Echelon Flex®; Ethicon), con carga blanca de 45mm para las venas suprahepáticas (o vena porta en abordaje intraglissoniano) y con carga azul de 60mm para los radicales portales de primer orden (en abordaje extraglissoniano).
En todos los casos se realizó clampaje hiliar extracorpóreo mediante paso de cinta por el hiato de Winslow a través de incisión de trocar de 5mm en el lado contralateral a la resección, lo que permite el ajuste manual de la presión sobre el pedículo hepático. La extracción del espécimen fue en Endobag® XL por incisión accesoria de Pfannenstiel o por ampliación de uno de los trócares. Solo se cerró la aponeurosis de los trócares de 11mm (o reductora) y de la incisión de extracción de la pieza. Todos los pacientes siguieron el mismo protocolo de recuperación posquirúrgica incentivada tipo «Fast Track»25, que incluye tanto la prehabilitación multimodal prequirúrgica26, como un protocolo de recuperación incentivada tras la cirugía (ERAS)27.
Análisis estadísticoSe usó la prueba t de Student o U de Mann-Whitney para variables continuas y la prueba exacta de Fisher y la prueba de χ2 de Pearson para variables categóricas. Variables expresadas mediante medidas de frecuencia (porcentaje) para las variables cualitativas, y medidas de valor central para las variables cuantitativas, media (desviación estándar) y mediana (rango), según su distribución. Significación estadística de doble cola p<0,05. Todos los análisis se realizaron con el software SPSS® (IBM Corporation, Armonk, NY, EE. UU.).
ResultadosSe recogieron prospectivamente 182 pacientes de cirugía hepática entre abril de 2018 y junio de 2022, 83 intervenidos por vía robótica (CHR) y 99 por vía laparoscópica (CHL) (fig. 2).
Las características de los pacientes se recogen en la tabla 1, observándose que las variables referidas a la edad, el sexo, el IMC, ASA y el índice de Charlson son similares para ambos grupos. En cuanto al diagnóstico etiológico, también recogido en la tabla 1, se observa un porcentaje similar de patología maligna (CHR: 86,7 vs. CHL: 89,9%) siendo la cirugía por metástasis de origen colorrectal lo más frecuente en ambos grupos, y destacando un mayor número de hepatocarcinomas intervenidos por cirugía robótica.
Datos demográficos y etiológicos
| CHR (n=83) | CHL (n=99) | Valor de p | |
|---|---|---|---|
| Edad (años) | 62,9+13,4 | 63,3+12,2 | 0,899 |
| Mujeres (%) | 33 (39,8) | 48 (48,5) | 0,194 |
| IMC | 26,81+4,9 | 25,89+4,4 | 0,295 |
| ASA | 2,41+0,7 | 2,47+0,6 | 0,334 |
| Charlson | 6,9+2,5 | 7,4+2,8 | 0,218 |
| Etiología | 0,328 | ||
| Lesiones malignas (%) | 72 (86,7) | 89 (89,9) | |
| MCCR | 41 | 68 | |
| MCNCR | 4 | 4 | |
| CHC | 19 | 9 | |
| CCIH | 8 | 7 | |
| CV | 0 | 1 | |
| Lesiones benignas (%) | 11 (13,3) | 10 (10,1) | |
| Adenoma BCM | 3 | 2 | |
| Cistoadenoma | 2 | 1 | |
| Quiste hidatídico | 2 | 2 | |
| Hemangioma | 1 | 2 | |
| Quiste complicado | 2 | 2 | |
| HNF | 1 | 0 | |
| Enfermedad de Caroli | 0 | 1 |
Los datos se expresan en medias y desviación estándar o en porcentajes.
BCM: beta-catenina mutado; CCIH: colangiocarcinoma intrahepático; CHC: carcinoma hepatocelular; CHL: cirugía hepática laparoscópica; CHR: cirugía hepática robótica; CV: carcinoma vesicular; HNF: hiperplasia nodular focal; MCCR: metástasis de cáncer colo-rectal; MCNCR: metástasis de cáncer no colorrectal.
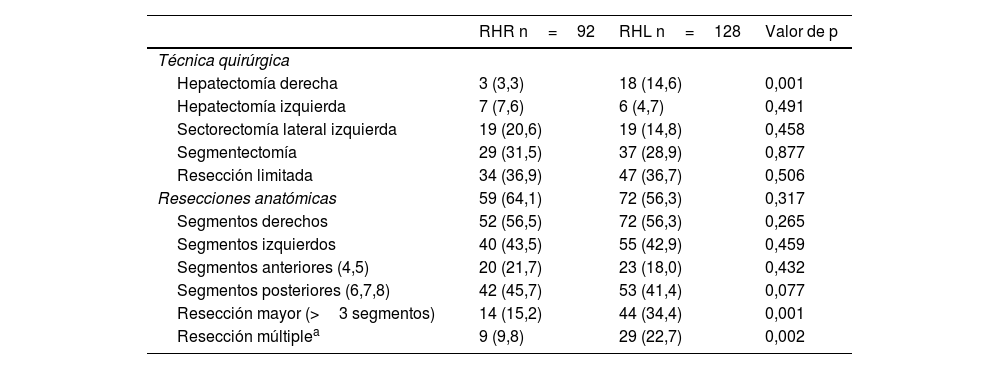
Tipos de resección (tabla 2)
Técnica quirúrgica. Resultados operatorios y postoperatorios
| RHR n=92 | RHL n=128 | Valor de p | |
|---|---|---|---|
| Técnica quirúrgica | |||
| Hepatectomía derecha | 3 (3,3) | 18 (14,6) | 0,001 |
| Hepatectomía izquierda | 7 (7,6) | 6 (4,7) | 0,491 |
| Sectorectomía lateral izquierda | 19 (20,6) | 19 (14,8) | 0,458 |
| Segmentectomía | 29 (31,5) | 37 (28,9) | 0,877 |
| Resección limitada | 34 (36,9) | 47 (36,7) | 0,506 |
| Resecciones anatómicas | 59 (64,1) | 72 (56,3) | 0,317 |
| Segmentos derechos | 52 (56,5) | 72 (56,3) | 0,265 |
| Segmentos izquierdos | 40 (43,5) | 55 (42,9) | 0,459 |
| Segmentos anteriores (4,5) | 20 (21,7) | 23 (18,0) | 0,432 |
| Segmentos posteriores (6,7,8) | 42 (45,7) | 53 (41,4) | 0,077 |
| Resección mayor (>3 segmentos) | 14 (15,2) | 44 (34,4) | 0,001 |
| Resección múltiplea | 9 (9,8) | 29 (22,7) | 0,002 |
Datos expresados en frecuencias y en porcentajes.
RHL: resección hepática laparoscópica; RHR: resección hepática robótica.
Se analizaron 92 RHR y 128 RHL. Se realizaron más resecciones mayores (p=0,001), hepatectomías derechas (p=0,001) y resecciones múltiples (p=0,002) en el grupo CHL. No obstante, el porcentaje de hepatectomías izquierdas, sectorectorectomías laterales izquierdas, segmentectomias, resecciones limitadas y resecciones anatómicas realizadas fue similar en ambos grupos. Se observó también un porcentaje similar de resecciones de segmentos derechos, segmentos izquierdos, segmentos posteriores (6,7,8) y segmentos anteriores.
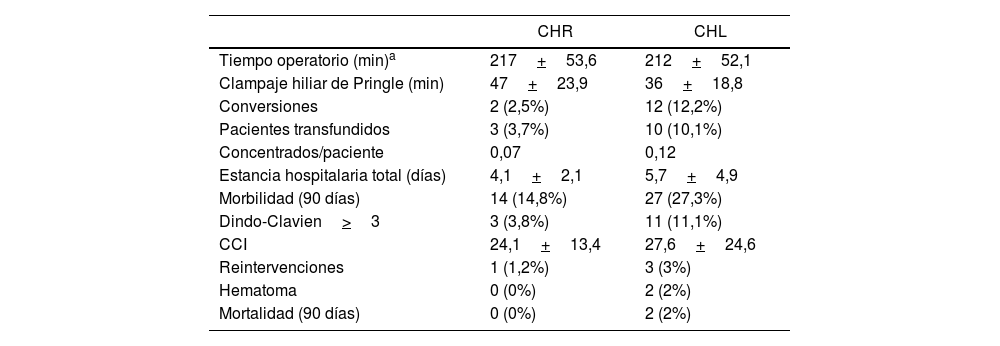
Análisis descriptivo intraoperatorio y postoperatorio (tabla 3).
Resultados descriptivos operatorios y postoperatorios
| CHR | CHL | |
|---|---|---|
| Tiempo operatorio (min)a | 217+53,6 | 212+52,1 |
| Clampaje hiliar de Pringle (min) | 47+23,9 | 36+18,8 |
| Conversiones | 2 (2,5%) | 12 (12,2%) |
| Pacientes transfundidos | 3 (3,7%) | 10 (10,1%) |
| Concentrados/paciente | 0,07 | 0,12 |
| Estancia hospitalaria total (días) | 4,1+2,1 | 5,7+4,9 |
| Morbilidad (90 días) | 14 (14,8%) | 27 (27,3%) |
| Dindo-Clavien>3 | 3 (3,8%) | 11 (11,1%) |
| CCI | 24,1+13,4 | 27,6+24,6 |
| Reintervenciones | 1 (1,2%) | 3 (3%) |
| Hematoma | 0 (0%) | 2 (2%) |
| Mortalidad (90 días) | 0 (0%) | 2 (2%) |
Datos expresados en frecuencias y porcentajes, medias y desviación estándar.
CHL: cirugía hepática laparoscópica; CHR: cirugía hepática robótica.
El tiempo medio operatorio fue de 217min (DE: 53,6) minutos con un tiempo medio de Pringle de 48,5min (DE: 23,9). La pérdida hemática fue de 169ml (DE: 126) (incluyendo en 44 casos sangrado negligible registrado como equivalente a 100ml), con una tasa de transfusión perioperatoria (primeras 24h) del 3,7% (media: 0,07 concentrados/paciente). Se convirtió un caso a cirugía laparoscópica por fallo irrecuperable del sistema de energía, lo que obligó a realizar la resección desde el inicio de la resección por vía laparoscópica, y otro caso a cirugía abierta por síndrome adherencial. Catorce pacientes (14,8%) presentaron algún tipo de morbilidad, con un CCI medio de 24,1 (DE: 13,4) de de los cuales 3 (3,8%) fueron Dindo-Clavien>3, incluyendo un caso de reintervención por lesión por deserosamiento de un asa durante las maniobras de adhesiolisis para la colocación de los trócares previa al docking. No hubo ningún caso de mortalidad. La estancia media hospitalaria fue de 4,1 (DE: 2,1) días.
Grupo CHLEl tiempo medio operatorio fue de 212min (DE: 52,1), con un tiempo medio de Pringle de 35min (DE: 18,9). Se registró una pérdida hemática de 276ml (DE: 256) (incluyendo sangrado negligible en 27 casos registrado como equivalente a 100ml), con una tasa de transfusión perioperatoria del 10,1% (media: 0,28 concentrados/paciente). Se convirtieron a laparotomía 12 pacientes (12,1%), 5 por intolerancia hemodinámica con la luxación del lóbulo hepático derecho (2), intolerancia a la reperfusión hepática tras desclampaje hiliar, o sangrado intraoperatorio (2), y 7 por falta de progresión de la disección quirúrgica debido a adherencias (2), infiltración diafragmática, riesgo de rotura de la cápsula tumoral, dificultad técnica de acceso al sitio de disección (2), y dificultad para localizar alguna de las lesiones. 27 (27,3%) pacientes presentaron algún tipo de morbilidad con un CCI medio de 27,6 (DE: 24,6), de los cuales 11 (11,1%) fueron Dindo-Clavien>3. Hubo una reintervención por estenosis posquirúrgica de la vía biliar tras hepatectomía derecha, una por evisceración de la laparotomía después de conversión a CHA y otra por oclusión intestinal por brida que requirió resección intestinal. Hubo 2 (2,1%) casos de mortalidad a 90 días (uno por progresión pulmonar de la enfermedad no resecada y otro por insuficiencia hepática postoperatoria tras el segundo tiempo de resección hepática tipo ALPPS). La estancia media fue de 5,7 (DE: 4,9) días.
DiscusiónSi bien la cirugía hepática mínimamente invasiva presenta unos resultados superiores a la CHA9–11, la CHR ha sido objeto de controversia desde su inicio12–16 por la falta de los instrumentos habituales en la cirugía hepática, tales como el disector ultrasónico CUSA, el coagulador de radiofrecuencia o el sellador bipolar. No obstante, presenta otras ventajas como son los instrumentos articulados que permiten rodear los pedículos glissonianos (especialmente del lado izquierdo) y facilitan realizar suturas en puntos de hemorragia16.
Entre los artículos recientemente publicados en CHR28–38, se ha comunicado la viabilidad y seguridad de los procedimientos robóticos con resultados equivalentes a la CHL en pacientes seleccionados y en centros de alto volumen39–43, por lo que la CHR mantiene una valoración no inferior al abordaje laparoscópico7,8.
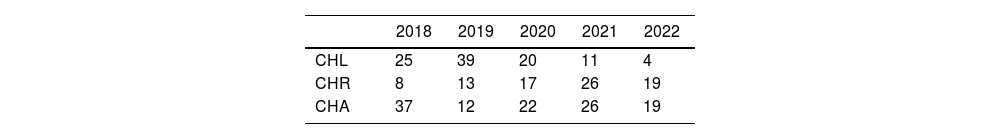
En nuestra experiencia, el abordaje robótico se ha incrementado año tras año, en detrimento del abordaje laparoscópico, que ha disminuido paralelamente (tabla 4). Aunque el uso de la CHR sigue siendo internacionalmente muy limitado17, se está incrementando en todo el mundo18, quizá favorecido por una curva de aprendizaje más corta44 que permite realizar resecciones complejas más tempranamente 39, registrando incluso menores complicaciones 45 y logrando completar un mayor número de cirugías de manera mínimamente invasiva40, optimizando la preservación de parénquima55 e incluso reduciendo la estancia hospitalaria56. Nuestra experiencia es coherente con las series publicadas recientemente, en las que se describe una menor tasa de conversión a CHA41,49,50.
Evolución de la vía de acceso en cirugía hepática electiva en función del tiempo durante el periodo de estudio (abril 2018-junio 2022)
| 2018 | 2019 | 2020 | 2021 | 2022 | |
|---|---|---|---|---|---|
| CHL | 25 | 39 | 20 | 11 | 4 |
| CHR | 8 | 13 | 17 | 26 | 19 |
| CHA | 37 | 12 | 22 | 26 | 19 |
Los valores totales incluyen resecciones mayores y menores.
CHA: cirugía hepática abierta; CHL: cirugía hepática laparoscópica; CHR: cirugía hepática robótica.
Si bien la CHL se encuentra en el estadio 3 IDEAL46 de la innovación quirúrgica («early adopter»), la CHR se encuentra actualmente en el estadio 2a («pioneer»). En su desarrollo cuenta con las lecciones ya aprendidas en la CHL: el abordaje caudal del hilio hepático47, el aislamiento de los pedículos siguiendo la cápsula de Laennec48 o las Cone Unit49, permitiendo resecciones más precisas y anatómicas. Su desarrollo representa un «regreso al futuro» para los cirujanos, dado que la falta de material específico para la transección del parénquima se ha compensado con el uso de las pinzas bipolares y las tijeras, asemejándose más a la ya conocida kellyclasia de la CHA.
La metodología de la transección parenquimatosa robótica no está sistematizada en la literatura, contando con un método híbrido en numerosas series. En nuestro caso se ha usado un procedimiento sistematizado puramente robótico consistente en la «microfractura-coagulación», sin usar herramientas externas a la plataforma (fig. 1), demostrando que las prestaciones robóticas de serie son suficientes para reproducir los resultados internacionalmente aceptados. De esta manera la transección del parénquima podría ser algo más lenta que en el abordaje laparoscópico, traduciéndose en un mayor tiempo de clampaje hiliar, lo que a su vez podría haber contribuido a obtener unas pérdidas hemáticas y un índice de tranfusión muy bajo en el grupo CHR.
La experiencia en CHL, con una curva de aprendizaje ya superada, permite realizar un mayor número de resecciones múltiples y de resecciones mayores. Aún así, mediante el sistema robótico se han conseguido realizar resecciones mayores antes que con la CHL en su momento, como la primera hepatectomía mayor antes de los primeros 10 casos (la primera hepatectomía izquierda fue operada en 3.° lugar y la primera hepatectomía derecha en 6.° lugar) y la primera bipartición hepática in situ tipo ALPPS antes de los 100 casos (82° lugar). El hecho de contar con 10 hepatectomías mayores en el grupo CHR (3 hepatectomías derechas) pero 24 en el grupo CHL (18 hepatectomías derechas) refleja que la complejidad quirúrgica de ambos grupos es diferente impidiendo realizar un análisis comparativo de los resultados. Posiblemente esta diferencia se deba a que inicialmente los casos más complejos eran intervenidos preferentemente por vía laparoscópica, aunque posteriormente la realización de RHR mayores se ha ido incrementando a medida que se acumulaba experiencia (fig. 2), siendo notoria la rapidez con que éstas se realizaron por primera vez.
Hay que matizar que a pesar de que estancia hospitalaria media fue menor para la CHR, quizás favorecida por haber menos resecciones mayores, en el grupo CHL hubo 12 conversiones que globalmente incrementaron la estancia. El mayor número de conversiones en este grupo podría deberse a una mejor selección de los pacientes en el grupo CHR.
Resulta sorprendente que a pesar de un mayor tiempo de clampaje hiliar en el grupo CHR, el tiempo operatorio de ambos grupos fue similar, quizás por el tiempo de embolsado y/o del tiempo empleado en la revisión hemostática, si bien no se registraron tales datos y podría ser interesante analizarlo en un futuro.
En referencia a las limitaciones del presente estudio, hay que destacar que los dos grupos no son comparables debido a la mayor incidencia de casos de hepatocarcinoma en el grupo CHR respecto al CHL, y también a la mayor incidencia de hepatectomías mayores y resecciones múltiples en el grupo CHL, por lo que no es posible el análisis comparativo de los resultados postoperatorios. Aunque el registro de los pacientes se efectuó prospectivamente, el análisis de los resultados fue retrospectivo. Por otra parte, el limitado número de RHR mayores no permitió realizar un emparejamiento ni un análisis de subgrupos. Aunque este hecho puede sesgar la interpretación de los resultados hay que destacar que la rápida implementación de la CHR permitió recoger un número similar de casos en el mismo periodo de tiempo.
Técnicamente el robot ofrece varias capacidades metahumanas, como la consola ergonómica, el fácil cambio a visión de verde de indocianina (ICG)51 desde los mandos de la consola a voluntad del cirujano, visión estereoscópica de 10 aumentos, 7 grados de movimiento, muy buena energía bipolar y monopolar, y filtrado del temblor esencial pudiendo todo ello influir en la proporción comparable de resecciones anatómicas o segmentos posteriores (6,7,8) consideradas difíciles por vía laparoscópica52–54. Como se indicó en la encuesta paneuropea sobre cirugía hepática57, hasta un 70% de los cirujanos hepáticos afirmaron que la cirugía hepática se realizará de forma mínimamente invasiva en el futuro, y hasta un 30% se inclinaron por la vía robótica, si bien actualmente el 85% de los cirujanos no ha realizado nunca CHR y un 40% nunca CHL compleja45.
Siguiendo así la vía de los pioneros, se apuesta por el trabajo multidisciplinar y se entiende el robot como una plataforma de implementación de nuevas tecnologías, como son la navegación intraoperatoria con ecografía intraoperatoria, ICG51, modelos 3D (virtuales y físicos)58,59 y su consulta intraoperatoria desde la consola, así como la realidad aumentada (AR)60, la telemedicina61 y/o la inteligencia artificial (IA). No hay que olvidar que la plataforma robótica ofrece una fuente inagotable de datos que van a tener un papel muy decisivo en la cirugía remota y en los protocolos de cirugía asistida por la IA. Se prevé que en los próximos 10 a 30 años la coexistencia de IA, AR, big data y la computación cuántica darán como resultado un salto disruptivo de la tecnología62, dotando a las plataformas robóticas de un potencial desconocido en el que los cirujanos deberemos implicarnos.
Como conclusión, la cirugía robótica permite, por un lado, realizar resecciones hepáticas de manera segura y reproducible con unos resultados no inferiores a las resecciones laparoscópicas, y por otro lado, dado que podría presentar una curva de aprendizaje más corta que la cirugía laparoscópica, permite llevar a cabo resecciones complejas de una manera más temprana. La evolución de la plataforma robótica nos lleva a pensar que en un futuro inmediato se instaure la cirugía robótica como el abordaje mínimamente invasivo de elección, requiriendo para ello estudios aleatorizados.
Conflicto de interesesLos autores firmantes declaran no tener ningún conflicto de intereses referente al contenido del presente manuscrito.