En los estudios multicéntricos la protocolización de los datos es una fase crítica que puede generar sesgos, sobre todo en estudios clínicos con presupuesto limitado. El objetivo es analizar la concordancia y la confiabilidad de los datos obtenidos en un estudio multicéntrico clínico entre la protocolización del centro de origen y la protocolización centralizada mediante un data-manager.
MétodoEstudio clínico multicéntrico de prevalencia nacional sobre un carcinoma familiar infrecuente, realizándose una doble protocolización de los datos: a)en el centro de origen, y b)centralizada con un data-manager. La concordancia se analiza para el global de los datos y para los dos subgrupos del proyecto: a)grupo a estudio (carcinoma familiar; protocolizan 30 investigadores) y b)grupo control (carcinoma esporádico; protocolizan 4). Las diferencias interobservador se evalúan mediante el índice de Kappa de Cohen.
ResultadosSe incluyen 689 pacientes: 252 del grupo a estudio y 437 del grupo control. Respecto al análisis de concordancia del estadio tumoral, se han objetivado un 2,5% de discordancias, siendo alta la concordancia entre protocolizadores (Kappa=0,931). Respecto a la valoración del riesgo de recidiva, las discordancias fueron del 7% de los casos, siendo alta la concordancia (Kappa=0,819). Respecto a la clasificación ecográfica TIRADS, las discordancias son del 6,9% y la concordancia es alta (Kappa=0,922). Se han detectado un 4,6% de errores de transcripción.
ConclusionesEn los estudios multicéntricos clínicos la protocolización centralizada de los datos por un data-manager parece presentar resultados similares a la protocolización directa en la base de datos en el centro de origen.
In multicenter studies, the protocolization of data is a critical phase that can generate biases. The objective is to analyze the concordance and reliability of the data obtained in a clinical multicenter study between the protocolization in the center of origin and the centralized protocolization of the data by a data-manager.
MethodsNational multicenter clinical study about an infrequent carcinoma. A double protocolization of the data is carried out: (i)center of origin; and (ii)centralized by a data manager. The concordance between the data is analyzed for the global data and for the two groups of the project: (i)study group (familiar carcinoma, 30 researchers protocolize); (ii)control group (sporadic carcinoma, 4 people protocolize). Interobserver variability is evaluated using Cohen's kappa coefficient.
ResultsThe study includes a total of 689 patients with carcinoma: 252 in the study group and 437 in the control group. Regarding the concordance analysis of the tumor stage, 2.5% of disagreements were observed and the concordance between people who protocolize was near perfect (Kappa=0.931). Regarding the evaluation of the recurrence risk, disagreements occurred in 7% of the cases and the concordance was near perfect (Kappa=0.819). Regarding the sonography evaluation (TIRADS), the disagreements were 6.9% and the concordance was near perfect (Kappa=0.922). Also, 4.6% of transcription errors were detected.
ConclusionsIn multicenter clinical studies, the centralized data protocolization by a data-manager seems to present similar results to the direct protocolization in the database in the center of origin.
En las patologías poco frecuentes se está potenciando la realización de estudios multicéntricos clínicos que permitan conseguir series suficientemente grandes en relativamente poco tiempo para poder sacar conclusiones representativas1,2. Sin embargo, estos estudios también presentan inconvenientes, ya que los pacientes son manejados en centros diferentes y con protocolos no siempre iguales, lo cual va generando una heterogeneidad que puede condicionar los resultados. Además, el trabajo a distancia y por diferentes investigadores puede condicionar diferentes sesgos3.
Uno de los pasos donde se pueden producir sesgos es la protocolización de los datos3. Actualmente, la tendencia es a generar una base de datos online en la nube que permita a todos los centros la protocolización simultánea. Sin embargo, esta protocolización conlleva la implicación de diferentes investigadores que puede condicionar una mayor heterogeneidad a la hora de cumplimentar la base. Por otro lado, la protocolización centralizada, generalmente por un data-manager, conlleva mayor gasto y no se ha mostrado una mayor utilidad3.
En la mayoría de ensayos clínicos, sobre todo farmacéuticos, se ha instaurado la recopilación de datos electrónicos directamente en una base mediante sistemas de captura de datos con el objetivo de conferir una mayor integridad de los datos y acortar el tiempo del estudio. Sin embargo, estos sistemas no son fáciles de implantar4, ya que precisa de unas instalaciones previas del centro investigador, un aprendizaje por parte de los usuarios, suele ser requerida la participación del paciente y conlleva unos costos económicos. Por ello, estos sistemas son poco coste-efectivos para proyectos multicéntricos clínicos1,4 en los que resulta inasumible su coste y la infraestructura que precisa. Además, la recopilación de datos electrónicos mediante sistema de captura no está exenta de riesgos, y sus ventajas pueden perderse sin una adecuada utilización5.
Lo que sí se ha generalizado en los proyectos multicéntricos clínicos, la mayoría sin financiación específica, es la utilización de bases de datos online en la nube para la protocolización, si bien no se ha testado qué sesgos o errores puede conllevar esta situación de recogida de datos en un sistema online frente a la protocolización por un data-manager6,7, sobre todo si se tiene en cuenta que un sistema de almacenamiento de datos confiable no garantiza la confiabilidad de la entrada de los mismos. Así, se han descrito errores en la transcripción de datos, de tal manera que las entradas cerca del final de la hoja de inserción de datos se correlacionan con un mayor número de errores. Sin embargo, aun en estos casos hay estudios que indican que el control por un administrador de datos o data-manager puede considerarse un costo evitable y, en todo caso, hay autores que sugieren el control electrónico para monitorear la confiabilidad de la entrada de datos6. Así, hay estudios de costes sobre el proceso de recopilación electrónica de datos en los ensayos clínicos que muestran una reducción de los costes de recopilación superiores al 50%, con un rango de ahorro según el proyecto entre el 49 y el 62%8.
El objetivo de este estudio es analizar en un estudio multicéntrico clínico la concordancia entre la cumplimentación del protocolo de recogida de datos en el centro de origen y la protocolización centralizada de los datos mediante un data-manager, para valorar la confiabilidad de los datos.
Material y métodoDiseño del estudioEstudio multicéntrico de prevalencia nacional avalado por la Asociación Española de Cirujanos, siendo este estudio el primer objetivo principal de dicho proyecto. La población a estudio la constituyen los pacientes con un carcinoma familiar de baja incidencia poblacional.
Se diseñó un protocolo de recogida de datos específico para esta patología, donde se recogen variables socio-personales, clínicas, terapéuticas y de seguimiento. Dicho protocolo conlleva un informe anexo que especifica los datos a recoger en cada una de las variables. Además, se incluye el contacto para consultar cualquier duda al cumplimentarlo.
Recogida de datosLos datos son recopilados en el centro de origen por cada uno de los investigadores que colabora en el proyecto, cumplimentando el protocolo del proyecto. Dicho protocolo puede ser digital o en papel, pero no vierte directamente a la base de datos del proyecto.
Se realiza una doble protocolización:
- 1)
Protocolización 1 - Centro de origen. Se registran los datos tal y como se obtienen en el protocolo remitido desde el centro de origen.
- 2)
Protocolización 2 - Centralizada por un data-manager. Se registran los datos de manera centralizada, por un mismo investigador data-manager, que puede consultar cualquier duda respecto a las variables analizadas con el centro de origen.
La concordancia entre la protocolización realizada con los datos del centro de origen y la protocolización centralizada mediante un data-manager se analiza en tres grupos diferentes:
- 1)
Grupo 1 - Global del estudio. Se analiza la concordancia en el total de la muestra a estudio.
- 2)
Grupo 2 - Grupo a estudio del carcinoma familiar. Se analiza la concordancia en el grupo del carcinoma familiar. En este grupo participan 30 investigadores en la recogida de los datos en el centro de origen, que corresponden a las diferentes unidades hospitalarias que participan en el proyecto.
- 3)
Grupo 3 - Grupo control del carcinoma esporádico. Se analiza la concordancia en el grupo control que corresponde al carcinoma esporádico. En este grupo participan 4 investigadores en la protocolización en el centro de origen, ya que estos datos proceden solo de 4 unidades hospitalarias.
Del análisis de concordancia se excluyen la mayoría de las variables socio-personales, clínicas y terapéuticas, donde es excepcional la presencia de una discordancia, excepto error de transcripción. Se analizan tres grupos de variables:
- 1)
Clasificación pronóstica según el sistema TNM del American Joint Committee on Cancer. Dentro de este sistema, se analizan:
- a)
Tamaño (T).
- b)
Afectación ganglionar (N).
- c)
Afectación sistémica (M).
- d)
Estadio TNM.
- 2)
Valoración del riesgo de recidiva según la ATA (American Thyroid Association), que diferencia tres grupos de riesgos:
- a)
Bajo riesgo.
- b)
Riesgo intermedio.
- c)
Alto riesgo.
- 3)
Valoración ecográfica y clasificación en TIRADS (Thyroid Imaging Reporting and Data System), según la clasificación TIRADS coreana9. En ella se diferencian siete grupos de riesgo:
- a)
TIRADS 1.
- b)
TIRADS 2.
- c)
TIRADS 3.
- d)
TIRADS 4a.
- e)
TIRADS 4b.
- f)
TIRADS 4c.
- g)
TIRADS 5.
Por último se valoran los errores de transcripción detectados durante el proceso de protocolización.
Análisis estadísticoEl análisis estadístico se realizó mediante el uso de un paquete de software (SPSS, versión 19.0 para Windows, SPSS, Chicago, Illinois). Las diferencias interobservador se evaluaron mediante el índice de Kappa de Cohen. El coeficiente de concordancia tiene un valor que oscila entre 0 y 1, y su interpretación se corresponde con los siguientes rangos:
- •
No existe concordancia.
- -
0,01-0,19 - Concordancia muy baja.
- -
0,20-0,39 - Concordancia baja.
- -
0,40-0,59 - Concordancia moderada.
- -
0,60-0,79 - Concordancia buena.
- -
0,80-0,99 - Concordancia alta.
- •
Concordancia perfecta.
Los valores de p<0,05 se consideraron estadísticamente significativos. Existe concordancia entre los protocolizadores solo si el coeficiente de correlación es superior a 0,00, con o sin significación estadística.
Para la comparación entre los grupos 2 y 3 se aplicó el test de t de Student. Se aplicó el test exacto de Fisher cuando las tablas de contingencia tenían celdas con una frecuencia esperada <5.
ResultadosAspectos generales del proyectoEn el estudio se incluyen un total de 689 pacientes con carcinoma, que corresponden al grupo a estudio de carcinoma familiar (n=252) y al grupo control de carcinoma esporádico (n=437).
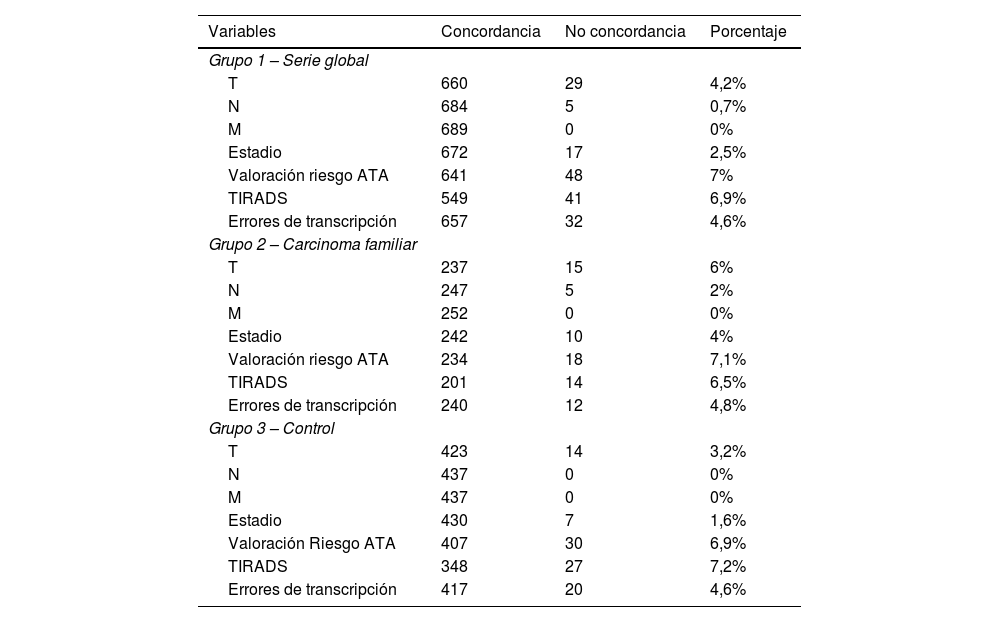
Análisis de concordancia según la clasificación pronóstica del sistema TNM1. Valoración del componente T del sistema TNMLa protocolización del componente T del sistema TNM ha presentado un 4,2% (n=29) de no concordancias. En el grupo2 del carcinoma familiar, con 30 protocolizadores, las discrepancias son del 6% (n=15), mientras que en el grupo3 control del carcinoma esporádico, con 4 protocolizadores, las discrepancias representan el 3,2% (n=14) de los casos (tabla 1). Dichas diferencias no son significativas (p=0,125).
Porcentaje de no concordancias entre la valoración inicial realizada en el centro de origen y la valoración final centralizada por data-manager
| Variables | Concordancia | No concordancia | Porcentaje |
|---|---|---|---|
| Grupo 1 – Serie global | |||
| T | 660 | 29 | 4,2% |
| N | 684 | 5 | 0,7% |
| M | 689 | 0 | 0% |
| Estadio | 672 | 17 | 2,5% |
| Valoración riesgo ATA | 641 | 48 | 7% |
| TIRADS | 549 | 41 | 6,9% |
| Errores de transcripción | 657 | 32 | 4,6% |
| Grupo 2 – Carcinoma familiar | |||
| T | 237 | 15 | 6% |
| N | 247 | 5 | 2% |
| M | 252 | 0 | 0% |
| Estadio | 242 | 10 | 4% |
| Valoración riesgo ATA | 234 | 18 | 7,1% |
| TIRADS | 201 | 14 | 6,5% |
| Errores de transcripción | 240 | 12 | 4,8% |
| Grupo 3 – Control | |||
| T | 423 | 14 | 3,2% |
| N | 437 | 0 | 0% |
| M | 437 | 0 | 0% |
| Estadio | 430 | 7 | 1,6% |
| Valoración Riesgo ATA | 407 | 30 | 6,9% |
| TIRADS | 348 | 27 | 7,2% |
| Errores de transcripción | 417 | 20 | 4,6% |
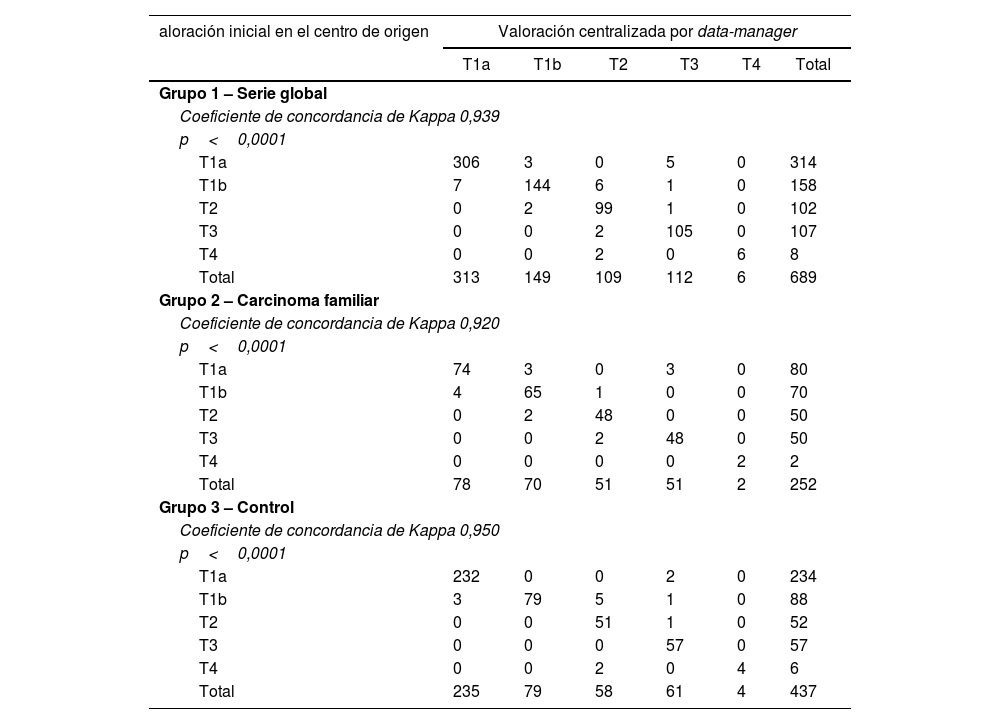
Tanto a nivel global (Kappa=0,939) como en el grupo2 del carcinoma familiar (Kappa=0,920) y en el grupo3 control (Kappa=0,950), la concordancia entre protocolizadores es alta (tabla 2).
Concordancia entre la valoración inicial realizada en el centro de origen y la valoración final centralizada por data-manager en la valoración del componente T (tamaño) del sistema TNM
| aloración inicial en el centro de origen | Valoración centralizada por data-manager | |||||
|---|---|---|---|---|---|---|
| T1a | T1b | T2 | T3 | T4 | Total | |
| Grupo 1 – Serie global | ||||||
| Coeficiente de concordancia de Kappa 0,939 | ||||||
| p<0,0001 | ||||||
| T1a | 306 | 3 | 0 | 5 | 0 | 314 |
| T1b | 7 | 144 | 6 | 1 | 0 | 158 |
| T2 | 0 | 2 | 99 | 1 | 0 | 102 |
| T3 | 0 | 0 | 2 | 105 | 0 | 107 |
| T4 | 0 | 0 | 2 | 0 | 6 | 8 |
| Total | 313 | 149 | 109 | 112 | 6 | 689 |
| Grupo 2 – Carcinoma familiar | ||||||
| Coeficiente de concordancia de Kappa 0,920 | ||||||
| p<0,0001 | ||||||
| T1a | 74 | 3 | 0 | 3 | 0 | 80 |
| T1b | 4 | 65 | 1 | 0 | 0 | 70 |
| T2 | 0 | 2 | 48 | 0 | 0 | 50 |
| T3 | 0 | 0 | 2 | 48 | 0 | 50 |
| T4 | 0 | 0 | 0 | 0 | 2 | 2 |
| Total | 78 | 70 | 51 | 51 | 2 | 252 |
| Grupo 3 – Control | ||||||
| Coeficiente de concordancia de Kappa 0,950 | ||||||
| p<0,0001 | ||||||
| T1a | 232 | 0 | 0 | 2 | 0 | 234 |
| T1b | 3 | 79 | 5 | 1 | 0 | 88 |
| T2 | 0 | 0 | 51 | 1 | 0 | 52 |
| T3 | 0 | 0 | 0 | 57 | 0 | 57 |
| T4 | 0 | 0 | 2 | 0 | 4 | 6 |
| Total | 235 | 79 | 58 | 61 | 4 | 437 |
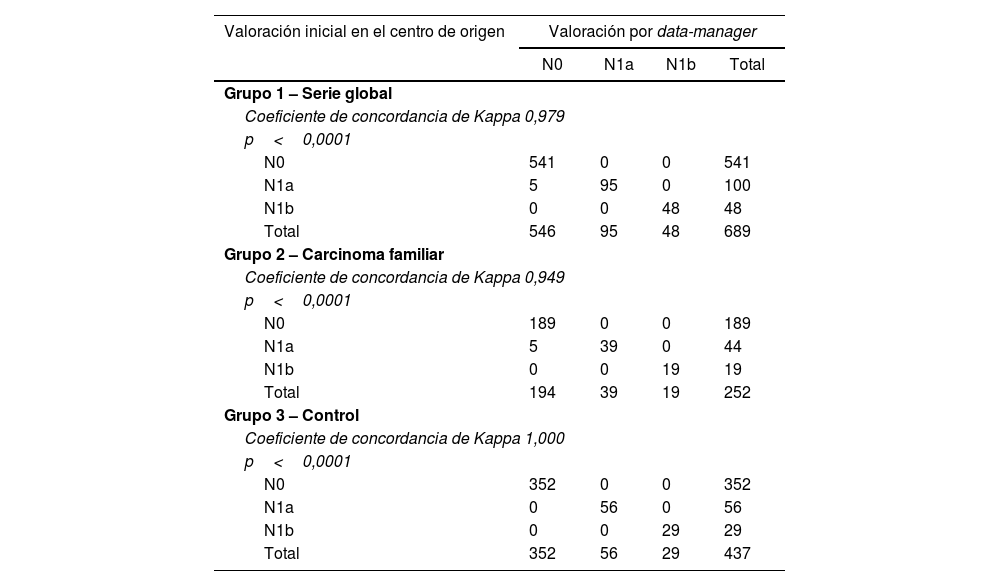
La protocolización del componente N de afectación ganglionar del sistema TNM ha presentado un 0,7% (n=5) de no concordancias, todas ellas en el grupo2 del carcinoma familiar (2%; n=5) (p=0,003) (tabla 1).
Tanto a nivel global (Kappa=0,979) como en el grupo2 del carcinoma familiar (Kappa=0,949) la concordancia entre protocolizadores es alta, y en el grupo3 control (Kappa=1,000) la concordancia es perfecta (tabla 3).
Concordancia entre la valoración inicial realizada en el centro de origen y la valoración final centralizada por data-manager en la valoración del componente N (afectación ganglionar) del sistema TNM
| Valoración inicial en el centro de origen | Valoración por data-manager | |||
|---|---|---|---|---|
| N0 | N1a | N1b | Total | |
| Grupo 1 – Serie global | ||||
| Coeficiente de concordancia de Kappa 0,979 | ||||
| p<0,0001 | ||||
| N0 | 541 | 0 | 0 | 541 |
| N1a | 5 | 95 | 0 | 100 |
| N1b | 0 | 0 | 48 | 48 |
| Total | 546 | 95 | 48 | 689 |
| Grupo 2 – Carcinoma familiar | ||||
| Coeficiente de concordancia de Kappa 0,949 | ||||
| p<0,0001 | ||||
| N0 | 189 | 0 | 0 | 189 |
| N1a | 5 | 39 | 0 | 44 |
| N1b | 0 | 0 | 19 | 19 |
| Total | 194 | 39 | 19 | 252 |
| Grupo 3 – Control | ||||
| Coeficiente de concordancia de Kappa 1,000 | ||||
| p<0,0001 | ||||
| N0 | 352 | 0 | 0 | 352 |
| N1a | 0 | 56 | 0 | 56 |
| N1b | 0 | 0 | 29 | 29 |
| Total | 352 | 56 | 29 | 437 |
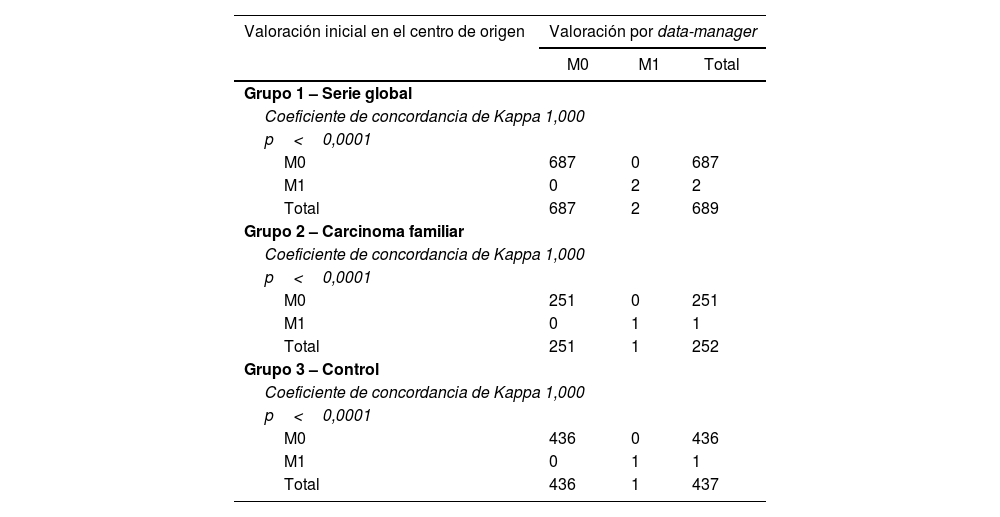
La protocolización del componente M de afectación sistémica del sistema TNM ha presentado una concordancia perfecta en los tres grupos (tablas 1 y 4).
Concordancia entre la valoración inicial realizada en el centro de origen y la valoración final centralizada por data-manager en la valoración del componente M (afectación sistémica) del sistema TNM
| Valoración inicial en el centro de origen | Valoración por data-manager | ||
|---|---|---|---|
| M0 | M1 | Total | |
| Grupo 1 – Serie global | |||
| Coeficiente de concordancia de Kappa 1,000 | |||
| p<0,0001 | |||
| M0 | 687 | 0 | 687 |
| M1 | 0 | 2 | 2 |
| Total | 687 | 2 | 689 |
| Grupo 2 – Carcinoma familiar | |||
| Coeficiente de concordancia de Kappa 1,000 | |||
| p<0,0001 | |||
| M0 | 251 | 0 | 251 |
| M1 | 0 | 1 | 1 |
| Total | 251 | 1 | 252 |
| Grupo 3 – Control | |||
| Coeficiente de concordancia de Kappa 1,000 | |||
| p<0,0001 | |||
| M0 | 436 | 0 | 436 |
| M1 | 0 | 1 | 1 |
| Total | 436 | 1 | 437 |
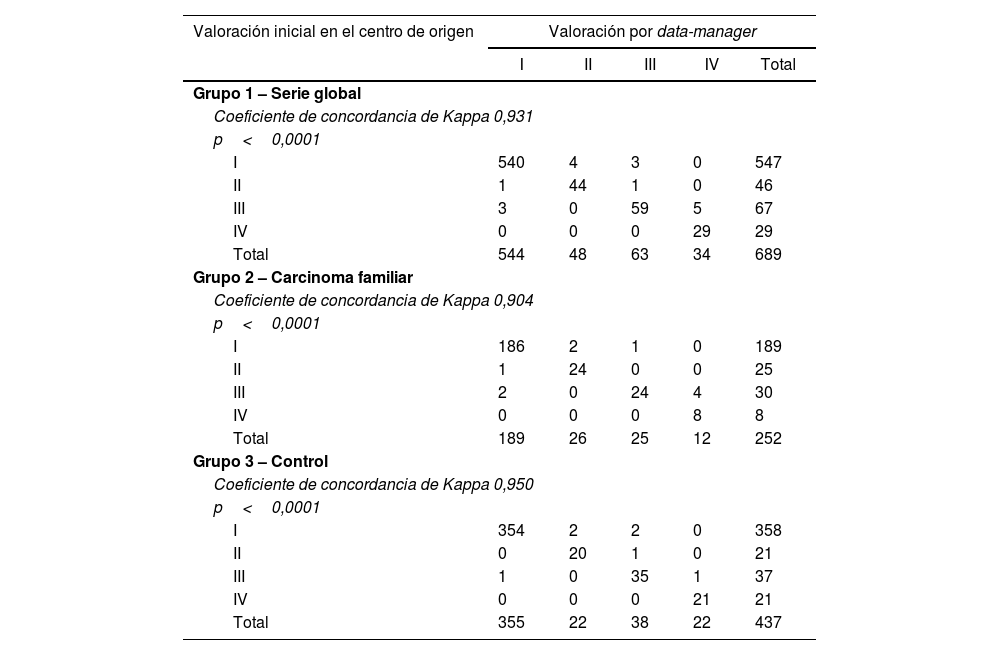
La protocolización del estadio del sistema TNM ha presentado un 2,5% (n=17) de no concordancias (n=17). Dicho porcentaje es mayor en el grupo2 del carcinoma familiar (4%; n=10) que en el grupo3 control del carcinoma esporádico (1,6%; n=7), si bien dichas diferencias no son significativas (p=0,094) (tabla 1).
Tanto a nivel global (Kappa=0,931) como en el grupo2 del carcinoma familiar (Kappa=0,904) y en el grupo3 control (Kappa=0,950), la concordancia entre protocolizadores es alta (tabla 5).
Concordancia entre la valoración inicial realizada en el centro de origen y la valoración final centralizada por data-manager en la valoración de la estadificación según el sistema TNM
| Valoración inicial en el centro de origen | Valoración por data-manager | ||||
|---|---|---|---|---|---|
| I | II | III | IV | Total | |
| Grupo 1 – Serie global | |||||
| Coeficiente de concordancia de Kappa 0,931 | |||||
| p<0,0001 | |||||
| I | 540 | 4 | 3 | 0 | 547 |
| II | 1 | 44 | 1 | 0 | 46 |
| III | 3 | 0 | 59 | 5 | 67 |
| IV | 0 | 0 | 0 | 29 | 29 |
| Total | 544 | 48 | 63 | 34 | 689 |
| Grupo 2 – Carcinoma familiar | |||||
| Coeficiente de concordancia de Kappa 0,904 | |||||
| p<0,0001 | |||||
| I | 186 | 2 | 1 | 0 | 189 |
| II | 1 | 24 | 0 | 0 | 25 |
| III | 2 | 0 | 24 | 4 | 30 |
| IV | 0 | 0 | 0 | 8 | 8 |
| Total | 189 | 26 | 25 | 12 | 252 |
| Grupo 3 – Control | |||||
| Coeficiente de concordancia de Kappa 0,950 | |||||
| p<0,0001 | |||||
| I | 354 | 2 | 2 | 0 | 358 |
| II | 0 | 20 | 1 | 0 | 21 |
| III | 1 | 0 | 35 | 1 | 37 |
| IV | 0 | 0 | 0 | 21 | 21 |
| Total | 355 | 22 | 38 | 22 | 437 |
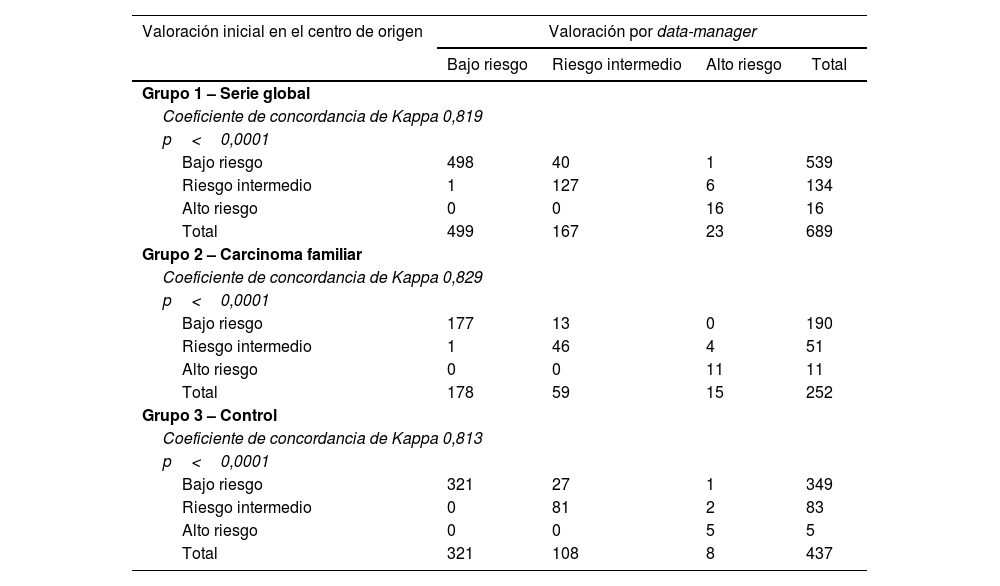
La protocolización de la valoración del riesgo de recidiva según la ATA ha presentado un 7% (n=48) de no concordancias. En el grupo2 del carcinoma familiar las discrepancias son del 7,1% (n=18), mientras que en el grupo3 control del carcinoma esporádico las discrepancias representan el 6,9% (n=30) de los casos (tabla 1). Dichas diferencias no son significativas (p=0,890).
Tanto a nivel global (Kappa=0,819) como en el grupo2 del carcinoma familiar (Kappa=0,829) y en el grupo3 control (Kappa=0,813), la concordancia entre protocolizadores es alta (tabla 6).
Concordancia entre la valoración inicial realizada en el centro de origen y la valoración final centralizada por data-manager en la valoración del riesgo de recidiva según la ATA
| Valoración inicial en el centro de origen | Valoración por data-manager | |||
|---|---|---|---|---|
| Bajo riesgo | Riesgo intermedio | Alto riesgo | Total | |
| Grupo 1 – Serie global | ||||
| Coeficiente de concordancia de Kappa 0,819 | ||||
| p<0,0001 | ||||
| Bajo riesgo | 498 | 40 | 1 | 539 |
| Riesgo intermedio | 1 | 127 | 6 | 134 |
| Alto riesgo | 0 | 0 | 16 | 16 |
| Total | 499 | 167 | 23 | 689 |
| Grupo 2 – Carcinoma familiar | ||||
| Coeficiente de concordancia de Kappa 0,829 | ||||
| p<0,0001 | ||||
| Bajo riesgo | 177 | 13 | 0 | 190 |
| Riesgo intermedio | 1 | 46 | 4 | 51 |
| Alto riesgo | 0 | 0 | 11 | 11 |
| Total | 178 | 59 | 15 | 252 |
| Grupo 3 – Control | ||||
| Coeficiente de concordancia de Kappa 0,813 | ||||
| p<0,0001 | ||||
| Bajo riesgo | 321 | 27 | 1 | 349 |
| Riesgo intermedio | 0 | 81 | 2 | 83 |
| Alto riesgo | 0 | 0 | 5 | 5 |
| Total | 321 | 108 | 8 | 437 |
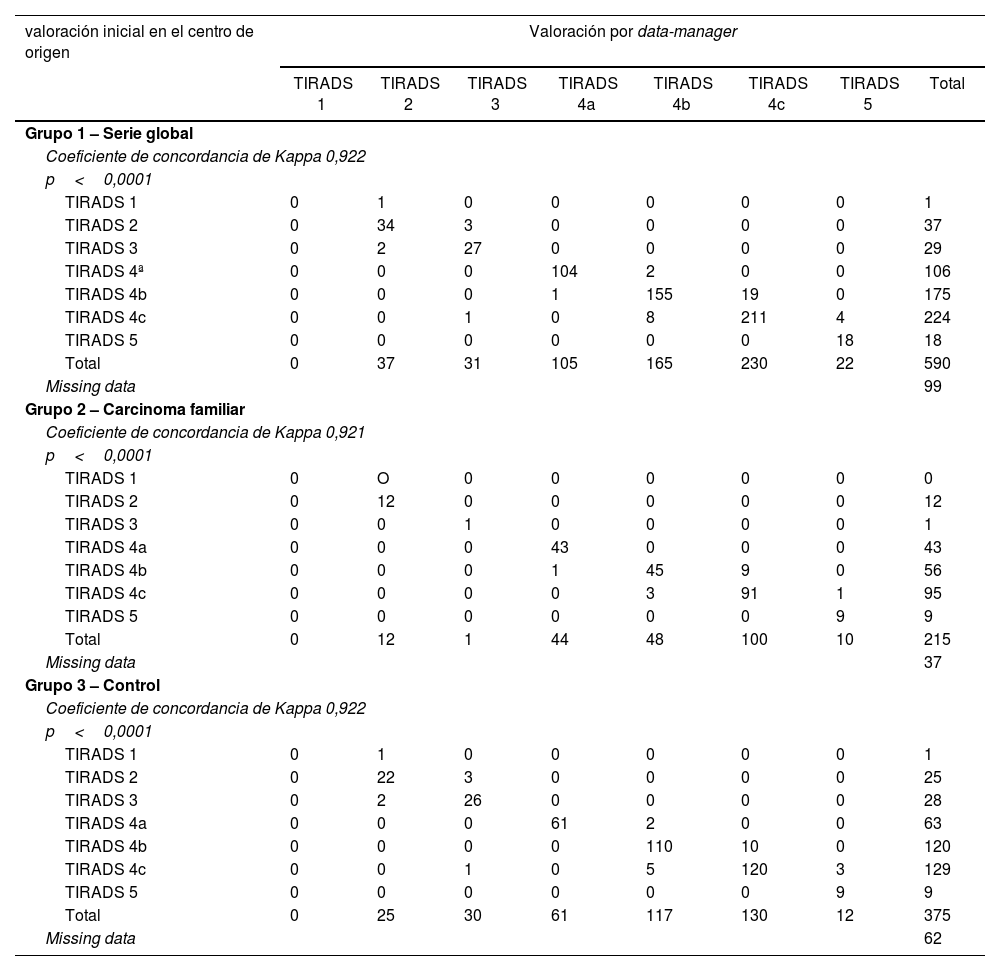
La protocolización de la valoración de la clasificación ecográfica del TIRADS ha presentado un 6,9% (n=41) de no concordancias. En el grupo2 del carcinoma familiar las discrepancias son del 6,5% (n=14), mientras que en el grupo3 control del carcinoma esporádico las discrepancias representan el 7,2% (n=27) de los casos (tabla 1). Dichas diferencias no son significativas (p=0,739).
Tanto a nivel global (Kappa=0,922) como en el grupo2 del carcinoma familiar (Kappa=0,921) y en el grupo3 control (Kappa=0,922), la concordancia entre protocolizadores es alta (tabla 7).
Concordancia entre la valoración inicial realizada en el centro de origen y la valoración final centralizada por data manager en la valoración del TIRADS ecográfico
| valoración inicial en el centro de origen | Valoración por data-manager | |||||||
|---|---|---|---|---|---|---|---|---|
| TIRADS 1 | TIRADS 2 | TIRADS 3 | TIRADS 4a | TIRADS 4b | TIRADS 4c | TIRADS 5 | Total | |
| Grupo 1 – Serie global | ||||||||
| Coeficiente de concordancia de Kappa 0,922 | ||||||||
| p<0,0001 | ||||||||
| TIRADS 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 |
| TIRADS 2 | 0 | 34 | 3 | 0 | 0 | 0 | 0 | 37 |
| TIRADS 3 | 0 | 2 | 27 | 0 | 0 | 0 | 0 | 29 |
| TIRADS 4ª | 0 | 0 | 0 | 104 | 2 | 0 | 0 | 106 |
| TIRADS 4b | 0 | 0 | 0 | 1 | 155 | 19 | 0 | 175 |
| TIRADS 4c | 0 | 0 | 1 | 0 | 8 | 211 | 4 | 224 |
| TIRADS 5 | 0 | 0 | 0 | 0 | 0 | 0 | 18 | 18 |
| Total | 0 | 37 | 31 | 105 | 165 | 230 | 22 | 590 |
| Missing data | 99 | |||||||
| Grupo 2 – Carcinoma familiar | ||||||||
| Coeficiente de concordancia de Kappa 0,921 | ||||||||
| p<0,0001 | ||||||||
| TIRADS 1 | 0 | O | 0 | 0 | 0 | 0 | 0 | 0 |
| TIRADS 2 | 0 | 12 | 0 | 0 | 0 | 0 | 0 | 12 |
| TIRADS 3 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 |
| TIRADS 4a | 0 | 0 | 0 | 43 | 0 | 0 | 0 | 43 |
| TIRADS 4b | 0 | 0 | 0 | 1 | 45 | 9 | 0 | 56 |
| TIRADS 4c | 0 | 0 | 0 | 0 | 3 | 91 | 1 | 95 |
| TIRADS 5 | 0 | 0 | 0 | 0 | 0 | 0 | 9 | 9 |
| Total | 0 | 12 | 1 | 44 | 48 | 100 | 10 | 215 |
| Missing data | 37 | |||||||
| Grupo 3 – Control | ||||||||
| Coeficiente de concordancia de Kappa 0,922 | ||||||||
| p<0,0001 | ||||||||
| TIRADS 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 |
| TIRADS 2 | 0 | 22 | 3 | 0 | 0 | 0 | 0 | 25 |
| TIRADS 3 | 0 | 2 | 26 | 0 | 0 | 0 | 0 | 28 |
| TIRADS 4a | 0 | 0 | 0 | 61 | 2 | 0 | 0 | 63 |
| TIRADS 4b | 0 | 0 | 0 | 0 | 110 | 10 | 0 | 120 |
| TIRADS 4c | 0 | 0 | 1 | 0 | 5 | 120 | 3 | 129 |
| TIRADS 5 | 0 | 0 | 0 | 0 | 0 | 0 | 9 | 9 |
| Total | 0 | 25 | 30 | 61 | 117 | 130 | 12 | 375 |
| Missing data | 62 | |||||||
Se han detectado errores de transcripción en el 4,6% (n=32) de los casos, porcentaje similar en el grupo2 (4,8%; n=12) y en el grupo3 (4,6%; n=20) (p=0,939) (tabla 1).
DiscusiónEn un ensayo clínico o estudio multicéntrico uno de los documentos básicos es el cuaderno de recogida de datos, donde el investigador incorpora los datos, clínicos y no clínicos, de los pacientes incluidos en el estudio. Estos datos deben integrarse en una base de datos electrónica para poder realizar el análisis de los mismos10,11. En la actualidad la recogida de datos tiende a realizarse directamente en una base de datos para agilizar el proyecto8. Además, los formularios electrónicos de recogida de datos suelen contener rutinas de verificación que reducen la entrada de datos erróneos y ofrecen a los administradores una visión continua de los datos y del proceso de recopilación4,12, pero presentan un coste difícil de asumir en muchos de los estudios multicéntricos clínicos, si bien hay que destacar que cada vez hay más plataformas informáticas y es de esperar que los costes irán bajando.
Independientemente de la forma de protocolización, es importante garantizar que la información se introduzca en la base de datos de forma coherente y precisa13-15, ya que incluso una pequeña proporción de errores puede tener un gran impacto en los resultados de un estudio16. Los errores aleatorios y sistémicos inadvertidos en la base de datos son fuentes de sesgo. Además, la disponibilidad de sistemas electrónicos confiables no es suficiente para garantizar la validez de los estudios transversales de base poblacional. De hecho, la relevancia del estudio depende en gran medida de dos pasos principales: la calidad de la recopilación de datos en las historias clínicas y la fidelidad de la transferencia de datos desde las historias clínicas al sistema electrónico. Cualquier debilidad en estas dos etapas invalida el estudio16-19. En este sentido, hay que resaltar la importancia de la capacitación de los investigadores clínicos, en especial la formación en buenas prácticas clínicas20-22.
Por todo ello, aunque los estudios multicéntricos ofrecen la ventaja de obtener información sobre patologías poco frecuentes en un período de tiempo relativamente corto, son estudios más heterogéneos y con más riesgos de presentar sesgos durante su realización1,3,22-24. Por ello, hay que buscar el equilibrio entre disminuir al máximo los potenciales sesgos que puede presentar el estudio, y no incrementar los costes de los estudios que los hagan poco viables. En este sentido, conceptualmente la protocolización centralizada de los datos por un data-manager implica una protocolización más homogénea de los mismos. Sin embargo, implica un coste económico a cargo del proyecto de investigación, a veces no asumible1,3,22-24, y suele implicar un mayor tiempo de protocolización que la protocolización independiente por los diferentes grupos.
Nuestro proyecto multicéntrico, desarrollado en el contexto de una sociedad científica nacional, muestra como con un desarrollo adecuado y un protocolo detallado con una explicación completa de lo que implica cada variable la concordancia es alta, y, por lo tanto, aceptable. El análisis detallado de los datos muestra que aunque en casi todas las variables analizadas la concordancia es alta y en algunos casos perfecta, existe un porcentaje de discordancias que en algunas variables llega hasta el 7%. Además, dichas discordancias se acentúan cuando el número de protocolizadores es más alto. Así, hay más discordancias en el grupo2 del carcinoma familiar, donde hay 30 protocolizadores, que en el grupo3 del grupo control del carcinoma esporádico, donde hay 4.
Además, las discrepancias se centran sobre todo en variables que tienen algún tipo de matización en su determinación. En este sentido, en variables como la afectación linfática (N) o la presencia de metástasis (M) la concordancia es casi perfecta, y el porcentaje de no concordancia es del 0,7% y del 0%, respectivamente. Sin embargo, en variables como la T, donde no solo es el tamaño, sino que factores como la afectación de estructuras vecinas, etc., la condicionan, el porcentaje de no concordancia es superior al 4%. Esta situación se acentúa en variables donde la clasificación es aún más compleja. Así, hay un 7% de discordancia en la valoración del riesgo de la ATA y un 6,9% en la clasificación ecográfica del TIRADS.
Por todo ello, aunque la concordancia entre la protocolización directa en el centro de origen y centralizada por un data-manager es alta, existe un porcentaje de discordancias en variables pronósticas importantes que oscila entre el 2,5% en el estadio tumoral TNM y el 7% en la valoración del riesgo según la ATA. Esto implica un porcentaje de error o sesgo solo en el proceso de protocolización de los datos del estudio multicéntrico. Así, en estas variables, aunque la concordancia es alta, está en el límite bajo de dicha concordancia, cerca de una concordancia solo buena. A esto hay que añadir un 4,6% de errores de transcripción detectados por el data-manager. Hay que recordar que la protocolización es un proceso lento y a veces tedioso, y no siempre se encarga el investigador principal en el centro de origen, sino que con frecuencia se delega. Todo ello conlleva errores de transcripción. Hay que indicar que el objetivo de este estudio no es detectar errores de transcripción, lo cual hace presuponer que posiblemente ese porcentaje sea mayor, ya que solo se pueden detectar errores de protocolización evidentes. Para detectarlos todos habría que revisar todas las variables del protocolo.
Por ello, la recogida de datos debe estar bien supervisada para mejorar la calidad de los estudios, ya que aunque el tener o no un data-manager no presenta diferencias, casi un 5% presenta errores de transcripción, y por ello hay que hacer bases de datos claras y de fácil cumplimentación, y es aconsejable que un miembro del equipo de recogida, con experiencia, revise los datos de las variables principales a estudio; o en la fase de diseño del estudio, incluir menos variables en la base pero de mayor calidad e interés para el análisis.
Se coincide con otros autores en que si el personal que protocoliza los datos está bien formado y supervisado, este no es el eslabón más débil de la cadena de gestión de datos6,25,26, si bien conlleva un margen de error, como se ha visto. Un aspecto que no se ha corroborado en nuestro proyecto, posiblemente por ser un protocolo corto, es que la posición en el campo de inserción en el protocolo juegue un papel importante en la proporción de errores. Las últimas posiciones están asociadas con más errores que las iniciales, especialmente cuando se consideran campos numéricos. Esto se ha atribuido a la fatiga del administrador de datos cuando los cuestionarios tienen demasiadas entradas6. Por lo tanto, estos resultados sugieren que, para crear cuestionarios más efectivos, la información más importante debe recopilarse en los primeros campos, debe reducirse el número de campos y deben usarse cuadros combinados o cuadros de texto en lugar de campos con inserción numérica directa (especialmente en la última parte del cuestionario). Una limitación de este estudio es que se basó en un único gestor de datos, por lo que es difícil generalizar nuestras conclusiones. Sin embargo, debe recordarse que la decisión de utilizar un solo administrador de datos se introdujo para mejorar la confiabilidad de la entrada de datos al reducir el sesgo entre administradores de datos. En este sentido hay que indicar que sería interesante poder realizar la comparación con otros estudios multicéntricos en otros contextos, para poder realizar una validación externa de los resultados. Por último, habría que valorar la calidad de los datos en los estudios multicéntricos sin data-manager, respecto a quién realiza la recogida de los datos (personal administrativo, residentes, etc.) y bajo qué supervisión, ya que todo ello puede condicionar los resultados, en cuyo caso la presencia de un data-manager sí que podría presentar diferencias.
En base a los datos de nuestro estudio, no es precisa la existencia de un data-manager dada la concordancia alta entre los dos sistemas de protocolización, y ello conlleva ahorro económico y de tiempo8. Los inconvenientes que puede presentar la protocolización online se pueden resolver, como en nuestro estudio, con bases de datos estándar que no precisan coste de línea directa o mantenimiento del sistema online, si bien no presenta las ventajas que ofrecen estos productos online con control de calidad, pero para proyectos multicéntricos como el que se evalúa en este trabajo pueden ser suficientes. Todos estos aspectos son importantes en estudios multicéntricos de patologías infrecuentes, donde la aportación de casos es importante, pero a la vez la financiación económica es reducida o inexistente. En un ensayo clínico en faseII los costos de administración de datos pueden estimarse como casi el 30% de los costos de los ensayos clínicos de faseIII8, y posteriormente dichos costos van a repercutir en los costos de comercialización de los medicamentos. En los estudios multicéntricos clínicos dichos costos van a condicionar la viabilidad del proyecto en sí27. Por último, indicar que, aunque no hay diferencias y podría no ser necesario un data-manager para protocolizar los datos, hay que mencionar que los data-manager suelen tener otras funciones en el desarrollo de un proyecto, como la coordinación de las pruebas de los pacientes, solucionar problemas que puedan surgir en los centros participantes, servir de enlace entre los investigadores, etc. Por lo tanto, si el presupuesto del proyecto lo permite, su contratación suele agilizar la realización de un proyecto.
En conclusión, podemos decir que en los estudios clínicos multicéntricos la protocolización centralizada de los datos por un data-manager parece presentar resultados similares a la protocolización directa en la base de datos en el centro de origen.
Comité éticoEl protocolo del estudio fue aprobado por el Comité Ético de Centro. Código del Comité de Ética: 2021-2-13-HCUVA.
Este estudio en seres humanos ha sido revisado por el Comité de Ética correspondiente y, por lo tanto, se ha realizado de acuerdo con las normas éticas establecidas en la Declaración de Helsinki de 2000, así como en la Declaración de Estambul de 2008.
Aspectos relevantes a destacar en el proyectoNo hay aspectos relevantes desde el punto de vista de la investigación que precisen ser destacados.
Contribución de los autores- 1.
Concepción y diseño: Ríos A.
- 2.
Adquisición de la parte sustancial de los datos: Ríos A, Ferrero-Herrero E, Puñal-Rodríguez JA, Durán M, Mercader-Cidoncha E, Ruiz-Pardo J, Rodríguez JM.
- 3.
Análisis e interpretación de los datos: Ríos A, Gutiérrez PR.
- 4.
Redacción del borrador del artículo: Ríos A.
- 5.
Revisión crítica del artículo: Ríos A, Gutiérrez PR, Mercader-Cidoncha E.
- 6.
Análisis y revisión estadística: Ríos A.
- 7.
Obtención de fondos para la financiación del proyecto: Ríos A.
- 8.
Supervisión: Ríos A, Ferrero-Herrero E, Puñal-Rodríguez JA, Gutiérrez PR, Durán M, Mercader-Cidoncha E, Ruiz-Pardo J, Rodríguez JM.
- 9.
Aprobación final de la versión a publicar: Ríos A, Ferrero-Herrero E, Puñal-Rodríguez JA, Gutiérrez PR, Mercader-Cidoncha E, Ruiz-Pardo J, Rodríguez JM.
No se han utilizado fuentes de financiación específicas para este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecer a la Asociación Española de Cirujanos y a la Sección de Cirugía Endocrina su apoyo en la realización de este trabajo.
Agradecer a las 24 unidades de cirugía endocrina españolas que participan en este estudio haber colaborado en la realización de este proyecto y facilitado los datos que lo han hecho posible.