La pancreatectomía distal (PD) mínimamente invasiva (MIS) está actualmente bien establecida, ya sea mediante técnica laparoscópica (PDL) o robótica (PDR).
MétodosDe 83 PD realizadas entre enero del 2018 y marzo del 2022, se realizaron 57 casos (68,7%) mediante MIS, 35 PDL y 22 PDR (da Vinci Xi). Se evalúa la experiencia de ambos procedimientos y el valor del abordaje robótico. Se analizan en detalle los casos de conversión.
ResultadosEl tiempo quirúrgico medio en las PDL y PDR fue de 201,2 (DE 47,8) y 247,54 (DE 35,8) min, (p=0,486). No se observaron diferencias en estancia hospitalaria ni en tasa de conversión, 6 (5-34) vs. 5,6 (5-22) días y 4 (11,4%) vs. 3 (13,6%) casos, respectivamente, (p=0.126). La tasa de reingresos fue de 3/35 (11,4%) y 6/22 (27,3%) casos, PDL vs. PDR respectivamente, (p=0.126).
No existieron diferencias en morbilidad (Dindo-Clavien ≥ III) entre ambos grupos. La mortalidad fue de un caso en el grupo robótico (un paciente con conversión precoz por afectación vascular). La tasa de resecciones R0 fue mayor en el grupo robótico (77,1% vs. 90,9%) alcanzando la significación estadística, p=0,04.
ConclusionesLa PDMIS es un procedimiento seguro y factible en pacientes seleccionados. Una planificación quirúrgica y la implementación escalonada basada en la experiencia previa ayudan a afrontar procedimientos técnicamente exigentes. Se sugiere que la PDR podría ser el abordaje de elección en la pancreatectomía corporocaudal, no siendo inferior a la PDL.
Distal pancreatectomy (DP) is currently well established as a minimally invasive surgery (MIS) procedure, using either a laparoscopic (LDP) or robotic (RDP) approach.
MethodsOut of 83 DP performed between January 2018 and March 2022, 57 cases (68.7%) were performed using MIS: 35 LDP and 22 RDP (da Vinci Xi). We have assessed the experience with the 2techniques and analyzed the value of the robotic approach. Cases of conversion have been examined in detail.
ResultsThe mean operative times for LDP and RDP were 201.2 (SD 47.8) and 247.54 (SD 35.8)min, respectively (p=0,486). No differences were observed in length of hospital stay or conversion rate: 6 (5–34) vs. 5.6 (5–22) days, and 4 (11.4%) vs. 3 (13.6%) cases, respectively (p=0.126). The readmission rate was 3/35 patients (11.4%) treated with LDP and 6/22 (27.3%) cases of RDP (p=0.126).
There were no differences in morbidity (Dindo-Clavien≥III) between the 2groups. Mortality was one case in the robotic group (a patient with early conversion due to vascular involvement). The rate of R0 resection was greater and statistically significant in the RDP group (77.1% vs. 90.9%) (P=,04).
ConclusionsMinimally invasive distal pancreatectomy (MIDP) is a safe and feasible procedure in selected patients. Surgical planning and stepwise implementation based on prior experience help surgeons successfully perform technically demanding procedures. RDP could be the approach of choice in distal pancreatectomy, and it is not inferior to LDP.
La primera pancreatectomía distal (PD) laparoscópica (PDL) fue realizada en 19941, desde entonces la cirugía mínimamente invasiva (MIS) del páncreas (CMIP) se ha ido extendiendo de forma lenta y poco uniforme2,3. En estos últimos años ha irrumpido la cirugía robótica aunque son pocos los centros de nuestro entorno que han adoptado esta técnica4-6.
Parece demostrado que la CMIP, en especial la PDL, así como la pancreatectomía distal robótica (PDR), consiguen una mejor y más rápida recuperación postoperatoria manteniendo los resultados oncológicos conseguidos en cirugía abierta7,8. El consenso internacional de 2019 acepta con un grado de evidencia 1B que ambas técnicas pueden ser utilizadas de forma indiferente. Sin embargo, en casos de enfermedad maligna (adenocarcinoma) se aceptó, con acuerdo de los expertos y del 95% de la audiencia, que se necesita aumentar el nivel de evidencia9,10.
El volumen del centro afecta en gran medida a los resultados y se considera el número total de resecciones pancreáticas y de CMIP9 un factor relevante. Es más controvertido si la experiencia en cirugía laparoscópica mejora el aprendizaje en cirugía robótica11.
Aunque las series en centros de alto volumen en cirugía robótica y estudios multicéntricos obtuvieron resultados prometedores, los datos no son concluyentes12,13; los 3 ensayos controlados aleatorizados en marcha están pendientes de resultados definitivos14-16.
En la reunión de consenso de Miami se recoge que no existe una evidencia clara en la superioridad de la PDR respecto a la PDL, siendo la capacitación, la experiencia y los recursos disponibles de cada centro los que deberían guiar qué abordaje utilizar7.
En este estudio se analiza una serie consecutiva de casos a los que se les ha realizado una pancreatectomía distal mínimamente invasiva (PDL y PDR), se presentan los resultados a corto plazo; todos los procedimientos se han realizado en el mismo periodo por el mismo grupo quirúrgico (acreditado para cirugía robótica). El objetivo fue evaluar su factibilidad, seguridad y resultados oncológicos, así como la morbilidad-mortalidad postoperatoria de ambas técnicas. Se analiza el valor de la cirugía robótica en la pancreatectomía corporocaudal.
MétodosDiseñoSe ha realizado un estudio consecutivo de casos entre enero del 2018 y abril del 2022, en 2hospitales de tercer nivel del área metropolitana de Barcelona (Hospital Universitari Germans Trias i Pujol y Hospital Universitari Mútua de Terrassa), con una población de referencia conjunta de 1.200.000 habitantes, analizando los resultados en pancreatectomías distales (PD) mediante abordaje laparoscópico y robótico. Para la PDR se ha utilizado en todos los casos en sistema robótico da Vinci Xi (Intuitive Surgical, Sunnyvale, CA, EE. UU.).
Criterios de inclusión y exclusiónSe ha incluido a todos los pacientes tratados mediante una PDMIS electiva, tanto por enfermedad benigna o maligna. Los criterios de exclusión han sido el tratamiento previo con neoadyuvancia, la presencia de tumores del cuello/cuerpo pancreático con posible afectación vascular, que se realizaron mediante abordaje abierto.
Población a estudioEn el periodo de estudio se realizaron, en estos centros, 311 cirugías pancreáticas, de las cuales 168 (54%) se realizaron mediante CMIP. De las 83 PD realizadas en este periodo, se han analizado 57 casos (35 PDL y 22 PDR).
Variables principalesLas variables principales estudiadas han sido: tiempo quirúrgico, estancia hospitalaria, tasa de conversión, morbilidad grave (Dindo-Clavien ≥ III17), morbilidad acumulada estimada mediante la escala Comprehensive complication index (CCI)18 y mortalidad asociada a los 30 y 90 días.
Se ha seguido el documento de consenso en estandarización de la terminología en cirugía pancreática MIS19. Se entiende por conversión el cambio en la técnica quirúrgica, ya sea de cirugía robótica a laparoscópica o de estas 2a laparotomía para seguir o completar el procedimiento (material suplementario).
Se evita el uso de terminología como puramente robótico o robótico combinado, considerándose estos casos como procedimientos robóticos.
Variables secundariasComo variables secundarias se han recogido: fístulas pancreáticas, hemorragia postoperatoria, margen de resección y tasa de reingreso a los 30 y 90 días.
Las fístulas pancreáticas y la hemorragia postoperatoria siguen las definiciones establecidas por el International Study Group of Pancreatic Surgery20,21.
Se ha considerado R0 si existía una distancia con el margen tumoral >1mm, R1 si la distancia con el margen tumoral era <1mm y R2 si existía tumor macroscópico en el margen de resección22.
Análisis estadísticoEste se ha realizado siguiendo un análisis por intención de tratamiento mediante el software SPSS (versión 25) IBM corp. EE.UU. La distribución de la normalidad se ha estudiado mediante el test de Kolmogorov-Smirnov y las diferentes variables mediante los test U de Mann-Whitney y la chi al cuadrado. Valores de p <0,05 son considerados estadísticamente significativos.
ResultadosDurante el periodo que comprende el estudio se han realizado 83 PD, 26 casos fueron intervenidos por laparotomía y los 57 restantes mediante PDMIS (35 PDL y 22 PDR).
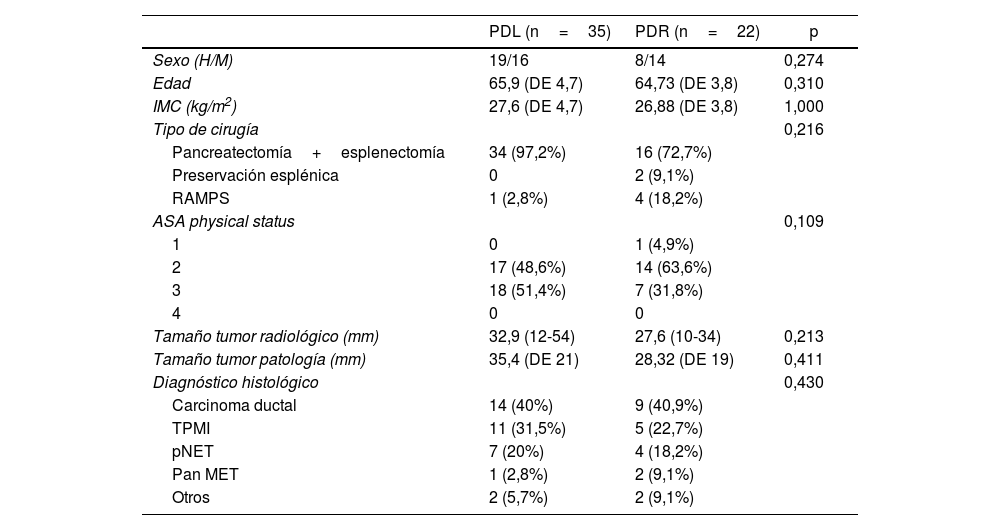
Características de los pacientesNo hay diferencias significativas entre los 2grupos en edad, sexo, índice de masa corporal ni ASA. El 48,6% (n=17) de los pacientes del grupo laparoscópico eran ASA 2 y el 51,4% (n=18) ASA 3. En el grupo robótico el 4,6% (n=1) era ASA 1, 63,6% (n=14) ASA 2 y el 31,8% (n=7) ASA 3.
En 2 casos de PDR se hizo preservación esplénica.
El diagnóstico de carcinoma ductal fue del 40% en PDL y del 40,9% en PDR. El segundo diagnóstico más frecuente fue el de TPMI, el 31,5 y rl 21,7%, respectivamente (tabla 1).
Características basales y variables demográficas de la muestra
| PDL (n=35) | PDR (n=22) | p | |
|---|---|---|---|
| Sexo (H/M) | 19/16 | 8/14 | 0,274 |
| Edad | 65,9 (DE 4,7) | 64,73 (DE 3,8) | 0,310 |
| IMC (kg/m2) | 27,6 (DE 4,7) | 26,88 (DE 3,8) | 1,000 |
| Tipo de cirugía | 0,216 | ||
| Pancreatectomía+esplenectomía | 34 (97,2%) | 16 (72,7%) | |
| Preservación esplénica | 0 | 2 (9,1%) | |
| RAMPS | 1 (2,8%) | 4 (18,2%) | |
| ASA physical status | 0,109 | ||
| 1 | 0 | 1 (4,9%) | |
| 2 | 17 (48,6%) | 14 (63,6%) | |
| 3 | 18 (51,4%) | 7 (31,8%) | |
| 4 | 0 | 0 | |
| Tamaño tumor radiológico (mm) | 32,9 (12-54) | 27,6 (10-34) | 0,213 |
| Tamaño tumor patología (mm) | 35,4 (DE 21) | 28,32 (DE 19) | 0,411 |
| Diagnóstico histológico | 0,430 | ||
| Carcinoma ductal | 14 (40%) | 9 (40,9%) | |
| TPMI | 11 (31,5%) | 5 (22,7%) | |
| pNET | 7 (20%) | 4 (18,2%) | |
| Pan MET | 1 (2,8%) | 2 (9,1%) | |
| Otros | 2 (5,7%) | 2 (9,1%) | |
Entre paréntesis, rango intercuartil y porcentajes.
ASA: American Society of Anesthesiologists; DE: desviación estándar; H/M: hombres/mujeres; IMC: Índice de masa corporal; PDL: pancreatectomía distal laparoscópica; PDR: pancreatectomía distal robótica; Pan MET: metástasis pancreática; pNET: tumor neuroendocrino pancreático; TPMI: tumor papilar mucinoso intraductal.
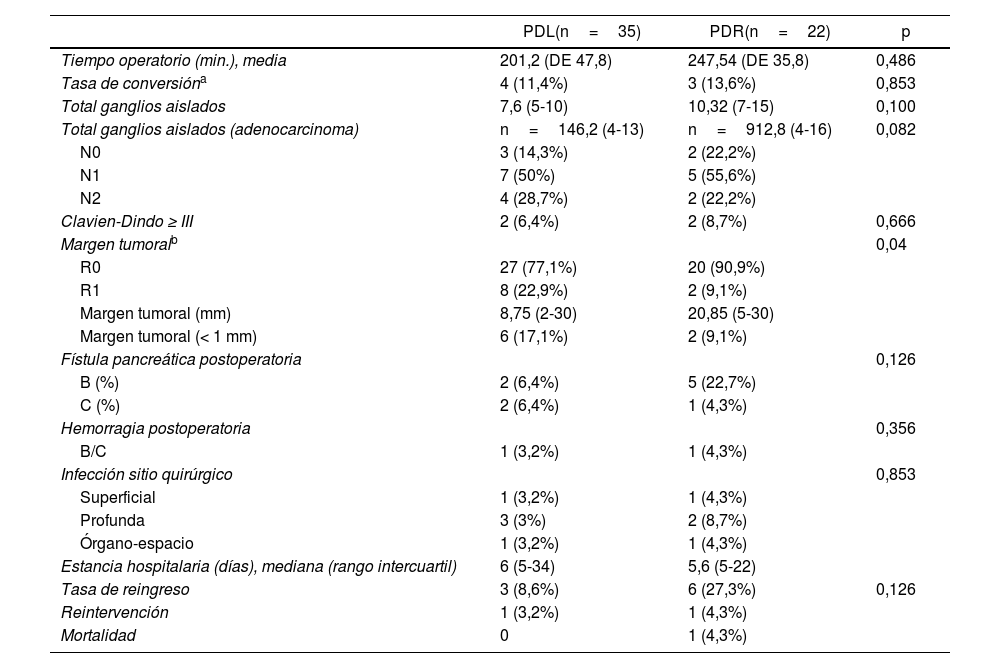
No se hallaron diferencias significativas entre los tiempos operatorios de ambos abordajes quirúrgicos. El tiempo operatorio medio de; 201,2 min en PDL y de 247,54 min en PDR.
La estancia hospitalaria media fue de 6 días (5-34) en el grupo PDL y de 5,6 días (5-22) en el grupo de PDR, sin diferencias significativas.
La conversión a cirugía abierta fue de 4 casos (11,4%) en el grupo PDL, 3casos por ausencia de progresión y un caso por dificultad en la movilización de la pieza (tumor de 60mm), y de 3casos (13,6%) en el grupo PDR, 2por englobar el confluente porto-esplénico y un caso por afectación de arteria hepática común.
No existieron conversiones de robot a laparoscopia ni conversiones urgentes, ni conversiones planificadas. En todos los casos la conversión se decidió por dificultad de disección o por no progresión con riesgo de complicación grave.
La morbilidad fue similar entre ambos grupos, 2 pacientes en cada grupo presentaron una complicación significativa en la clasificación Dindo-Clavien. La mediana del valor del índice de complicaciones CCI fue de 8,9 (0-20,6) para el grupo PDL y 20,9 (0-26,2) para PDR, sin diferencias estadísticas.
Un paciente de cada grupo precisó de reintervención, por perforación gástrica inadvertida en el grupo PDR y por hemorragia en el grupo PDL.
Un caso del grupo PDR, con comorbilidad, precisó de conversión precoz a cirugía abierta por extensa afectación vascular, falleciendo durante postoperatorio inmediato por neumonía por Pseudomonas y fallo multiorgánico (tabla 2).
Resultados de las variables principales y secundarias
| PDL(n=35) | PDR(n=22) | p | |
|---|---|---|---|
| Tiempo operatorio (min.), media | 201,2 (DE 47,8) | 247,54 (DE 35,8) | 0,486 |
| Tasa de conversióna | 4 (11,4%) | 3 (13,6%) | 0,853 |
| Total ganglios aislados | 7,6 (5-10) | 10,32 (7-15) | 0,100 |
| Total ganglios aislados (adenocarcinoma) | n=146,2 (4-13) | n=912,8 (4-16) | 0,082 |
| N0 | 3 (14,3%) | 2 (22,2%) | |
| N1 | 7 (50%) | 5 (55,6%) | |
| N2 | 4 (28,7%) | 2 (22,2%) | |
| Clavien-Dindo ≥ III | 2 (6,4%) | 2 (8,7%) | 0,666 |
| Margen tumoralb | 0,04 | ||
| R0 | 27 (77,1%) | 20 (90,9%) | |
| R1 | 8 (22,9%) | 2 (9,1%) | |
| Margen tumoral (mm) | 8,75 (2-30) | 20,85 (5-30) | |
| Margen tumoral (< 1 mm) | 6 (17,1%) | 2 (9,1%) | |
| Fístula pancreática postoperatoria | 0,126 | ||
| B (%) | 2 (6,4%) | 5 (22,7%) | |
| C (%) | 2 (6,4%) | 1 (4,3%) | |
| Hemorragia postoperatoria | 0,356 | ||
| B/C | 1 (3,2%) | 1 (4,3%) | |
| Infección sitio quirúrgico | 0,853 | ||
| Superficial | 1 (3,2%) | 1 (4,3%) | |
| Profunda | 3 (3%) | 2 (8,7%) | |
| Órgano-espacio | 1 (3,2%) | 1 (4,3%) | |
| Estancia hospitalaria (días), mediana (rango intercuartil) | 6 (5-34) | 5,6 (5-22) | |
| Tasa de reingreso | 3 (8,6%) | 6 (27,3%) | 0,126 |
| Reintervención | 1 (3,2%) | 1 (4,3%) | |
| Mortalidad | 0 | 1 (4,3%) | |
Entre paréntesis (rango intercuartil y porcentajes).
DE: desviación estándar; PDL: pancreatectomía distal laparoscópica; PDR: pancreatectomía distal robótica.
El grupo robótico obtuvo una mayor tasa de R0 (90,9% n=20) frente al grupo laparoscópico (77,1%, n=27), siendo esta diferencia estadísticamente significativa, p=0,04.
La media del total de ganglios aislados en el abordaje laparoscópico 7,6 (5-10) fue menor en comparación con la PDR, 10,3 (7-15), sin significación estadística.
La tasa de fístula pancreática fue de 12,8% (n=4) en los pacientes del grupo PDL, 2 fueron grado B y 2 grado C. En el grupo robótico esta fue del 27% (n=6), 5 fístula grado B y solo uno de los pacientes presentó fístula pancreática grado C. Sin diferencias significativas entre grupos.
Un paciente de cada grupo, el 3,2% en PDL y el 4,3% en PDR, presentó hemorragia postoperatoria grado B o C.
La tasa de reingreso fue menor en el grupo PDL (8,6%, n=3), un caso por neumonía nosocomial y 2por colección postoperatoria, un caso precisó de reintervención por infección órgano-espacio grave y otro de drenaje externo; todos evolucionaron de forma favorable.
En el grupo PDR, 6 pacientes (27,3%) precisaron de reingreso, 2casos por atelectasia/neumonía y 4por colección postoperatoria que se solucionó en 2de ellos con drenaje y el resto con tratamiento antibiótico (tabla 2).
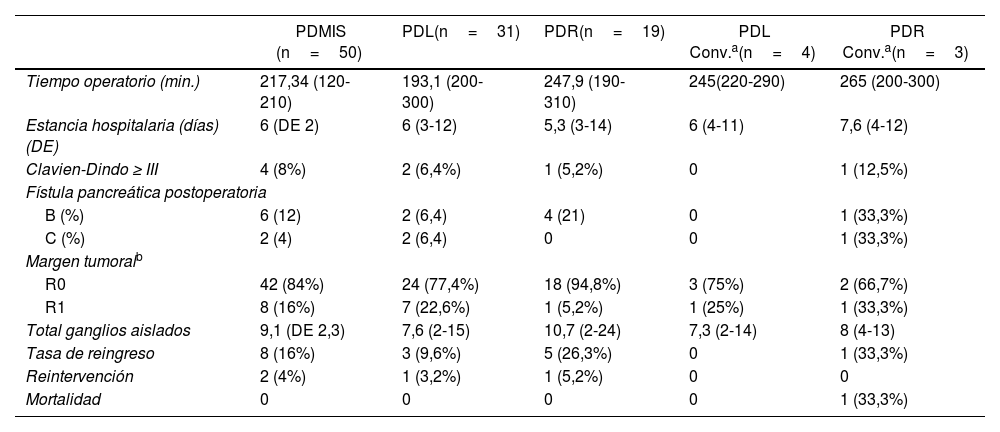
Análisis de los casos convertidosEl tiempo quirúrgico medio del total de las todas las pancreatectomías sin conversión fue de 217,3 min, mientras que en el grupo laparoscópico convertido fue de 245 min y el robótico convertido de 265 min.
La estancia hospitalaria es similar en todos los grupos independientemente de si se precisó de conversión o no. No hay diferencias significativas en cuanto a las complicaciones postoperatorias entre los diversos grupos: laparoscópico sin conversión 2 pacientes (6,4%), robótico sin conversión un paciente (6,2%), laparoscópico con conversión sin complicaciones postoperatorias y robótico con conversión un paciente (12,5%).
Entre los grupos con conversión a cirugía abierta y sin conversión, no se encontraron diferencias en la incidencia de fístulas pancreáticas, tasa de reingreso o tasa de R0 (tabla 3).
Análisis comparativo entre abordaje y conversión
| PDMIS (n=50) | PDL(n=31) | PDR(n=19) | PDL Conv.a(n=4) | PDR Conv.a(n=3) | |
|---|---|---|---|---|---|
| Tiempo operatorio (min.) | 217,34 (120-210) | 193,1 (200-300) | 247,9 (190-310) | 245(220-290) | 265 (200-300) |
| Estancia hospitalaria (días) (DE) | 6 (DE 2) | 6 (3-12) | 5,3 (3-14) | 6 (4-11) | 7,6 (4-12) |
| Clavien-Dindo ≥ III | 4 (8%) | 2 (6,4%) | 1 (5,2%) | 0 | 1 (12,5%) |
| Fístula pancreática postoperatoria | |||||
| B (%) | 6 (12) | 2 (6,4) | 4 (21) | 0 | 1 (33,3%) |
| C (%) | 2 (4) | 2 (6,4) | 0 | 0 | 1 (33,3%) |
| Margen tumoralb | |||||
| R0 | 42 (84%) | 24 (77,4%) | 18 (94,8%) | 3 (75%) | 2 (66,7%) |
| R1 | 8 (16%) | 7 (22,6%) | 1 (5,2%) | 1 (25%) | 1 (33,3%) |
| Total ganglios aislados | 9,1 (DE 2,3) | 7,6 (2-15) | 10,7 (2-24) | 7,3 (2-14) | 8 (4-13) |
| Tasa de reingreso | 8 (16%) | 3 (9,6%) | 5 (26,3%) | 0 | 1 (33,3%) |
| Reintervención | 2 (4%) | 1 (3,2%) | 1 (5,2%) | 0 | 0 |
| Mortalidad | 0 | 0 | 0 | 0 | 1 (33,3%) |
PDL: pancreatectomía distal laparoscópica; PDR: pancreatectomía distal robótica; PDMIS: pancreatectomía distal mínimamente invasiva; DE: desviación estándar; Conv.: conversión.
Varios estudios han demostrado importantes ventajas de la PDL respecto al abordaje abierto23-25. Dos ensayos aleatorizados (RCT) han confirmado los resultados de las series publicadas previamente. El primer RCT compara tanto PDR como laparoscópica con cirugía abierta8, la recuperación funcional fue menor y estadísticamente significativa a favor del abordaje mínimamente invasivo, 4 vs. 6 días de estancia hospitalaria. El segundo RCT compara PDL con cirugía abierta8, con una estancia hospitalaria de 5 vs. 6 días y una tasa de conversión del 3,4%. En esta serie hemos observado una estancia hospitalaria de 5-6 en ambos grupos, similares a las descritas.
El mayor tiempo operatorio de la PDL se reduce considerablemente a medida que se asimila la curva de aprendizaje, entre 10-37 casos según los estudios publicados26,27. En nuestra serie la PDL presenta un tiempo operatorio acorde con la literatura, con una morbilidad baja y unos resultados oncológicos adecuados, con un 41% de casos intervenidos por adenocarcinoma.
En una interesante publicación se analiza el número de pacientes que recibieron quimioterapia después de la pancreatectomía distal (abierta vs. MIS) se analizó a 1.807 pacientes; la PD MIS (51 PDL/454 PDR) se asocia a una mayor tasa de quimioterapia adyuvante28. Creemos que esto podría ser debido a que la MIS consigue una recuperación más rápida debido a una menor agresividad del procedimiento. Este aspecto es relevante ya que el tratamiento completo del cáncer de páncreas es la cirugía+quimioterapia, aumentar el número de casos con el tratamiento completo podría mejorar la supervivencia global.
La PDR añade a las ventajas de la cirugía laparoscópica una mejor visión, mayor precisión en la disección y control vascular. Todos estos aspectos, así como la similitud con los movimientos naturales de las manos, permite acortar la curva de aprendizaje. Sin embargo, todavía su uso es menos frecuente comparado con el abordaje laparoscópico29,30.
En nuestra experiencia la PDR obtiene similares resultados a la PDL, con una estancia hospitalaria y una morbilidad muy similares. Si bien, el tiempo operatorio fue discretamente mayor, la tasa de R0 en los casos de adenocarcinoma de páncreas fue considerablemente mayor en el grupo robótico, probablemente debido a las ventajas descritas previamente, destacando la facilidad y precisión de disección. Este hecho permitiría una mayor tasa de preservaciones esplénicas, como parece ser la tendencia en esta serie.
Las tasas de conversión observadas son similares entre ambos procedimientos y acordes con las series mencionadas, el 11,4 para PDL y el 13,6% para PDR. Estos datos apoyan que el hecho que el aprendizaje robótico sea más rápido y fácil, mientras que la curva de aprendizaje de la cirugía laparoscópica del grupo quirúrgico estaba finalizada, los pacientes incluidos en el grupo robótico son los iniciales de la serie. Esto hace que la cirugía robótica sea buena tanto para el paciente como para el cirujano.
Un aspecto ya conocido es que la conversión no planificada tiene una mayor morbimortalidad31,32. Si bien la mortalidad en el grupo de PDR de la serie es mayor, no consideramos que sea atribuida a la técnica robótica, la conversión precoz a cirugía abierta fue por extensa afectación vascular en un paciente con comorbilidades importantes.
Por lo que, al coste económico de la cirugía robótica, diversos autores apuntan un incremento de más de 6.000 euros en la PDR33,34. Sin embargo, cuando se consideran de forma acumulativa la recuperación postoperatoria, la estancia hospitalaria y la calidad de vida, el aumento del coste de la plataforma robótica es similar e incluso en caso de PD por adenocarcinoma resulta menor30,35. Se debe subrayar que la mayoría de estos datos provienen de centros de alto volumen. Por lo tanto, el análisis coste-efectivo actual puede no ser aplicable a los centros de menor volumen36.
En nuestro caso, la incorporación de la plataforma robótica a la cirugía hepatobiliopancreática fue iniciada dentro de un programa de cirugía robótica ya establecido y con toda la tecnología disponible.
En la actualidad consideramos que la pancreatectomía distal mínimamente invasiva supone el abordaje de elección tanto para enfermedad benigna como maligna. A pesar de la falta de estudios aleatorizados, el menor impacto quirúrgico, una menor estancia hospitalaria, menos complicaciones y una mejor recuperación funcional permitirían completar el tratamiento oncológico adyuvante en los pacientes que lo requieran.
Si bien no queda claro y tampoco en esta serie se ha podido demostrar los beneficios de la PDR respecto al abordaje laparoscópico, una curva de aprendizaje más corta con mayor radicalidad oncológica amplía el beneficio del paciente al cirujano. En un reciente e interesante editorial, con el que estamos de acuerdo, Azagra et al.37 afirman que: «dejar la cirugía laparoscópica para pasar a la robótica es una evolución natural, en la que el equipo quirúrgico arrastra al cirujano y siendo la estandarización de la técnica con todo un equipo implicando clave en el proceso».
Con mayor experiencia y adquisición de habilidades en cirugía robótica es posible aumentar el número de casos de preservación de parénquima pancreático sin necesidad de pancreatectomías extensas. La capacidad de la plataforma robótica en el futuro de incorporar inteligencia artificial, modelización 3D y realidad aumentada incrementará el valor añadido de esta.
En nuestra experiencia, en PDR nos permite afirmar que el paso previo por la cirugía laparoscópicaa no es imprescindible, siendo factible el salto de la cirugía abierta a la robótica.
Consideramos, en especial al inicio de la curva de aprendizaje, una selección adecuada de los casos, con tumores alejados del cuello, sin afectación del plano posterior, para pasar a casos de preservación esplénica38 y RAMPS36,39.
ConclusionesEn un grupo seleccionado de pacientes, la PD mínimamente invasiva es segura y efectiva realizada por grupos con experiencia en cirugía pancreática y MIS.
El valor añadido del abordaje robótico es una mejor visión, mayor precisión en la disección y control vascular, lo que probablemente le confiere en nuestra experiencia una menor curva de aprendizaje.
En esta serie, el abordaje robótico presenta similar estancia hospitalaria, con los mismos resultados de morbilidad, siendo oncológicamente adecuada en casos de malignidad, con una tasa de R0 mayor.
Se sugiere que, con mayor experiencia, la PDR será el estándar de calidad. Futuros estudios multicéntricos aleatorizados son necesarios para confirmar esta hipótesis.
FinanciaciónLos autores declaran no haber recibido financiación para la elaboración del presente artículo.