La reconstrucción mamaria inmediata tras mastectomías ahorradoras de piel en pacientes sometidas a quimioterapia neoadyuvante todavía resulta controvertida. El objetivo es determinar factores relacionados con downstaging axilar y respuesta patológica completa (RPC), y como esta, condiciona la decisión de someterse a mastectomía bilateral con reconstrucción inmediata.
MétodosSe realizó un análisis retrospectivo de pacientes con cáncer de mama sometidas a quimioterapia neoadyuvante y mastectomía bilateral con reconstrucción inmediata entre 2000-2018. Se compararon dos grupos: 1) RPC y 2) no RPC. Se analizaron datos demográficos, anatomopatológicos y el estadio clínico inicial y final. Análisis estadístico descriptivo y comparativo.
ResultadosSesenta y nueve pacientes; Grupo1: 26 (37,68%) alcanzaron RPC y 43(62,32%) no RPC. Mediana de seguimiento 45,3meses (RIQ: 23,0-94,0). En análisis bivariante, edad menor a 35 (p<0,001), menor T al diagnóstico (p=0,006) y subtipo HER2 (p<0,001) se asociaron significativamente con mayores tasas de RPC. La indicación más frecuente fue la elección de la paciente (31,8%). La tasa de negativización axilar fue del 80% en el grupo 1 y 59,3% en grupo 2 y las tasas de linfadenectomía axilar fueron similares (73,1% y 83,72%).
ConclusionesLa RPC tras la quimioterapia neoadyuvante no parece ser un factor de peso en la decisión de realizar la mastectomía bilateral con reconstrucción inmediata.
Immediate breast reconstruction after skin-sparing mastectomy in patients undergoing neoadjuvant chemotherapy is still controversial. The objective of this study is to determine factors related with axillary downstaging and complete pathological response (CPR), and how CPR influences the decision to perform bilateral mastectomy with immediate reduction.
MethodsA retrospective analysis of breast cancer patients who had undergone neoadjuvant chemotherapy and bilateral mastectomy with immediate reduction between 2000-2018 was performed. Two groups were compared:1) CPR and 2) non-CPR. Descriptive and comparative statistical analyses are provided.
Results69 patients; 26 (37.68%) reached CPR and 43 (62.32%) non-CPR. Median follow-up of 45.3 months (IQR: 23.0-94.0). Age under 35 (p <.001), small size tumor at diagnosis (p=.006) and subtype HER2 (p <.001) were associated with higher rates of CPR in bivariate analysis. Axillary negativization rate was 80% in group 1 and 59.3% in group 2, and lymphadenectomy rates were similar (73.1% and 83.72%).
ConclusionsCPR after neoadjuvant chemotherapy did not influence the decision to perform bilateral mastectomy with immediate reduction.
La terapia sistémica neoadyuvante basada en quimioterápicos (QTNA) en el cáncer de mama se administra antes del tratamiento quirúrgico para lograr una serie de objetivos clínicos1,2. En tumores grandes, si se consigue una respuesta adecuada permite aumentar las tasas de cirugía conservadora al disminuir el tamaño tumoral, evitando la realización de mastectomía en algunas pacientes3,4.
Además, las pacientes con axila clínicamente positiva al diagnóstico que responden a la QTNA se pueden beneficiar de la realización de biopsia selectiva del ganglio centinela tras el tratamiento, evitando el vaciamiento axilar en caso de resultar negativo5,6.
Por otra parte, la respuesta a la QTNA es un importante indicador pronóstico que permite evaluar la respuesta del tumor durante el tratamiento7. Esta respuesta está muy influenciada por el subtipo histológico. Los no luminales (con receptores hormonales negativos) y los tumores que sobreexpresan HER2 presentan las mayores tasas de respuesta patológica completa (RPC), en torno al 33-45%, mientras que los tumores luminales y HER2 negativos responden en un 15-23%8,9.
Sin embargo, y a pesar de los avances terapéuticos incluyendo la QTNA, hasta un 45% de pacientes con cáncer de mama serán sometidas a mastectomía10 y hasta un 20-40% asociarán alguna técnica reconstructiva con objeto de mejorar la calidad de vida y disminuir el impacto sociopsicológico de la mastectomía11.
Aunque varios estudios aseguran viable y seguro realizar la reconstrucción mamaria inmediata tras mastectomías ahorradoras de piel en pacientes previamente sometidas a QTNA12, todavía resulta controvertido para algunos autores13,14. Además, el papel que juega la respuesta a la QTNA sobre la planificación quirúrgica y la decisión de realizar una reconstrucción inmediata tras la mastectomía no es conocido y se precisan más estudios al respecto.
El objetivo de este trabajo es identificar características del tumor y las pacientes que pudieran asociarse con la obtención de respuesta patológica completa (RPC) y downstaging axilar y si la RPC tras QTNA era un factor en la decisión de someterse a mastectomía bilateral con reconstrucción inmediata (MBRMI).
MétodosSe realizó un análisis observacional retrospectivo para identificar a las pacientes con cáncer de mama sometidas a QTNA y MBRMI mediante prótesis directa durante el periodo 2000-2018.
Los criterios de inclusión para llevar a cabo esta técnica fueron: la relación del tamaño tumoral respecto a la mama, multicentricidad y/o multifocalidad, pacientes con contraindicaciones para realizar cirugía conservadora incluyendo carcinoma inflamatorio y la elección de la paciente. Se han excluido las pacientes sometidas a QTNA que eran candidatas de inicio a cirugía conservadora o que lo fueron tras buena respuesta a QTNA.
El estadio clínico inicial se basa en examen físico y pruebas de imagen (mamografía, ecografía y/o resonancia magnética nuclear) y se basa en la clasificación TNM.
Los datos demográficos y los datos anatomopatológicos y el estadio clínico final se obtuvieron de la base de datos de la Unidad.
La RPC fue definida como ausencia de enfermedad invasiva o in situ en mama y axila y la no RPC como todo lo que no se incluyese en la categoría anterior, incluyendo ausencia de respuesta o la respuesta parcial.
Se divide a las pacientes en dos grupos de estudio. Grupo 1, si obtuvieron RPC y grupo 2, si no la alcanzaron.
La evaluación axilar al inicio fue clínica, mediante exploración física, ecografía y punción con aguja fina clasificándolos en negativos o positivos. Tras la QTNA los ganglios fueron reevaluados mediante exploración física.
Las pacientes con ganglios positivos persistentes fueron sometidas a vaciamiento axilar (niveles I-II de Berg).
Las pacientes con ganglios positivos de inicio que se negativizaron fueron sometidas a biopsia selectiva del ganglio centinela y si el resultado fue positivo se realizó el vaciamiento axilar mientras que si fue negativo no se actuó sobre la axila.
Los regímenes de QTNA incluían antraciclina, taxano o una combinación de ambos. En las pacientes con sobreexpresión de HER2 se añadió trastuzumab solo o combinado con pertuzumab dependiendo del momento en que se administró el tratamiento.
La variable principal fue determinar características clínico-patológicas del tumor y las pacientes que pudieran asociarse con la obtención de RPC y downstaging axilar.
Este estudio fue aprobado por el comité ético del centro y por el Comité Ético de Investigación Clínica de Aragón (C.P. - C.I. PI16/002).
Análisis estadísticoSe realiza en primer lugar un análisis descriptivo de las variables a estudio. Para variables cualitativas se aportan frecuencias relativas y absolutas. Para variables cuantitativas media y desviación estándar (DE). Se evalúa la relación entre variables cualitativas mediante el test de Chi-cuadrado. Para comparar medias entre dos grupos independientes se utiliza el test U Mann-Whitney o t de Student, según criterios de normalidad.
Se establece el nivel de significación estadística para un p valor menor a 0,05. Para todo el análisis se ha utilizado el programa estadístico SPSS 22.0 para Windows (SPSS Ibérica, Madrid, España).
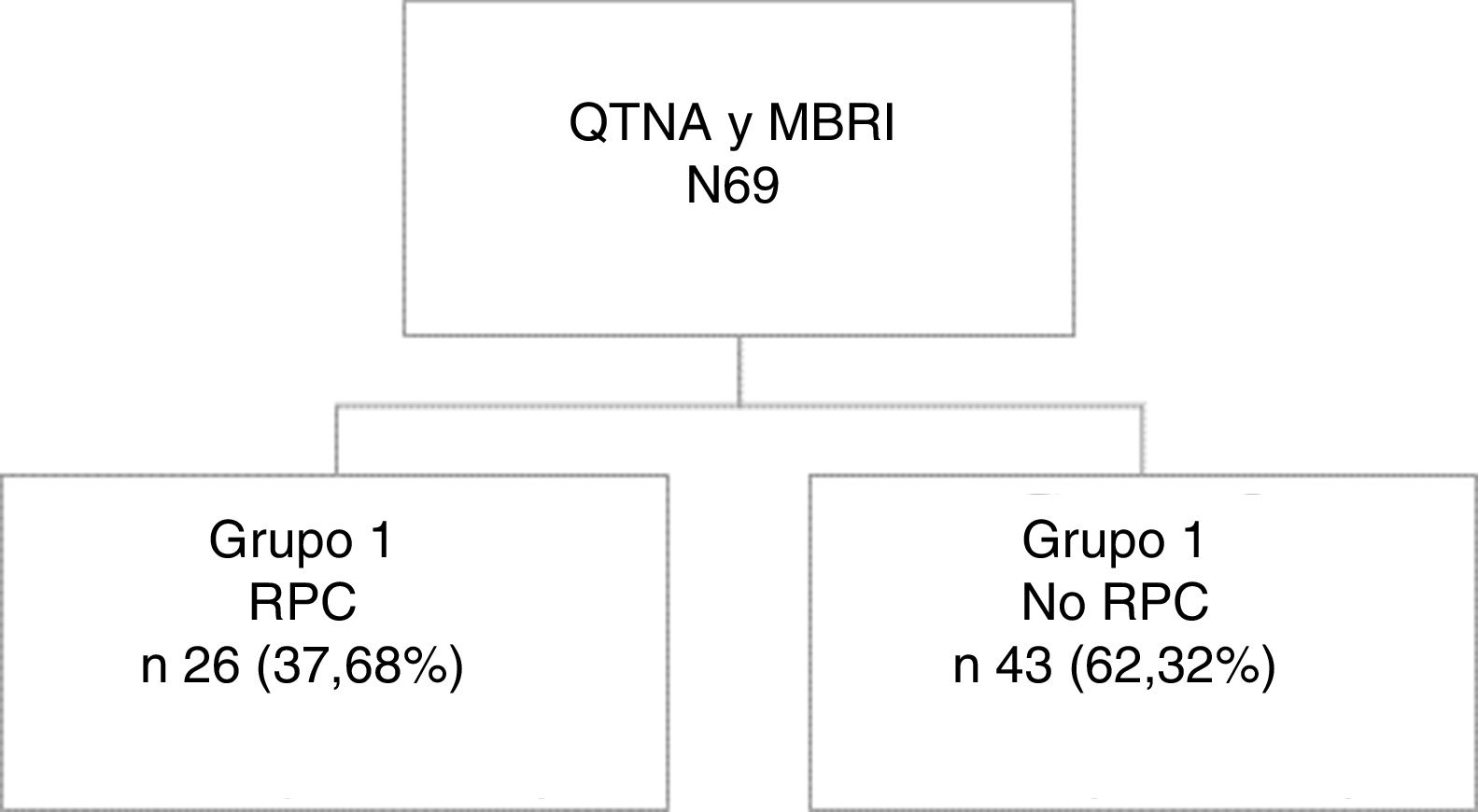
ResultadosSe identificaron 69 pacientes con cáncer de mama sometidas a QTNA y posterior MBRI en el periodo de estudio. De ellas, 26 (37,68%) presentaron RPC y 43 (62,32%) no presentaron RPC (34 [79%] con respuesta parcial y 9 [21%] ausencia de respuesta). La mediana de seguimiento de las pacientes fue de 45,3(RIQ:23,0-94,0) meses (fig. 1).
- Resultados generales
--Datos demográficos y relativos al tumor
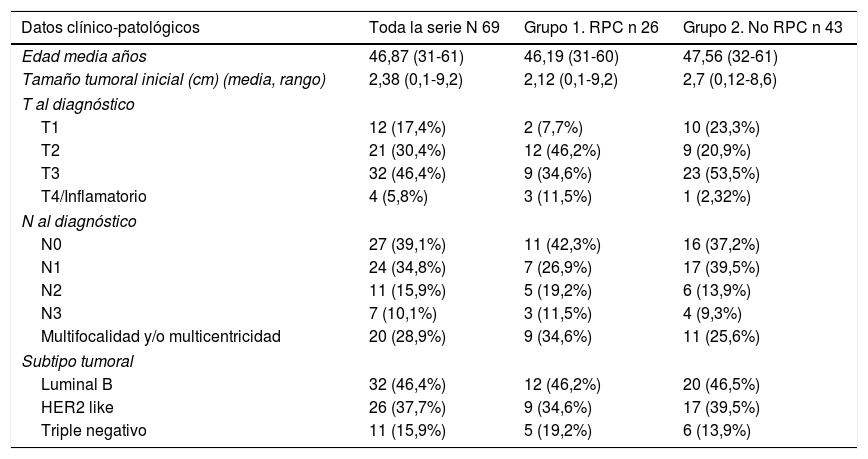
Las pacientes presentaban una edad media de ±46,87 años (rango 31-61) al momento de la intervención quirúrgica. En el grupo 1 fue de±46,19 años (rango 31-60) y en el grupo 2 de±47,56 años (rango 32-61). Los datos clínico-patológicos relativos al tumor se exponen en la tabla 1.
Datos clínico-patológicos y comorbilidades
| Datos clínico-patológicos | Toda la serie N 69 | Grupo 1. RPC n 26 | Grupo 2. No RPC n 43 |
|---|---|---|---|
| Edad media años | 46,87 (31-61) | 46,19 (31-60) | 47,56 (32-61) |
| Tamaño tumoral inicial (cm) (media, rango) | 2,38 (0,1-9,2) | 2,12 (0,1-9,2) | 2,7 (0,12-8,6) |
| T al diagnóstico | |||
| T1 | 12 (17,4%) | 2 (7,7%) | 10 (23,3%) |
| T2 | 21 (30,4%) | 12 (46,2%) | 9 (20,9%) |
| T3 | 32 (46,4%) | 9 (34,6%) | 23 (53,5%) |
| T4/Inflamatorio | 4 (5,8%) | 3 (11,5%) | 1 (2,32%) |
| N al diagnóstico | |||
| N0 | 27 (39,1%) | 11 (42,3%) | 16 (37,2%) |
| N1 | 24 (34,8%) | 7 (26,9%) | 17 (39,5%) |
| N2 | 11 (15,9%) | 5 (19,2%) | 6 (13,9%) |
| N3 | 7 (10,1%) | 3 (11,5%) | 4 (9,3%) |
| Multifocalidad y/o multicentricidad | 20 (28,9%) | 9 (34,6%) | 11 (25,6%) |
| Subtipo tumoral | |||
| Luminal B | 32 (46,4%) | 12 (46,2%) | 20 (46,5%) |
| HER2 like | 26 (37,7%) | 9 (34,6%) | 17 (39,5%) |
| Triple negativo | 11 (15,9%) | 5 (19,2%) | 6 (13,9%) |
Asimismo, se categorizan tres subtipos tumorales: luminal B (ER/PR+, HER2−y KI67 > 20%) Her2 like (ER−, PR−, HER2+) y triple negativo (ER−, PR−, HER2−).
La distribución de estos factores entre los grupos del estudio fue homogénea (p=0,005).
En el análisis bivariante la edad menor a 35 años (p <0,001), menor T al diagnóstico (p=0,006) y el subtipo HER 2 (p <0,001) se asoció significativamente con mayores tasas de RPC.
--Indicaciones
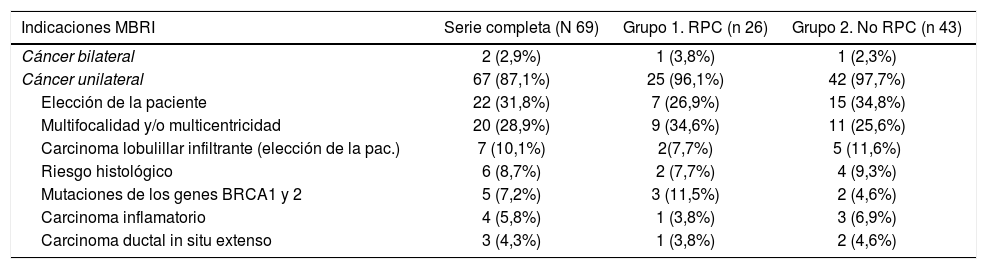
La indicación para practicar una MBRMI más frecuente fue la elección de la paciente 22/69 (31,8%) seguida de multicentricidad y/o multifocalidad (MC y/o MF) 20/69 (28,9%) para toda la serie, y MC y/o MF en el grupo 1 9/26 (34,6%) y elección de la paciente 13/43 (30,2%) en el grupo 2, como se expone en la tabla 2.
Indicaciones mastectomía bilateral con reconstrucción inmediata tras QTNA
| Indicaciones MBRI | Serie completa (N 69) | Grupo 1. RPC (n 26) | Grupo 2. No RPC (n 43) |
|---|---|---|---|
| Cáncer bilateral | 2 (2,9%) | 1 (3,8%) | 1 (2,3%) |
| Cáncer unilateral | 67 (87,1%) | 25 (96,1%) | 42 (97,7%) |
| Elección de la paciente | 22 (31,8%) | 7 (26,9%) | 15 (34,8%) |
| Multifocalidad y/o multicentricidad | 20 (28,9%) | 9 (34,6%) | 11 (25,6%) |
| Carcinoma lobulillar infiltrante (elección de la pac.) | 7 (10,1%) | 2(7,7%) | 5 (11,6%) |
| Riesgo histológico | 6 (8,7%) | 2 (7,7%) | 4 (9,3%) |
| Mutaciones de los genes BRCA1 y 2 | 5 (7,2%) | 3 (11,5%) | 2 (4,6%) |
| Carcinoma inflamatorio | 4 (5,8%) | 1 (3,8%) | 3 (6,9%) |
| Carcinoma ductal in situ extenso | 3 (4,3%) | 1 (3,8%) | 2 (4,6%) |
- Respuesta a QTNA
De toda la serie, 26 pacientes (37,68%) (Grupo 1) obtuvieron una RPC, mientras que 43 (62,32%) no la alcanzaron (Grupo 2).
Las pacientes del grupo 1 presentaban menor tamaño tumoral (T) al diagnóstico (P=0,006) y eran más frecuentemente subtipo HER 2(P <0,001), pero no se encontraron diferencias estadísticamente significativas en cuanto al estado ganglionar (N) al diagnóstico (P=0,177).
--Downstaging axilar
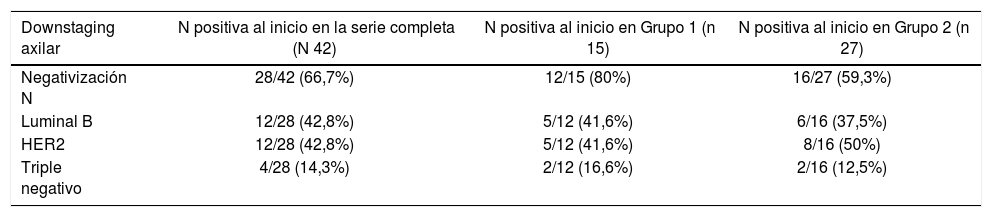
De las 69 pacientes, 42 (60,8%) presentaban afectación axilar al diagnóstico y de ellas, 28 (66,8%) se negativizaron tras la QTNA. De las 42 pacientes con N positiva, 15 correspondían al grupo 1 con RPC y 27 al grupo 2.
En el grupo de RPC la tasa de negativización fue del 80% (12 de las 15 pacientes con N positiva), siendo en un 41,6% tumores luminal B (5/12), 41,6% HER 2 (5/12) y 16,6% triple negativo (2/12).
En el grupo 2, sin RPC la tasa de negativización axilar fue del 59,3% (16 de las 27 pacientes con N positiva) correspondiendo en 37,5% a tumores luminales B (6/16), 37,5% a HER2 (6/16) y 12,5% triple negativo (2/16). Estos resultados se exponen en la tabla 3.
Downstaging axilar
| Downstaging axilar | N positiva al inicio en la serie completa (N 42) | N positiva al inicio en Grupo 1 (n 15) | N positiva al inicio en Grupo 2 (n 27) |
|---|---|---|---|
| Negativización N | 28/42 (66,7%) | 12/15 (80%) | 16/27 (59,3%) |
| Luminal B | 12/28 (42,8%) | 5/12 (41,6%) | 6/16 (37,5%) |
| HER2 | 12/28 (42,8%) | 5/12 (41,6%) | 8/16 (50%) |
| Triple negativo | 4/28 (14,3%) | 2/12 (16,6%) | 2/16 (12,5%) |
Las tasas de linfadenectomía axilar fueron similares (73,1% [19/26] en el grupo 1 y 83,72% [36/43] en el grupo 2), sin embargo, las tasas de biopsia de ganglio centinela positivo que obligaron a la realización de un vaciamiento axilar fueron diferentes en ambos grupos (0% [0/19] en grupo 1 y 16,27% [7/36] en grupo 2), sin encontrar diferencias estadísticamente significativas en función de si habían alcanzado la RPC o no (p=0,12).
DiscusiónCon este trabajo se pretende determinar factores relacionados con downstaging axilar y RPC, y como esta condiciona la decisión de someterse a MBRMI.
La tasa global de RPC en nuestro estudio fue del 37,68%. Sin embargo, como se observa en otros estudios, la tasa de respuesta axilar fue mayor.
Así, encontramos downstaging axilares significativos; 66,8% de pacientes (26/42) que presentaban ganglios afectos al diagnóstico se convierten a ganglios negativos tras el tratamiento. La tasa de negativización fue mayor en el grupo de RPC (80%) comparada con el grupo sin RPC (59,3%).
Como se ha descrito, estadios más iniciales (menor tamaño tumoral) y la edad más joven de las pacientes son factores que se asocian con la obtención de RPC15, también en este estudio.
Sin embargo, el análisis realizado no se corresponde con la actitud terapéutica llevada a cabo sobre la axila. Así, durante los primeros años del estudio (2000-2015) estaba establecido realizar linfadenectomía axilar en toda paciente con axila positiva al diagnóstico independientemente de la respuesta a QTNA, sin embargo, en los últimos años hemos asistido a un cambio de paradigma, con la realización de BSGC tras QTNA (incluso marcando con diferentes técnicas los ganglios positivos antes del tratamiento para poderlos identificar a posteriori en caso de respuestas completas16.
En general, las pacientes de este estudio sometidas a mastectomía bilateral en lugar de cirugía conservadora no eran candidatas para esta, atendiendo a las propias características del tumor. Sin embargo, la decisión de realizar mastectomía bilateral en pacientes con un tumor unilateral, es decir, realizar la mastectomía profiláctica contralateral fue en un gran porcentaje de casos (31,8%) por elección de las propias pacientes.
La RPC no se asoció con la decisión de someterse a MBRMI, dado que de las pacientes que eligieron someterse a esta intervencion sin tener otra indicación clínica de las expuestas en la tabla 2 (22 de 69 pacientes [31,8%]) solo un 31,8% (7/22) presentaban RCP, el restante 68,1% (15/22) eran pacientes sin RPC.
Las indicaciones en las pacientes con RPC (grupo 1) fueron similares a las pacientes sin RPC (Grupo 2), a la elección de la paciente le siguen la multifocalidad y/o multicentricidad y el carcinoma inflamatorio, como vemos en la tabla 2, sin encontrar diferencias estadísticamente significativas (p=0,07).
El presente estudio presenta limitaciones por su carácter retrospectivo y el escaso tamaño muestral al tratarse de casos de una única institución, por lo que evaluar el impacto de la respuesta a QTNA sobre el tratamiento quirúrgico es complicado y los resultados no pueden generalizarse.
En conclusión, la respuesta patológica completa tras el tratamiento neoadyuvante no parece ser un factor de peso en la decisión de realizar la MBRMI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.