La mayoría de los cánceres de mama (CM) se diagnostican en mujeres sin antecedentes familiares y no portadoras de mutaciones de riesgo. En las últimas décadas se ha producido un aumento de mastectomías profilácticas contralaterales (MPC) en estas pacientes. El CBCRisk es un modelo que calcula el riesgo absoluto de cáncer de mama contralateral (CMC) y pretende servir para el asesoramiento de pacientes con CM esporádico sobre la MPC.
MétodoAnálisis observacional retrospectivo de pacientes con un cáncer de mama esporádico sometidas a MPC durante 2017-2019. Análisis descriptivo, comparativo y de regresión logística univariante para identificar factores predictivos de LMAR y/o CMC oculto. Evaluación del modelo CBCRisk publicado en 2017 y distintos valores límite para la recomendación de MPC.
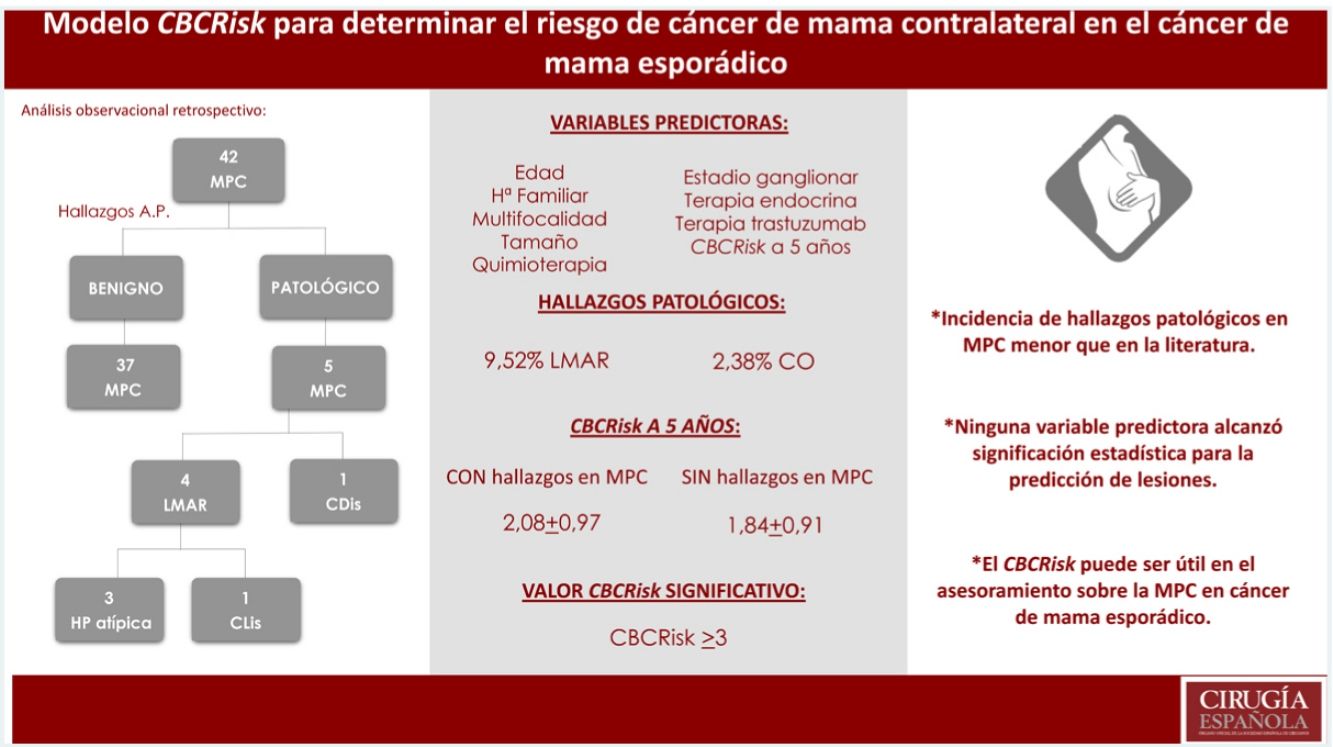
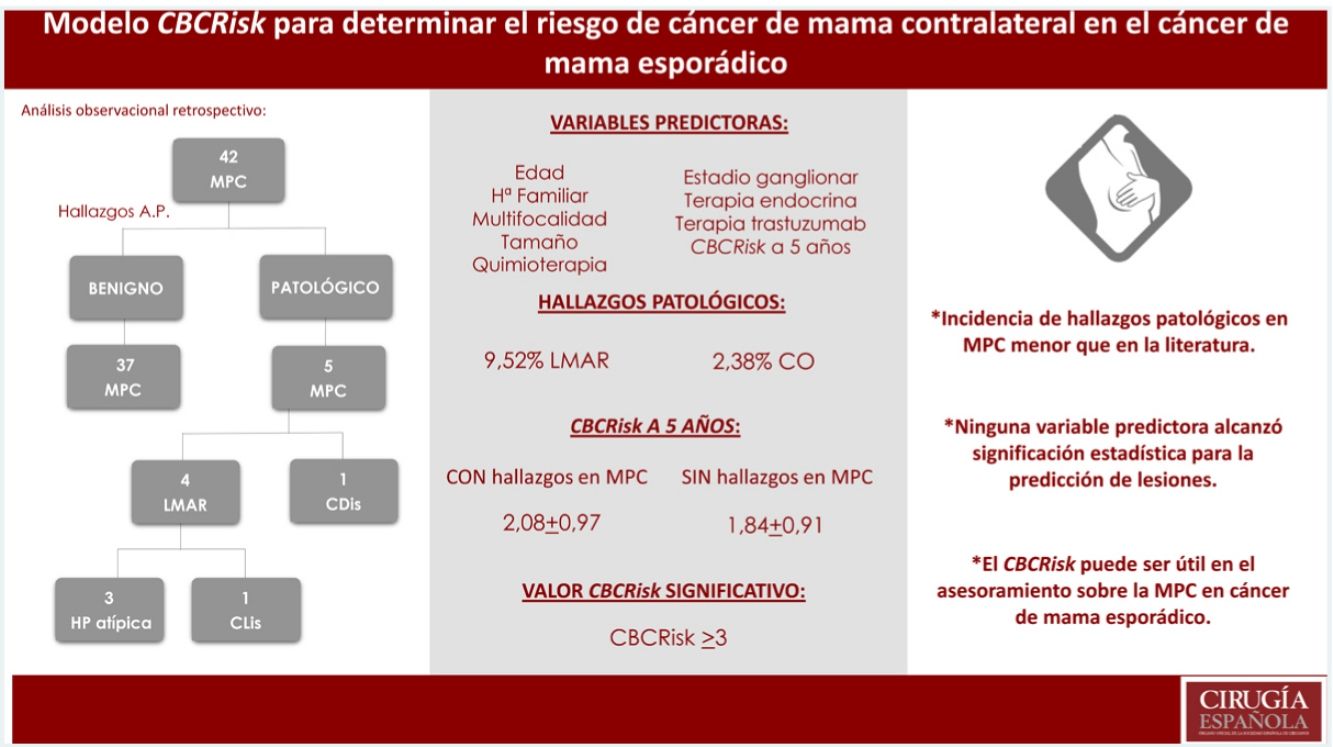
ResultadosSe seleccionaron 42 pacientes. Incidencia de LMAR y cáncer oculto (CO) menor que la descrita en la literatura (9,52% LMAR, 2,38% CO). Ninguna de las variables evaluadas alcanzó significación estadística para la predicción de lesiones. El valor de CBCRisk a cinco años medio en pacientes con hallazgos patológicos fue de 2,08 (DE 0,97), superior al CBCRisk medio del conjunto (1,87 ± 0,91) y del subgrupo de MPC sin hallazgos patológicos (1,84 ± 0,91). Solo el CBCRisk ≥ 3 resultó significativo (p = 0,04) para la predicción de hallazgos patológicos.
ConclusiónLas pacientes con CM esporádico deben ser adecuadamente informadas de los riesgos y beneficios estimados de la MPC. El CBCRisk puede ser útil para el asesoramiento de estas pacientes, pero precisa validación en cohortes más amplias y prospectivas.
The great majority of breast cancer (BC) cases are diagnosed in women who have no known family history of the disease and are not carriers of any risk mutation. During the past few decades an increase in the number of contralateral prophylactic mastectomy (CPM) has been produced in these patients. The CBCRisk model calculates the absolute risk of suffering from contralateral breast cancer (CBC); thus, it can be used to counselling patients with sporadic breast cancer.
MethodAn observational, retrospective study including sporadic breast cancer patients treated with contralateral prophylactic mastectomy has been conducted between 2017 and 2019. A descriptive and comparative study with one variation of logistic regression has been carried out in order to identify predictive factors of occult tumors (OT) and medium/high risk damage (MHRD). Evaluation of the CBCRisk model published in 2017 and different limit values for the CPM recommendation.
Results42 patients were selected. Incidence of MHRD and OT was lower than that described in the literatura (9.52% MHRD, 2.38% OT). None of the evaluated variables reached statistical significance for predicting injuries. The average value of CBCRisk 5 years ahead found in patients with pathological findings was 2.08 (SD 0.97), higher than the average value of the whole group (1.87 ± 0.91) and the subgroup without pathological findings (1.84 ± 0.91). Only values ≥ 3 for CBCRisk were considered statistically significant (p = 0.04) for the prediction of histological lesions.
ConclusionPatients with sporadic breast cancer should be adequately informed about the estimated risks and benefits of undergoing a contralateral prophylactic mastectomy. The CBCRisk may be useful for the counseling of these patients, but it requires validation in larger and prospective cohorts.
La mastectomía profiláctica contralateral (MPC) ha sido evaluada como estrategia para la reducción del riesgo de cáncer de mama contralateral (CMC) en pacientes con un cáncer de mama esporádico (es decir, sin mutaciones en los principales genes asociados al cáncer de mama hereditario, y sin una fuerte historia familiar)1.
La MPC constituye la estrategia terapéutica que aporta mayor reducción del riesgo de CMC, disminuye la necesidad de controles, y con ello, la preocupación y ansiedad de las pacientes, además de aportar beneficios en cuanto a simetrización. Sin embargo, se trata de un procedimiento comprometido: es agresivo, irreversible, duplica el riesgo de complicaciones quirúrgicas2, puede retrasar la administración de terapias adyuvantes y con frecuencia requiere otras intervenciones (fundamentalmente por asociar algún tipo de reconstrucción mamaria). Puede asociarse con dolor crónico3 e influir negativamente en la salud mental y sexual de las pacientes4. Además, el beneficio en términos de supervivencia de la MPC en mujeres no portadoras de mutaciones BRCA no ha sido claramente demostrado, a excepción quizá de las mujeres menores de 49 años con tumores triple negativo5.
Las indicaciones de consenso1 para la MPC incluyen el antecedente de irradiación supradiafragmática antes de los 30 años y la mutación demostrada BRCA 1/2. Puede considerarse en el caso de portadoras de mutaciones CHEK2/PTEN/p53/PALB2/CDH1, pacientes con fuerte historia familiar sin mutaciones de riesgo demostradas, o en caso de importante asimetría tras la mastectomía unilateral (con o sin reconstrucción).
En las últimas décadas, hemos asistido a un aumento en la realización de MPC en pacientes con CM esporádico, más notable entre la población estadounidense que en la europea, por factores sociales y culturales aún no aclarados6,7. Este hecho resulta paradójico, ya que el diagnóstico precoz del CM junto con la mejoría en las terapias adyuvantes ha permitido, por un lado, aumentar las posibilidades de conservación de la mama (ampliándose las indicaciones de la cirugía conservadora) y, por otro, disminuir la recurrencia, mortalidad e incidencia de CMC8.
Algunos autores atribuyen este incremento de las MPC a una sobreestimación del riesgo de CMC por parte de las pacientes, junto con la generalización del acceso a reconstrucción inmediata1,6.
Hasta la publicación en 2017 del modelo predictivo de riesgo absoluto CBCRisk9, no se disponía de una herramienta cuantitativa útil para el asesoramiento individual de riesgo de CMC en mujeres con CM unilateral esporádico. Este modelo calcula el riesgo absoluto de CMC por periodos, a través de la combinación de ocho factores de riesgo: edad al diagnóstico del primer CM, terapia antiestrogénica, antecedentes familiares de CM de primer grado, lesiones de moderado-alto riesgo (LMAR) previas, estatus de receptores estrogénicos, densidad mamaria al diagnóstico, tipo de tumor primario y edad al nacimiento del primer hijo. Está especialmente diseñado para mujeres con CM unilateral esporádico, al no incluir información sobre mutaciones de riesgo.
Posteriormente, se evaluó la capacidad del modelo para discriminar mujeres con alto/bajo riesgo de CMC en dos cohortes independientes10, pero los datos de seguimiento solo permitieron hacerlo con un periodo de tres a cinco años. Se concluyó que, a pesar de que existen diferencias según la prevalencia del CM, las características de la cohorte y los parámetros codificados como «desconocidos», el modelo puede ser útil para el asesoramiento individual en la práctica clínica habitual.
El objetivo de este trabajo es evaluar si el CBCRisk es capaz de identificar aquellas pacientes con mayor probabilidad de presentar LMAR o malignidad oculta en la mama contralateral y poder así seleccionar aquellas que obtendrían un mayor beneficio de la MPC.
MétodosPoblación a estudioSe incluyen mujeres con un CM unilateral esporádico sometidas a MPC, entre enero de 2017 y marzo de 2019 en una única Unidad de Mama.
Se aplicaron como criterios de exclusión:
- –
Edad < 18 años y > 88 años (para ajustar la muestra al modelo CBCRisk, especialmente diseñado en mujeres entre 18-88).
- –
Pacientes con cáncer de mama y mutaciones genéticas de alto riesgo demostradas.
- –
Pacientes sin cáncer de mama sometidas a mastectomía reductora de riesgo bilateral.
- –
Pacientes con cáncer de mama bilateral.
- –
Pacientes con carcinoma lobulillar in situ (CLIS).
- –
Pacientes con tumores de estirpe no ductal ni lobulillar.
- –
Pacientes sometidas a radioterapia supradiafragmática antes del primer diagnóstico de CM.
Se analizaron retrospectivamente dos grupos de variables:
1.Variables demográficas necesarias para el cálculo del CBCRisk:
- –
Edad al diagnóstico del primer CM.
- –
Terapia antiestrogénica para el tratamiento del tumor primario.
- –
Antecedentes de CM en familiares de primer grado.
- –
Lesiones de moderado-alto riesgo (LMAR) previas al diagnóstico de CM.
- –
Densidad mamaria al diagnóstico (según la clasificación de BI-RADS: predominio graso, patrón de densidades parcheadas, heterogéneas y extremadamente densas).
- ?
Edad al nacimiento del primer hijo (< 30 años o nuliparidad, 30-39, ≥ 40).
- ?
Tipo de tumor primario (cáncer no invasivo [CDIS] puro, invasivo puro, mixto-CDIS e invasivo)
2. Variables clinicopatológicas:
Relativas al tumor:
- –
Tamaño tumor (≤ 2 cm, 2-5 cm, ≥ 5 cm).
- –
Multifocalidad.
- –
Estadio ganglionar.
- –
Quimioterapia adyuvante.
- –
Positividad receptores estrogénicos (terapia hormonal).
- –
Positividad HER2 + (terapia con trastuzumab).
- –
Hallazgos en piezas de MPC.
Se consideraron lesiones de moderado-alto riesgo (LMAR), la hiperplasia atípica (HA) ductal o lobulillar y el carcinoma lobulillar in situ (CLIS).
Análisis estadísticoSe compararon los hallazgos anatomopatológicos en las piezas de MPC con el CBCRisk a cinco años calculado con el modelo mediante la calculadora online (disponible en https://cbc-predictor-utd.shinyapps.io/CBCRisk/). Se consideró exclusivamente el CBCRisk a los cinco años.
Se realiza en primer lugar un análisis descriptivo de las variables a estudio: frecuencias relativas y absolutas (v. cualitativas) y media y desviación estándar (DE) (v. cuantitativas). Se evalúa la relación entre variables cualitativas mediante el test de χ2. Para comparar medias entre dos grupos independientes, se utiliza el test U de Mann-Whitney o t de Student, según criterios de normalidad. Análisis de regresión logística univariante para identificar factores predictivos de LMAR y/o cáncer de mama contralateral oculto. Se establece el nivel de significación estadística para un valor p menor a 0,05. Para todo, el análisis ha utilizado el programa estadístico SPSS 22.0, este estudio fue aprobado por el Comité Ético del centro (Hospital Clínico Universitario Lozano Blesa, Zaragoza, España).
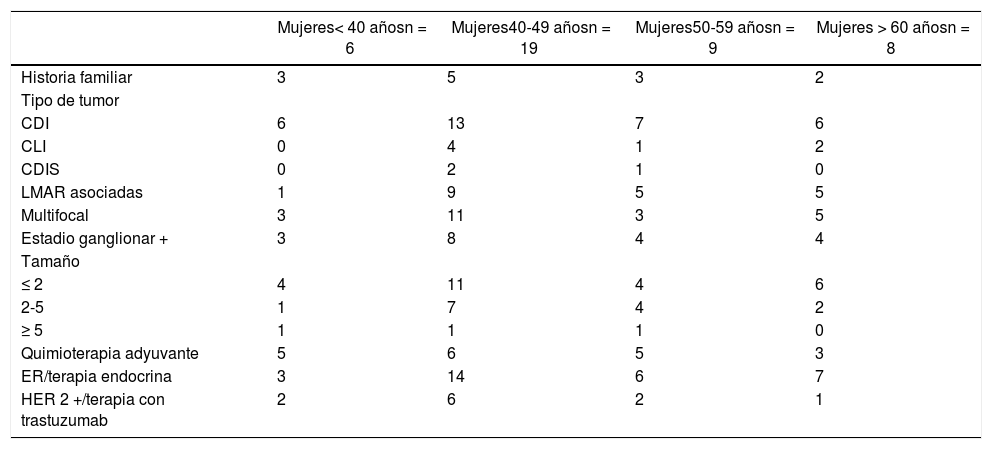
ResultadosDescripción de la población del estudioSe intervinieron un total de 42 mujeres realizando mastectomía bilateral por un cáncer de mama unilateral esporádico. Las características demográficas y clínicopatológicas se describen por rangos de edad en la tabla 1.
Datos demográficos y clinicopatológicos
| Mujeres< 40 añosn = 6 | Mujeres40-49 añosn = 19 | Mujeres50-59 añosn = 9 | Mujeres > 60 añosn = 8 | |
|---|---|---|---|---|
| Historia familiar | 3 | 5 | 3 | 2 |
| Tipo de tumor | ||||
| CDI | 6 | 13 | 7 | 6 |
| CLI | 0 | 4 | 1 | 2 |
| CDIS | 0 | 2 | 1 | 0 |
| LMAR asociadas | 1 | 9 | 5 | 5 |
| Multifocal | 3 | 11 | 3 | 5 |
| Estadio ganglionar + | 3 | 8 | 4 | 4 |
| Tamaño | ||||
| ≤ 2 | 4 | 11 | 4 | 6 |
| 2-5 | 1 | 7 | 4 | 2 |
| ≥ 5 | 1 | 1 | 1 | 0 |
| Quimioterapia adyuvante | 5 | 6 | 5 | 3 |
| ER/terapia endocrina | 3 | 14 | 6 | 7 |
| HER 2 +/terapia con trastuzumab | 2 | 6 | 2 | 1 |
CDI: carcinoma ductal infiltrante; CLI: carcinoma lobulillar infiltrante; CDIS: carcinoma ductal in situ; ER: estrogen-receptor, receptores estrogénicos; HER 2+: human epidermalgrowth factor receptor 2, receptor del factor de crecimiento epidérmico humano 2.
La edad media del conjunto fue de 48,61 años (DE 10,56). Solo 13 de ellas (30,95%), contaban con historia familiar de CM. El tipo de tumor más frecuente de la muestra en todos los grupos de edad fue el CDI (76,2%). Los tumores primarios en 22 casos fueron multifocales (52,38%) y asociaron LMAR hasta en 20 mujeres (47,61%). La mayoría de los tumores fueron diagnosticados con un tamaño ≤ 2 cm (59,52%) y sin extensión ganglionar (54,77%).
El 71,42% de las mujeres fueron sometidas a terapia endocrina debido al estatus hormonal del tumor primario. Sin embargo, solo el 45,23 y el 26,19% recibieron quimioterapia y terapia con trastuzumab, respectivamente.
Riesgo calculado y hallazgos anatomopatológicos de CMC y LMAR en piezas de MPC.
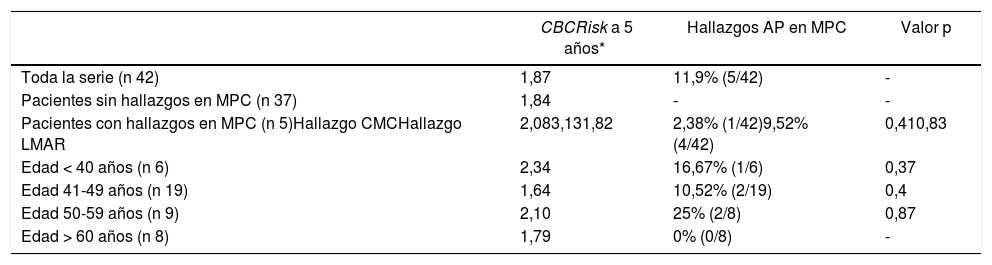
El CBCRisk calculado medio a los cinco años fue de 1,87 (DE 0,91), es decir, el riesgo absoluto de CMC medio a cinco años en nuestra serie fue del 1,87%.
Se encontraron cuatro LMAR (9,52%), tres hiperplasias atípicas (7,14%) y un CLIS (2,38%) y un cáncer no invasivo (CDIS) (2,38%). No se diagnosticó ningún carcinoma infiltrante.
El CBCRisk medio a cinco años de las pacientes con hallazgos en las piezas de MPC fue de 2,08 (DE 0,97), ligeramente superior al CBCRisk medio del conjunto (1,87 ± 0,91) y del subgrupo de MPC, sin hallazgos patológicos (1,84 ± 0,91). La paciente que presentó CDIS en la pieza de MC, tenía un CBCRisk calculado de 3,13 (sin ser estadísticamente significativa esta diferencia) y su tumor primario se trataba de un CDIS T1N0 con receptores hormonales positivos, no precisando quimioterapia. Los resultados se exponen en la tabla 2.
CBCRisk calculado a 5 años y hallazgos anatomopatológicos en piezas MPC
| CBCRisk a 5 años* | Hallazgos AP en MPC | Valor p | |
|---|---|---|---|
| Toda la serie (n 42) | 1,87 | 11,9% (5/42) | - |
| Pacientes sin hallazgos en MPC (n 37) | 1,84 | - | - |
| Pacientes con hallazgos en MPC (n 5)Hallazgo CMCHallazgo LMAR | 2,083,131,82 | 2,38% (1/42)9,52% (4/42) | 0,410,83 |
| Edad < 40 años (n 6) | 2,34 | 16,67% (1/6) | 0,37 |
| Edad 41-49 años (n 19) | 1,64 | 10,52% (2/19) | 0,4 |
| Edad 50-59 años (n 9) | 2,10 | 25% (2/8) | 0,87 |
| Edad > 60 años (n 8) | 1,79 | 0% (0/8) | - |
Cabe destacar que al igual que en el artículo original, las variables menos disponibles en la historia de las pacientes han sido la densidad de la mama al diagnóstico y la edad al nacimiento del primer hijo, por lo que el modelo puede ser calculado, pero requiere una interpretación cautelosa.
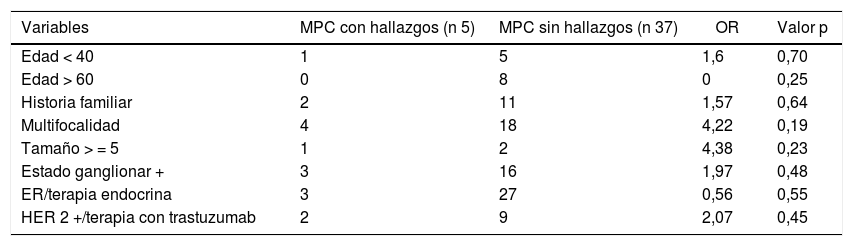
Factores predictores de CMC y LMARSe realizó un análisis univariante tratando de identificar factores predictores de CMC y/o LMAR.
Ninguna de las variables analizadas alcanzó la significación estadística, probablemente por tratarse de un tamaño muestral pequeño (tabla 3).
Análisis factores predictores de CMC y/o LMAR
| Variables | MPC con hallazgos (n 5) | MPC sin hallazgos (n 37) | OR | Valor p |
|---|---|---|---|---|
| Edad < 40 | 1 | 5 | 1,6 | 0,70 |
| Edad > 60 | 0 | 8 | 0 | 0,25 |
| Historia familiar | 2 | 11 | 1,57 | 0,64 |
| Multifocalidad | 4 | 18 | 4,22 | 0,19 |
| Tamaño > = 5 | 1 | 2 | 4,38 | 0,23 |
| Estado ganglionar + | 3 | 16 | 1,97 | 0,48 |
| ER/terapia endocrina | 3 | 27 | 0,56 | 0,55 |
| HER 2 +/terapia con trastuzumab | 2 | 9 | 2,07 | 0,45 |
Se evaluaron en la muestra distintos puntos de corte del modelo CBCRisk, encontrando el CBCRisk ≥ 3, como único valor estadísticamente significativo (p = 0,04), para la predicción de hallazgos patológicos en la pieza de mastectomía contralateral.
DiscusiónEl riesgo de CMC en la población general oscila entre 0,1-0,6% anual11. Sin embargo, se han descrito factores individuales y derivados del tratamiento del tumor primario que podrían modificar este riesgo.
En el estudio publicado por King et al.12, se identificó CMC oculto en 6% y LMAR en 28%. En el análisis univariado, la multifocalidad/multicentricidad fue el único factor asociado con CMC (OR 2,88, p = 0,04). Sin embargo, cuando realizaron análisis multivariante, encontraron asociación entre la edad y la positividad del receptor de progesterona. Los autores concluyeron que, por el momento, y hasta que no se identificasen predictores confiables, las bajas tasas de CMC oculto no justificaban el uso de MPC en mujeres con riesgo medio.
La incidencia de hallazgos patológicos en nuestra serie fue menor (9,52% para LMAR y 2,38% para CO). No se diagnosticó enfermedad invasiva, lo que hace todavía más difícil valorar el verdadero beneficio de la MPC para la mayoría de las mujeres.
El modelo del CBCRisk recoge factores de riesgo previamente reconocidos en la literatura. Sin embargo, se rechazaron para su diseño otros factores también bien conocidos. La menor edad al diagnóstico, presencia de antecedentes familiares de primer grado, los receptores estrogénicos negativos y el nacimiento del primer hijo, más allá de los 40 años, se asociaron con mayor incidencia de CMC. Se descartaron el tamaño tumoral y número de ganglios afectados, siendo que previamente se había considerado que un tamaño tumoral entre 2 y 5 cm incrementaría el riesgo relativo (RR) 1,51 y tumores > 5 cm presentarían un RR del 1,89, así como que la afectación de más de 10 ganglios obtendría un RR 1,6213. Se desestimó la valoración de antecedentes familiares diferentes al primer grado, cuando es conocido que la influencia de la historia familiar responde a un sistema complejo, pero el riesgo parece superior en caso de antecedentes múltiples, o si además de un familiar de primer grado se asocia un familiar de segundo grado13. También se rechazaron la presencia de menopausia, la positividad para HER-2, historia personal o familiar de cáncer de ovario, terapias de reemplazo hormonal e índice de masa corporal.
Por otra parte, se desconoce si la combinación de determinados factores puede aumentar exponencialmente el riesgo. Otra limitación del modelo es que no se diferencia entre el tipo de terapia antiestrogénica administrada, habiéndose demostrado ya que la reducción de riesgo de CMC es diferente, en caso de administrar tamoxifeno e inhibidores de la aromatasa (50 vs. 70%, respectivamente, de reducción de riesgo en no portadoras)14.
La calculadora permite, excepto para la edad al diagnóstico y características del tumor primario, la opción «desconocido» en todas las categorías. Lo cual tiene la ventaja de poder calcular el CBCRisk, aun con escasa información, pero asumiendo su valor limitado. No se ha establecido el número máximo de variables que pueden codificarse como «desconocido», sin que el CBCRisk pierda completamente su valor. Este problema se resolvería en caso de recogida prospectiva de los datos.
Por otra parte, no se han determinado los valores de CBCRisk, a partir de los cuales podría recomendarse la MPC en la población general. Los valores considerados como «riesgo bajo» difirieron en las dos cohortes de validación (2,4 y 1,53)10, ninguno de estos límites ha resultado estadísticamente significativo en nuestra muestra (p = 0,37 y p = 0,64, respectivamente). Si consideramos como hemos mencionado anteriormente que el riesgo anual máximo en la población general es de 0,6%, podríamos considerar como límite el CBCRisk a cinco años ≥ 3. En nuestra muestra, el 11,9% de las pacientes tienen un CBCRisk ≥ 3, encontrándose entre ellas el 40% (2/5) de los hallazgos patológicos y el único CDIS diagnosticado. Además, en nuestro conjunto de pacientes, el CBCRisk ≥ 3, este es el único valor de corte que ha alcanzado la significación estadística (p = 0,04).
Este estudio cuenta con limitaciones metodológicas: una muestra pequeña y recogida de datos retrospectiva (motivo por el que no es infrecuente la elección de «desconocido» para el cálculo del modelo). Sin embargo, consideramos que el CBCRisk puede resultar útil en la práctica clínica habitual, ya que hemos observado una pequeña diferencia entre los valores de CBCRisk a cinco años de las pacientes con hallazgos patológicos en la pieza de MPC y el valor CBCRisk ≥ 3 ha resultado estadísticamente significativo en nuestra muestra. Se precisan estudios con mayor tamaño muestral y diseño prospectivo.
En conclusión, urge el desarrollo de herramientas cuantitativas para el asesoramiento individual del riesgo de CMC en mujeres con CM unilateral esporádico, que permitan evitar las MPC innecesarias. Las pacientes deben ser adecuadamente informadas de los riesgos y beneficios esperables de la MPC, en cada caso particular.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.