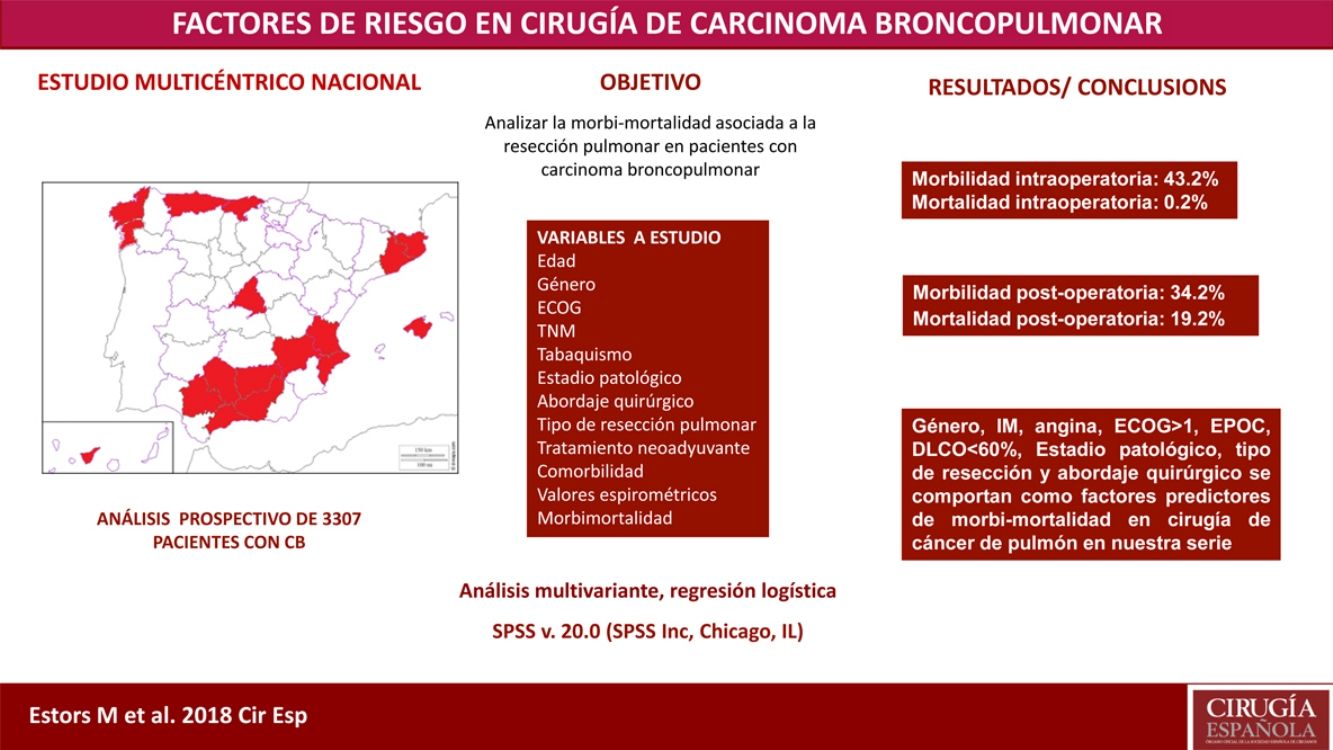
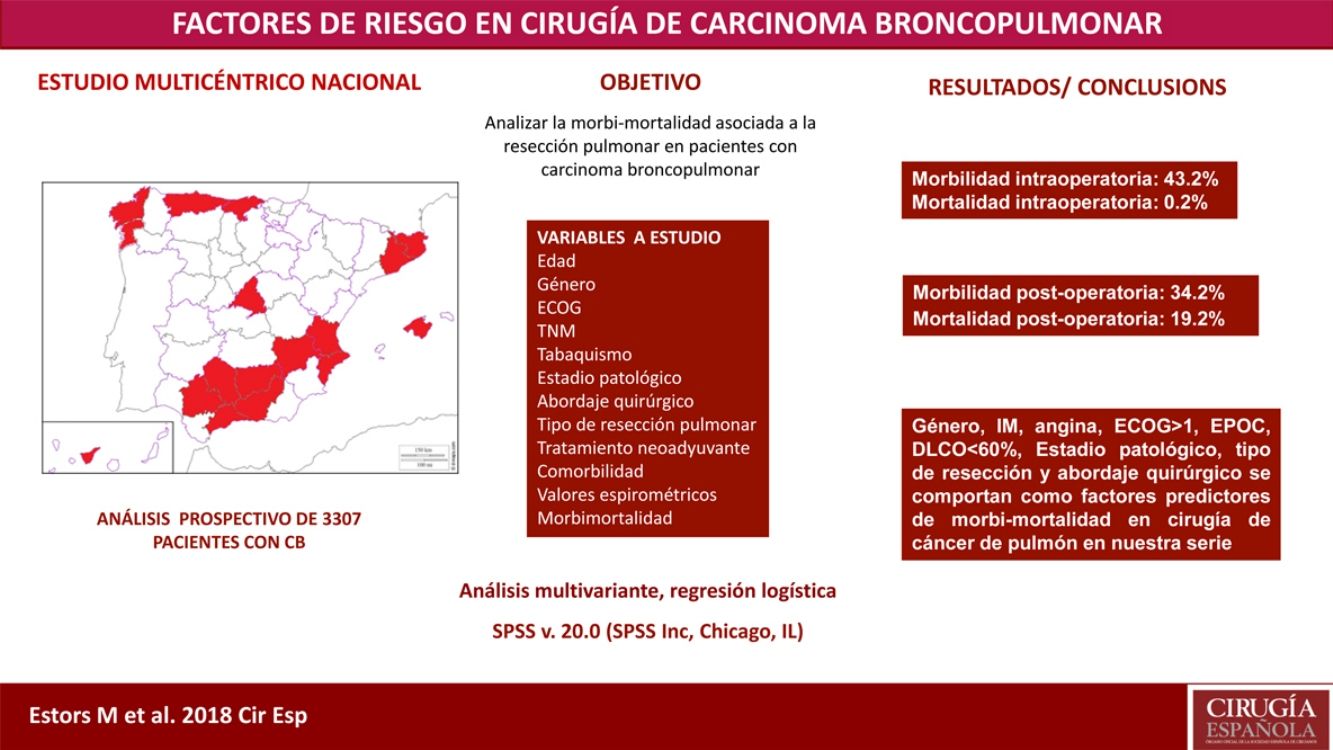
El tratamiento más adecuado en la mayoría de los pacientes con cáncer de pulmón en estadio inicial es la resección quirúrgica. A pesar de evaluar anteriormente que el estado de cada paciente sea el adecuado para detectar posibles complicaciones inherentes a la intervención quirúrgica, no se ha alcanzado ningún consenso sobre los factores que son de «alto riesgo» en esos pacientes. Nuestro estudio tuvo como objetivo analizar la morbilidad y la incidencia de mortalidad asociada con esta intervención quirúrgica en nuestro entorno con un estudio multicéntrico y descubrir los parámetros de riesgo.
MétodosSe trata de un estudio de análisis prospectivo con 3.307 pacientes operados de carcinoma broncopulmonar en 24 hospitales. Las variables de estudio fueron edad, sistema TNM, sexo, estadio, tabaquismo, abordaje quirúrgico, resección quirúrgica, escala ECOG, tratamiento neoadyuvante, comorbilidad, valores espirométricos y morbimortalidad intra- y postoperatoria. Se realizó un análisis de regresión logística multivariante de los factores pronósticos de morbilidad y mortalidad.
ResultadosRegistramos el 34,2% de morbilidad postoperatoria y el 2,1% de mortalidad postoperatoria. Sexo, infarto de miocardio, angina, ECOG ≥ 1, EPOC, DLCO < 60%, estado clínico patológico, resección quirúrgica y abordaje quirúrgico aparecieron como factores pronósticos de morbilidad y mortalidad en cirugía de cáncer de pulmón en nuestra serie.
ConclusionesLas principales variables que deben tenerse en cuenta al evaluar a pacientes con cáncer de pulmón para realizarles una intervención quirúrgica son sexo, infarto de miocardio, angina, ECOG, EPOC, DLCO, estado clínico patológico, resección quirúrgica y abordaje quirúrgico.
The most suitable treatment in most early-stage lung cancer patients is surgical resection. Despite previously assessing each patient's status being relevant to detect possible complications inherent to surgery, no consensus has been reached on which factors are “high risk” in such patients. Our study aimed to analyse the morbidity and the mortality incidence associated with this surgery in our setting with a multicentre study and to detect risk parameters.
MethodsA prospective analysis study with 3,307 patients operated for bronchopulmonary carcinoma in 24 hospitals. Study variables were age, TNM, gender, stage, smoking habit, surgery approach, surgical resection, ECOG, neoadjuvant therapy, comorbidity, spirometric values, and intraoperative and postoperative morbidity and mortality. A multivariate logistic regression analysis of the morbidity and mortality predictor factors was done.
ResultsWe recorded 34.2% postoperative morbidity and 2.1% postoperative mortality. Gender, myocardial infarction, angina, ECOG ≥1, COPD, DLCO <60%, clinical pathological status, surgical resection and surgery approach were shown as morbidity and mortality predictor factors in lung cancer surgery in our series.
ConclusionsThe main variables to consider when assessing the lung cancer patients to undergo surgery are gender, myocardial infarction, angina, ECOG, COPD, DLCO, clinical pathological status, surgical resection and surgery approach.
El carcinoma broncopulmonar es en la actualidad la principal causa de muerte por cáncer en todo el mundo. En los estadios iniciales la exéresis quirúrgica sigue siendo el tratamiento más adecuado en la mayoría de los pacientes: resulta de primordial importancia la valoración del estado de cada paciente antes de la intervención y la previsión de la aparición de complicaciones inherentes a este tipo de cirugía1. Se estima que uno de cada 5pacientes con cáncer pulmonar no microcítico (CPNM) de estadio I corre un elevado riesgo de complicaciones postoperatorias2 y se han publicado tasas de mortalidad del 2,2% de pacientes a quienes se les ha realizado una resección de CPNM3.
Se han propuesto diversos factores como influyentes en el riesgo quirúrgico de este tipo de intervención que afectan a la evolución de los pacientes, como la edad, la enfermedad pulmonar obstructiva crónica (EPOC), el infarto de miocardio (IM) previo, el tabaquismo o, más recientemente, los niveles de la capacidad de difusión pulmonar (DLCO) ≥ 60%4,5. En los últimos tiempos se han desarrollado diversos modelos de estratificación de riesgos que se han propuesto como herramientas para el cirujano torácico3,5,6. Sin embargo, hasta la fecha, aún no existe consenso sobre la definición de «alto riesgo» en este tipo de pacientes, lo que dificulta la elección del plan para cada paciente.
Actualmente, el estudio prequirúrgico sobre el que se basa la decisión final del equipo médico tiene en cuenta parámetros como la evaluación cardiológica, la capacidad respiratoria y la evaluación del parénquima pulmonar5,7.
El objetivo de nuestro estudio es analizar la incidencia de morbimortalidad asociada a esta cirugía en nuestro entorno mediante un estudio multicéntrico que incluye a pacientes provenientes de 24 hospitales de ámbito nacional, así como valorar cuáles son los parámetros de riesgo que están interviniendo y que han de ser tenidos en cuenta a la hora de planificar el tratamiento más adecuado en cada paciente.
Pacientes y métodosEstudio basado en un análisis prospectivo que incluye a 3.307 pacientes intervenidos de carcinoma broncopulmonar en 24 hospitales de ámbito nacional (tabla 1) en el período comprendido entre el 1 junio del 2012 y el 30 de noviembre del 2014. Todos los centros realizaron el mismo registro de datos en relación con la enfermedad, tratamiento y evolución de los pacientes.
Hospitales que han participado en el estudio
| Hospital Universitario Central de Asturias |
| Hospital General Universitari de València |
| Hospital Universitario de Jaén |
| Hospital Universitario Nuestra Señora de Candelaria (Tenerife) |
| Hospital Clínico San Carlos (Madrid) |
| Hospital General de Palma de Mallorca |
| Hospital Universitario Puerta de Hierro Majadahonda (Madrid) |
| Hospital General Universitario de Albacete |
| Hospital Clínic i Provincial de Barcelona |
| Hospital Universitari Sagrat Cor (Barcelona) |
| Hospital Universitario Virgen del Rocío (Sevilla) |
| Hospital Gregorio Marañón (Madrid) |
| Hospital Germans Trias i Pujol (Badalona, Barcelona) |
| Hospital Universitario Virgen de las Nieves (Granada) |
| Hospital Regional Universitario de Málaga |
| Hospital General Universitario de Alicante |
| Hospital Universitari de la Ribera (Alzira, Valencia) |
| Hospital Universitario La Paz (Madrid) |
| Hospital Universitario de A Coruña |
| Hospital Islas Cíes (Vigo, Pontevedra) |
| Hospital Universitario Reina Sofía (Córdoba) |
| Hospital Universitari de Girona Doctor Josep Trueta |
| Hospital Universitario Donostia |
| Hospital Clínico Universitario de Santiago de Compostela (La Coruña) |
Se excluyó a los pacientes con tumores irresecables a quienes se les habían realizado toracotomías exploradoras. Todos los hospitales implicados registraron los mismos datos sobre enfermedad, tratamiento y evolución del paciente; los cuidados eran revisados por los propios cirujanos. Después, un administrador de datos externo recopiló los datos de manera uniforme. Una reunión garantizó que la recopilación de datos fuera adecuada. Se excluyeron histologías diferentes de carcinoma broncopulmonar. Se siguieron los criterios de las directivas europeas de cirugía, tratamiento neoadyuvante y diagnóstico posterior8.
Las variables de estudio se eligieron de acuerdo con la bibliografía anterior8,9, se definieron de antemano y se acordaron por todos los autores: edad, estadio, sexo, estadio patológico, tabaquismo, abordaje quirúrgico, resección quirúrgica, estadio clínico, tratamiento neoadyuvante (quimioterapia o quimiorradioterapia), comorbilidad, parámetros espirométricos (DLCO, volumen espiratorio máximo en el primer segundo [VEF1]) y morbimortalidad intra- y postoperatoria. A este efecto, se tuvieron en cuenta la morbimortalidad postoperatoria durante los primeros 30 días. Los tumores se estadificaron según la 7.ª Revisión del Sistema Internacional de Estadificación del Cáncer de Pulmón (TNM). Se utilizó la escala del Eastern Cooperative Oncology Group (ECOG) para clasificar el estadio clínico.
Todas las complicaciones recogidas en los datos tuvieron trascendencia clínica. Para analizar la morbilidad, se utilizó la clasificación sistemática de la morbilidad operatoria en 5grupos normalizados (tabla 2) propuesta por Dindo et al.7, que ayudó a establecer una comparación objetiva entre intervenciones quirúrgicas y series de pacientes, y también entre diferentes cirujanos y equipos de cirugía.
Grado de complicación de la morbilidad de los pacientes
| Grado | Definición | n | Porcentaje |
|---|---|---|---|
| Complicación secundaria | |||
| I | No se requiere tratamiento farmacológico ni ningún otro tipo de tratamiento | 786 | 23,7 |
| II | Se necesita una intervención menor o tratamiento farmacológico adicional | 565 | 17 |
| Complicación principal | |||
| III | Se requieren intervención quirúrgica, radiológica o endoscópica, o tratamientos múltiples | ||
| III a | No requiere anestesia general | 129 | 3,9 |
| III b | La intervención requiere anestesia general | 94 | 2,8 |
| IV | Se necesita tratamiento en cuidados intensivos y unidad de soporte vital | ||
| IVa | Disfunción de un solo órgano | 49 | 1,5 |
| IVb | Disfunción multiorgánica | 30 | 0,9 |
| V | Muerte del paciente provocada por la complicación | 71 | 2,1 |
Cada paciente fue inscrito después de la aceptación del documento de consentimiento informado. El protocolo del estudio fue aprobado por los comités de ética de los hospitales participantes y se llevó a cabo de conformidad con la Declaración de Helsinki.
Análisis estadísticoLas variables cualitativas se expresaron en valores absolutos y porcentajes (%). Se realizó un análisis de regresión logística multivariante para analizar la correlación entre la morbilidad (incluidas las complicaciones principales y secundarias), la mortalidad y las características clínicas de los pacientes (edad, TNM, sexo, estadio patológico, tabaquismo, abordaje quirúrgico, resección quirúrgica, ECOG, tratamiento neoadyuvante, comorbilidad y parámetros espirométricos). La correlación entre las características clínicas y la mortalidad intraoperatoria no se mostraron por el número limitado de pacientes en este grupo (n=3). Las variables que muestran un umbral de significación mínimo en el análisis univariante se incluyeron en la prueba multivariante. El nivel de significación se tuvo en cuenta a partir de un valor de p ≤ 0,05. Para el análisis estadístico se usó el paquete SPSS, v. 20.0 (SPSS Inc, Chicago, IL, EE. UU.).
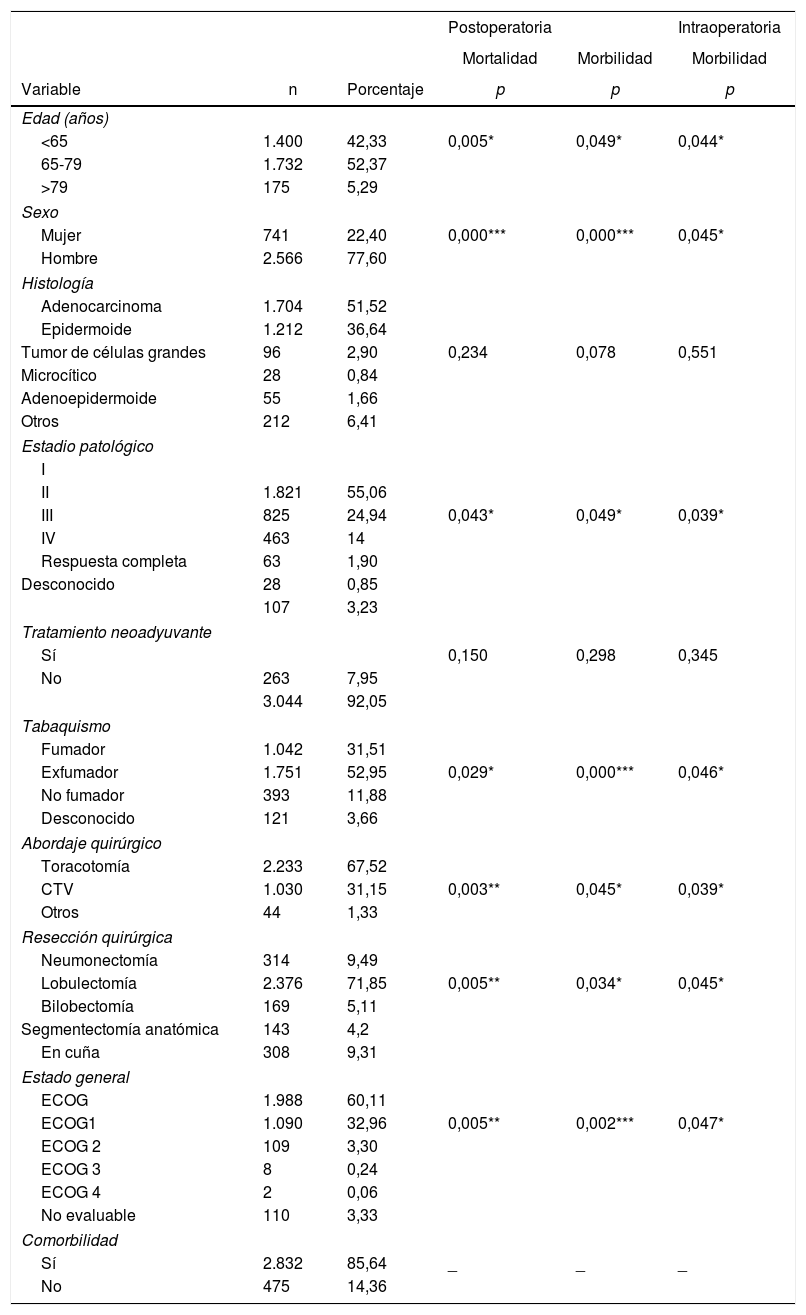
ResultadosEn la tabla 3 se presentan las características clínico-patológicas de los pacientes incluidos en nuestro estudio. De 3.307 casos, el 77,6% eran hombres, con una media de edad de 66 años. El adenocarcinoma fue el subtipo histológico más frecuente (55,1%). La distribución por estadios fue la siguiente: I, 55,1%; II, 24,9%; III, 14%, y IV, 1,9%. Un total de 263 pacientes (8%) recibieron tratamiento neoadyuvante.
Resultados de análisis univariante sobre la asociación entre las características de los pacientes y la morbilidad y la mortalidad
| Postoperatoria | Intraoperatoria | ||||
|---|---|---|---|---|---|
| Mortalidad | Morbilidad | Morbilidad | |||
| Variable | n | Porcentaje | p | p | p |
| Edad (años) | |||||
| <65 | 1.400 | 42,33 | 0,005* | 0,049* | 0,044* |
| 65-79 | 1.732 | 52,37 | |||
| >79 | 175 | 5,29 | |||
| Sexo | |||||
| Mujer | 741 | 22,40 | 0,000*** | 0,000*** | 0,045* |
| Hombre | 2.566 | 77,60 | |||
| Histología | |||||
| Adenocarcinoma | 1.704 | 51,52 | |||
| Epidermoide | 1.212 | 36,64 | |||
| Tumor de células grandes | 96 | 2,90 | 0,234 | 0,078 | 0,551 |
| Microcítico | 28 | 0,84 | |||
| Adenoepidermoide | 55 | 1,66 | |||
| Otros | 212 | 6,41 | |||
| Estadio patológico | |||||
| I | |||||
| II | 1.821 | 55,06 | |||
| III | 825 | 24,94 | 0,043* | 0,049* | 0,039* |
| IV | 463 | 14 | |||
| Respuesta completa | 63 | 1,90 | |||
| Desconocido | 28 | 0,85 | |||
| 107 | 3,23 | ||||
| Tratamiento neoadyuvante | |||||
| Sí | 0,150 | 0,298 | 0,345 | ||
| No | 263 | 7,95 | |||
| 3.044 | 92,05 | ||||
| Tabaquismo | |||||
| Fumador | 1.042 | 31,51 | |||
| Exfumador | 1.751 | 52,95 | 0,029* | 0,000*** | 0,046* |
| No fumador | 393 | 11,88 | |||
| Desconocido | 121 | 3,66 | |||
| Abordaje quirúrgico | |||||
| Toracotomía | 2.233 | 67,52 | |||
| CTV | 1.030 | 31,15 | 0,003** | 0,045* | 0,039* |
| Otros | 44 | 1,33 | |||
| Resección quirúrgica | |||||
| Neumonectomía | 314 | 9,49 | |||
| Lobulectomía | 2.376 | 71,85 | 0,005** | 0,034* | 0,045* |
| Bilobectomía | 169 | 5,11 | |||
| Segmentectomía anatómica | 143 | 4,2 | |||
| En cuña | 308 | 9,31 | |||
| Estado general | |||||
| ECOG | 1.988 | 60,11 | |||
| ECOG1 | 1.090 | 32,96 | 0,005** | 0,002*** | 0,047* |
| ECOG 2 | 109 | 3,30 | |||
| ECOG 3 | 8 | 0,24 | |||
| ECOG 4 | 2 | 0,06 | |||
| No evaluable | 110 | 3,33 | |||
| Comorbilidad | |||||
| Sí | 2.832 | 85,64 | _ | _ | _ |
| No | 475 | 14,36 | |||
CTV: cirugía torácica con vídeo; ECOG: escala de The Eastern Cooperative Oncology Group.
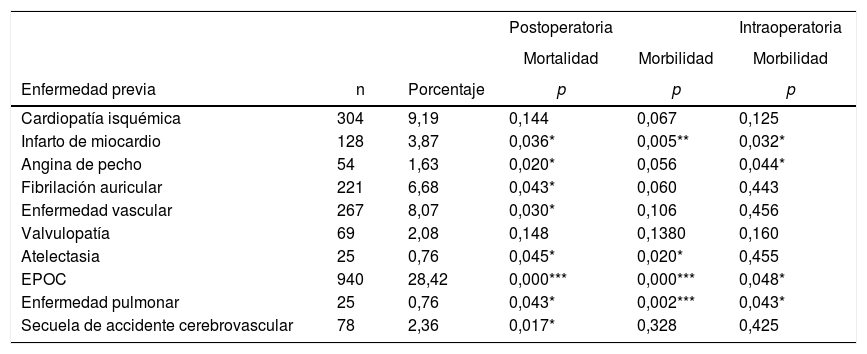
El abordaje quirúrgico más frecuente fue la toracotomía (67%). La lobectomía fue la resección quirúrgica más realizada (71,8%). En cuanto a la comorbilidad (tabla 4), los criterios de EPOC (28,4%) fueron los más frecuentes, seguidos por la miocardiopatía isquémica (9,2%), la enfermedad vascular (8,1%) y la fibrilación auricular (6,7%).
Resultados de análisis univariante sobre la asociación entre las características de los pacientes y la morbilidad y mortalidad
| Postoperatoria | Intraoperatoria | ||||
|---|---|---|---|---|---|
| Mortalidad | Morbilidad | Morbilidad | |||
| Enfermedad previa | n | Porcentaje | p | p | p |
| Cardiopatía isquémica | 304 | 9,19 | 0,144 | 0,067 | 0,125 |
| Infarto de miocardio | 128 | 3,87 | 0,036* | 0,005** | 0,032* |
| Angina de pecho | 54 | 1,63 | 0,020* | 0,056 | 0,044* |
| Fibrilación auricular | 221 | 6,68 | 0,043* | 0,060 | 0,443 |
| Enfermedad vascular | 267 | 8,07 | 0,030* | 0,106 | 0,456 |
| Valvulopatía | 69 | 2,08 | 0,148 | 0,1380 | 0,160 |
| Atelectasia | 25 | 0,76 | 0,045* | 0,020* | 0,455 |
| EPOC | 940 | 28,42 | 0,000*** | 0,000*** | 0,048* |
| Enfermedad pulmonar | 25 | 0,76 | 0,043* | 0,002*** | 0,043* |
| Secuela de accidente cerebrovascular | 78 | 2,36 | 0,017* | 0,328 | 0,425 |
EPOC: enfermedad pulmonar obstructiva crónica.
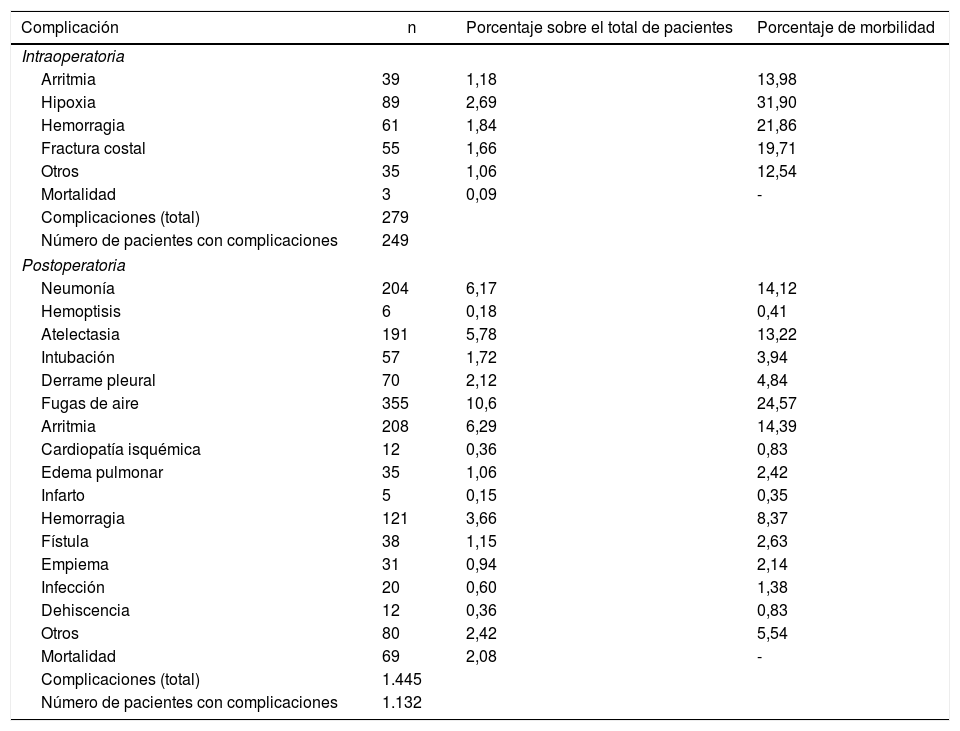
Registramos una morbilidad intraoperatoria del 7,5%. Encontramos 279 complicaciones, entre las cuales hipoxia (<60 O2 mmHg: 2,7%), hemorragia (por sección yatrógena de arteria o vena, 1,8%) y fractura costal (1,7%) fueron las más frecuentes. La morbilidad postoperatoria alcanzó el 34,2%, en la cual destacaron las fugas de aire (10,6%), la arritmia (6,3%) y la neumonía (6,2%) (tabla 5). En general, encontramos que la mayoría de las complicaciones de los pacientes fueron secundarias (78,4%) (tabla 2). La mortalidad intraoperatoria fue del 0,1%. La tasa de mortalidad postoperatoria a los 30 días fue del 2,1% (69 pacientes). De ellos, a 41 se les había realizado lobectomía; a 19, neumonectomía; a 5, resección sublobular y a 4, bilobelectomía. La mayor tasa de muertes se dio en la neumonectomía (el 6,1% de neumonectomía frente al 1,7% de lobectomía, el 2,4% de bilobecectomía y el 1,1% de resección sublobular).
Morbilidad de los pacientes
| Complicación | n | Porcentaje sobre el total de pacientes | Porcentaje de morbilidad |
|---|---|---|---|
| Intraoperatoria | |||
| Arritmia | 39 | 1,18 | 13,98 |
| Hipoxia | 89 | 2,69 | 31,90 |
| Hemorragia | 61 | 1,84 | 21,86 |
| Fractura costal | 55 | 1,66 | 19,71 |
| Otros | 35 | 1,06 | 12,54 |
| Mortalidad | 3 | 0,09 | - |
| Complicaciones (total) | 279 | ||
| Número de pacientes con complicaciones | 249 | ||
| Postoperatoria | |||
| Neumonía | 204 | 6,17 | 14,12 |
| Hemoptisis | 6 | 0,18 | 0,41 |
| Atelectasia | 191 | 5,78 | 13,22 |
| Intubación | 57 | 1,72 | 3,94 |
| Derrame pleural | 70 | 2,12 | 4,84 |
| Fugas de aire | 355 | 10,6 | 24,57 |
| Arritmia | 208 | 6,29 | 14,39 |
| Cardiopatía isquémica | 12 | 0,36 | 0,83 |
| Edema pulmonar | 35 | 1,06 | 2,42 |
| Infarto | 5 | 0,15 | 0,35 |
| Hemorragia | 121 | 3,66 | 8,37 |
| Fístula | 38 | 1,15 | 2,63 |
| Empiema | 31 | 0,94 | 2,14 |
| Infección | 20 | 0,60 | 1,38 |
| Dehiscencia | 12 | 0,36 | 0,83 |
| Otros | 80 | 2,42 | 5,54 |
| Mortalidad | 69 | 2,08 | - |
| Complicaciones (total) | 1.445 | ||
| Número de pacientes con complicaciones | 1.132 | ||
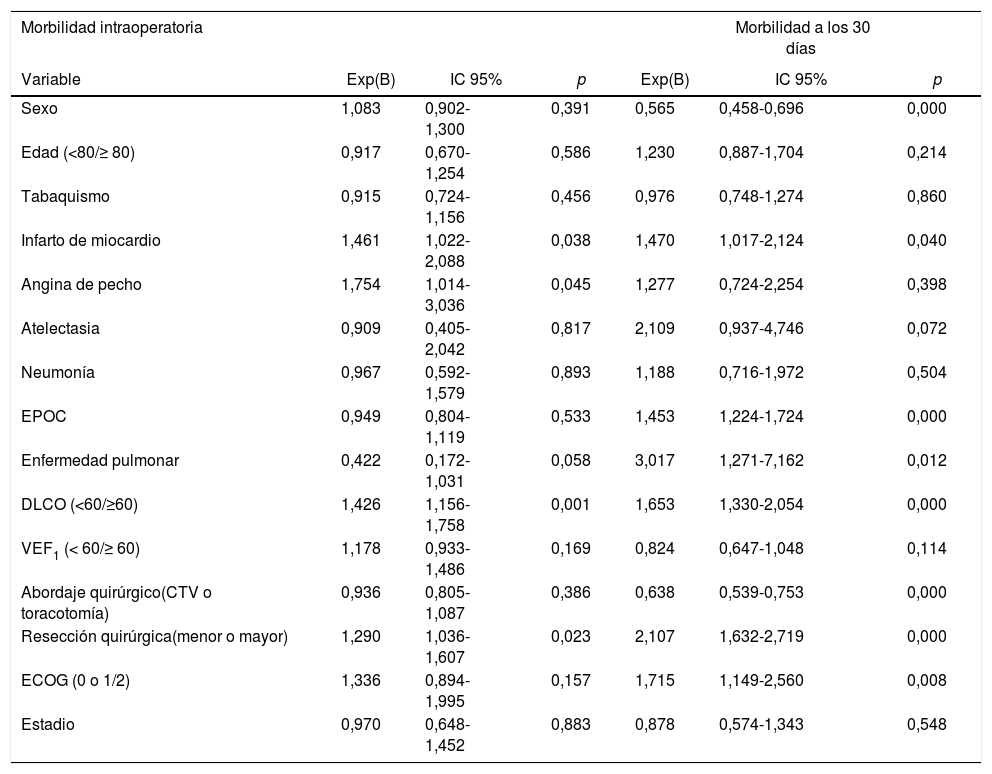
El análisis univariante de la asociación entre las características de los pacientes y la morbimortalidad se presenta en las tablas 3 y 4. Respecto a los factores prequirúrgicos que influyeron en la morbimortalidad intra- y postoperatoria (tabla 6), el análisis multivariante muestra que aquellos pacientes con antecedentes de infarto de miocardio (OR: 1,4; IC 95%: 1-2,1), angina (OR: 1,7; IC 95%: 1-3), DLCO <60% (OR: 1,4; IC 95%: 1,1-1,7) y resección mayor (OR: 1,3; IC 95%: 1-1,6) presentaron mayor probabilidad de morbilidad intraoperatoria. Los pacientes con antecedentes de infarto de miocardio (OR: 1,4; IC 95%: 1-2,1), EPOC (OR: 1,4; IC 95%: 1,2-1,7), enfermedad pulmonar (OR: 3,1; IC 95%: 1,3-7,2), ECOG ≥ 2 (OR: 1,7; IC 95%: 1,1-2,6), DLCO <60% (OR: 1,6; IC 95%: 1,3-2,1) y resección mayor (OR: 2,1; IC 95%: 1,6-2,7) presentaron mayor probabilidad de morbilidad postoperatoria. Las mujeres (OR: 0,6; IC 95%: 0,4-0,7) y los pacientes a quienes se les realizó cirugía torácica vídeo asistida (VATS) (OR: 0,6; IC 95%: 0,5-0,7) tenían menos probabilidades de presentar morbilidad postoperatoria.
Análisis multivariante sobre la asociación entre las variables de los pacientes y la morbilidad y la mortalidad
| Morbilidad intraoperatoria | Morbilidad a los 30 días | |||||
|---|---|---|---|---|---|---|
| Variable | Exp(B) | IC 95% | p | Exp(B) | IC 95% | p |
| Sexo | 1,083 | 0,902-1,300 | 0,391 | 0,565 | 0,458-0,696 | 0,000 |
| Edad (<80/≥ 80) | 0,917 | 0,670-1,254 | 0,586 | 1,230 | 0,887-1,704 | 0,214 |
| Tabaquismo | 0,915 | 0,724-1,156 | 0,456 | 0,976 | 0,748-1,274 | 0,860 |
| Infarto de miocardio | 1,461 | 1,022-2,088 | 0,038 | 1,470 | 1,017-2,124 | 0,040 |
| Angina de pecho | 1,754 | 1,014-3,036 | 0,045 | 1,277 | 0,724-2,254 | 0,398 |
| Atelectasia | 0,909 | 0,405-2,042 | 0,817 | 2,109 | 0,937-4,746 | 0,072 |
| Neumonía | 0,967 | 0,592-1,579 | 0,893 | 1,188 | 0,716-1,972 | 0,504 |
| EPOC | 0,949 | 0,804-1,119 | 0,533 | 1,453 | 1,224-1,724 | 0,000 |
| Enfermedad pulmonar | 0,422 | 0,172-1,031 | 0,058 | 3,017 | 1,271-7,162 | 0,012 |
| DLCO (<60/≥60) | 1,426 | 1,156-1,758 | 0,001 | 1,653 | 1,330-2,054 | 0,000 |
| VEF1 (< 60/≥ 60) | 1,178 | 0,933-1,486 | 0,169 | 0,824 | 0,647-1,048 | 0,114 |
| Abordaje quirúrgico(CTV o toracotomía) | 0,936 | 0,805-1,087 | 0,386 | 0,638 | 0,539-0,753 | 0,000 |
| Resección quirúrgica(menor o mayor) | 1,290 | 1,036-1,607 | 0,023 | 2,107 | 1,632-2,719 | 0,000 |
| ECOG (0 o 1/2) | 1,336 | 0,894-1,995 | 0,157 | 1,715 | 1,149-2,560 | 0,008 |
| Estadio | 0,970 | 0,648-1,452 | 0,883 | 0,878 | 0,574-1,343 | 0,548 |
| Mortalidad intraoperatoria | Mortalidad a los 30 días | |||||
|---|---|---|---|---|---|---|
| Sexo | - | - | - | 0,180 | 0,042-0,770 | 0,021 |
| Edad (<80/≥80) | - | - | - | 1,506 | 0,578-3,928 | 0,402 |
| Tabaquismo | - | - | - | 1,529 | 0,354-6,609 | 0,570 |
| Infarto de miocardio | - | - | - | 2,121 | 0,858-5,244 | 0,103 |
| Angina de pecho | - | - | - | 4,009 | 1,286-12,497 | 0,017 |
| Atelectasia | - | - | - | 1,532 | 0,194-12,094 | 0,686 |
| Neumonía | - | - | - | 2,895 | 0,979-8,562 | 0,055 |
| EPOC | - | - | - | 2,124 | 1,246-3,621 | 0,006 |
| Enfermedad pulmonar | - | - | - | 2,964 | 0,564-15,578 | 0,199 |
| DLCO (<60/≥60) | - | - | - | 1,066 | 0,537-2,116 | 0,854 |
| VEF1 (<60/≥60) | - | - | - | 0,871 | 0,426-1,781 | 0,705 |
| Abordaje quirúrgico(CTV o toracotomía) | - | - | - | 0,307 | 0,138-0,682 | 0,004 |
| Resección quirúrgica(menor o mayor) | - | - | - | 2,116 | 0,811-5,517 | 0,125 |
| Estadio | - | - | - | 0,345 | 0,128-0,927 | 0,035 |
| ECOG (0 o 1/2) | - | - | - | 2,910 | 1,258-6,731 | 0,013 |
| Secuela de accidente cerebrovascular | - | - | - | 3,378 | 1,259-9,064 | 0,016 |
| Enfermedad vascular | - | - | - | 1,492 | 0,728-3,06 | 0,274 |
| Fibrilación | - | - | - | 1,549 | 0,678-3,535 | 0,299 |
CTV: cirugía torácica con vídeo; DLCO: capacidad de difusión pulmonar para el monóxido de carbono; ECOG: escala de The Eastern Cooperative Oncology Group; EPOC: enfermedad pulmonar obstructiva crónica; VEF1: volumen espiratorio máximo en el primer segundo.
Asimismo, los pacientes con antecedentes de angina (OR: 4; IC 95%: 1,3-12,5), EPOC (OR; 2,1; IC 95%: 1,2-3,6), accidente cerebrovascular anterior con secuelas (OR: 3,4; IC 95%: 1,2-9,1) y ECOG ≥ 1 (OR: 2,9; IC 95%: 1,2-6,4) presentaron mayor probabilidad de mortalidad postoperatoria, mientras que las mujeres (OR: 0,2; IC 95%: 0,1-0,8), los pacientes operados con VATS (OR: 0,3; IC 95%: 0,1-0,7) y los pacientes de estadios I y II (OR: 0,3; IC 95%: 0,1-0,9) presentaron menor probabilidad de mortalidad postoperatoria.
DiscusiónLa resección quirúrgica continúa siendo el tratamiento de elección durante las primeras etapas del CPNM y sus resultados dependen tanto de evaluaciones oncológicas correctas como de una cuidadosa selección perioperatoria general, las cuales evitan que surjan complicaciones inherentes a este tratamiento1-3.
En nuestra serie, encontramos una morbilidad intraoperatoria del 7,5% y una morbilidad postoperatoria en los primeros 30 días del 34,2%. La mortalidad postoperatoria e intraoperatoria fueron del 2,1 y el 0,1%, respectivamente. Estos datos concuerdan con las cifras de la bibliografía2,3,10. La reducción de la mortalidad postoperatoria encontrada en los últimos estudios fue especialmente importante en comparación con la del estudio de la Sociedad Española de Patología del Aparato Respiratorio (SEPAR), que comunicaba tasas de morbimortalidad del 35,2 y el 6,8%, respectivamente, de pacientes a quienes se les había realizado toracotomía entre 1993 y 19971. Varias cuestiones pueden explicar esta sensibilidad positiva en la calidad de la cirugía del CPNM, como una mejor selección de pacientes para cirugía (gracias a la introducción de imágenes PET en las herramientas de estadificación clínica preoperatoria) y la implementación de programas perioperatorios de rehabilitación respiratoria.
En nuestro estudio, encontramos que la fuga aérea (10,6%) fue la complicación más frecuente, si bien se presentó con más frecuencia en otras series1, seguida de arritmia cardíaca, que, por lo general, se describe en la mayoría de los estudios similares con tasas que oscilan entre el 3,8 y el 40%.
Uno de los factores pronósticos más importantes de morbimortalidad después de la resección quirúrgica del CPNM es el estado clínico del paciente antes de la cirugía11. Como se esperaba, esta variable fue significativa estadísticamente en nuestra serie en los pacientes con valores de ECOG superiores o iguales a 1, los cuales presentaron mayor probabilidad de morbimortalidad intra- y postoperatoria.
Una de las preguntas más controvertidas es si la edad es un factor limitante para la cirugía pulmonar, específicamente en pacientes mayores de 80 años12. En nuestro estudio, los pacientes octogenarios mostraron tasas de morbimortalidad similares a las de otros grupos de edad. Muchos estudios corroboraron este hallazgo4,13,14 y concluyeron que a los pacientes octogenarios se les puede realizar resección pulmonar. No debemos olvidar que estos pacientes son más frágiles y siempre hay que valorar la cirugía sublobular como una alternativa, siempre y cuando sea factible, y el abordaje VATS, dado que este último supone una agresión menor.
En las últimas décadas, la proporción de mujeres diagnosticadas con carcinoma broncopulmonar ha aumentado de forma considerable en España1, probablemente en relación con el hábito social de fumar. Como se informó en la bibliografía5, en nuestra serie, las mujeres presentaron tasas más bajas de morbimortalidad postoperatoria, quizá debido a menos comorbilidades.
Como es bien sabido, un alto porcentaje de pacientes con carcinoma broncopulmonar presenta criterios clínicos de EPOC2. En nuestra muestra, el 28,4% de los pacientes presentan criterios de EPOC, lo cual se ha relacionado estadísticamente con morbimortalidad postoperatoria. Las lesiones estructurales que provocan esta enfermedad aumentan el espacio muerto fisiológico, la alteración de la relación ventilación-perfusión, los cambios hemodinámicos en los capilares pulmonares y la alteración de la difusión, lo que aumenta los esfuerzos para respirar y puede provocar insuficiencia respiratoria, que es la principal causa de muerte tras la resección quirúrgica del pulmón15.
Los valores bajos de VEF1 están relacionados con mayor morbimortalidad cardiorrespiratoria16,17. Después de un análisis multivariante en nuestra muestra, para el cual repartimos los valores de VEF1 en superiores o iguales al 60% y en inferiores al 60% según la bibliografía previa18, observamos que esta variable no actuaba como un factor de riesgo independiente para la morbimortalidad. Sin embargo, como hemos mencionado, la EPOC se ha relacionado estadísticamente con la morbimortalidad, y no debemos olvidar que el VEF1 es uno de los criterios clínicos utilizados para definir la enfermedad pulmonar obstructiva.
Al establecer para la DLCO el límite del 60%, encontramos que esta actuó como un factor de riesgo de morbilidad, pero no de mortalidad. La DLCO preoperatoria <60 se ha asociado con el 25% de mortalidad y el 40% de morbilidad en pacientes a quienes se les realizó resección quirúrgica pulmonar. Los valores bajos predichos de DLCO actúan como un factor pronóstico de complicaciones cardiorrespiratorias y de mortalidad, incluso en pacientes con un VEF1 que se encuentra dentro de los límites de la normalidad. Brunelli et al.19 encontraron una correlación débil entre los valores preoperatorios de DLCO y los valores del volumen espiratorio máximo en el primer segundo (VEF1) y los cálculos sistemáticos postoperatorios de DLCO, lo que mejora la predicción del riesgo de resección pulmonar. Actualmente, este es el motivo por el cual las guías del American College of Chest Physicians8 y las de la European Respiratory Society y la European Society of Thoracic Surgeons20 recomiendan tomar mediciones preoperatorias de DLCO en todos los pacientes candidatos a resección quirúrgica pulmonar. En nuestro estudio, no encontramos que la DLCO fuera un factor de riesgo independiente para la mortalidad, pero debe tenerse en cuenta que es otro de los criterios clínicos utilizados para definir la EPOC.
La miocardiopatía isquémica es un factor de alto riesgo para la resección quirúrgica pulmonar, con una incidencia que oscila entre el 11 y el 17%. Su existencia implica un riesgo del 3% de complicaciones cardíacas21,22. Obtuvimos una incidencia similar en nuestra serie. Aquellos pacientes con antecedentes de angina antes de la cirugía tienen mayor probabilidad de presentar morbilidad intraoperatoria. Del mismo modo, aquellos pacientes que han sufrido un infarto de miocardio antes de la cirugía presentan mayor morbilidad postoperatoria.
Al parecer, la cirugía videoasistida (VATS) ofrece resultados similares a los abordajes abiertos convencionales y remite a la posibilidad de lograr resecciones oncológicas óptimas23,24. Varios estudios13,25,26 han propuesto que las resecciones pulmonares por VATS en centros cualificados están asociadas con menor morbilidad. Coincidimos con estos estudios porque en nuestra serie el abordaje quirúrgico por VATS se asoció estadísticamente con menor morbilidad. También encontramos menor mortalidad postoperatoria, lo que también se ajusta a los resultados anteriores5,16.
Las resecciones sublobulares han obtenido excelentes resultados oncológicos en tumores <2cm y han mostrado menor riesgo de morbilidad perioperatoria27. Entre las ventajas de las resecciones menores pueden citarse el mantenimiento de la función pulmonar, menor riesgo de morbimortalidad perioperatoria, la posibilidad de que los pacientes toleren futuras resecciones si aparece un segundo tumor primario de pulmón o tumores recurrentes y la posibilidad de llevarlas a cabo mediante técnicas menos invasivas. La principal desventaja actual de estas operaciones es el mayor riesgo de recurrencia locorregional. Se ha demostrado que la tasa de supervivencia a 5 años de la segmentectomía en tumores <3cm es similar a la lobectomía28. Sin embargo, la resección en cuña se correlaciona con una supervivencia peor y con mayor tasa de recurrencia29.
Cabe destacar que también se tuvo en cuenta el estadio patológico de los pacientes de nuestra serie como factor pronóstico de mortalidad. Así, los pacientes de los estadios I y II presentaron menor probabilidad de mortalidad. Esto puede deberse al hecho de que la resección y el abordaje quirúrgicos empleados en las primeras etapas son menos intensivos y también a que estos pacientes no recibieron terapia neoadyuvante, lo que tal vez podría afectar a la morbilidad.
Reconocemos las limitaciones de nuestro análisis. De los diferentes hospitales que participaron en el estudio, no podemos evaluar los efectos, si los hay, que los diferentes cirujanos, sus equipos de trabajo o el volumen del hospital tienen sobre el desarrollo de complicaciones de los pacientes. Además, analizamos las complicaciones por completo, en lugar de evaluar las complicaciones individuales por separado. Por último, otras variables no contempladas en el estudio podrían desempeñar un papel en la morbimortalidad de los pacientes.
A pesar de estas limitaciones, nuestro estudio tiene varias fortalezas. El gran número de pacientes de diferentes regiones incluidos refleja los patrones de práctica actuales en todo el país y puede servir para guiar a los cirujanos en la selección adecuada de pacientes. Además, estos hallazgos pueden ser útiles para estimular la implementación de mejores protocolos perioperatorios diseñados para reducir la incidencia de complicaciones postoperatorias entre los pacientes con carcinoma broncopulmonar.
En resumen, encontramos que el infarto de miocardio, DLCO <60%, resección mayor, angina, EPOC y enfermedad pulmonar son las comorbilidades relacionadas con la morbilidad intra- y postoperatoria durante la cirugía del carcinoma broncopulmonar y provocan, sobre todo, complicaciones secundarias, entre las cuales la fuga aérea, la arritmia, la neumonitis y la hipoxia son las más frecuentes. Asimismo, parece que la mortalidad está relacionada principalmente con angina, accidente cerebrovascular anterior o ECOG ≥ 1.
ConclusionesRegistramos una morbilidad y mortalidad postoperatorias del 34,2 y del 2,1%, respectivamente. Sexo, infarto de miocardio, angina, ECOG ≥ 1, EPOC, DLCO <60%, estadio patológico tumoral, tipo de resección y abordaje quirúrgicos se comportaron como factores pronósticos de morbimortalidad en la cirugía del cáncer de pulmón en nuestra serie.
FinanciaciónEste estudio fue financiado por una subvención de la Sociedad Española de Cirugía Torácica (SECT).
Conflicto de interesesNo existe ningún conflicto de intereses.
Antonio Cueto Ladrón de Guevara; Florencio Quero Valenzuela; Inmaculada Piedra Fernández; José Galbis Caravajal; Francisco Javier Algar Algar; Ricardo Arrabal Sánchez; Nicolás Moreno Mata; Francisco Garcia Gomez; Pablo León Atance; Guillermo González Casaurran; Joaquín Calatayud Gastardi; Silvana Crowley Carrasco; Concepción Partida González; Ricardo Guijarro Jorge; Miriam Estors Guerrero; Enrique Pastor Martínez; Sergio Bolufer Nadal; José Miguel Izquierdo; Javier Aragón Valverde; Eva María García Fontán; Jorge Quiroga Martínez; Jorge Hernández Ferrández; Samuel García Reina; Carmen María Rodríguez Gómez; Cristina Izquierdo; Ángel Francisco Carvajal Carrasco; María Delgado Roel; Jorge Herrero Collantes; Juan Jose Fibla; Laureano Molins.
Estudio colaborativo auspiciado por la Sociedad Española de Cirugía Torácica. Este estudio se ha realizado por el grupo de estudio de Complicaciones de Resecciones Pulmonares por Carcinoma Broncogénico de la Sociedad Española de Cirugía Torácica (anexo).