La relación entre desnutrición prequirúrgica y morbimortalidad está documentada desde hace años. A pesar de la existencia de herramientas que nos permiten detectar y tratar esta entidad, su aplicación en la práctica clínica es, a día de hoy, lenta. Por otra parte, tanto la insulinorresistencia como la hiperglucemia perioperatoria se asocian a mayor morbimortalidad postoperatoria y estancia media más prolongada. La ingesta de bebidas ricas en hidratos de carbono 2-4 h antes de la intervención permite disminuir dicha insulinorresistencia. Otro factor que reduce la estancia y las complicaciones es el soporte nutricional enteral postoperatorio precoz en relación con el soporte vía parenteral tradicional. También las fórmulas con inmunonutrientes han demostrado ser eficaces a la hora de disminuir complicaciones posquirúrgicas y estancia media. A la vista de la evidencia científica y de las guías de práctica clínica recomendamos la adopción de estas medidas, sustituyendo a las tradicionales.
The relationship between preoperative malnutrition and morbi-mortality has been documented for years. Despite the existence of tools that allow its detection, and therefore treat this entity, their introduction into clinical practice is not wide-spread. Both perioperative insulin resistance and hyperglycemia are associated with increased perioperative morbidity and length of hospital stay. The intake of carbohydrate-rich drinks 2-4h prior to surgery reduces insulin resistance. In the immediate postoperative period, the enteral route is safe and well tolerated and its early use reduces hospital stay and postoperative complications compared with parenteral nutritional support. Inmunonutrition has been proven effective to decrease postoperative complications and hospital stay. In view of these data we opted for the adoption of these measures replacing bowel rest and the indiscriminate use of postoperative parenteral nutrition.
Es un hecho consumado que la desnutrición perioperatoria se asocia con mayor morbimortalidad1 y, aun a sabiendas de esta realidad, hasta el 65% de los pacientes que van a someterse a una intervención quirúrgica (IQ) del tracto gastrointestinal superior presentan criterios de desnutrición2 y dos tercios de los pacientes intervenidos experimentan disminución de peso durante la estancia hospitalaria3. En el estudio multicéntrico español Prevalencia de Desnutrición y Costes Asociados (PREDyCES©), la prevalencia de desnutrición del paciente quirúrgico se estableció en el 10%4.
Ya en 1936 Studley documentó la estrecha relación existente entre desnutrición y aparición de complicaciones en pacientes intervenidos por enfermedad ulcerosa péptica: el 33% de los pacientes con pérdida de peso previo a cirugía superior al 20% falleció, frente al 3,5% de aquellos con pérdida de peso previo inferior al 20%5.
Cincuenta años después, pese al avance de las técnicas quirúrgicas y anestésicas, la desnutrición previa a la intervención en pacientes afectos de tumores digestivos se asoció a una mayor tasa de complicaciones posquirúrgicas (72 vs 29%) y mortalidad (23 vs 4%) respecto a aquellos normonutridos6.
Pese al gran desarrollo de la nutrición clínica en los últimos años y a su aportación a la práctica médica habitual, actualmente siguen manteniéndose las prácticas del ayuno preoperatorio y del reposo digestivo posquirúrgico en una gran mayoría de los centros hospitalarios7. Esta situación no nos es ajena: en nuestro país, en una encuesta realizada en 2005, se determinó que el ayuno pre- y postoperatorio predominaba sobre el soporte nutricional (SN) perioperatorio de forma alarmante, y que la técnica de SN más utilizada en pacientes intervenidos quirúrgicamente por enfermedad biliopancreática era el SN parenteral8.
La desnutrición preoperatoria en la cirugía gastrointestinal está causada en la mayoría de los casos por uno de estos 2 factores7: caquexia tumoral o disminución de la ingesta.
El objetivo de esta revisión es proporcionar evidencia científica acerca de las nuevas tendencias sobre el SN perioperatorio; para ello se realizó una búsqueda en Pubmed de los artículos publicados en los últimos 15 años, seleccionando los más relevantes (guías de práctica clínica [GPC], metaanálisis, revisiones sistemáticas de la literatura, estudios prospectivos aleatorizados).
Cribado nutricional precirugíaEn los últimos años se han desarrollado herramientas para el cribado y el diagnóstico de desnutrición (por ejemplo, Malnutrition Screening Tool [MUST], Nutritional Risk Screening-2002 [NRS-2002] o Subjective Global Assessment [SGA]) y GPC para llevar a cabo un SN eficiente; aun así, el conocimiento del personal médico en esta materia continúa siendo deficiente9.
Numerosos estudios han analizado la relación entre estado nutricional preoperatorio1,10–15, riesgo de desnutrición y resultados postoperatorios y confirman que la desnutrición asociada a enfermedad se asocia con mayor morbimortalidad y estancia hospitalaria, mayores tasas de reingreso y costes de tratamiento superiores respecto a pacientes normonutridos. De estas conclusiones se deduce la importancia de contar con buenas herramientas de cribado y diagnóstico de desnutrición. Con el conocimiento científico actualmente existente, podemos decir que la valoración antropométrica o los métodos funcionales aislados no son de gran utilidad a la hora de establecer el diagnóstico de desnutrición o riesgo de la misma7 y que no hay estudios suficientes para determinar si alguna de las herramientas de cribado ofrece mayor rendimiento que las restantes.
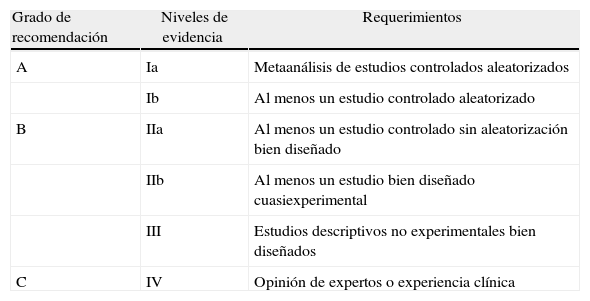
Las principales sociedades científicas en el campo de la nutrición clínica son American Society for Parenteral and Enteral Nutrition (ASPEN) y European Society of Parenteral and Enteral Nutrition (ESPEN). Ambas han publicado sus GPC sobre nutrición artificial que se basan en el sistema Agency for Healthcare Research and Quality (AHRQ) a la hora de establecer sus recomendaciones16 (tabla 1).
Grados de recomendación y niveles de evidencia de la AHQR
| Grado de recomendación | Niveles de evidencia | Requerimientos |
| A | Ia | Metaanálisis de estudios controlados aleatorizados |
| Ib | Al menos un estudio controlado aleatorizado | |
| B | IIa | Al menos un estudio controlado sin aleatorización bien diseñado |
| IIb | Al menos un estudio bien diseñado cuasiexperimental | |
| III | Estudios descriptivos no experimentales bien diseñados | |
| C | IV | Opinión de expertos o experiencia clínica |
AHQR: Agency for Healthcare Research and Quality.
ESPEN17 recomienda determinar los siguientes parámetros para la valoración perioperatoria del paciente quirúrgico:
- –
Pérdida de peso superior al 10-15% en los 6 meses previos.
- –
Índice de masa corporal (IMC) inferior a 18,5 kg/m2.
- –
SGA grado C.
- –
Albúmina inferior a 3g/dl sin alteración hepática o renal que lo justifique.
Por su parte, ASPEN, en una revisión de sus guías de cribado nutricional17, no realiza recomendaciones concretas para este tipo de pacientes.
Optimización del soporte nutricional periquirúrgicoSoporte nutricional preoperatorioEl objetivo del SN preoperatorio es mantener o mejorar el estado nutricional del paciente antes de la agresión quirúrgica.
Aunque se sabe que la desnutrición no se corrige en corto tiempo y que posponer una IQ permite una discreta mejoría del estado nutricional, la evidencia científica recopilada acerca del SN prequirúgico, sobre todo en pacientes moderada o severamente desnutridos, ha derivado en una serie de recomendaciones en las GPC de ASPEN (2002)18 y ESPEN19 (tabla 2). A continuación se describen distintas situaciones en las que estaría indicado realizar SN preoperatorio y la forma aconsejada de cómo proceder a realizarlo20 (tabla 3). Siempre que sea posible, el plan de SN ha de ser individualizado, a poder ser de forma ambulatoria y utilizando la vía oral o enteral.
Recomendaciones de ASPEN y ESPEN acerca del SN prequirúrgico
| Recomendaciones de ASPEN 200218acerca del SN prequirúrgico |
| Se debe administrar SN preoperatorio durante 7-10 días a todos los pacientes con desnutrición moderada o severa que vayan a ser operados de cirugía mayor en los que esta pueda posponerse (A) |
| Recomendaciones de ESPEN 200619acerca del SN prequirúrgico |
| En pacientes de alto riesgo nutricional (según los criterios de ESPEN descritos en el apartado anterior) está indicado realizar SN durante 10-14 días previos a cirugía, retrasando la intervención quirúrgica si fuera preciso (A) |
| Está indicado iniciar un SN, preferiblemente enteral, en pacientes normonutridos en los que se prevé que no van a ingerir alimentos durante 7 días perioperatoriamente, o que no alcanzarán el 50-60% de sus requerimientos por vía oral durante los 10 días previos a la intervención quirúrgica (C) |
ASPEN: American Association of Parenteral and Enteral Nutrition; ESPEN: European Society of Parenteral and Enteral Nutrition; SN: soporte nutricional.
Modalidades de SN preoperatorio
| Situación nutricional | Medidas nutricionales |
| Ingesta oral posible pero insuficiente (50- 75% de los requerimientos estimados) | - Revisar unas normas alimentarias adaptadas a la enfermedad de base- Prescripción de fórmulas enterales para la toma oral en forma de suplementos |
| Ingesta oral posible, pero<50-60% de las necesidades (anorexia intensa, disfagia ante sólidos, etc.). Incluye pacientes normonutridos en los que se prevé que no van a ingerir alimentos durante 7 días perioperatoriamente, o que no puedan mantener una ingesta oral por encima del 60% de la ingesta recomendada durante más de 10 días | - NE completa vía oral- NE completa a través de un acceso digestivo (sonda de enterostomía o apertura de ostomía según duración del SN) |
| Anorexia tan intensa que no permite tomar en cantidades suficientes una dieta natural o nutrición enteral, o alteraciones mecánicas que impiden tragar (disfagia alta o disfagia ante sólidos o líquidos) | - NE completa a través de un acceso digestivo (sonda de enterostomía o apertura de ostomía según duración del SN) |
| Contraindicación para realizar un SN preoperatorio vía enteral | - Ingreso para NP |
NE: nutrición enteral; NP: nutrición parenteral; SN: soporte nutricional.
Fuente: Tomado de,Cáncer et al.20.
El ayuno preoperatorio constituye una rutina en la práctica clínica diaria21, si bien se ha demostrado que su práctica induce una situación de insulinorresistencia, disfunción mitocondrial y estrés metabólico22.
La insulinorresistencia, caracterizada por la disminución de la respuesta de los tejidos a la acción de la insulina, se ha asociado con un aumento de la morbimortalidad postoperatoria y de la estancia hospitalaria23.
La hiperglucemia también se ha asociado con un aumento del riesgo de complicaciones24. La mejoría del control glucémico mediante insulinoterapia intravenosa intensiva conlleva una reducción de la morbimortalidad por todas la causas en pacientes intervenidos quirúrgicamente durante su estancia en cuidados intensivos23 pero el principal riesgo de este tratamiento está en la hipoglucemia y en la inducción de variabilidad glucémica, que se ha asociado con una mayor mortalidad de los pacientes ingresados en unidades de cuidados intensivos25. Por ello, y a pesar de que mantener un adecuado control glucémico es beneficioso, se ha intentado buscar nuevos métodos para disminuir la insulinorresistencia e hiperglucemia postoperatoria.
El grupo de Ljungqvist ha descrito un sencillo método para lograr tales efectos; se trata de la ingestión de bebidas ricas en hidratos de carbono 2 o 3 h antes de la IQ22. Esta estrategia logra producir una liberación de insulina similar a la inducida por una comida mixta y una reducción de la insulinorresistencia asociada al estrés quirúrgico que puede ser un 50% menor respecto a la no administración de la bebida hidrocarbonada durante el preoperatorio22.
Se han intentado estudiar los posibles mecanismos mediante los cuales estas bebidas pueden disminuir la insulinorresistencia asociada a cirugía. Citamos a continuación las conclusiones de estos estudios:
- –
Las bebidas ricas en hidratos de carbono contribuyen a replecionar los niveles de glucógeno hepático previamente a cirugía26.
- –
Favorecen la oxidación de los hidratos de carbono, reducida en situaciones de insulinorresistencia, al estimular la transformación de piruvato en acetil coenzima-A a través de la disminución de los niveles de piruvato deshidrogenasa tipo 4 muscular27.
Actualmente no hay evidencia de que los pacientes que toman líquidos hasta 2 o 3 h antes de la cirugía tengan más riesgo de aspiración o regurgitación que los que realizan un ayuno de más de 12 h. El estómago tarda en vaciarse menos de 90 min tras la ingestión de una bebida rica en hidratos de carbono, por lo que en pacientes sin riesgo de aspiración (se excluyen situaciones de cirugía urgente o pacientes con retraso del vaciamiento gástrico conocido) se podrían dar líquidos hasta 2 h antes de la intervención. ESPEN, en sus GPC, recomienda reducir el ayuno preoperatorio a unas 6-8 h y administrar una bebida rica en hidratos de carbono 2-3 h antes de la cirugía (tabla 4). En otros estudios, la ingesta de bebidas hidrocarbonadas se ha relacionado con disminución de la sensación de hambre, sed y la ansiedad perioperatoria de los enfermos28–30.
Recomendaciones de la ESPEN sobre el ayuno prequirúrgico
| Recomendaciones de ESPEN 200619acerca del ayuno preoperatorio |
| El ayuno desde la noche anterior de la cirugía no es necesario en la mayoría de los pacientes. Los pacientes sin riesgo de aspiración pueden beber líquidos hasta 2 h antes de la anestesia y tomar sólidos hasta 6 h antes (A) |
| La ingesta de bebidas ricas en hidratos de carbono la noche anterior (800ml) y 2 h antes (400ml) de la cirugía, en vez del ayuno nocturno, se recomienda en la mayoría de los pacientes de cirugía mayor (B) |
ESPEN: European Society of Parenteral and Enteral Nutrition.
Por su parte, ASPEN no se pronuncia a este respecto.
Nutrición postoperatoriaUno de los dogmas más extendidos dentro de la cirugía del aparato digestivo, además del ayuno preoperatorio, es el ayuno postoperatorio. Aunque su eficacia no ha sido demostrada, esta práctica se ha ido perpetuando entre las sucesivas generaciones de cirujanos7.
Normalmente no se comienza con una dieta líquida hasta que aparecen ruidos intestinales y, posteriormente, la dieta se progresa de forma gradual. Esto lleva a que muchos pacientes se mantengan en ayunas durante periodos prolongados. El ayuno favorece el sobrecrecimiento bacteriano, a la vez que produce una pérdida de trofismo de la mucosa intestinal. Además, el reposo intestinal se ha asociado con una disminución en la secreción intestinal de inmunoglobulina A y con una atrofia del tejido linfoide asociado al intestino, lo que produce una disminución de las defensas contra la agresión de las bacterias entéricas. Todo ello favorece la traslocación bacteriana y el paso de toxinas desde la luz intestinal hasta la circulación sanguínea. Esto sucede no solo durante el ayuno, sino también en el curso de la nutrición parenteral (NP) total20.
Desde hace tiempo se sabe que la nutrición enteral precoz es bien tolerada. En el año 2001, un metaanálisis publicado en el British Journal of Medicine31 determinó que el reposo digestivo posquirúrgico no se traducía en claros beneficios para el paciente; además, al comparar esta estrategia («nil per os» o «nada por boca») frente a la introducción de una NE precoz (24 h poscirugía), concluyó que la aplicación de la segunda estrategia se traducía en disminución de las complicaciones infecciosas y de la estancia media hospitalaria.
También se describió una tendencia a la reducción de la incidencia de dehiscencia de suturas y mortalidad, aunque estos resultados no fueron estadísticamente significativos. En 2009, otro metaanálisis32 comparando de nuevo NE precoz versus reposo digestivo en pacientes intervenidos de cirugía del tracto digestivo concluyó que, además, la NE precoz se asociaba también a una disminución de la mortalidad.
Actualmente se sabe que el íleo producido tras la cirugía abdominal es un fenómeno transitorio que ocurre debido a una inhibición de la motilidad intestinal por un estímulo del reflejo simpático secundario al traumatismo quirúrgico de la cavidad abdominal. El peristaltismo del intestino delgado se recupera a las 6-12 h de la cirugía, el del estómago a las 12-24 h y el del colon a las 48-120 h20. Todos los procedimientos que logren disminuir el íleo, facilitarán la ingesta oral temprana. A este respecto, están describiéndose nuevos protocolos de medidas perioperatorias encaminados a acelerar la recuperación de los pacientes intervenidos por cirugía convencional o laparoscópica: los enhance recovery after surgery (ERAS). Este conjunto de medidas que reducen el estrés quirúrgico pueden minimizar el catabolismo y favorecer el anabolismo rápido, para lograr una óptima recuperación y cicatrización tisular. Uno de los programas más desarrollados es el de cirugía colorrectal33. En él abogan por la no necesidad de ayuno preoperatorio clásico (evidencia A), la administración de una bebida hidrocarbonada 2 o 3 h antes de la cirugía (evidencia A), la no preparación mecánica del colon (evidencia A), la realización de una cirugía mínimamente invasiva o de incisiones horizontales, la utilización de anestesia epidural tópica alta y unos cuidados postoperatorios más agresivos, con restricción en la fluidoterapia, mejora del control del dolor, disminución de las náuseas, inicio de una dieta líquida en el postoperatorio inmediato (NE vía oral) y movilización temprana (el mismo día de la IQ) (evidencia A). Estos protocolos han demostrado disminuir la resistencia a la insulina durante el postoperatorio y la estancia media hospitalaria.
Con estos datos, las directrices de ESPEN acerca del ayuno postoperatorio19 abogan por la disminución al máximo del reposo digestivo posquirúrgico y la adaptación de la ingesta oral según la tolerancia del paciente y el tipo de cirugía (tabla 5). Nuevamente ASPEN no se pronuncia acerca del tema18.
Recomendaciones de la ESPEN sobre el ayuno posquirúrgico
| Recomendaciones de ESPEN 2006 acerca del ayuno postoperatorio |
| En general, la interrupción de la ingesta nutricional tras la cirugía no es necesaria en la mayoría de pacientes (A) |
| La ingesta oral se puede introducir a las pocas h tras la cirugía en la mayoría de pacientes intervenidos por cirugía colónica (sobre todo bajo un programa ERAS) sin diferencias entre la cirugía abierta y la cirugía laparoscópica (A) |
| La ingesta oral tras la intervención quirúrgica debe adaptarse a la tolerancia individual del paciente y al tipo de cirugía (C) |
ERAS: Enhance Recovery After Surgery; ESPEN: European Society of Parenteral and Enteral Nutrition.
Fuente: Basada en, Weinman et al.19.
Una vez intervenidos los pacientes, se debe plantear un SN postoperatorio. Ya hemos indicado que la nutrición oral es adecuada en pacientes intervenidos de cirugía colónica, principalmente mediante programas ERAS, si bien, hay un conjunto de pacientes en los que la ingesta oral temprana tras la cirugía no es posible. Es el caso de los enfermos intervenidos de neoplasias del tracto gastrointestinal superior. Disponemos para estos casos de 2 modalidades de SN: enteral y parenteral y esta última ha sido de preferencia durante muchos años. Bozzetti34 en el año 2001 dio a conocer las conclusiones de un estudio prospectivo aleatorizado multicéntrico en el que comparó la NE precoz con la NP en el postoperatorio de pacientes desnutridos operados con cirugía del tracto gastrointestinal. En él incluyó a 317 pacientes y ambos tipos de SN aportaban el mismo contenido en calorías y proteínas. Concluyó que la NE se asociaba a un menor número de complicaciones postoperatorias (34 vs 49%; p<0,05) y a una menor estancia hospitalaria (13,4 vs 15 días; p < 0,05). Posteriormente, en 2008 se publicó un metaanálisis que incluía a 2.552 sujetos comparando de nuevo NE y NP postoperatoria35. Los resultados volvieron a avalar a la NE precoz como una modalidad de SN postoperatorio asociada a reducción de: cualquier tipo de complicación (infecciosas y no infecciosas), dehiscencia de sutura, incidencia de abscesos abdominales y estancia hospitalaria. Recientemente, un estudio de intervención prospectivo de Jie et al.36 sobre 1.831 pacientes sometidos a un SN enteral, parenteral o ausencia de SN, demostró que las complicaciones posquirúrgicas, principalmente infecciosas, fueron significativamente menores en el grupo de la NE respecto al de la NP y al grupo que no recibió ningún tipo de SN, sin encontrarse diferencias significativas entre estos 2 últimos grupos.
Por lo tanto, podemos concluir que la vía enteral es la vía de elección a la hora de realizar un SN posquirúrgico si la vía oral no es factible. Para ello es necesario disponer de un acceso digestivo. De ello debe encargarse el equipo quirúrgico, colocando una sonda nasoentérica durante la operación. prevea que la recuperación pueda ser difícil o que el SN se requiera durante más de 6 semanas, está indicada la apertura de una ostomía quirúrgica durante la intervención. En los casos en los que no haya sido posible dejar una sonda nasoenteral o abrir una ostomía, el SN postoperatorio se realizará mediante NP. La NP también se utilizará en los casos en los que los requerimientos nutricionales no pudiesen alcanzarse por vía enteral o si se produjesen complicaciones postoperatorias con fallo intestinal que hagan prever que el paciente será incapaz de alcanzar sus requerimientos mediante ingesta oral en 7-10 días si está normonutrido o 5-7 días si está malnutrido.
Las recomendaciones de las principales asociaciones científicas respecto a este tema se recogen en la tabla 6.
Recomendaciones de ASPEN y ESPEN acerca de nutrición postoperatoria
| Recomendaciones generales |
| No se debe administrar NP de forma rutinaria en el postoperatorio de los pacientes con cirugía mayor gastrointestinal (A de ASPEN) |
| Se debe administrar SN tras la cirugía en aquellos pacientes en los que se prevean tiempos de ayuno de al menos 7-10 días (B de ASPEN) |
| La NE por un acceso digestivo debe iniciarse en las primeras 24 h siguientes a la cirugía (A de ESPEN) |
| Se recomienda instaurar NE precoz en pacientes en los que la ingesta oral temprana no es posible, como: el postoperatorio de cirugía mayor de cabeza y cuello o de tumores del tracto digestivo superior, el trauma severo (por mayor riesgo de sepsis y fallo multiorgánico) y en pacientes con desnutrición severa detectada en el momento de la cirugía (A de ESPEN) |
| Está indicada la NE precoz en el postoperatorio si se prevé una ingesta oral menor al 60% durante más de 10 días (C de ESPEN) |
| La NE postoperatoria debe iniciarse a ritmo lento (10-20ml hora) debido a la tolerancia limitada del tracto gastrointestinal. Pueden tardarse 5-7 días en llegar a ritmo completo sin ser ello perjudicial (C de ESPEN) |
| Tipo de fórmula |
| Está recomendado el uso de fórmulas con inmunomoduladores en el postoperatorio de pacientes operados con cirugía mayor de cáncer de cabeza y cuello o abdomen superior (esófago, estómago y páncreas-duodeno) o con trauma severo, independientemente de su estado nutricional (C de ESPEN) |
| Las fórmulas con inmunomoduladores deben iniciarse, a ser posible, en el preoperatorio (A de ESPEN) |
| En la mayoría de los pacientes con SN enteral, la fórmula enteral utilizada suele ser una polimérica (C de ESPEN) |
| Cuando se utiliza una fórmula inmunomoduladora, debe mantenerse durante 5-7 días tras la cirugía (si la cirugía no se ha complicado) (C de ESPEN) |
| Tipo de acceso enteral |
| La colocación de una sonda nasoyeyunal o de una yeyunostomía se recomienda como acceso digestivo para el soporte nutricional en los pacientes intervenidos de cirugía mayor abdominal (A de ESPEN) |
| Si hay anastomosis en el tracto gastrointestinal proximal debe colocarse una sonda que se progrese distal a dicha anastomosis (B de ESPEN) |
| Si se precisa NE durante más de 4 semanas (traumatismo craneoencefálico severo) debe considerarse la colocación percutánea de una gastrostomía (C de ESPEN) |
El estrés quirúrgico induce cambios en la actividad del sistema inmune, tanto en la inmunidad innata como en la adaptativa37. La respuesta inmunológica inicial ante el estrés quirúrgico es la inflamación local. Este tipo de respuesta parece ser adaptativa y se produce no solo en la especie humana, sino también en muchas otras. Sin embargo, este tipo de respuesta puede llegar a ser inapropiada a la noxa y convertirse en una respuesta sistémica (denominado síndrome de respuesta inflamatoria sistémica), que, a su vez, puede desembocar en fallo multiorgánico37.
La inmunonutrición va a intentar modular la respuesta inflamatoria intentando evitar el síndrome de respuesta inflamatoria sistémica y el fallo multiorgánico en la medida de lo posible. Para ello, pueden administrarse distintos nutrientes por vía enteral.
A día de hoy los inmunonutrientes más estudiados son: arginina, glutamina y ácidos grasos omega 3.
La arginina es un aminoácido condicionalmente esencial, es decir que su síntesis por parte del organismo no satisface la demanda en determinadas situaciones, como puede ser el estrés posquirúrgico o la sepsis38. La arginina cumple múltiples actividades metabólicas, pero esencialmente está implicada en la producción de poliaminas a través de su conversión en ornitina. Las poliaminas son moléculas clave en el crecimiento y diferenciación celular por aceleración de la síntesis proteica. A dosis farmacológicas es capaz de aumentar la síntesis de hormonas anabólicas tales como prolactina, hormona del crecimiento y los factores de crecimiento derivados de insulina; además, estimula la función de las células T y es precursora de la síntesis de óxido nítrico39, que mejora la circulación microvascular. En situaciones de estrés secundario a cirugía o trauma, el déficit de arginina altera la respuesta inmune adaptativa y perturba el buen funcionamiento del receptor de las células T.
La evidencia clínica acerca de la suplementación con arginina en situaciones de estrés es aún limitada, por lo que actualmente sus indicaciones dependen de la enfermedad de base causante del estrés. Un metaanálisis publicado en 200140 concluyó que su administración a los pacientes sépticos carecía de efectos beneficiosos y que incluso podría aumentar la mortalidad de estos. Posteriormente, otro metaanálisis41 describió propiedades favorables en pacientes quirúrgicos (disminución de la tasa de infección posquirúrgica, de la estancia hospitalaria y de la duración de la ventilación mecánica durante la estancia en UCI). A partir de esto, las GPC de ESPEN alertan acerca del posible efecto dañino de su administración a pacientes sépticos, mientras que detallan que la suplementación en pacientes quirúrgicos puede ser beneficiosa19.
Los ácidos grasos omega 3 derivan de la elongación del ácido graso esencial α-linolénico. Sus derivados más estudiados son el ácido eicosapentaenoico (EPA) y el ácido docosahexaenoico, a los que se les han atribuido numerosas propiedades antiinflamatorias, ya que son base de la producción de las prostaglandinas de la serie 3.
Aparte de su acción antiinflamatoria, existen estudios que relatan propiedades anabólicas de esta familia de ácidos grasos. Ryan et al.7 en un estudio prospectivo aleatorizado a doble ciego demostraron que la suplementación prequirúrgica con EPA a pacientes que iban a ser operados de una esofaguectomía permitía mantener la masa magra de estos respecto a los no suplementados.
La glutamina es el aminoácido más abundante en el cuerpo humano y su función no es solo estructural, sino que, aparte de su reconocida utilidad como sustrato energético (principal fuente de energía de enterocitos, macrófagos y linfocitos), también se le han atribuido las siguientes capacidades37:
- –
Señalización celular.
- –
Función antioxidante (precursor de la síntesis de glutatión).
- –
Inmunomoduladora: atenúa la respuesta inmune ante agresiones externas, intentando que esta sea proporcionada.
- –
Aumenta la expresión de proteínas de choque térmico.
La glutamina es considerada un aminoácido condicionalmente esencial. En situaciones de estrés, sus depósitos se agotan rápidamente y puede producir una situación deficitaria en este aminoácido que conlleva disfunción inmune y alteración de la función de barrera del epitelio intestinal37. Tanto en experimentación animal como en ensayos clínicos, la suplementación con glutamina ha demostrado restaurar la integridad de la barrera gastrointestinal y disminuir la traslocación bacteriana37. En 2002, Novak42, en una revisión sistemática de la literatura científica disponible en aquel momento acerca de la suplementación con glutamina, concluyó que esta acción era capaz de reducir la complicaciones infecciosas y la estancia hospitalaria en pacientes sometidos a una IQ.
Hoy en día, la combinación de glutamina, arginina y ácidos grasos omega 3 es el cóctel más estudiado como principal inmunomodulador dietético. Dos metaanálisis publicados en 201043,44 determinaron que la utilización de estas fórmulas en pacientes quirúrgicos disminuía las complicaciones posquirúrgicas y la estancia hospitalaria.
Actualmente, las directrices de ESPEN recomiendan este tipo de fórmulas durante el perioperatorio de pacientes afectos de neoplasias del tracto gastrointestinal superior.
ProbióticosUna nueva área de interés en la aproximación del SN en el paciente quirúrgico lo constituye la administración de probióticos en el preoperatorio, con el fin de conseguir efectos beneficiosos en el postoperatorio. La administración de Lactobacillus plantarum en unos casos ha sido capaz de reducir la incidencia de infecciones postoperatorias (sobre todo neumonía)45, mientras que en otro estudio aleatorizado46 no produjo efectos beneficiosos significativos. La dosis de probiótico empleada en el segundo estudio fue menor, lo que pudo causar las diferencias. No obstante, se necesitan más estudios con diferentes cantidades y cepas de microorganismos administradas a la hora de establecer una recomendación definitiva.
ConclusiónLa desnutrición aumenta la morbimortalidad postoperatoria, la duración y el coste del ingreso. La valoración del estado nutricional previa a la intervención nos permite detectar a los pacientes con riesgo nutricional, los cuales se verán beneficiados de un programa de SN perioperatorio para reducir las complicaciones posquirúrgicas asociadas.
El reposo digestivo posquirúrgico no se ha revelado como efectivo, más bien contraproducente comparándolo frente al inicio de una alimentación precoz (tanto por vía oral como enteral).
La NE precoz se muestra superior a la NP total en enfermos operados de cirugía digestiva, pero para ello es necesario que el equipo quirúrgico coloque una sonda de alimentación adecuada durante el acto quirúrgico.
En el caso de estar indicado un SN enteral, las fórmulas inmunomoduladoras son especialmente eficaces en los pacientes intervenidos por neoplasias del tracto gastrointestinal superior.
En el último periodo existen nuevas áreas de interés en la aproximación del SN en el paciente quirúrgico: por ejemplo el aporte de hidratos de carbono preoperatorios o la administración de probióticos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.