La disminución del colesterol de las lipoproteínas de baja densidad (c-LDL) se asocia a un descenso de la morbilidad y la mortalidad cardiovascular. Se ha demostrado que no existe un valor de c-LDL por debajo del cual deje de obtenerse un beneficio preventivo con su disminución, y tampoco se ha observado una mayor incidencia de efectos secundarios asociada a las concentraciones más bajas de c-LDL. Disponemos de un amplio arsenal terapéutico hipolipidemiante, sin embargo, en un elevado porcentaje de pacientes no se alcanzan los objetivos de c-LDL. Las estatinas de alta potencia disminuyen el c-LDL por encima del 50%, y al asociar ezetimiba se consigue un descenso adicional del c-LDL de un 15-30% y puede doblar el porcentaje de pacientes que alcanzan los objetivos. Dicha combinación se ha mostrado segura y eficaz en prevención primaria y secundaria de la enfermedad cardiovascular. Otra opción es la combinación de estatinas con resinas de intercambio, aunque requiere un manejo algo más complejo. La inhibición de la proteína PCSK9 con anticuerpos monoclonales disminuye el c-LDL por encima del 60% y es eficaz en la prevención de la enfermedad cardiovascular. Sin embargo, debido a su coste, su uso queda restringido a los pacientes isquémicos o con hipercolesterolemia familiar que no alcanzan los objetivos con los fármacos convencionales.
La base de evidencias sobre el beneficio y la seguridad de lograr los objetivos de control del c-LDL es muy amplia y va en aumento. En los próximos años va a ser necesario adecuar la intensidad del tratamiento de la hipercolesterolemia al grado de riesgo vascular de los pacientes y al grado de descenso necesario para lograr los objetivos terapéuticos. Ello redundará en una prevención cardiovascular más eficaz y en una mayor calidad de vida, en particular en el amplio colectivo de pacientes de mayor riesgo vascular.
The reduction of low density lipoprotein-cholesterol (LDL-chol) has been associated with a decrease in cardiovascular morbidity and mortality. It has been demonstrated that there is no value of LDL-chol below which there ceases to be a preventive benefit with its reduction, and neither has it been observed that there is a higher incidence of secondary effects associated with lower concentrations of LDL-chol. Although there is a wide range of lipid-lowering drugs available, a high percentage of patients do not achieve the desired LDL-chol levels. The high-potency statins reduce the LDL-chol by 15-30%, and can double the percentage of patients that reach their desired level. This combination has shown to be safe and effective in the primary and secondary prevention of cardiovascular disease. Another option is the combination of statins with exchange resins, although this requires a more complex management. The inhibition of PCSK9 protein with monoclonal antibodies reduces the LDL-chol by more than 60%, and is effective in the prevention of cardiovascular disease. However, due to its cost, its use is restricted to patients with ischaemia or familial hypercholesterolaemia that do not achieve the desired levels with conventional drugs.
The evidence base as regards the benefit and safety of achieving the desired levels of LDL-chol is very wide and is still increasing. In the next few years, it may be necessary to adjust the intensity of the hypercholesterolaemia treatment to the level of vascular risk of the patients, and to the level of reduction necessary to achieve the therapeutic targets. This will result in a more effective cardiovascular prevention and in a better quality of life, particularly in the large group of patients at higher vascular risk.
La reducción del colesterol de las lipoproteínas de baja densidad (c-LDL) se asocia a un descenso de la morbimortalidad cardiovascular, tanto en prevención primaria como secundaria. En este sentido, y de acuerdo con los resultados del metanálisis del Cholesterol Treatment Trialists’ Collaboration por cada 1mmol/l (≈40mg/dl) de reducción del c-LDL mediante la terapia con estatinas se consigue una reducción del riesgo relativo del 22%1. Además, el c-LDL es el único parámetro biológico que no presenta un nivel inferior por debajo del cual no se obtienen beneficios2, y por lo tanto la hipótesis de la concentración plasmática de c-LDL «0mg/dl» como máximo exponente del axioma «c-LDL, cuanto más bajo mejor» tiene todo su sentido en los pacientes de alto/muy alto riesgo vascular3. En este contexto, el estudio Improved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT)4 demostró en pacientes con un síndrome coronario agudo que la combinación de una estatina más ezetimiba redujo la concentración plasmática de c-LDL hasta los 54mg/dl, sin producir un incremento de efectos secundarios y sí una reducción de episodios cardiovasculares, después de un seguimiento clínico de unos 6 años. Más recientemente, los hallazgos de los estudios Fourier y Odyssey Outcomes con los nuevos inhibidores de PCSK9, evolocumab y alirocumab, respectivamente, han ampliado la evidencia científica del beneficio cardiovascular de la reducción del c-LDL, al alcanzar al final del ensayo clínico concentraciones medias de c-LDL de 30 y 53mg/dl, respectivamente5,6.
En el terreno de la prevención primaria, en pacientes con una proteína C reactiva de alta sensibilidad ≥2mg/l y una concentración de c-LDL<130mg/dl, el estudio JUPITER señaló el beneficio del tratamiento con 20mg/día de rosuvastatina frente a placebo después de un seguimiento de 2 años7; además, aquellos pacientes tratados con rosuvastatina que alcanzaron un c-LDL<50mg/dl presentaron reducciones adicionales de episodios cardiovasculares, sin un incremento de efectos adversos8.
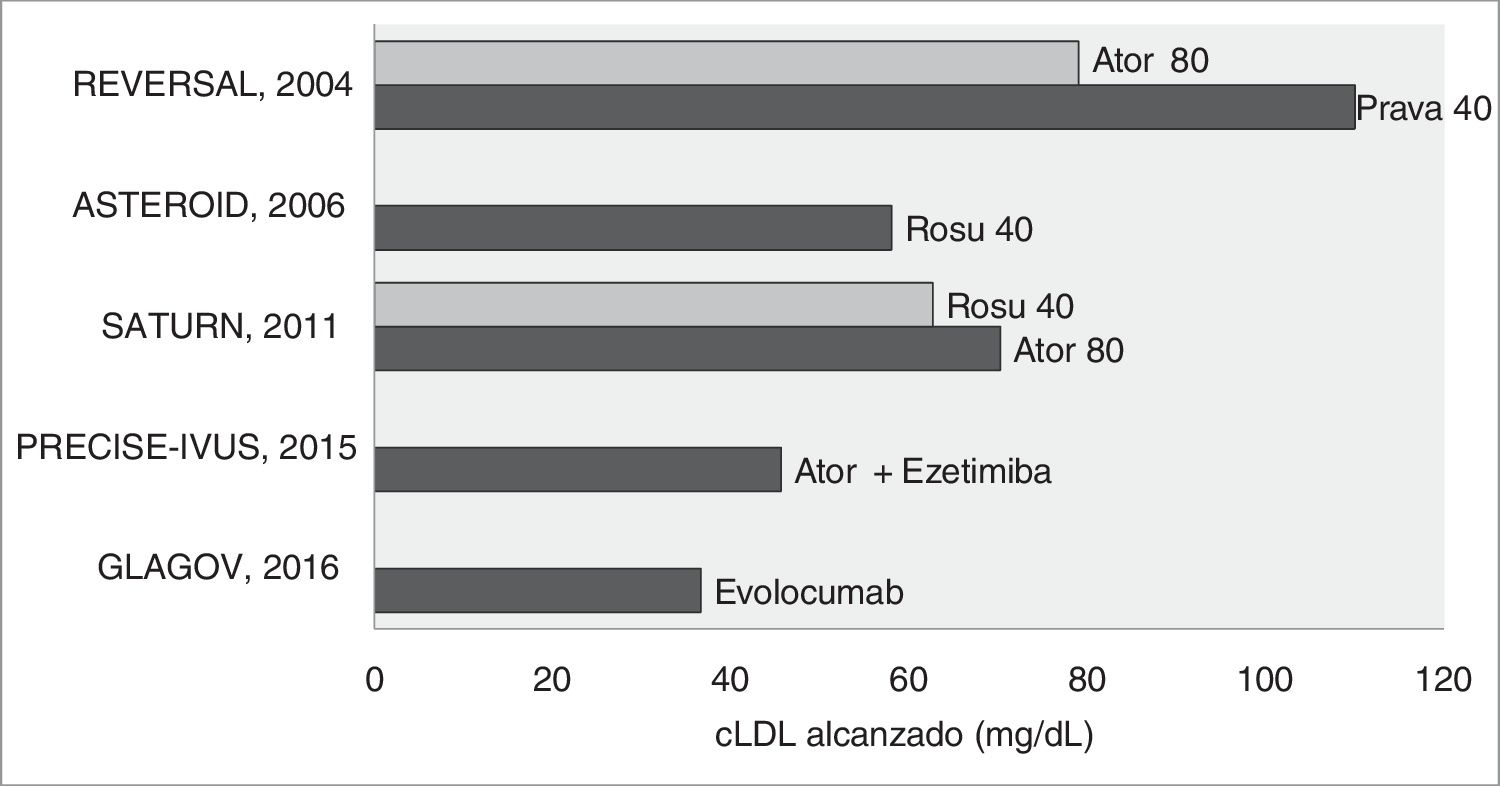
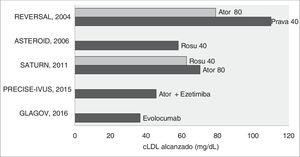
Por otra parte, los estudios de regresión/progresión de la enfermedad ateromatosa refuerzan el concepto de que el c-LDL cuanto más bajo mejor, existiendo el consenso que con niveles de 70mg/dl se frena la progresión, y que por debajo de los mismos se inicia la regresión. Y ello es válido para el tratamiento con estatinas en monoterapia9–11, en combinación con ezetimiba12 o con los inhibidores de PCSK913 (fig. 1). En definitiva, todos estos estudios de imagen, utilizando la mayoría de ellos la ultrasonografía intravascular, confirman la relación lineal existente entre la disminución del c-LDL y la reducción de la carga de aterosclerosis coronaria. De hecho, la evidencia actual muestra que el beneficio cardiovascular depende de la magnitud absoluta de la reducción del c-LDL, siempre que la terapia hipolipidemiante utilizada comporte un incremento directo o indirecto de la actividad del receptor LDL14,15.
La seguridad de las concentraciones plasmáticas bajas o muy bajas de c-LDL viene avalada por las evidencias de diferentes situaciones clínicas. En primer lugar, la concentración media del c-LDL de la sangre del cordón umbilical de los recién nacidos en España es de 35mg/dl16. Además de este irrefutable testimonio fisiológico, cabe destacar que nuestros ancestros pertenecientes a sociedades primitivas fundamentalmente cazadoras-recolectoras mantenían unas concentraciones de c-LDL inferiores a los 50mg/dl17.
Otro escenario clínico de enorme interés que aporta pruebas adicionales en términos de beneficios cardiovasculares y seguridad son las hipocolesterolemias genéticas. En este sentido, los individuos portadores de mutaciones genéticas que comportan un catabolismo acelerado de las partículas LDL, incluso aquellas que conducen a niveles muy bajos de c-LDL (<25mg/dl) están asintomáticos y presentan tasas muy bajas de enfermedad cardiovascular18,19.
En los últimos años, los estudios de aleatorización mendeliana han demostrado que el beneficio cardiovascular de la exposición de por vida a bajos niveles de c-LDL es mayor que el observado con el tratamiento hipolipidemiante en los estudios de intervención farmacológica, ya que en estos últimos la edad de inicio del tratamiento acontece a partir de los 45-50 años. Por tanto, el concepto de c-LDL acumulado a lo largo de los años tiene todo su sentido y adquiere su máximo exponente en los estudios de aleatorización mendeliana15. Así mismo, no debemos olvidar que la aterosclerosis se inicia en fases relativamente tempranas de la vida, y por regla general las estrategias terapéuticas se instauran tardíamente. Diferentes estudios necrópsicos demuestran de forma fehaciente la presencia de lesiones coronarias ateromatosas en jóvenes víctimas traumáticas20,21. Además, la disminución de episodios cardiovasculares en función de la reducción del c-LDL es inferior a la esperada a medida que se retrasa la edad de inicio de la intervención22.
De lo expuesto en este apartado podemos concluir que las evidencias procedentes de los estudios de intervención farmacológica y de aleatorización mendeliana confirman que las concentraciones bajas/muy bajas de c-LDL se acompañan de beneficios cardiovasculares, sin aumentar la aparición de efectos perjudiciales.
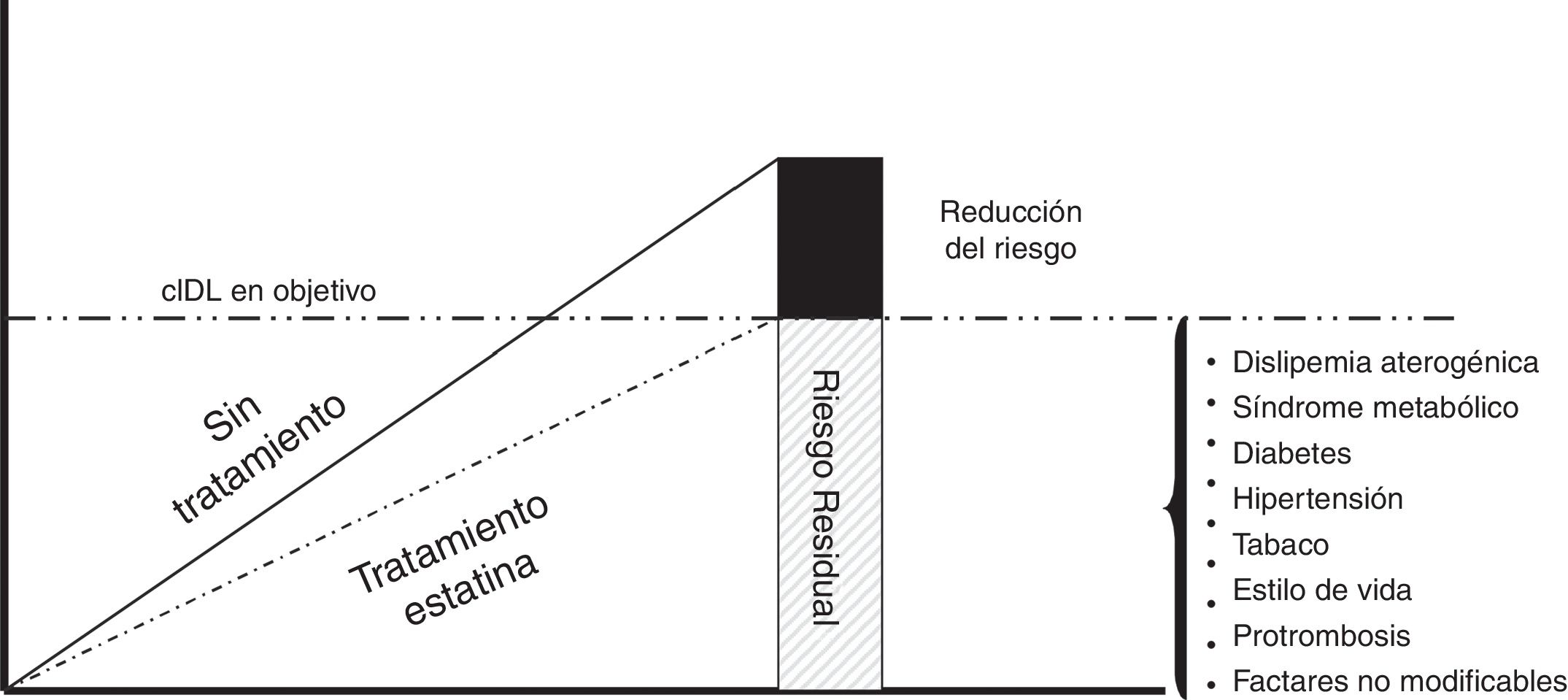
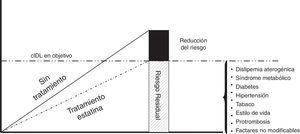
Riesgo residual dependiente del colesterol ligado a lipoproteínas de baja densidadEl concepto de riesgo residual se ha utilizado para explicar por qué los pacientes de alto/muy alto riesgo cardiovascular mantienen un elevado riesgo de presentar nuevos episodios cardiovasculares, a pesar de un aceptable control de sus factores de riesgo, y concretamente el c-LDL. Ello expresa que el riesgo vascular no se elimina en la magnitud que sería de desear, a pesar de los tratamientos óptimos. Este riesgo residual está directamente relacionado con las complicaciones macrovasculares y, en el caso de la diabetes, en la que el riesgo residual es especialmente relevante, también con las complicaciones microvasculares23. En la figura 2 se muestran los diferentes componentes del riesgo residual.
Sin embargo, el principal motivo del elevado riesgo residual en la práctica clínica es la falta de consecución de los objetivos terapéuticos en c-LDL. Por tanto, para conseguir una prevención cardiovascular eficaz es fundamental alcanzar los objetivos terapéuticos en c-LDL24, y además, cuanto antes mejor. De hecho, cuanto más se tarda en alcanzar dichos objetivos, mayor es el riesgo de presentar complicaciones cardiovasculares25. Asimismo, se ha confirmado que disminuir la intensidad del tratamiento farmacológico hipolipidemiante reduciendo la dosis de la estatina, o cambiando a una estatina menos potente, o no empleando la terapia combinada hipolipidemiante cuando sea necesario, se asocia con un mayor riesgo de complicaciones cardiovasculares26. Del mismo modo, está bien documentado que la suspensión de la medicación hipolipidemiante comporta un incremento de la mortalidad coronaria y de los episodios cardiovasculares27,28.
A pesar de lo expuesto, diferentes estudios de control de factores de riesgo cardiovascular, tanto nacionales como europeos y americanos, han puesto de manifiesto que la tasa de consecución de los objetivos en c-LDL es subóptima, muy especialmente en los pacientes de muy alto riesgo cardiovascular, como son los que tienen enfermedad cardiovascular establecida29–31. Entre los diferentes motivos que podrían explicar este control insuficiente del colesterol cabe citar la infraestimación del riesgo cardiovascular, la posibilidad de efectos secundarios al tratamiento, el escaso uso de la terapia combinada hipolipidemiante y la falta de adherencia al tratamiento.
La guía conjunta de la European Society of Cardiology y la European Atherosclerosis Society sobre el control de la dislipidemia recomienda en prevención secundaria un objetivo de c-LDL<55mg/dl, o al menos una reducción del 50% cuando el c-LDL basal sin tratamiento se sitúa entre 70 y 135mg/dl24. Más recientemente, y fruto de los resultados del estudio IMPROVE-IT4, las recomendaciones de la American Association of Clinical Endocrinologists and American College of Endocrinology consideran un grupo de riesgo extremo formado por pacientes con enfermedad cardiovascular progresiva, enfermedad cardiovascular establecida en pacientes con diabetes o enfermedad renal crónica estadios 3 y 4 o hipercolesterolemia familiar, o enfermedad cardiovascular prematura para los que el objetivo terapéutico en c-LDL se fija por debajo de 55mg/dl32.
En el estudio EUROASPIRE IV, en el que se incluyeron a pacientes con cardiopatía isquémica crónica de 24 países europeos, España entre ellos, se objetivó que, a pesar de que alrededor del 86% de los pacientes tomaba estatinas, solo el 20% alcanzó los objetivos recomendados de control de c-LDL31. Los recientes resultados del EUROASPIRE V33 muestran una mejoría en el control del c-LDL en prevención secundaria, pasando del 20% al 32%. Esta mejoría también se ha observado en España; así, el estudio LIPICERES constató que un 52% de los pacientes coronarios había alcanzado el objetivo de c-LDL<70mg/dl34.
En la actualidad se dispone de fármacos hipolipidemiantes con mecanismos de acción complementarios, que permitirían el control adecuado del c-LDL en un elevado porcentaje de pacientes. En este sentido, una mayor utilización de la terapia combinada estatina y ezetimiba mejoraría los porcentajes de control de c-LDL con un excelente perfil de seguridad35,36.
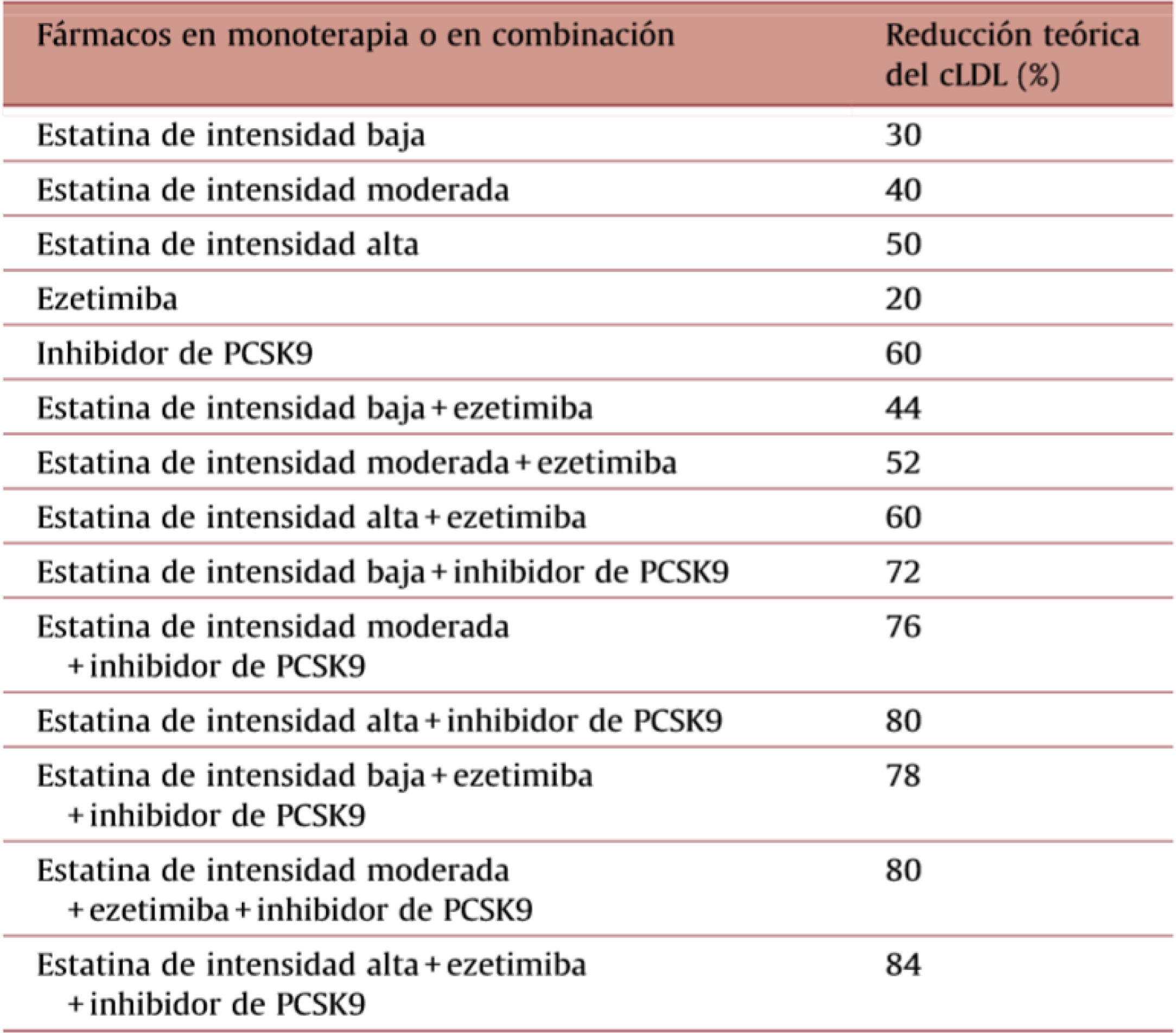
Tratamiento combinado en el tratamiento de la hipercolesterolemiaPara el tratamiento de la hipercolesterolemia grave o en los pacientes de alto riesgo cardiovascular en los que no se logran los objetivos terapéuticos con estatinas en monoterapia, la alternativa de primera elección es la combinación de una estatina de alta potencia con ezetimiba. En nuestro país están disponibles distintas presentaciones que asocian en un mismo comprimido o cápsula una estatina con ezetimiba. Así, han sido comercializadas las combinaciones de simvastatina a dosis de 20 o 40mg, atorvastatina 20, 40 u 80mg o rosuvastatina 5,10 o 20mg, con 10mg de ezetimiba. En los pacientes en los que no pueda utilizarse la ezetimiba, las estatinas pueden asociarse con una dosis baja o media de resinas de intercambio, como la colestiramina o el colestipol37. Una alternativa más reciente es la asociación de una estatina en monoterapia o asociada a ezetimiba, con un agente inhibidor de la proteína PCSK9 (iPCSK9). En la tabla 1 se describen los porcentajes de descenso del c-LDL que pueden conseguirse mediante las estatinas, la ezetimiba y los iPCSK938. A continuación se describen los principales fármacos hipocolesterolemiantes, prestando especial atención a los aspectos relacionados con las combinaciones que se utilizan en el tratamiento de la hipercolesterolemia.
Disminución teórica del colesterol-LDL con estatinas, ezetimiba o inhibidores de PCSK9 en monoterapia o en combinación
Modificada de Masana et al.38. El grado de intensidad de las estatinas se define de acuerdo con lo indicado en la tabla 2.
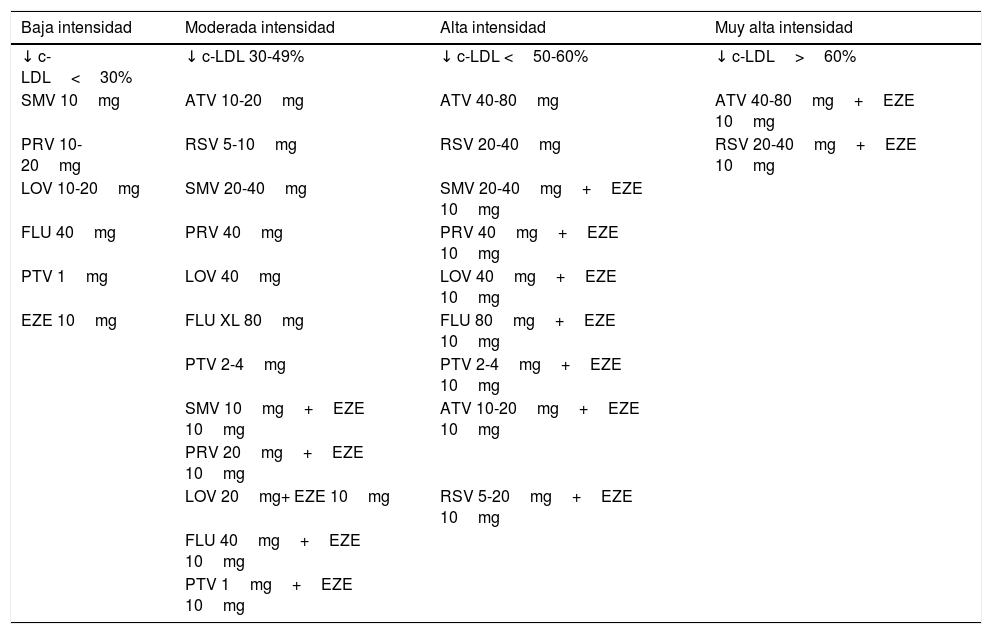
Las estatinas son los fármacos hipolipidemiantes más eficaces para disminuir el colesterol aterogénico y prevenir las enfermedades cardiovasculares. Estos fármacos disminuyen la conversión enzimática de la HMG-CoA a mevalonato, fenómeno limitante del ritmo de producción endógena de colesterol39. Este efecto produce una depleción del contenido intracelular de colesterol, un aumento de la expresión de receptores de las LDL y un incremento del aclaramiento plasmático de las LDL y de las partículas remanentes de lipoproteínas ricas en triglicéridos. La mayoría del colesterol plasmático procede de la síntesis en el organismo y no de la dieta, por ello este mecanismo es tan eficiente. Actualmente existen 7 estatinas comercializadas en nuestro país que son la lovastatina, la simvastatina, la pravastatina, la fluvastatina, la atorvastatina, la rosuvastatina y la pitavastatina. Las estatinas producen un descenso del c-LDL dosis dependiente, que supera el 50% con las estatinas más potentes. El c-HDL aumenta, en general, entre un 5-15%, y los triglicéridos disminuyen de forma muy variable dependiendo del fenotipo de la dislipidemia y de la gravedad de la misma, en general entre un 10-40%40. Las dosis diarias de lovastatina oscilan entre 20-80mg, las de simvastatina entre 10-40mg, las de pravastatina entre 10-40mg, las de fluvastatina entre 20-80mg, las de atorvastatina entre 10-80mg, las de rosuvastatina de 5-40mg y las de pitavastatina de 1-4mg/día. Para seleccionar qué estatina y qué dosis vamos a emplear para tratar a un paciente determinado debemos considerar, en primer lugar, el porcentaje de descenso necesario para llegar al objetivo terapéutico del c-LDL. En la tabla 2 se muestra el grado de descenso del c-LDL con las distintas opciones de tratamiento con estatinas en monoterapia o asociadas a ezetimiba41. En particular, en los pacientes de alto o muy alto riesgo cardiovascular es preferible iniciar el tratamiento con la dosis adecuada para alcanzar el objetivo de c-LDL en un primer paso. Además, hay que considerar otros aspectos farmacológicos, relacionados con las interacciones y los efectos secundarios. Las estatinas que se metabolizan por la isoenzima 3A4 del citocromo P450, lovastatina, simvastatina y atorvastatina, interactúan con los fármacos que inhiben o utilizan esta vía de eliminación. Entre ellos se encuentran los antifúngicos azólicos, los macrólidos, la ciclosporina, los bloqueadores de los canales del calcio y de los receptores 2 de histamina. La fluvastatina se metaboliza por la isoenzima 2C9 que interviene en la metabolización de un menor número de fármacos, y la pravastatina, la rosuvastatina y la pitavastatina se metabolizan de forma principal por vías independientes del citocromo P450 3A4, por lo que tienen un menor potencial de efectos secundarios42. Las estatinas previenen las enfermedades cardiovasculares, tanto en la población general como en los pacientes isquémicos, y en pacientes con una amplia variedad de condiciones clínicas asociadas, como la diabetes, la insuficiencia renal, el trasplante de órganos y en los pacientes con distintos grados de hipercolesterolemia y riesgo cardiovascular43,44. La principal indicación de las estatinas es el tratamiento de la hipercolesterolemia, con el objetivo de disminuir el c-LDL y de la globalidad del colesterol aterogénico, el cual es representado por el c-no HDL en los análisis clínicos. También son útiles en los pacientes con dislipidemia mixta, es decir, con un aumento del colesterol y los triglicéridos plasmáticos, ya que disminuyen ambos parámetros. De hecho, en las dislipidemias mixtas que cursan con concentraciones de triglicéridos inferiores a 500mg/dl se recomienda iniciar el tratamiento con una estatina, ya que en estos casos el objetivo prioritario es controlar el exceso de c-LDL y de c-no HDL37. Las estatinas tienen un alto nivel de seguridad. Se trata de fármacos, en general, bien tolerados45. Cuando se utilizan a dosis altas, entre un 1% y un 2% de los pacientes presentan un aumento moderado de las transaminasas, inferior a 3 veces el valor máximo del intervalo de referencia. Sin embargo, dicho aumento no se ha relacionado con un mecanismo de hepatotoxicidad, en muchos pacientes subyacen otras causas de aumento de transaminasas, sobre todo la esteatohepatitis46, y en otros los niveles se normalizan a pesar del mantener el tratamiento. La miopatía es el efecto secundario más importante de las estatinas. En alrededor de un 10% de los pacientes pueden aparecer mialgias o debilidad muscular, con frecuencia sin aumentos de las enzimas musculares que pueden persistir largo tiempo si se mantiene el tratamiento, y que con frecuencia puede tener una base psicosomática47. También se ha descrito un aumento de las enzimas musculares sin aparición de sintomatología. En los casos poco frecuentes de síntomas musculares y aumento de enzimas superior a 5 veces el límite máximo de referencia hay que interrumpir el tratamiento, ya que esta situación puede evolucionar a miopatías más graves y rabdomiólisis48. Esta complicación suele ocurrir en pacientes con factores predisponentes, como el uso de fármacos que aumentan las concentraciones plasmáticas de estatinas por interacción con la isoenzima CYP3A4, el consumo excesivo de alcohol, el hipotiroidismo, la deficiencia de vitamina D, la insuficiencia renal, la fragilidad, la historia previa personal o familiar de intolerancia a las estatinas y determinados factores genéticos49. Existen también casos que pueden considerarse raros, de pacientes tratados con estatinas que presentan síntomas miopáticos y elevación de las enzimas musculares que pueden persistir, e incluso progresar, a pesar de la retirada del fármaco. La biopsia muscular puede identificar una nueva y rara entidad denominada miopatía necrosante autoinmune por estatinas, que cursa con la presencia de anticuerpos anti-HMGCoA reductasa. Suele afectar a personas de edad media o avanzada y los síntomas pueden aparecer hasta 10 años después de haber iniciado las estatinas, o incluso tras haber interrumpido el tratamiento50. Las estatinas se asocian a un aumento moderado del riesgo de diabetes51, que es mayor cuando se utilizan dosis altas de estatinas de alta potencia y en los pacientes con factores de riesgo de diabetes52, aunque se considera escaso que su repercusión es muy inferior al beneficio obtenido en prevención cardiovascular53.
Grados de intensidad del tratamiento para disminuir el c-LDL con estatinas en monoterapia de la combinación de estatinas con ezetimiba (dosis diaria)
| Baja intensidad | Moderada intensidad | Alta intensidad | Muy alta intensidad |
|---|---|---|---|
| ↓ c-LDL<30% | ↓ c-LDL 30-49% | ↓ c-LDL <50-60% | ↓ c-LDL>60% |
| SMV 10mg | ATV 10-20mg | ATV 40-80mg | ATV 40-80mg+EZE 10mg |
| PRV 10-20mg | RSV 5-10mg | RSV 20-40mg | RSV 20-40mg+EZE 10mg |
| LOV 10-20mg | SMV 20-40mg | SMV 20-40mg+EZE 10mg | |
| FLU 40mg | PRV 40mg | PRV 40mg+EZE 10mg | |
| PTV 1mg | LOV 40mg | LOV 40mg+EZE 10mg | |
| EZE 10mg | FLU XL 80mg | FLU 80mg+EZE 10mg | |
| PTV 2-4mg | PTV 2-4mg+EZE 10mg | ||
| SMV 10mg+EZE 10mg | ATV 10-20mg+EZE 10mg | ||
| PRV 20mg+EZE 10mg | |||
| LOV 20mg+ EZE 10mg | RSV 5-20mg+EZE 10mg | ||
| FLU 40mg+EZE 10mg | |||
| PTV 1mg+EZE 10mg |
ATV: atorvastatina; c-LDL: colesterol ligado a lipoproteínas de baja densidad; EZE: ezetimiba; FLU: fluvastatina; LOV: lovastatina; PRV: pravastatina; PTV: pitavastatina; RSV: rosuvastatina; SMV: simvastatina.
Modificada de Masana et al.41.
La ezetimiba es un fármaco perteneciente al grupo de las azetidinonas que inhibe la absorción de colesterol en un 50% y también de esteroles vegetales. Ejerce su acción al nivel del borde en cepillo de las células de la mucosa del intestino delgado54. Dicho efecto lo realiza a través de su acción sobre la proteína de Niemann-Pick C1-like 1 y de un complejo proteico heterogéneo que incluye la anexina 2 y la caveolina 1. Ezetimiba disminuye la absorción del colesterol de los alimentos y del contenido en la bilis. No interfiere la absorción de vitaminas liposolubles, triglicéridos, ácidos grasos ni hormonas esteroideas. Se metaboliza por vía hepática con la intervención de distintas uridín-difosfato-glucuronil transferasa hepáticas e intestinales (UGT1A1, UGT1A2, UGTB27 y UGTB15), y no depende del citocromo P450 para su metabolización, por lo que tiene un escaso potencial de interacciones. De hecho, no interactúa con las estatinas, por lo que no es necesario ajustar las dosis cuando se asocian ambos fármacos55. Tampoco interactúa con la digoxina, los cumarínicos, el etinilestradiol o los anticonceptivos trifásicos (levonorgestrel y etinilestradiol). La toma de ezetimiba con resinas disminuye su absorción, por lo que estas deberían tomarse 1hora después o 4horas antes de la toma de ezetimiba. La administración de ciclosporina aumenta la biodisponibilidad de ezetimiba cerca de 4 veces, mientras que dicha asociación incrementa en menor medida, pero de forma significativa, las concentraciones de ciclosporina, efecto que cabe tenerse en cuenta en los pacientes que siguen dicho tratamiento. En los pacientes con insuficiencia renal grave (aclaramiento de creatinina<30ml/mn/1,73m2) el área bajo la curva de la concentración de ezetimiba aumenta 1,5 veces, si bien en el estudio Sharp (Heart and Renal Protection) la combinación de simvastatina 20mg/día al día con ezetimiba 10mg/día en pacientes con insuficiencia renal, entre los cuales más de 1.500 tenían un filtrado glomerular<30ml/min/m2, mostró un buen perfil de seguridad56. Ezetimiba es un fármaco, en general, bien tolerado y la incidencia de efectos secundarios cuando se combina con estatinas es similar a la de la monoterapia con estos últimos fármacos57. La ezetimiba, en monoterapia o asociada a colestiramina, está indicada en el tratamiento de la sitosterolemia, trastorno en el que se consiguen disminuciones de campesterol y sitosterol superiores al 50%58. La ezetimiba incrementa el grado de descenso del c-LDL entre un 15 y un 30% sobre el conseguido con estatinas37 y dobla en promedio la consecución de los objetivos terapéuticos del c-LDL59. En el estudio de mayor magnitud realizado con la combinación de estatina y ezetimiba4, el estudio IMPROVE-IT, en el que se incluyeron 18.144 pacientes, el c-LDL disminuyó un promedio cercano al 24% al asociar ezetimiba a dosis de 10mg/día a la simvastatina a dosis de 40mg/día (citado más adelante). En el estudio EXPLORER260, en el que se incluyeron casi 469 pacientes de alto y muy alto riesgo cardiovascular, se comparó el tratamiento con rosuvastatina, 40mg/día en monoterapia, con la combinación de rosuvastatina, 40mg/día y ezetimiba, 10mg/día. La disminución del c-LDL fue mucho más marcada en el grupo de terapia combinada, alcanzando un 70% de reducción media, frente a un 57% en el brazo en monoterapia. También se observaron disminuciones superiores de colesterol total y de triglicéridos en el grupo de terapia combinada. En los pacientes de muy alto riesgo cardiovascular el objetivo de c-LDL<70mg/dl se logró en el 80% de los pacientes con la combinación y en el 35% con la monoterapia. En los pacientes de alto riesgo el objetivo de c-LDL<100mg/dl lo alcanzaron el 94% y el 81% de los pacientes, respectivamente.
En el estudio The Compare the Efficacy and Safety of a Combination Therapy of Ezetimibe and Rosuvastatin Versus Monotherapy of Rosuvastatin in Hypercholesterolemia Patients (I-ROSETTE) se analizó el efecto de añadir ezetimiba al tratamiento en curso con rosuvastatina en 6 esquemas terapéuticos (dosis diarias de 5, 10 y 20mg de rosuvastatina en monoterapia vs. las mismas dosis de rosuvasatina asociadas a ezetimiba 10mg). El porcentaje promedio de cambio del c-LDL en los grupos tratados con rosuvastatina-ezetimiba fue de −57,0% (2,1%) y en el grupo de rosuvastatina en monoterapia de −44,4% (2,1%); (p<0,001)61.
El tratamiento combinado con estatinas y ezetimiba se ha asociado a efectos preventivos de la enfermedad cardiovascular de origen aterotrombótico en distintos ensayos clínicos. En el ensayo controlado aleatorizado PRECISE-IVUS se compararon los efectos de la combinación de ezetimiba y atorvastatina con la atorvastatina en monoterapia en pacientes japoneses que fueron sometidos a una intervención coronaria percutánea. La combinación condujo a unas concentraciones más bajas de c-LDL que la monoterapia con atorvastatina y una mayor incidencia de regresión de la arteriosclerosis (78% vs. 58%; p=0,004)62. En el mencionado estudio Sharp, el tratamiento durante un promedio de 4,9 años con la combinación de simvastatina y ezetimiba fue superior al placebo en la prevención de la enfermedad cardiovascular (infarto de miocardio no mortal, muerte de causa cardiovascular, ictus no hemorrágico y cualquier proceso de revascularización)56. En el estudio The Simvastatin and Ezetimibe in Aortic Stenosis study ((SEAS), realizado con 1.873 pacientes con estenosis aórtica ligera-moderada asintomática que fueron tratados con simvastatina 40mg+ezetimiba 10mg al día o con placebo durante un periodo medio de 52 meses, se observó una menor incidencia de episodios isquémicos en los que recibieron tratamiento activo (n=148) que en los que recibieron placebo (n=187) (razón de riesgo 0,78; IC 95%: 0,63-0,97; p=0,02), sobre todo por un menor número de pacientes que fueron sometidos a cirugía de revascularización coronaria. Sin embargo, no se observaron diferencias en cuanto a la cirugía de recambio valvular63. En un análisis post hoc solo se observó una menor progresión de la estenosis aórtica en los pacientes con mayores concentraciones de c-LDL portadores de una estenosis aórtica ligera (0,06m/s menos progresión al año en comparación con el placebo de la máxima velocidad del flujo de salida aórtico, IC 95%: 0,01-0,11; p=0,03)64. El ensayo clínico con la combinación de estatina y ezetimiba de mayor relevancia ha sido el IMPROVE-IT en el que se incluyeron 18.144 pacientes con síndrome coronario agudo que fueron tratados con simvastatina 40mg/día asociada a ezetimiba 10mg/día o placebo. El promedio de C-LDL durante el estudio fue de 1,8 mmol/l en el grupo de simvastatina y 1,4 mmol/l en el de simvastatina y ezetimiba. La incidencia de enfermedad cardiovascular, representada por la variable principal de valoración (muerte de causa cardiovascular, infarto de miocardio, accidente cerebrovascular, angina inestable que requería hospitalización, revascularización coronaria≥30 días después de la aleatorización) tras un tiempo medio de seguimiento de 7 años fue del 32,7% en el grupo de simvastatina-ezetimiba y del 34,7% en el grupo de simvastatina en monoterapia, con una reducción del riesgo absoluto del 2% (razón de riesgo 0,936; IC 95%: 0,89-0,99; p=0,016). El ictus isquémico se redujo en un 21% (p<0,008). No se observó disminución de la mortalidad por todas las causas o la de causa cardiovascular. La incicencia de efectos secundarios musculares, hepáticos y de cáncer fue similar en ambos grupos. El estudio IMPROVE-IT fue el primero que proporcionó información de alta calidad sobre la eficacia y seguridad de reducir las concentraciones de C-LDL hasta 1,4mmol/l4. En un análisis posterior de los primeros episodios isquémicos, y también de los episodios recurrentes que ocurrieron durante el seguimiento, se registraron 9.545 episodios (el 56% eran primeros episodios y el 44% eran recurrencias). La incidencia de este conjunto de episodios disminuyó un 9% con ezetimiba/simvastatina vs. placebo/simvastatina (tasa de incidencia: 0,91; IC 95%: 0,85 a 0,97; p=0,007)65. Un 27% (n=4.933) de la población del estudio IMPROVE-IT era diabética, y en ella la adición de ezetimiba al tratamiento con estatinas disminuyó el c-LDL un 1,1mmol/l adicional, en comparación con 0,6mmol/l con monoterapia con estatinas, y el riesgo relativo fue un 14% menor, y un 5,5% menor en términos absolutos, mientras que en los no diabéticos la disminución del riesgo absoluto fue del 2%66. Estos datos van de acuerdo con el concepto de que la ezetimiba tiene un efecto hipolipidemiante más acusado en la población diabética67, y el efecto preventivo frente a la enfermedad cardiovascular en esta población es proporcional a dicho efecto hipolipidemiante.
En una revisión sistemática de ensayos clínicos aleatorizados la combinación de una dosis baja de estatina con ezetimiba no mostró efectos negativos sobre el metabolismo de la glucosa68. Los síntomas musculares asociados a las estatinas son frecuentes y también dependientes de la dosis de estatina. La asociación de dosis bajas o medias de estatinas de alta potencia o de estatinas de potencia intermedia con ezetimiba permite lograr un mayor descenso del c-LDL y del colesterol aterogénico, con un menor riesgo de efectos secundarios que la monoterapia con dosis altas de estatinas24. Un metaanálisis de 18 ensayos clínicos, que incluyó 14.497 pacientes, no mostró diferencias significativas en la aparición de efectos secundarios musculares, incluyendo las mialgias o el aumento de las CK, y hepáticos, entre el tratamiento combinado con estatinas y ezetimiba en comparación con las estatinas en monoterapia69. A modo de conclusión, la ezetimiba es el segundo paso terapéutico de elección cuando el objetivo de c-LDL no se alcanza con dosis altas de estatinas de alta potencia en monoterapia. En los pacientes intolerantes o con circunstancias que contraindican el uso de dosis altas de estatinas, la asociación con ezetimiba permite utilizar dosis menores o intermitentes de estatinas para lograr descensos muy acusados del c-LDL70.
Resinas de intercambio aniónicoLas resinas son polímeros de alto peso molecular que actúan a nivel intestinal y carecen de efectos sistémicos. Al disminuir el reciclaje intestinal de ácidos biliares, las resinas dan lugar a un aumento de su síntesis a partir de colesterol y una activación de los receptores de las LDL mediada por el factor Sterol Response Element Binding Protein-2. Dicho factor también activa la enzima HMG-CoA reductasa y con ello la síntesis de colesterol. Las estatinas potencian el efecto hipocolesterolemiante de las resinas al inhibir dicha enzima71,72. La colestiramina a dosis de 8 a 16g/día disminuye el colesterol total y el c-LDL entre un 21% y 27% y un 26% y 31%, respectivamente73. En los pacientes con hipertrigliceridemia el tratamiento con resinas puede dar lugar a un incremento de las concentraciones de triglicéridos, por lo que no se aconsejan cuando la concentración basal de triglicéridos es>400mg/dl. La colestiramina ha mostrado un efecto preventivo frente a la enfermedad cardiovascular. En el estudio de las clínicas de lípidos americanas la colestiramina disminuyó un 19% el riesgo coronario en hombres con hipercolesterolemia que no tenían antecedentes isquémicos74. Distintos ensayos clínicos aleatorizados han demostrado que las resinas previenen la progresión y favorecen la regresión de la aterosclerosis coronaria75. En un metaanálisis de 8 ensayos clínicos se observó que las resinas disminuyen un 30% la mortalidad de causa cardiaca76.
La principal indicación de las resinas es su asociación con estatinas para potenciar su efecto reductor del c-LDL en los pacientes que requieren descensos muy acusados del colesterol, o en los que no se pueden usar dosis altas de estatinas. La asociación de una dosis de 4-8g/día de colestiramina incrementa el descenso del c-LDL alrededor de un 20%, lo que equivalente a doblar 3 veces la dosis de estatina, por ejemplo a pasar de una dosis de 10 a 80mg/día de atorvastatina77. Las resinas tienen un moderado efecto antidiabético78. La combinación de ezetimiba y resinas disminuye el c-LDL entre un 35% y un 40%. Al añadir ezetimiba a un tratamiento previo con resinas se logra un descenso adicional cercano al 20% y también una disminución de los triglicéridos de un 14%79. La triple terapia con estatinas, resinas y ezetimiba es una alternativa a considerar para facilitar un control óptimo de la hipercolesterolemia. Así, se ha observado que en los pacientes con hipercolesterolemia familiar la asociación de rosuvastatina 20mg/día, ezetimiba 10mg/día y una resina (colestimide 3,6g/día) disminuye el c-LDL un 66% y permite alcanzar el objetivo de c-LDL<100mg/dl en cerca de la mitad de los pacientes80. La colestiramina es un fármaco adecuado para tratar la hipercolesterolemia en pacientes que no pueden utilizar las estatinas, entre ellos los pacientes con síntomas musculares o incremento de las CK por estatinas o con hepatopatía crónica. También, al igual que la ezetimiba, se utiliza asociada a dosis bajas o intermitentes de estatinas para evitar el uso de dosis altas de estatinas y así disminuir el riesgo de efectos indeseables o intolerancia a estos fármacos81,82. Las resinas son útiles en el tratamiento de la hipercolesterolemia severa en los niños, particularmente en los afectos de hipercolesterolemia familiar heterocigótica, y son los únicos fármacos hipocolesterolemiantes que pueden utilizarse en mujeres que puedan iniciar una gestación83. Cuando se utilizan a dosis altas y de forma prolongada las resinas pueden disminuir la absorción de ácido fólico, por lo que es aconsejable promover una dieta rica en esta vitamina, sobre todo vegetales de hoja verde, y monitorizar las concentraciones séricas de folatos cuando se usan en las mujeres que pueden iniciar una gestación. No se aconseja el uso de resinas durante el embarazo debido a la falta de ensayos clínicos en mujeres gestantes.
El principal efecto secundario de las resinas es el estreñimiento, pero su incidencia es escasa si se realiza un aporte de fibra y una hidratación adecuadas, y se evitan en las personas con tendencia al estreñimiento. Las resinas pueden interferir la absorción intestinal de otros fármacos, por lo que deben administrarse una hora después o 4horas antes de la toma de estos.
La resincolestiramina y el colestipol se administran preferiblemente dentro de una hora de la ingesta de la primera comida del día, y puede disolverse en agua o en cualquier otro líquido. El tratamiento se inicia con dosis bajas, de uno o medio sobre de 4g de colestiramina o 5g de colestipol al día, y si no se observa un efecto suficiente, la dosis puede aumentarse a 2 sobres al día.
Inhibidores de la proteína PCSK9La proteína PCSK9 (proproteína convertasa subtilisina/kexina tipo 9) se une al receptor LDL y provoca su degradación impidiendo su reciclaje. Ello determina una menor actividad de los receptores LDL y, por tanto, un menor catabolismo de estas partículas, lo que determina un aumento de las concentraciones de c-LDL84. Las estatinas aumentan la expresión de PCSK9, probablemente como un mecanismo de retroalimentación que sigue al incremento de la expresión del receptor LDL inducido por estas, fenómeno que limita su eficacia. Existen distintos agentes dirigidos a inhibir la actividad PCSK9 (iPCSK9), oligonucleótidos antisentido, pequeñas moléculas de ARN interferidoras y anticuerpos monoclonales anti-PCSK9. Entre ellos, actualmente están disponibles los anticuerpos monoclonales, evolocumab y alirocumab. Un tercer agente de esta familia, el bococizumab, fue retirado por reducción de la eficacia hipolipidemiante debido a la aparición de anticuerpos neutralizantes85. Estos agentes se administran por vía subcutánea cada 2-4 semanas. En los ensayos clínicos de fase ii se ha demostrado que al añadirlos a un tratamiento con estatinas, asociadas o no a ezetimiba, se logran descensos adicionales del c-LDL superiores al 60%, lo que permite alcanzar los objetivos terapéuticos del c-LDL en la gran mayoría de los pacientes, incluyendo los de muy alto riesgo cardiovascular86 y de los triglicéridos de un 25%, efecto este último proporcional al grado de hipertrigliceridemia87. Los efectos secundarios son escasos y se limitan principalmente a molestias en el lugar de la inyección. La principal indicación de estos agentes es la hipercolesterolemia familiar heterocigótica o las hipercolesterolemias severas en los pacientes de alto riesgo cardiovascular, en particular los que han padecido un episodio isquémico de origen aterotrombótico, cuando no se logran los objetivos terapéuticos con estatinas potentes a las dosis máximas toleradas, asociadas o no a ezetimiba88.
Los iPCSK9 han sido estudiados en un amplio programa de ensayos clínicos de fases ii y iii que han incluido diferentes poblaciones, entre ellas pacientes isquémicos, con hipercolesterolemia familiar heterocigota u homocigota, con dislipidemia mixta e intolerantes a estatinas. Dicho efecto hipocolesterolemiante se ha observado con independencia de que el paciente fuera tratado con estatinas de baja o alta potencia, a dosis altas o bajas y asociadas o no a ezetimiba84. Así mismo, se han realizado 3 grandes ensayos clínicos de prevención cardiovascular con iPCSK9. El primero fue el estudio FOURIER5, en el que se incluyeron pacientes con ECV ateromatosa y factores de riesgo cardiovascular asociados, que mantenían un c-LDL>70mg/dl a pesar del tratamiento con estatinas de alta intensidad asociadas o no a ezetimiba. Los pacientes se aleatorizaron a evolocumab o placebo durante un tiempo promedio de 2,2 años. Un 9,8% de los pacientes tratados con evolocumab y un 11,3% de los tratados con placebo presentaron una recurrencia isquémica (muerte por ECV, infarto de miocardio, ictus, hospitalización por angina de pecho o revascularización coronaria) (p<0,001). Dicho efecto preventivo se observó con independencia de la intensidad de la estatina basal y del valor inicial del c-LDL89. Cuanto más bajo era el c-LDL obtenido con el tratamiento, menor era la incidencia de ECV90. En el ODYSSEY OUTCOMES6 se incluyeron pacientes que habían presentado un síndrome coronario agudo en los 12 meses previos a su inclusión y que mantenían un c-LDL>70mg/dl (o un c-no HDL>100mg/dl o una apolipoproteína B>80mg/dl), a pesar de un tratamiento con la dosis máxima tolerada de estatinas asociadas o no a otros fármacos hipolipidemiantes. Los pacientes fueron aleatorizados a alirocumab o placebo durante un tiempo promedio de 2,8 años. Un 9,5% de los pacientes tratados con alirocumab y un 11,1% de los tratados con placebo presentaron una recurrencia isquémica (muerte por ECV, infarto de miocardio, ictus u hospitalización por angina de pecho) (p<0,0003). El efecto de alirocumab fue más acusado en un subgrupo preespecificado con un c-LDL≥100mg/dl en comparación con los pacientes con un c-LDL menor (HR 0,76; IC 95%: 0,65-0,87). Así mismo, el tratamiento con alirocumab se asoció a una menor incidencia de muerte por cualquier causa que el placebo (3,5% vs. 4,1%; HR: 0,85, IC 95%: 0,73-0,98, p=0,026)6. Un tercer estudio con bocicizumab, el estudio SPIRE85, que fue interrumpido debido a una pérdida de eficacia hipolipidemiante de este agente, mostró un beneficio cardiovascular consistente con los estudios previos.
Es destacable que los análisis de los niveles de colesterol durante el tratamiento de los estudios con estatinas en monoterapia o asociadas a ezetimiba y con iPCK9 muestran un beneficio que continúa progresivamente para descensos del c-LDL de hasta al menos 30-40mg/dl, sin que exista un nivel a partir del que desaparezca el efecto beneficioso o aumenten los efectos secundarios3. Sin embargo, las indicaciones de los iPCSK9 están condicionadas por su elevado coste. Por esta razón, y si bien desde el punto de vista estrictamente clínico parecería razonable tratar con iPCSK9 a todos los pacientes isquémicos que no alcancen el objetivo de c-LDL<70mg/dl con estatinas asociadas a ezetimiba, estos fármacos deben limitarse a los pacientes que por su mayor riesgo cardiovascular vayan a obtener un mayor beneficio clínico y a un coste que sea asequible para nuestro sistema sanitario88.
En síntesis, en un elevado porcentaje de pacientes de alto y muy alto riesgo cardiovascular la hipercolesterolemia es insuficientemente tratada y no se alcanzan los objetivos terapéuticos, a pesar de que disponemos de fármacos con un intenso efecto hipocolesterolemiante. La base de evidencias sobre el beneficio y la seguridad de lograr los objetivos de control del c-LDL en estos pacientes es muy amplia y va en aumento. Por ello, es necesario adecuar la intensidad de los tratamientos de la hipercolesterolemia al grado de riesgo vascular del paciente y al grado de descenso necesario para lograr los objetivos de c-LDL. En los pacientes en los que no se logran estos objetivos con estatinas de alta intensidad en monoterapia es necesaria la combinación con un segundo fármaco, en particular la ezetimiba, y en los pacientes que a pesar de dicha combinación no se logre un control adecuado hay que considerar los iPCSK9.
Conflicto de interesesJuan Pedro-Botet ha recibido honorarios por conferencias o participación en comités científicos de Amgen, Astra-Zeneca, Esteve, Ferrer, MSD, Mylan, Rovi, Sanofi y Servier.
Xavier Pintó ha recibido honorarios por conferencias o participación en comités científicos de Amgen, Esteve, Ferrer, Mylan, Rubió, Sanofi y Servier.
Nota al suplementoEste artículo forma parte del suplemento «Actualidad de la dislipemia aterogénica en 2018», que cuenta con el patrocinio de laboratorios Mylan.