La teoría lipídica de la arteriosclerosis data de hace más de un siglo. A pesar de ello, algunos autores han cuestionado la relevancia de la hipercolesterolemia en el desarrollo de la misma. Múltiples evidencias experimentales, epidemiológicas y clínicas sustentan esta asociación. Las complicaciones cardiovasculares de la aterosclerosis continúan siendo la causa principal de muerte en el mundo. Recientes estudios genéticos de aleatorización mendeliana y ensayos clínicos aleatorizados dirigidos a la reducción del colesterol LDL, resumidos en este artículo, ratifican de modo inequívoco el papel etiológico del colesterol LDL en el desarrollo de aterosclerosis. En consecuencia, la reducción del colesterol LDL es la piedra angular del tratamiento hipolipemiante para la reducción de las complicaciones cardiovasculares de la aterosclerosis.
The lipid theory of atherosclerosis dates back more than a century. Despite this, some authors have questioned the relevance of hypercholesterolaemia in its development.
Multiple experimental, epidemiological, and clinical evidence underpins this association.
Atherosclerotic cardiovascular disease remains as the major cause of mortality in the world. Recent genetic studies of Mendelian randomisation and randomised clinical trials aimed at LDL cholesterol reduction, are summarised in this article. They, unequivocally ratify the aetiological role of LDL cholesterol in the development of atherosclerosis. Thus, LDL cholesterol lowering is the cornerstone of lipid lowering therapy for the reduction of cardiovascular complications of atherosclerosis
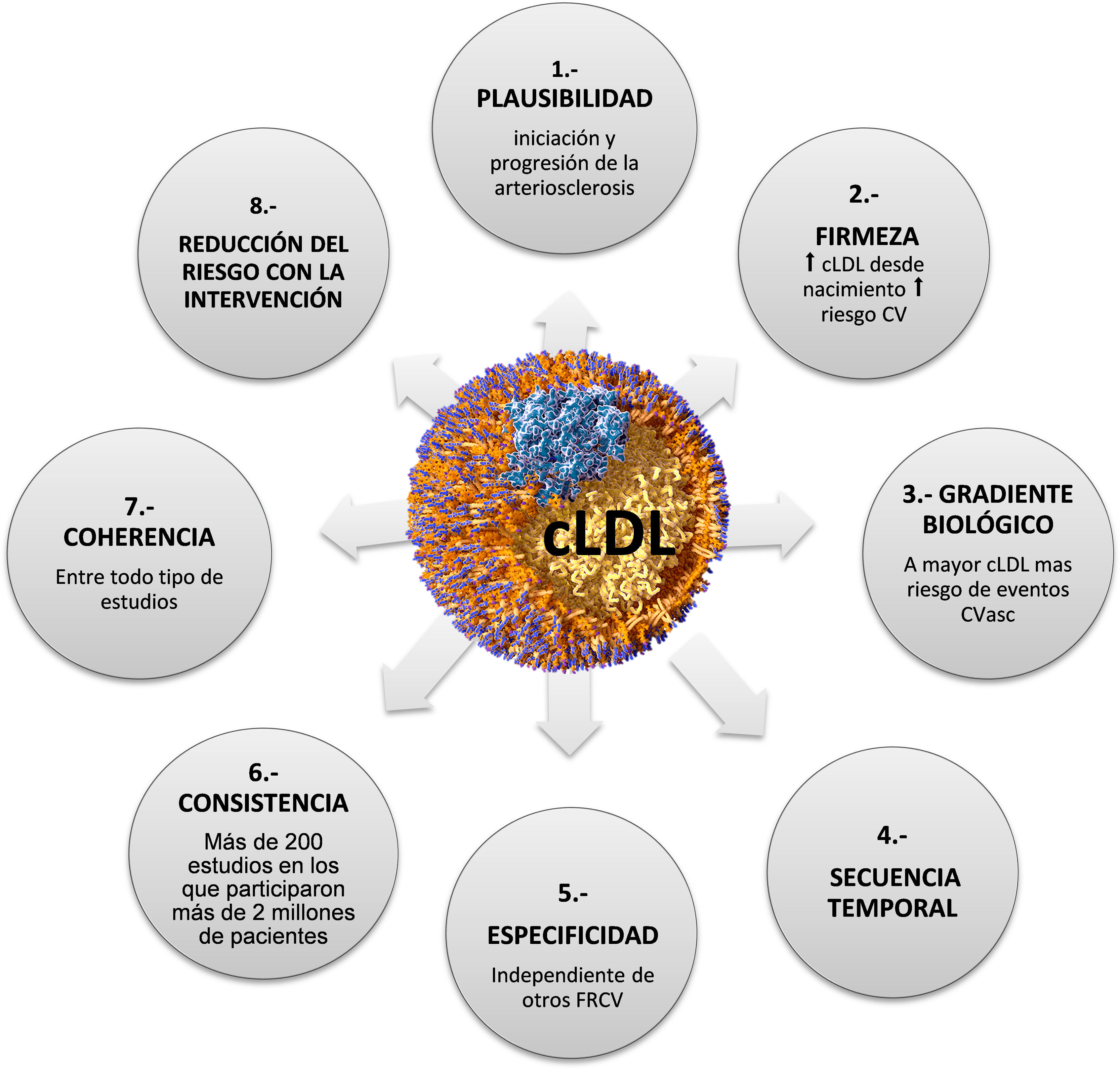
Aunque la hipótesis lipídica de la arteriosclerosis tiene más de un siglo de antigüedad1, no ha sido hasta finales del siglo XX cuando se ha cerrado el ciclo de la demostración de causalidad con los resultados concluyentes de diversos estudios de intervención farmacológicos2. Paradójicamente, en el último lustro han tenido eco en los medios de comunicación y en algunos foros científicos una variedad de iniciativas intentando desvirtuar el papel del colesterol en el desarrollo de la arteriosclerosis3. Afortunadamente, el papel crucial del colesterol, y en particular el colesterol vehiculado por lipoproteínas de baja densidad (c-LDL) como agente causal de la arteriosclerosis se sustenta en un sólido edificio con pilares epidemiológicos, genéticos, experimentales y de estudios de intervención2 (fig. 1). Si bien los modelos experimentales han sido muy relevantes en el conocimiento de la fisiopatología de la arteriosclerosis y sus complicaciones, en este artículo nos limitaremos a realizar un repaso de la evidencia científica centrada en los estudios realizados en la especie humana.
Criterios de causalidad: lipoproteínas de baja densidad (LDL) y arteriosclerosis. Adaptada de Ference et al.2.
El colesterol es un componente esencial de las membranas celulares y un precursor de los ácidos biliares y las hormonas esteroides, por lo que desempeña un papel metabólico esencial. De hecho todas las células del organismo humano son capaces de sintetizar colesterol para las funciones fisiológicas4. El transporte intercelular de colesterol se realiza sustancialmente a través de las lipoproteínas que contienen apoproteína B (apo B) en plasma, tal como se describe en el artículo correspondiente en este mismo número de Clínica e investigación en arteriosclerosis.
En la mayoría de las personas, el colesterol vehiculado por las LDL constituye el 90% del colesterol circulante, por lo que existe una alta correlación entre los niveles de colesterol total y c-LDL: en la práctica habitual, los niveles de colesterol LDL no se miden directamente, sino que se estiman mediante la ecuación de Friedewald en la que el colesterol LDL es una función lineal del colesterol total. Por este motivo, en muchos estudios epidemiológicos los resultados obtenidos mediante el uso del colesterol total o colesterol LDL calculado son prácticamente equivalentes. Estudios recientes han demostrado que la determinación del número de partículas que contienen apo B puede ser un mejor marcador de carga aterogénica que los niveles de colesterol total o LDL5. De hecho, la medición de apo B incluye la aportación de otras lipoproteínas aterogénicas como las de muy baja densidad (VLDL) y sus residuos, lipoproteínas de densidad intermedia (IDL) y lipoproteína (a). Sin embargo, la mayor parte de los estudios epidemiológicos y de intervención se han dirigido a evaluar el colesterol total y colesterol LDL, que será el objeto principal de comentario en esta breve revisión2,6.
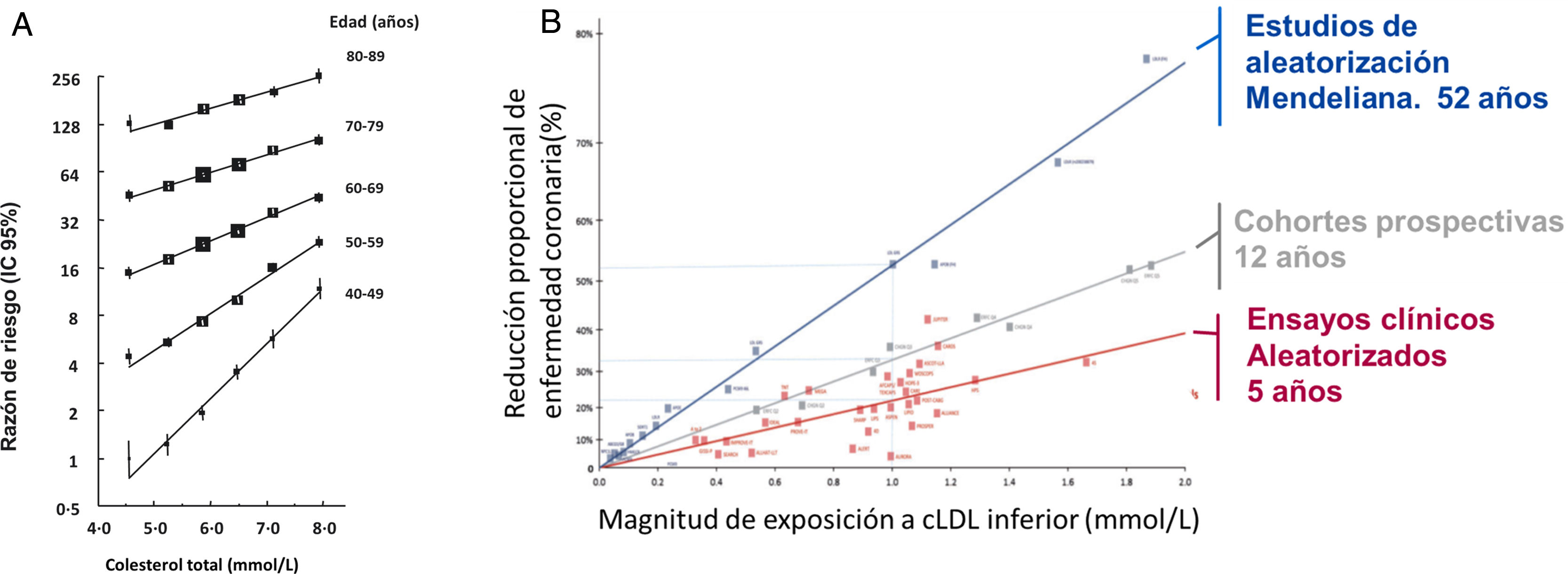
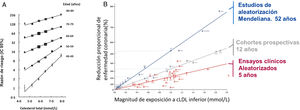
Estudios epidemiológicos prospectivosEl estudio de los 7 países7 plantó la semilla de una larga serie de estudios epidemiológicos observacionales que, agrupados en metaanálisis, muestran de modo concluyente la asociación entre los niveles de colesterol y el desarrollo de arteriosclerosis. La Colaboración de Estudios Prospectivos (Prospective Studies Collaboration) ha publicado un impresionante metaanálisis a partir de datos de participantes individuales con cerca de 900.000 personas sin enfermedad cardiovascular al comienzo de 61 estudios prospectivos de cohortes con un total de seguimiento de más de 12 millones de personas-año y 55.000 muertes de causa cardiovascular (fig. 2A)8. La relación log-lineal entre los niveles de colesterol total y el riesgo de mortalidad por cardiopatía isquémica fue similar para todos los niveles de colesterol estudiados y para todos los rangos de edad. Aunque no se dispuso de los niveles de colesterol LDL de todos los participantes, en una submuestra de 153 798 individuos para los que se disponía de mediciones de c-HDL, el efecto del colesterol no HDL sobre el riesgo de mortalidad por cardiopatía isquémica fue casi idéntico al efecto del colesterol total por mililimol por litro.
Relación entre el colesterol y la mortalidad por enfermedad coronaria en estudios epidemiológicos clásicos (A), de aleatorización mendeliana y ensayos clínicos aleatorizados (A y B). La relación entre los cambios en los niveles de colesterol y la mortalidad coronaria se demuestra en estudios epidemiológicos clásicos, para todos los rangos de colesterol estudiados y edades. Adaptada de Lewington et al.8. Los cambios en colesterol y la morbilidad cardiovascular muestran una misma relación log-lineal en estudios de cohortes clásicas, estudios de aleatorización mendeliana y ensayos clínicos de intervención. Los efectos sobre la morbilidad son dependientes tanto del cambio de los niveles de colesterol como de la duración temporal de los mismos: en torno a 5 años en estudios de intervención, 12 años en estudios de cohortes y > 50 años en estudios de aleatorización mendeliana. Adaptada de Ference et al.2.
Con posterioridad, la «Colaboración en Factores de Riesgo Emergentes» (Emerging Risk Factors Collaboration) profundizó en la asociación de distintas fracciones lipídicas y la mortalidad por cardiopatía isquémica en un extenso metaanálisis con datos más de 300.000 sujetos sin enfermedad cardiovascular, provenientes de 68 estudios prospectivos con un seguimiento de 2,78 millones de personas-año y más de 9.000 eventos cardiovasculares6. En este estudio, la concentración plasmática de c-LDL, calculado según la ecuación de Friedewald se asoció de forma log-lineal con un mayor riesgo de infarto agudo de miocardio o muerte por cardiopatía isquémica. Los autores ratificaron este hecho en una submuestra de 8 estudios en los que participaron 44.234 individuos, en los que los niveles de c-LDL fueron medidos de modo directo. La adición de otros marcadores lipídicos como apoproteína A1, apoproteína B y lipoproteína (a) a las ecuaciones de riesgo apenas modificó la capacidad predictora de las categorías de riesgo vascular (<1% de índice neto de reclasificación), subrayando por tanto el papel determinante del colesterol LDL en la determinación del riesgo vascular.
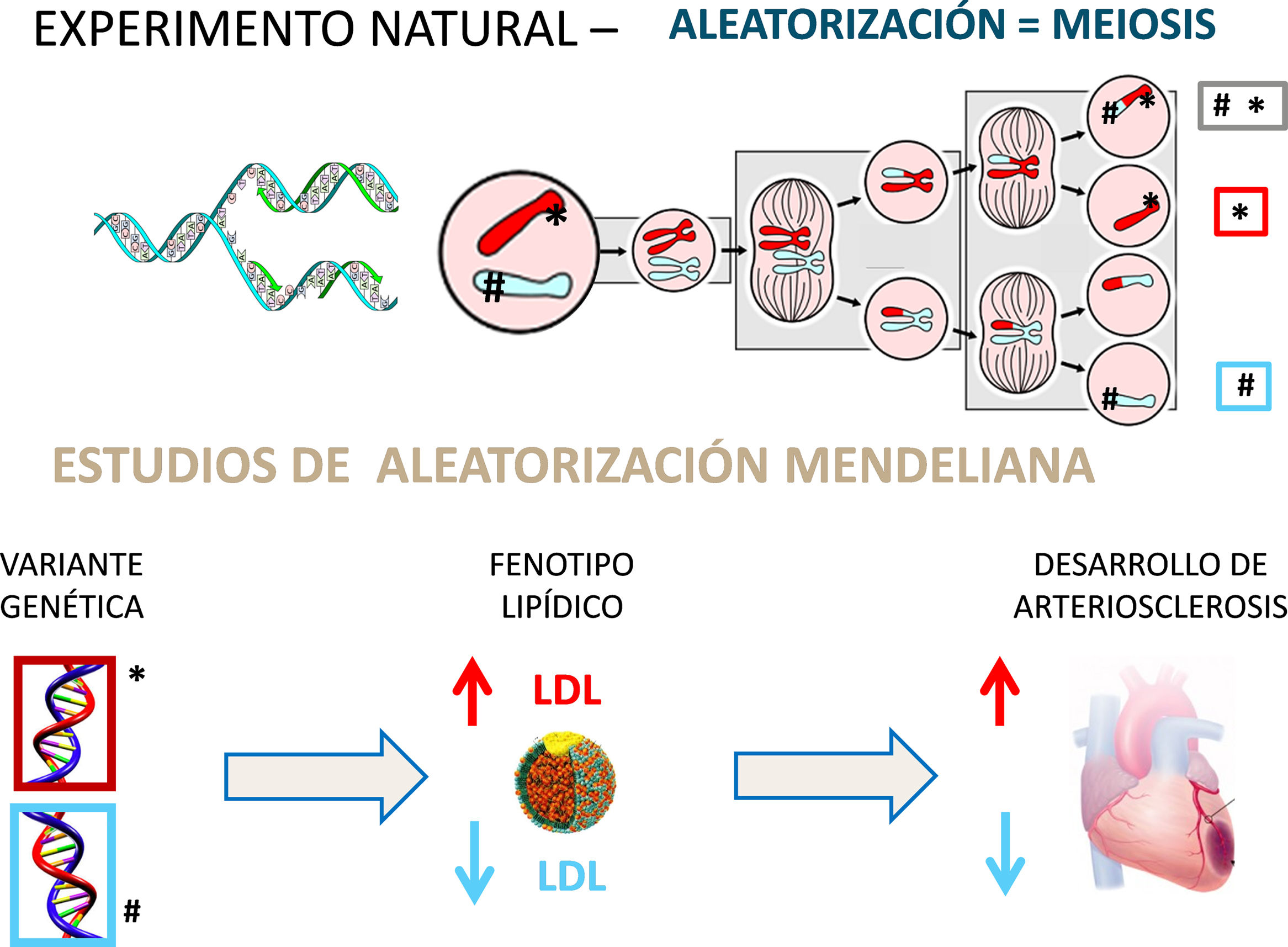
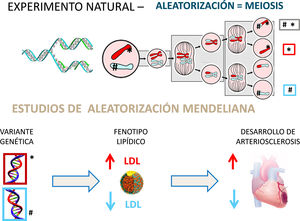
Estudios de aleatorización mendelianaAunque la asociación entre el c-LDL es potente, dosis-dependiente y reproducible, los estudios epidemiológicos observacionales no son aleatorizados y no pueden demostrar causalidad: están sujetos a factores de confusión no identificados, entre otros posibles sesgos. Recientemente se ha prestado una gran atención a otro tipo de estudios observacionales denominados «estudios de aleatorización mendeliana»9 (fig. 3). La distribución aleatoria de los genes de ambos progenitores en el proceso de la meiosis para dotar de 23 cromosomas a las células germinales emula en cierto modo al proceso de «asignación aleatoria» de las intervenciones en los ensayos clínicos. Se han descrito numerosas variantes de diversos genes que se asocian con cambios en los niveles de c-LDL10. De este modo es posible evaluar si un genotipo que condiciona un fenotipo con un aumento del c-LDL se traduce en un aumento de la incidencia de cardiopatía isquémica. Recíprocamente, un gen cuyo fenotipo implica una reducción del c-LDL debería asociarse con un descenso del riesgo de cardiopatía isquémica.
Aleatorización mendeliana: un «experimento» natural. La recombinación y reparto aleatorizado de los genes de ambos progenitores en el proceso de meiosis proporciona un «experimento natural» que permite evaluar el efecto de la «asignación aleatoria» de genes que producen cambios en los niveles de colesterol y su repercusión en la incidencia de cardiopatía isquémica. La demostración de que los sujetos que heredan un gen que condiciona un aumento de c-LDL (* v.gr. variante defectiva del receptor LDL) presentan una mayor frecuencia de enfermedad coronaria ratifica el papel etiológico del colesterol en el desarrollo de arteriosclerosis. Recíprocamente, la herencia de un gen que produce un descenso de c-LDL (# v.gr. variante defectiva de PCSK-9) se asocia con una reducción de la incidencia de enfermedad coronaria.
Si la variante genética evaluada se asocia únicamente con un descenso en los niveles de c-LDL-C y no con otros efectos lipídicos o no lipídicos, y si la asignación es realmente aleatoria, entonces comparar el riesgo de enfermedad aterosclerosa entre las personas con y sin tal variante debe proporcionar una estimación del efecto causal de la variación de los niveles de c-LDL en el riesgo de ASCVD de una manera análoga a un ensayo aleatorizado a largo plazo. Adicionalmente, dado que las variantes genéticas actúan desde la concepción, si se evalúa a sujetos en edades medias o avanzadas de la vida es posible determinar los efectos de las mismas durante varias décadas, a diferencia de la duración más limitada de los ensayos clínicos (fig. 2B).
Se han descrito variantes en más de 50 genes asociados con cambios en los niveles de colesterol LDL en ausencia de efectos conocidos en otros predictores o factores de riesgo de arteriosclerosis11. Estudios de aleatorización mendeliana han demostrado de modo consistente que la reducción de niveles de c-LDL asociada a estas variantes genéticas se asocian con una reducción del riesgo de cardiopatía isquémica5. Es interesante destacar que el efecto de las variaciones genéticas sobre la incidencia de enfermedad coronaria tiene una relación log-lineal con los cambios en los niveles de c-LDL de modo independiente del gen concreto involucrado y del mecanismo fisiopatológico por la que esta se ha producido. En otras palabras, cuando se «normaliza» para el cambio en colesterol LDL de cada variante, los efectos de los genes sobre la incidencia de enfermedad coronaria es idéntico (fig. 2B y fig. 4).
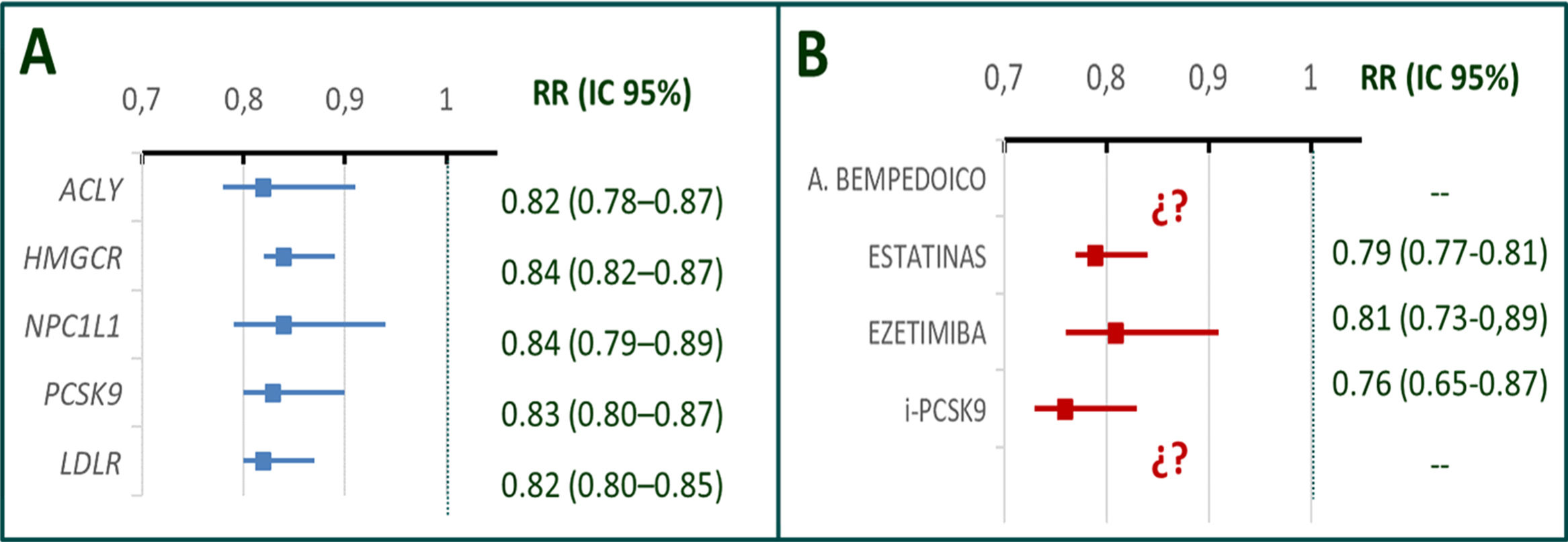
Efecto de la reducción del colesterol ligado a lipoproteínas de baja densidad (colesterol LDL) sobre eventos coronarios según el mecanismo de reducción.
A) Asociación de diferentes puntuaciones genéticas de genes asociados con cambios en niveles de colesterol e incidencia de enfermedad coronaria ajustada para un descenso equivalente a 10mg/dl de colesterol LDL. B) Efecto protector cardiovascular de distintos tratamientos farmacológicos que actúan sobre las variantes genéticas mencionadas ajustado para una reducción equivalente a 38,7mg/dl en ensayos clínicos aleatorizados. Se muestra que el efecto de los cambios en colesterol LDL de origen genético sobre el riesgo de eventos vasculares es aproximadamente el mismo para cada cambio de unidad en c-LDL. Del mismo modo, el efecto protector cardiovascular de estatinas, ezetimibe e inhibidores de PCSK9 es similar para cambios equivalentes de colesterol LDL. Nótese que el efecto protector de alteraciones genéticas (que actúan a lo largo de toda la vida) es aproximadamente cuatro veces superior al de los tratamientos farmacológicos (duración habitual 4-5 años). El efecto del ácido bempedoico no ha sido todavía evaluado en ensayos clínicos aleatorizados. No existen fármacos que actúen directamente sobre la expresión del receptor de LDL.
A. bempedoico: ácido bempedoico; ACYL: ATP citrato liasa; (i) PCSK9: (inhibidores de) proproteína convertasa subtilisina-kexina tipo 9; LDLR: receptor de LDL; NPC1L1: proteína similar a Niemann–Pick C1; OR: odds ratio e intervalo de confianza al 95%. Adaptada de Ference et al.2,Ference et al.13 y Guijarro et al.18.
Es interesante destacar cómo las variantes genéticas han ratificado «a posteriori» en los estudios de aleatorización mendeliana la aproximación farmacológica de diversos tratamientos hipolipemiantes. Así, las variantes genéticas que modifican los niveles de colesterol en relación con la absorción (NCP1-L1), síntesis de colesterol (HMG-CoA reductasa) o reciclado del receptor LDL (PCSK-9) dan soporte a los tratamientos con ezetimibe, estatinas e inhibidores de PCSK9 (ver estudios de intervención más adelante)2. Esta aproximación sustenta, por otro lado, la búsqueda de fármacos cuya diana sean los productos de las variantes genéticas relevantes detectadas en estudios de aleatorización mendeliana12.
Recientemente, estudios de aleatorización mendeliana muestran que un descenso en la actividad de la la ATP citrato liasa, una enzima situada en la vía biosintética del colesterol previa a la HMG-Coa reductasa, se asocia con un descenso en los niveles de colesterol y en la incidencia de enfermedad aterosclerosa13. En el momento actual se está evaluando si la reducción de los niveles de colesterol con ácido bempedoico, un inhibidor de la ATP citrato liasa se traducen en la reducción esperable de complicaciones cardiovasculares14.
Alteraciones genéticas del metabolismo lipídico y enfermedad cardiovascularLa hipercolesterolemia familiar es el trastorno metabólico congénito más frecuente (en torno a 1/200-300 casos en la población general)15,16. Se trata de un trastorno autosómico codominante resultado de una mutación con pérdida de función del gen del receptor LDL (LDLR). Menos a menudo, se asocia a una variante en el gen de la apo B, que conlleva un defecto en el reconocimiento de las LDL por su receptor. Por último, el fenotipo de hipercolesterolemia familiar se puede producir por una ganancia de función en el gen de PCSK9 con una reducción secundaria de los receptores LDL funcionantes por una degradación acelerada de los mismos. En todos los casos, la hipercolesterolemia familiar se caracteriza por niveles marcadamente elevados de c-LDL (≈200-500mg/dl) y aterosclerosis prematura, afectando especialmente a las arterias coronarias16.
La forma homozigota de la hipercolesterolemia familiar es mucho más infrecuente y exhibe un fenotipo extremo caracterizado por niveles plasmáticos de c-LDL extremadamente elevados (>500mg/dl) y produce arteriosclerosis en las dos primeras décadas de la vida17. Aunque el fenotipo de la HF es variable, el riesgo de enfermedad coronaria se relaciona con la magnitud absoluta de los niveles elevados de c-LDL y la duración de la exposición a los mismos.
La imagen especular de la hipercolesterolemia familar es la presencia de variantes con pérdida de función de proproteína-convertasa subtiliina-kexina 9 (PCSK9). Estos sujetos presentan una actividad aumentada de los receptores LDL; niveles de c-LDL marcadamente descendidos y una reducción del riesgo del desarrollo de aterosclerosis18.
Otras alteraciones genéticas cuya expresión fenotípica es menos acentuada que los trastornos mencionados muestran también consistentemente que los cambios de c-LDL asociados a variantes genéticas se relacionan con el riesgo de desarrollo de aterosclerosis en estudios de aleatorización mendeliana19 (fig. 2B).
Estudios de intervenciónPara confirmar la relación de causalidad entre el c-LDL y la aterosclerosis son importantes todas las evidencias comentadas previamente, pero la demostración de que la reducción de los niveles de c-LDL se asocian con una regresión del tamaño de las placas de aterosclerosis o la reducción de eventos cardiovasculares resulta de gran trascendencia2. En este sentido, es importante resaltar la evidencia obtenida tanto en estudios de prevención primaria como secundaria demostrando que una mayor reducción en los niveles de c-LDL lograda con estatinas y con otros tratamientos no estatínicos, se asocia a una mayor disminución en las tasas de eventos cardiovasculares20.
La mayor evidencia en esta área procede de la inhibición de la HMG-CoA reductasa con estatinas. La mayoría de estos estudios vienen recogidos en uno de los metaanálisis de los Cholesterol Treatment Trialists (CTT)21 que incluía datos de 170 000 participantes individuales de 26 ensayos clínicos. Demostró que por cada mmol/l (sobre 39mg/dl) de reducción en las cifras de c-LDL, el riesgo relativo de eventos cardiovasculares mayores disminuye un 22-23% con el tratamiento con estatinas, durante una mediana de 5 años. Este efecto fue independiente del nivel basal de c-LDL y se incrementó a lo largo de los años de tratamiento, siendo este beneficio menor durante el primer año de seguimiento. Además, estudios con ultrasonido intravascular de la placa de ateroma coronaria han demostrado claramente que el tratamiento con estatinas de alta intensidad estabiliza la progresión o incluso regresa el volumen de la placa aterosclerótica cuando se alcanzan niveles de c-LDL de 70mg/dL22. Y esto no solo tiene lugar con la cardiopatía isquémica y las coronarias, si no que diversos estudios han demostrado cómo el tratamiento intensivo con estatinas reduce el riesgo de ictus isquémico y la progresión de la arterioesclerosis a nivel de las carótidas, correlacionándose también con la intensidad de la reducción del c-LDL23.
Pero estos efectos beneficiosos por la reducción de los nievles de c-LDL no son atribuibles exclusivamente a las estatinas. Otros tratamientos que también reducen el c-LDL pero sin inhibir la HMG-CoA reductasa también han demostrado reducir el riesgo de eventos cardiovasculares. Las primeras evidencias fueron con colestiramina, un secuestrador de ácidos biliares, que en el ensayo «Lipid Research Clinics Coronary Primary Prevention Trial»24 demostró que una reducción del c-LDL en 0,7 mmol/L se acompañaba de una reducción del 19% en el riesgo relativo de muerte cardiovascular o infarto de miocardio. De manera similar, la reducción de 1,85 mmol/L de c-LDL mediante cirugía de derivación ileal en el «Program on the Surgical Control of the Hyperlipidemias (POSCH)»25, demostró la reducción en un 35% del riesgo relativo de muerte cardiovascular o infarto de miocardio. En estos 2 ensayos, la reducción del riesgo en relación con la reducción del c-LDL observada fue muy similar a la que se demostraba en el metaanálisis de los CTT con estatinas21, reforzando la teoría lipídica de la aterosclerosis.
Más recientemente, el estudio IMPROVE-IT26, con ezetimiba un inhibidor de la absorción intestinal de colesterol al unirse a la proteína transportadora NPC1L1, también confirmó que la reducción del c-LDL se asociaba a una reducción de eventos cardiovasculares. Ezetimiba más simvastatina 40mg frente a simvastatina 40mg en monoterapia redujo los niveles de c-LDL en 0,40 mmol/L (16mg/dl) adicionales, lo que llevó a una reducción del 6,5% en los eventos cardiovasculares mayores. También con ezetimibe, unos años antes, el ensayo SHARP27 en pacientes con enfermedad renal crónica, demostró que el tratamiento combinado de simvastatina+ezetimibe conseguía una reducción adicional de los niveles de c-LDL en 33mg / dL, lo que se acompañaba de una reducción del 17% de eventos cardiovasculares mayores en comparación con el placebo. Al igual que con otros tratamientos para reducir el c-LDL, como con las estatinas, la magnitud del beneficio clínico del ezetimibe se relacionaba con la reducción absoluta del c-LDL, lo que sugiere que las estatinas y ezetimibe tienen efectos beneficiosos similares y relacionados con la intensidad en la reducción del c-LDL.
Más recientemente, esta teoría se ha ratificado con los datos de los estudios clínicos llevados a cabo con inhibidores de la PCSK9 que, añadidos a las estatinas o solos en caso de pacientes con intolerancia a estas, consiguen una reducción del 50- 60%, de forma rápida y sostenida de los niveles de c-LDL. Los principales estudios realizados con estos fármacos en pacientes con enfermedad CV estable (estudio FOURIER)28, o después de un síndrome coronario agudo (estudio ODYSSEY Outcomes)29, han confirmado que esta importante reducción de los niveles de c-LDL se asocia a una disminución adicional en las tasas de eventos CV, en torno al 15% de reducción del riesgo relativo en el objetivo primario combinado. Además, cuando se analizaron los beneficios por cada año de tratamiento, los iPCSK9 en sus respectivos estudios, conseguían efectos protectores cardiovasculares similares a los descritos para las estatinas en el metaanálisis de los CTT21 para una reducción equivalente de c-LDL. Y aún más, el ensayo GLAGOV30 demostró que la adición de evolocumab en pacientes tratados con estatinas de intensidad moderada o alta, consiguió una reducción importante de los niveles de c-LDL, lo que produjo una regresión de la aterosclerosis coronaria medida con ecografía intracoronaria (ultrasonido intravascular), en tan solo 18 meses de tratamiento. En comparación con el valor inicial de volumen de placa, los pacientes del grupo de tratamiento con placebo no presentaron cambios de la carga de ateroma (0,05%, p=0,78), mientras que los pacientes del grupo de evolocumab mostraron una reducción significativa (−0,95%, P <0,001), para una diferencia entre grupos de -1,01% (p <0,001). Estos hallazgos proporcionan evidencia de que la inhibición de PCSK9 produce beneficios incrementales sobre la progresión/regresión de la enfermedad coronaria en pacientes tratados con estatinas, ya que producen una reducción adicional de los niveles de c-LDL.
Todos los estudios mencionados que apuntan a que la reducción farmacológica de
c-LDL se relaciona con reducción de eventos cardiovasculares, tal como se muestra en un metaanálisis que incluyó a 312 175 participantes tratados con 9 tipos diferentes de tratamientos para reducir el c-LDL: en coherencia con los hallazgos previos del metaanálisis de los CTT21, los eventos cardiovasculares se reducen un 20-25% por cada milimol/litro de reducción en el c-LDL20, independientemente del tratamiento que se emplee para reducir el c-LDL. Estos hallazgos están en línea con los de los estudios de aleatorización mendeliana y demuestran que el beneficio clínico de reducir el C-LDL es independiente del mecanismo por el cual se reduce el c-LDL.
ConclusiónEl c-LDL desempeña un papel causal o etiológico en el desarrollo de la aterosclerosis. Las dianas identificadas desde el punto de vista genético con estudios de aleatorización mendeliana (HMG-coA reductasa, NPC1L1, PCSK9) se han confirmado en estudios de intervención, en los que se demuestra que la reducción de los niveles de c-LDL mediante procedimientos o tratamientos farmacológicos, se acompañan de una regresión de las placas de ateroma y una reducción de eventos cardiovasculares relacionados con la aterosclerosis.
Conflicto de interesesLos autores declaran que la preparación de este artículo ha sido financiado con una ayuda sin restricciones de Daiichi-Sankyo. El patrocinador no ha intervenido en la elaboración ni el contenido del mismo, que sólo expresa la opinión de los autores.
El Dr. Carlos Guijarro declara que ha recibido ayudas externas relacionadas con la realización del trabajo en forma de financiación directa de Daichii Sankyo y que ha recibido aportaciones de Amgen, Daiichi Sankyo, Ferrer, MSD, Rubió, Sanofi, en concepto de asesoría/ponencias, no relacionadas con la realización del trabajo.
El Dr. Juan Cosín declara que ha recibido ayudas externas relacionadas con la realización del trabajo en forma de financiación directa de Daichii Sankyo y que ha recibido aportaciones de Daiichi Sankyo, Sanofi, Amgen Almirall, Mylan, en concepto de asesoría/ponencias, no relacionadas con la realización del trabajo.
Nota al suplementoEste artículo forma parte del suplemento «Lípidos y nuevos tratamientos en dislipemias», que cuenta con el patrocinio de Daiichi-Sankyo.