La incidencia de las enfermedades arterioscleróticas ha aumentado en los países desarrollados. La dislipemia es un factor de riesgo cardiovascular mayor y el descenso del cLDL es el objetivo terapéutico. Hay que individualizar los objetivos en cada paciente y las estatinas han demostrado ser un tratamiento coste-efectivo tanto en prevención primaria como en secundaria. La aparición de los inhibidores de PSCK9, más potentes y por tanto consiguiendo un mayor descenso de las cifras de cLDL, son un avance en el tratamiento de la enfermedad cardiovascular. La publicación en 2019 de las guías de dislipemias (Sociedad Europea de Cardiología/Sociedad Europea de Arteriosclerosis), con el nivel de evidencia y fuerza de recomendación, pueden ayudar en la toma de decisiones y beneficios para nuestros pacientes en la práctica clínica diaria.
The incidence of atherosclerotic cardiovascular disease has increased in the developed countries. Dyslipidemia is a primary major risk factor for atherosclerotic cardiovascular disease and LDL lowering is one of the main objectives. Although treatment goals for dyslipidemias should be personalized in every patient, statins are cost-effective in primary and secondary prevention of atherosclerotic cardiovascular disease. New treatments with higher power and greater decreases in LDL, PSCK9 inhibitors, have made a new breakthrough in atherosclerotic cardiovascular disease treatment. The 2019 guidelines for de management of dyslipidemias: lipid modification to reduce cardiovascular risk (European Society of Cardiology/European Atherosclerosis Society) with the level of evidence and the strength of the recommendations can facilitate the best decisions and benefits to our patients in clinical practice.
La incidencia de las enfermedades cardiovasculares (ECV) sigue aumentando en los países desarrollados. La dislipemia juega un papel esencial en el desarrollo de la enfermedad arteriosclerótica. Estudios prospectivos, ensayos clínicos y los estudios de aleatorización mendeliana han demostrado que el aumento de colesterol de lipoproteínas de baja densidad (cLDL) es una causa de ECV. En todo el rango de elevación de cLDL se considera que «cuanto más bajo esté el cLDL es mejor» sin un umbral más bajo, al menos hasta 1mmol/l (40mg/dl). La aparición en los últimos años de nuevos fármacos más potentes, y la publicación de los diferentes estudios y metaanálisis, ha llevado a realizar cambios en las guías internacionales.
Lo que no se ha modificado es la consideración del cLDL como el objetivo terapéutico primario para conseguir una reducción de este riesgo cardiovascular (RCV). Bajar el cLDL puede generar beneficios valiosos en los pacientes teniendo en cuenta el RCV total y los niveles basales de cLDL. La reducción proporcional en el riesgo de ECV logrado al reducir el cLDL depende de la reducción absoluta del cLDL, ya que con cada reducción de 1mmol/l disminuye el riesgo de ECV en un 22%.
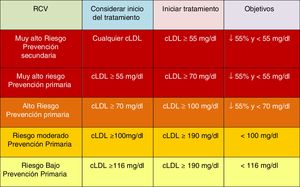
La intensificación de los objetivos del tratamiento es importante para asegurarse de que el tratamiento de los pacientes de mayor riesgo logre la mayor reducción de cLDL posible. Se establece un porcentaje mínimo de reducción de cLDL del 50% y un objetivo de tratamiento absoluto de cLDL<55mg/dl para pacientes de muy alto riesgo, y <70mg/dl para pacientes de alto riesgo.
Las estatinas son fármacos de elección con alta eficacia para disminuir la concentración plasmática de cLDL y prevenir las ECV. La asociación con ezetimiba y/o inhibidores de proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9) reduce aún más el riesgo de ECV.
La disponibilidad de nuevos agentes hipolipemiantes de alta potencia, en particular los Ac monoclonales iPCSK9, ha abierto un nuevo horizonte en la prevención y tratamiento de la ECV con reducciones mayores del cLDL.
LDL como agente causal de la enfermedad cardiovascularLa aterosclerosis se desencadena por la acumulación de lípidos en las células arteriales subendoteliales1. La acumulación de lípidos intracelulares es causada por lipoproteínas de baja densidad (LDL) que circulan en la sangre humana. Se ha demostrado que solo las lipoproteínas modificadas, pero no las LDL nativas, pueden causar una acumulación intracelular de lípidos en las células de la pared arterial humana2. Aunque la oxidación sigue siendo la modificación aterogénica más frecuentemente observada de las LDL, se han detectado otras formas de LDL modificadas en la sangre de pacientes ateroscleróticos.
Las partículas de LDL están compuestas por lípidos (80%, predominantemente colesterol esterificado) y proteínas. El contenido de triglicéridos en las LDL es relativamente bajo en condiciones normales (5-10%), pero aumenta con diabetes, obesidad, síndrome metabólico, hipercolesterolemia familiar combinada e insuficiencia renal.
La LDL transporta el colesterol en la sangre y los fluidos extracelulares, y esto se controla en gran medida por las interacciones de las proteínas de la superficie con las proteínas transportadoras de lípidos, las enzimas y los receptores de la membrana celular. La apolipoproteína (Apo) B100 actúa como el ligando para los receptores de LDL y contribuye a la interacción entre las LDL y los proteoglicanos de la pared arterial, promoviendo así la retención subendotelial de las LDL aterogénicas en la aterosclerosis temprana3. En comparación con las lipoproteínas de alta densidad (HDL), las partículas de LDL contienen relativamente pocas proteínas, que representan aproximadamente el 15% del contenido de proteínas LDL no Apo B1004. Esto implica que la composición de LDL está asociada principalmente con su propio metabolismo.
Los estudios proteómicos y cinéticos de LDL reafirman que el cLDL es el producto final del metabolismo de las lipoproteínas endógenas. Cuatro de las 5 partículas de cLDL se eliminan a través de la vía LDL-LDL receptor (LDLR) en el hígado5,6. Debido a que las células de los mamíferos no tienen sistemas enzimáticos para degradar el colesterol, la vía LDL-LDLR es, junto con el transporte inverso de cHDL, el mecanismo principal para la eliminación del colesterol del organismo. La principal consecuencia de una ruta LDL-LDLR defectuosa es un aumento en la LDL circulante, lo que provoca la acumulación de cLDL en la pared arterial y otros tejidos periféricos. Esto está respaldado por la evidencia de normalización de los niveles de cLDL en pacientes con hipercolesterolemia familiar homocigótica (HFH) después de un trasplante de hígado7.
El papel del cLDL en la etiopatogenia de la arteriosclerosis ha sido demostrado en numerosos estudios epidemiológicos y ensayos clínicos aleatorizados que no solo han puesto de manifiesto la relación entre el cLDL y la ECV, sino también el efecto beneficioso que se obtiene con la reducción de las cifras de cLDL.
Entre los estudios epidemiológicos, el estudio de Framingham8–10 demostró una relación lineal e independiente entre los niveles elevados de colesterol total, niveles elevados de cLDL y una disminución de cHDL con el riesgo de padecer cardiopatía isquémica. En el estudio MRFIT se observó una relación continua y gradual (sin umbral para el comienzo de esa relación) entre hipercolesterolemia y mortalidad por enfermedad coronaria11. Asimismo, esta relación se ha observado en poblaciones de distinta índole sociocultural y racial12. La reducción de la hipercolesterolemia mediante la reducción del cLDL produce una disminución de la incidencia y mortalidad por cardiopatía isquémica y ECV en general, tanto en prevención primaria como en prevención secundaria13. La importancia de la dislipemia también se ha puesto de manifiesto en el estudio INTERHEART14, en el que la dislipemia fue la causa del 54% del riesgo atribuible poblacional de infarto de miocardio. Sin embargo, la dislipemia no se definió únicamente por el cLDL, sino como el cociente ApoB/ApoA-I, que es un valor representativo del cociente de las concentraciones de lipoproteínas de muy baja densidad (VLDL), densidad intermedia (IDL) y cLDL, que son aterógenas, respecto de las cHDL ateroprotectoras15.
El control adecuado de los diferentes factores de riesgo en general, y del cLDL en particular, continúa siendo el pilar fundamental para reducir el riesgo de presentar un nuevo evento cardiovascular16. Teniendo en cuenta la etiopatogenia de la aterosclerosis, reducir las cifras de cLDL supone el eje central a la hora de prevenir la aparición de un evento cardiovascular. Pero, a diferencia de lo que ocurre con otros factores de riesgo cardiovascular (FRCV) —como la presión arterial en hipertensos o la HbA1c en los diabéticos en quienes una reducción excesiva de dichos factores podría ser perjudicial en determinados subgrupos de pacientes, como aquellos sujetos más frágiles—, con respecto al cLDL todavía no se ha objetivado una cifra por debajo de la cual reducir el cLDL pueda suponer un mayor riesgo. Por ello, en la actualidad, según la evidencia científica disponible para la prevención de la ECV, se sigue afianzando la teoría de la hipótesis lipídica del cLDL de «cuanto más bajo esté mejor»17,18, incluso con concentraciones extremadamente bajas, en torno a 20mg/dl de cLDL, se siguen obteniendo beneficios en prevención cardiovascular sin efectos perjudiciales para la salud19,20.
Los ensayos clínicos aleatorizados con estatinas tanto en prevención primaria (WOSCOP con pravastatina21, AFCAPS/TexCAPS con lovastatina22, ASCOT-LLA con atorvastatina23, ALLHAT-LLT con pravastatina24, CARDS con atorvastatina25, MEGA con pravastatina26 y JUPITER27 y HOPE-328 con rosuvastatina, y en metaanálisis de estudios en prevención primaria29,30) como en prevención secundaria cardiovascular (4S31, CARE32, LIPID33 y HPS34 llevados a cabo en pacientes con enfermedad coronaria estable, el MIRACL35, el PROVE-IT36 y el A a Z (fase Z)37 en pacientes con síndrome coronario agudo, GRACE38, TNT39 e IDEAL40 en pacientes con angina estable), así como diversos metaanálisis41,42, han puesto de manifiesto que la magnitud de la reducción absoluta de eventos vasculares mayores que se obtiene con el tratamiento con estatinas es directamente proporcional a la reducción absoluta de cLDL que se logra, con el beneficio adicional de un tratamiento más intensivo con la terapia hipolipemiante, incluso en aquellos pacientes en los que el cLDL ya está en objetivos terapéuticos.
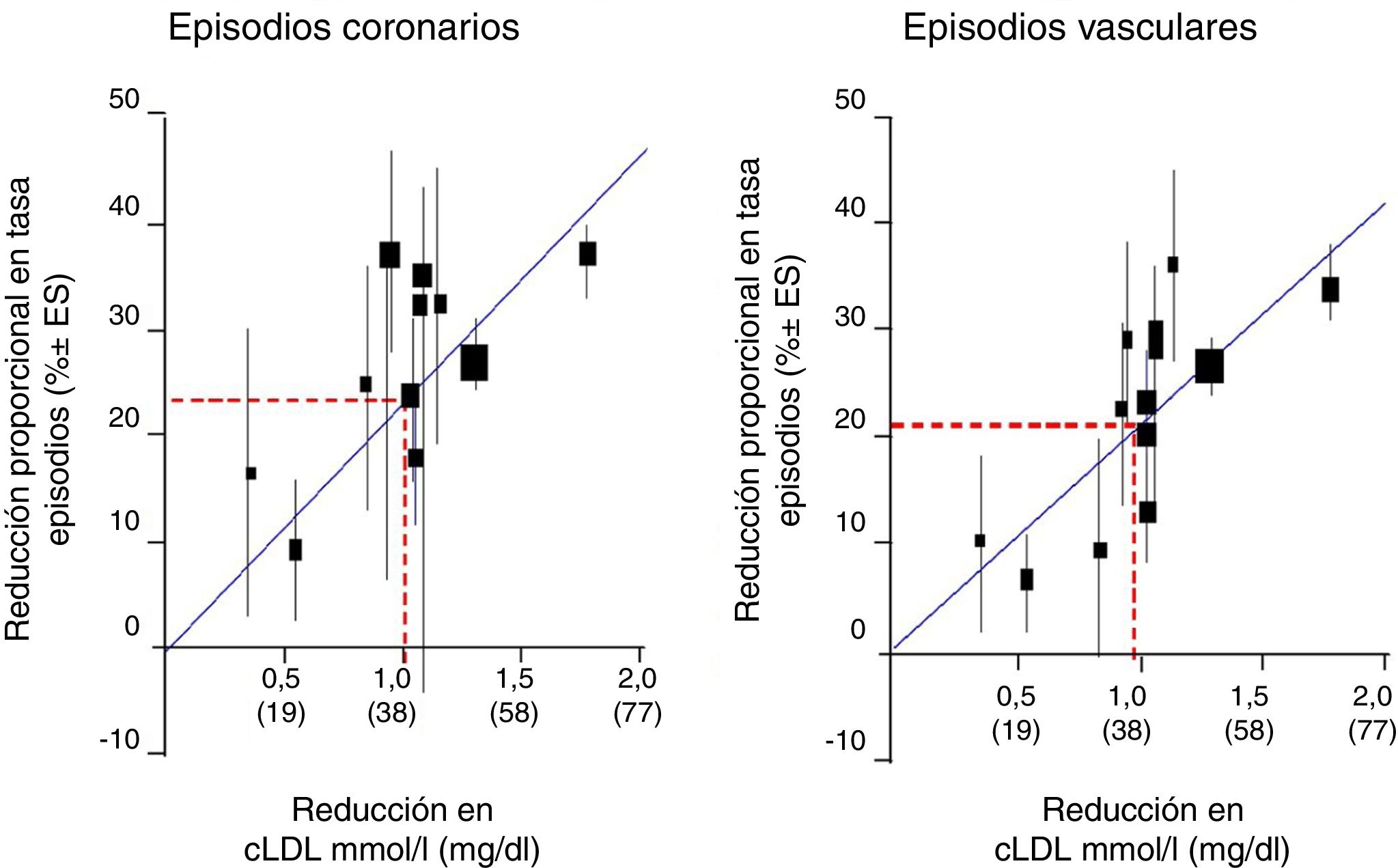
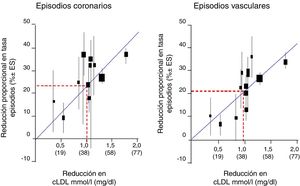
Cuando observamos la relación entre el cLDL y el riesgo relativo para el desarrollo de ECV mediante regresión logarítmica en un metaanálisis prospectivo efectuado con datos de 170.000 individuos procedentes de 26 ensayos de intervención con estatinas, con el objetivo de analizar la relación entre la reducción proporcional en la incidencia de episodios coronarios graves y episodios vasculares mayores y la reducción media absoluta de cLDL al año, en general, hubo una reducción proporcional del 22% en el riesgo de eventos vasculares importantes por cada reducción de 1mmol/l en el cLDL, lo que implica que, al menos dentro del rango de cLDL estudiado hasta la fecha, una reducción de 2mmol/l reduce el riesgo en aproximadamente un 40% y una reducción de 3mmol/l podría reducir el riesgo en aproximadamente un 50% (fig. 1).
Reducción del cLDL en mmol/l (mg/dl).
Fuente: Modificado del metaanálisis del Cholesterol Treatment Trialists’ (CTT) Collaboration.42.
El metaanálisis de Robinson et al.43 muestra que la disminución del RCV es proporcional al descenso del cLDL, independientemente de la terapia utilizada (estatinas, resinas, cirugía o dieta). El beneficio pronóstico del tratamiento hipolipemiante observado en 19 ensayos clínicos de prevención primaria y secundaria se explica de forma casi exclusiva por la reducción del LDL y esto respalda la hipótesis de que reducciones más intensivas de cLDL podrían llevar a un mayor beneficio clínico. En este metaanálisis diferentes estrategias de tratamiento han puesto de manifiesto que el uso de terapias con estatinas y sin estatinas que actúan a través de la regulación al alza de la expresión del receptor de LDL para reducir el cLDL se asoció con riesgos relativos similares de eventos vasculares mayores por cambio en el cLDL. Los niveles más bajos de cLDL alcanzados se asociaron con tasas más bajas de eventos coronarios mayores43.
En los estudios que analizan los efectos de la terapia hipolipemiante sobre el volumen de la placa aterosclerótica, se puede observar cómo conforme se reducen las cifras de cLDL, si esta reducción es moderada, el tratamiento es capaz de disminuir la progresión de la placa aterosclerótica, pero cuando la reducción es más intensa, el volumen de la placa aterosclerótica se reduce e incluso podría llegar a desaparecer con un tratamiento intensivo mantenido en el tiempo.
Las estatinas también han demostrado su eficacia para retardar la progresión o incluso promover la regresión de la aterosclerosis coronaria. El estudio REVERSAL realizado con IVUS en pacientes con enfermedad coronaria estable para demostrar que la terapia intensiva con atorvastatina 80mg/día, que alcanzó niveles de cLDL de 79mg/dl, disminuía significativamente la progresión de las lesiones ateromatosas a los 18 meses de seguimiento, en comparación con la terapia estándar con pravastatina 40mg/día, que solo redujo el cLDL a 110mg/dl44.
El estudio ASTEROID demostró que el tratamiento intensivo con rosuvastatina 40mg/día permitió alcanzar niveles de cLDL de 61mg/dl, lo que se correlacionó con una reducción significativa en el tamaño de la placa ateromatosa, demostrando una regresión de la ateroesclerosis mediante la aplicación de terapia hipolipemiante intensiva con estatinas45.
Por lo tanto, ya no se trata de disminuir la progresión de la enfermedad aterosclerótica, de estabilizar la aterosclerosis, sino de regresar la placa aterosclerótica. Y esto solo es posible con reducciones muy importantes del cLDL, como se demostró con el tratamiento intensivo a dosis máximas con estatinas, dosis máximas de estatinas con ezetimiba46 y con evolocumab en el estudio GLAGOV47.
Nuevas evidencias han confirmado que el evento iniciador clave en la aterogénesis es la retención de cLDL y otras lipoproteínas que contienen ApoB rica en colesterol dentro de la pared arterial. Varios estudios clínicos recientes controlados con placebo han demostrado que la adición de ezetimiba o anticuerpos monoclonales iPCSK919,48 al tratamiento con estatinas proporciona una reducción adicional en el riesgo de enfermedad cardiovascular aterosclerótica (ECVA), que es directamente y correlacionó positivamente con la reducción de cLDL absoluta lograda incrementalmente. Además, estos ensayos clínicos han indicado claramente que cuanto más bajos son los valores alcanzados de cLDL, menor es el riesgo de futuros eventos cardiovasculares, sin límite inferior para los valores de cLDL, o no existiendo el efecto de la curva «J» para el cLDL.
Adicionalmente, los estudios sobre la seguridad clínica de estos valores muy bajos de cLDL han demostrado ser tranquilizadores, aunque se requiere una monitorización en períodos más largos de tiempo. Finalmente, los estudios de aleatorización mendeliana en humanos han demostrado el papel crítico del cLDL, y otras lipoproteínas que contienen ApoB ricas en colesterol, en la formación de placa aterosclerótica y eventos cardiovasculares posteriores relacionados. Por lo tanto, se ha establecido que el aumento de los valores de cLDL están causalmente relacionados con ECV, y que la reducción de las partículas de LDL y otras lipoproteínas que contienen ApoB reduce lo más posible los eventos cardiovasculares.
Ante estas nuevas evidencias, las nuevas guías de lípidos de la European Society of Cardiology (ESC) y la European Atherosclerosis Society (EAS) publicadas en el año 201949 han adoptado un enfoque más práctico, más simplificado y mucho más agresivo, con nuevos objetivos más bajos para la reducción del cLDL para la mayoría de las categorías de RCV50 que las anteriores recomendaciones de las guías ESC/EAS de 201618. Destacan la importancia de reducir los niveles de cLDL de forma rápida e intensa en los pacientes con mayor RCV, y recomiendan nuevas estrategias de tratamiento en general y en algunos subgrupos poblacionales en particular.
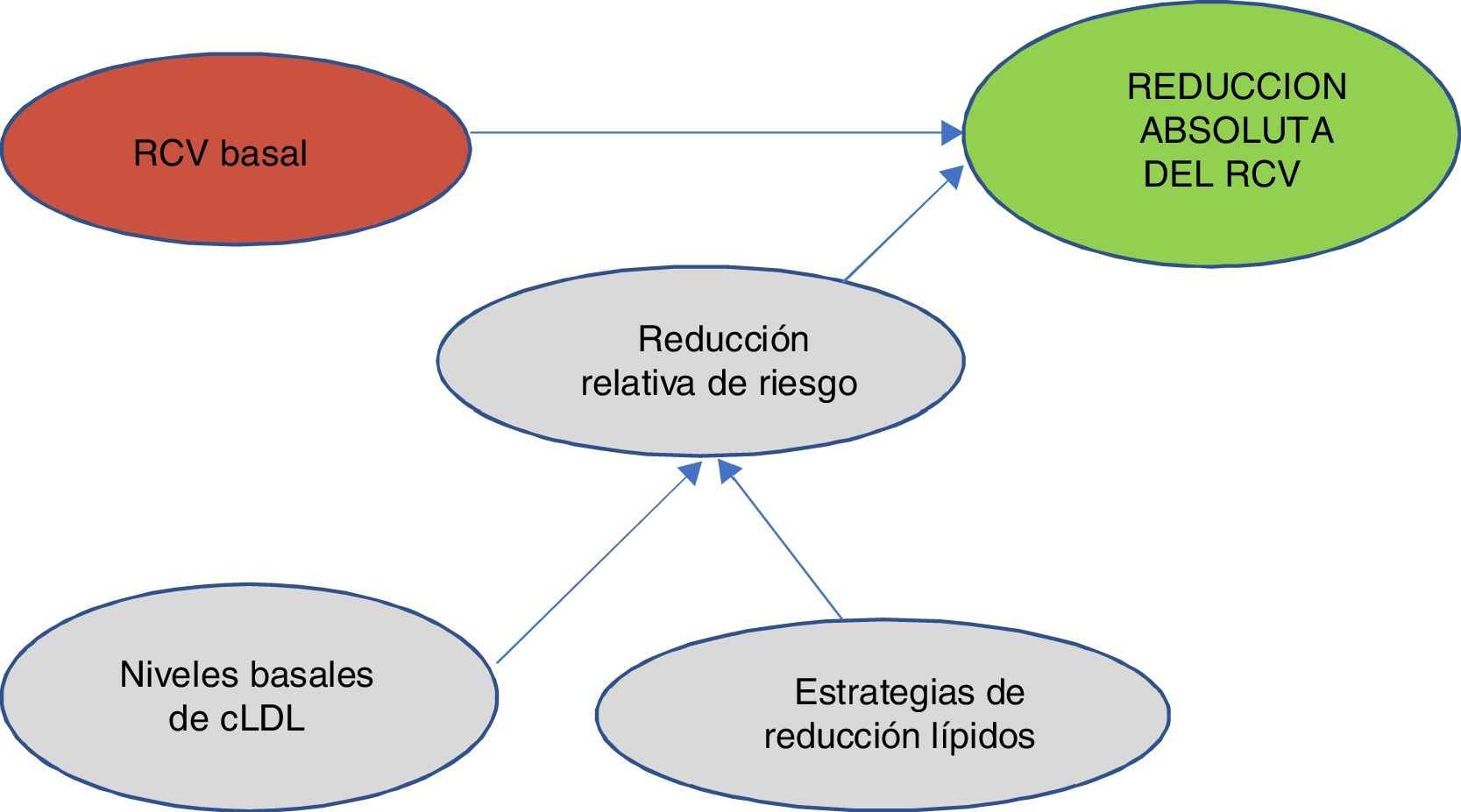
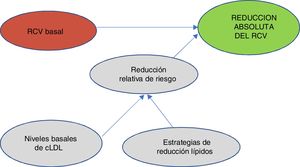
Uno de los conceptos más importantes y novedosos en los que se ha puesto más énfasis en la publicación de estas guías49 es que a la hora de predecir el beneficio que esperamos en el RCV es muy importante tener en cuenta 2 factores: el RCV basal y los niveles basales de cLDL. Teniendo en cuenta el RCV basal y los niveles basales de cLDL, nos llevará a utilizar una estrategia de control lipídico determinado que nos conducirá a una reducción del cLDL y al final van a ser estos 2 factores, es decir, el perfil del riesgo del paciente y la reducción que hayamos obtenido del cLDL lo que nos determinará la reducción absoluta del RCV que obtengamos en un paciente determinado (fig. 2).
Evaluación del beneficio previsto.
cLDL: colesterol de lipoproteínas de baja densidad; RCV: riesgo cardiovascular.
Fuente: Elaboración propia a partir de Mach et al.49.
Todas las pautas actuales sobre la prevención de ECV en la práctica clínica recomiendan la evaluación del riesgo total de ECV. La prevención de ECV en una persona determinada debe relacionarse con su RCV total: cuanto mayor es el riesgo, más intensa debe ser la acción.
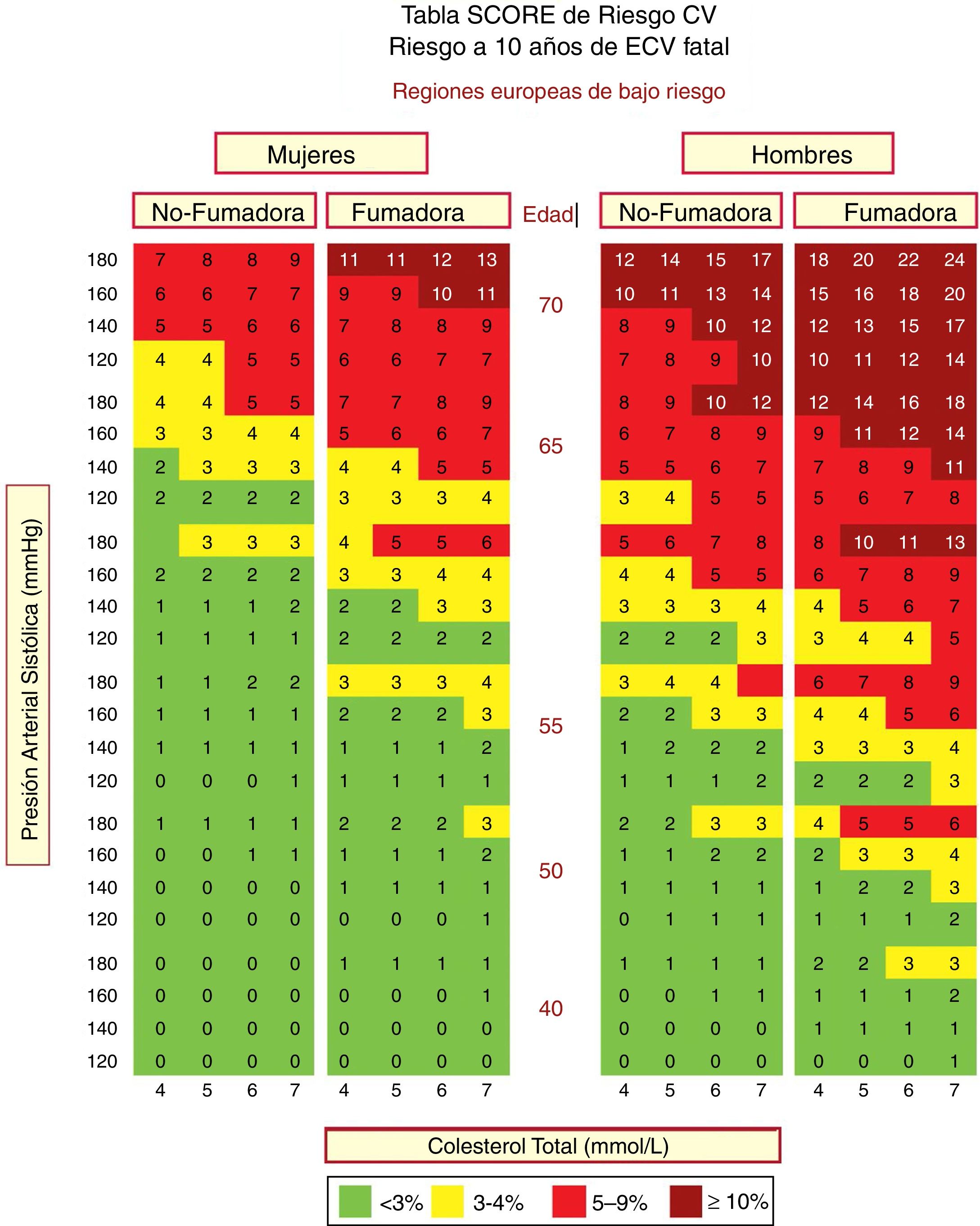
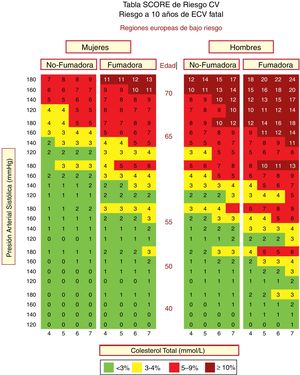
En España se recomienda el empleo de la tabla SCORE (Systematic Coronary Risk Estimation) para los países de bajo RCV. Las tablas de riesgo SCORE incluidas en la guía ESC/EAS 201949 difieren ligeramente de las de las guías de la EAS/ESC de 201618 para el tratamiento de las dislipemias, en que (fig. 3):
- 1.
La edad se ha extendido de 65 a 70 años.
- 2.
Se ha incorporado la interacción entre la edad y cada uno de los otros factores de riesgo, reduciendo así la sobreestimación del riesgo en las personas mayores en los cuadros originales de estimación sistemática del riesgo coronario.
- 3.
La banda de colesterol de 8mmol/l se ha eliminado ya que dichas personas calificarán para una evaluación adicional, en cualquier caso.
Tabla SCORE de estimación del riesgo coronario para poblaciones europeas con bajo riesgo de enfermedad cardiovascular (ECV). El riesgo a 10 años de ECV mortal en poblaciones con bajo riesgo de ECV se establece en función de los siguientes factores de riesgo: edad, sexo, tabaquismo, presión arterial sistólica y colesterol total. Para convertir el riesgo de ECV mortal en riesgo de ECV total (fatal o no mortal), multiplique por 3 en hombres y por 4 en mujeres, y un poco menos en las personas mayores. Nota: la tabla de SCORE se usa en personas sin ECV manifiesta, diabetes (tipo 1 y 2), enfermedad renal crónica, hipercolesterolemia familiar o niveles muy altos de factores de riesgo individuales porque esas personas ya tienen un alto riesgo y necesitan una gestión intensiva de factores de riesgo. Colesterol: 1mmol/l=38,67mg/dl. SCORE: Systematic Coronary Risk Estimation.
Fuente: Modificado de Mach et al.49.
Las personas con ECVA documentada, diabetes mellitus tipo 1 o diabetes mellitus tipo 2 de larga evolución, niveles muy altos de factores de riesgo individuales, enfermedad renal crónica, hipercolesterolemia familiar, placas carotideas o femorales, puntuación de calcio en arterias coronarias >100 o elevación extrema de lipoproteína (a) [Lp(a)], generalmente tienen un RCV total muy alto o muy alto y no se necesitan modelos de estimación de riesgo para tales personas. Todos necesitan una gestión activa de todos los factores de riesgo.
En las personas que no han padecido un evento cardiovascular, aparentemente sanas, se recomienda el uso de un sistema de estimación de riesgos como SCORE, que estima el riesgo acumulado de 10 años de un primer evento aterosclerótico fatal para estimar el RCV total, ya que muchas personas tienen varios factores de riesgo que, en combinación, pueden resultar en altos niveles de RCV total. Esta es la base para la estimación y gestión del RCV total. La detección de factores de riesgo, incluido el perfil lipídico, debe considerarse en hombres mayores de 40 años y en mujeres mayores de 50 años o posmenopáusicas.
En los jóvenes es de utilidad la tabla de riesgo relativo. En los pacientes mayores, en quienes la morbimortalidad por ECV es muy elevada, se han desarrollado tablas específicas para ellos, consiguiendo una disminución de falsos positivos y por ello una reducción del sobretratamiento en esta población tan vulnerable y con comorbilidades importantes51.
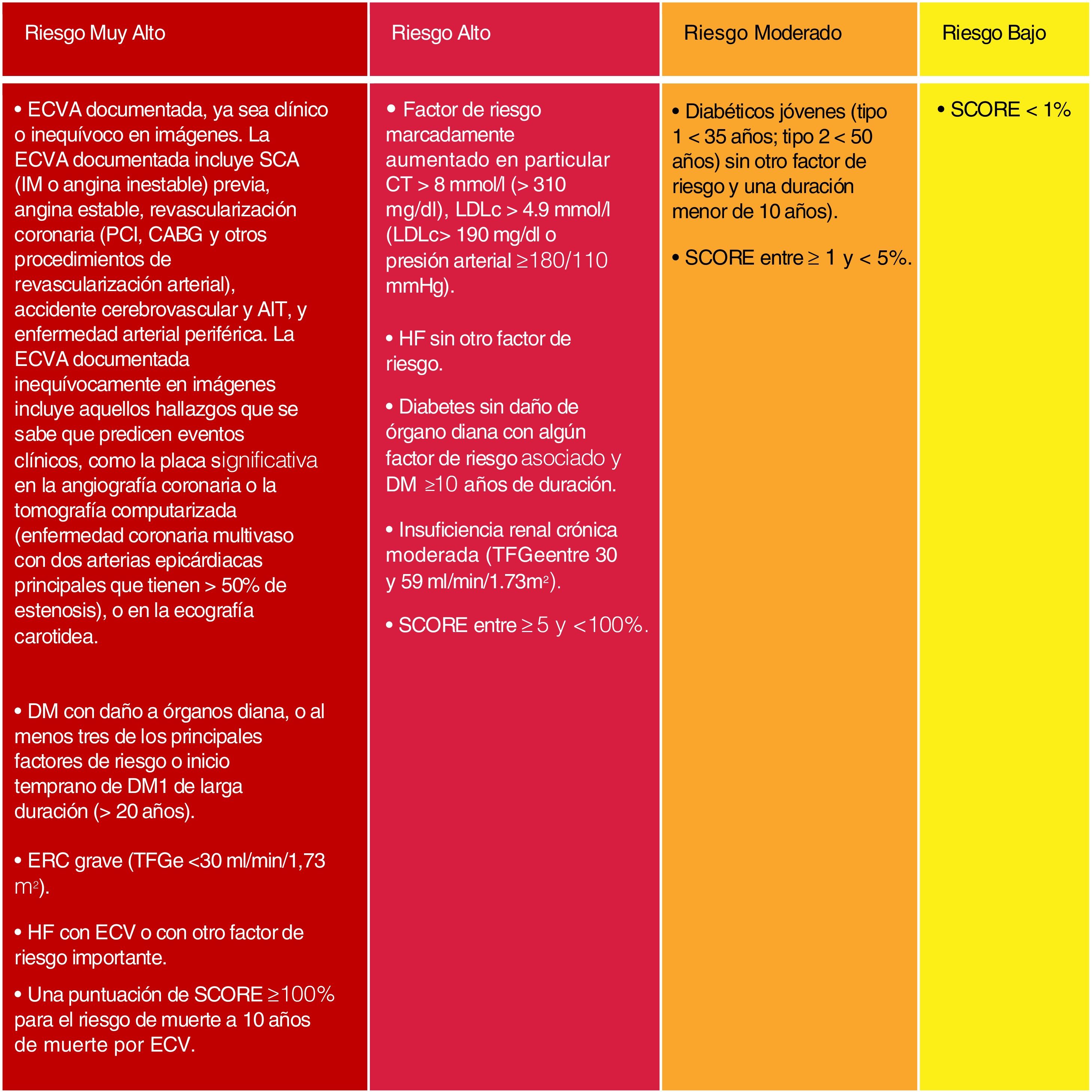
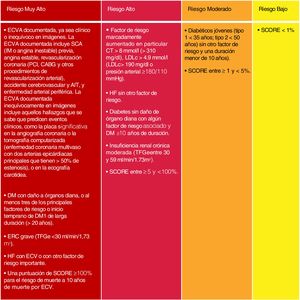
Si bien se mantienen las categorías de riesgo publicadas en las guías ESC/EAS 201618, se han introducido algunas modificaciones en esta última versión de 201949. Así, se determinan 4 categorías de RCV (fig. 4).
Categorías de riesgo cardiovascular.
C-no HDL: colesterol no HDL; CT: colesterol total; DM: diabetes mellitus; ECV: enfermedad cardiovascular; ECVA: enfermedad cardiovascular aterosclerótica; ERC: enfermedad renal crónica; HDLc: colesterol de lipoproteína de alta densidad; HF: hipercolesterolemia familiar; LDLc: colesterol de lipoproteínas de baja densidad; SCORE: Systematic Coronary Risk Estimation; TFGe: tasa de filtrado glomerular.
Fuente: Modificado de Mach et et al.49.
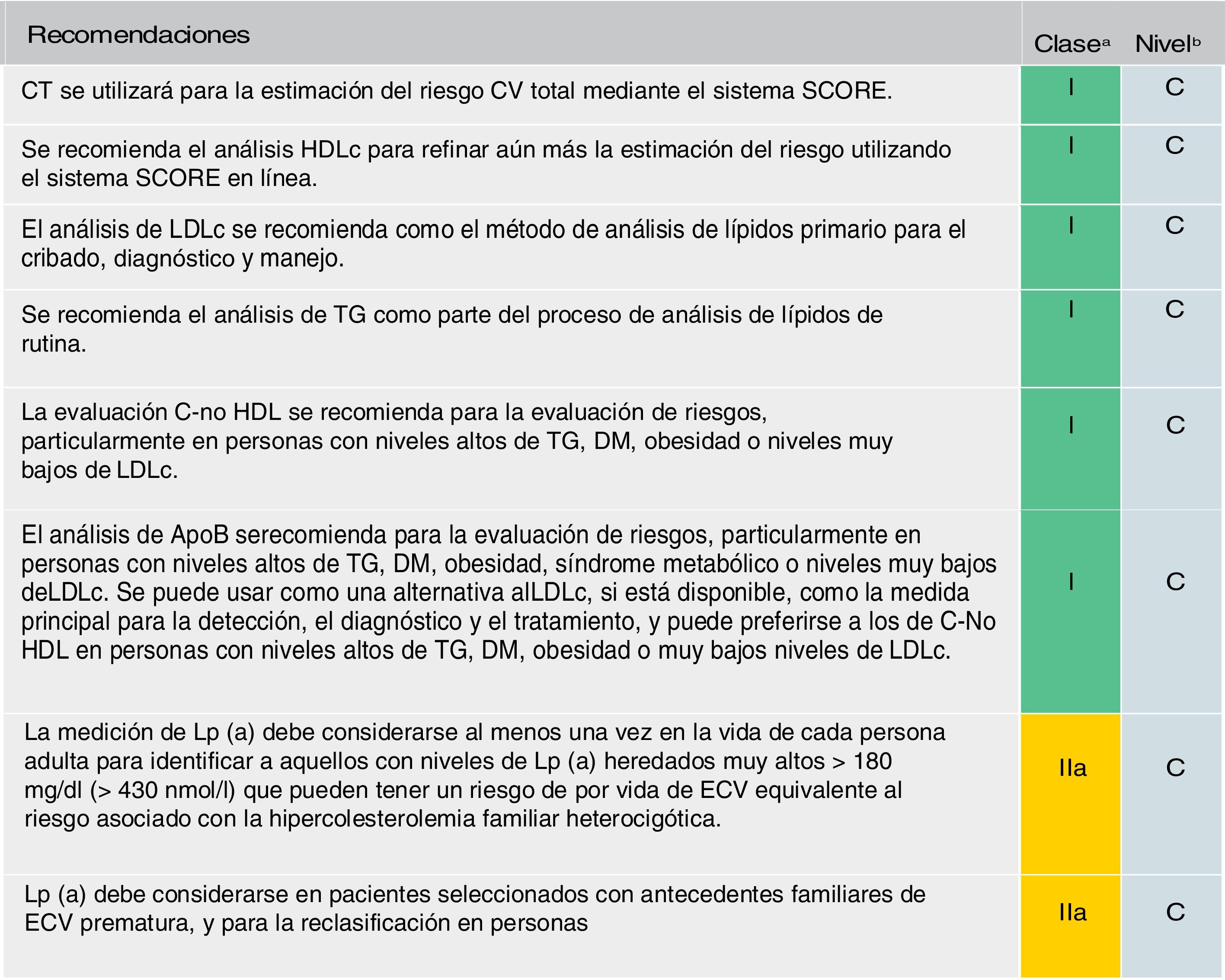
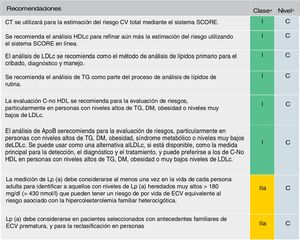
Se mantiene la recomendación de solicitar un perfil lipídico completo (colesterol total, cLDL, triglicéridos, cHDL y cálculo del colesterol no HDL [C-no HDL]) (fig. 5). Se considera el cLDL como el marcador lipídico primario, aunque alcanza el mismo grado de recomendación (IC) que el C-no HDL y la ApoB. De estar disponible, la ApoB puede ser una mejor medida de la exposición de un individuo a las lipoproteínas ateroscleróticas y, por lo tanto, su uso puede ser particularmente útil para la evaluación de riesgos en personas en quienes la medición del cLDL subestima esta carga, como aquellas con triglicéridos altos, diabetes, obesidad o muy bajo nivel de cLDL.
Análisis de lípidos para estimar el riesgo de enfermedad cardiovascular.
Apo: apolipoproteína; C-no HDL: colesterol no HDL; CT: colesterol total; CV: cardiovascular; DM: diabetes mellitus; ECV: enfermedad cardiovascular; ECVA: enfermedad cardiovascular aterosclerótica; HDLc: colesterol de lipoproteína de alta densidad; LDLc: colesterol de lipoproteínas de baja densidad; Lp(a): lipoproteína (a); TG: triglicéridos.
a Clase de recomendación.
b Nivel de evidencia.
Fuente: Modificado de Mach et et al.49.
También recomienda una sola medición de Lp(a) en todos los individuos al menos una vez en la vida (valores ≥180mg/dl determinan un riesgo equivalente a la hipercolesterolemia familiar). Una medición única de Lp(a) puede ayudar a identificar a las personas con niveles heredados muy altos de Lp(a) que pueden tener un riesgo sustancial de ECV durante toda la vida. También puede ser útil para optimizar aún más la estratificación del riesgo de pacientes con alto riesgo, en pacientes con antecedentes familiares de ECV prematura y para determinar estrategias de tratamiento en personas cuyo riesgo estimado está en el límite de las categorías de riesgo52–54.
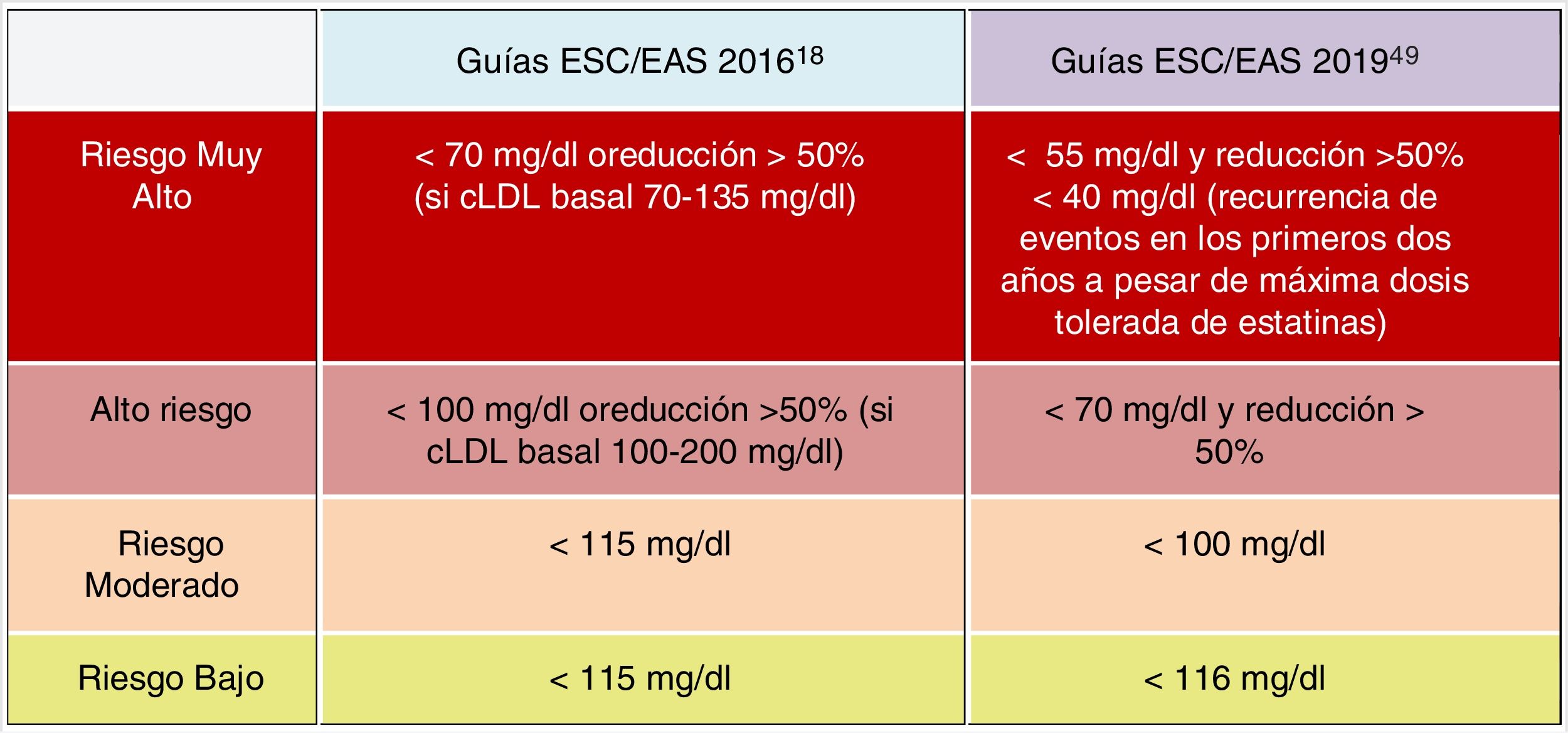
Objetivos lipídicos de control de cLDLEl cLDL se recomienda como el método de análisis de lípidos primario para el cribado, diagnóstico y manejo, siendo considerado por todas las guías de tratamiento de dislipemia el objetivo primario de control. Las nuevas guías determinan nuevos objetivos de cLDL (valores lipídicos más bajos) en comparación con las recomendaciones anteriores de las guías de 201618 (fig. 6).
Las nuevas guías destacan la importancia de reducir los niveles de cLDL de forma rápida e intensa en pacientes con RCV elevado. La estrategia clave en estas guías es «menores niveles de cLDL son mejores en la prevención de la ECV», y si bien esto se ha recomendado en general en las guías ESC/EAS 201618, las nuevas guías recomiendan con más énfasis que el beneficio todavía se mantiene en niveles muy bajos de cLDL, con un enfoque más simple que antes, y en los pacientes de mayor riesgo están recomendando que el cLDL se reduzca lo más posible sin realmente tener un límite inferior.
En este sentido, las guías ESC/EAS 201949 recomiendan un objetivo de cLDL de menos de 1,4mmol/l (<55mg/dl) para pacientes con riesgo muy alto y un objetivo aún más bajo de menos de 1,0mmol/l (<40mg/dl) para los pacientes con el mayor riesgo, aquellos con múltiples eventos recientes (fig. 7).
Recomendaciones para los objetivos de tratamiento del cLDL.
ECVA: enfermedad cardiovascular aterosclerótica; HF: hipercolesterolemia familiar; LDLc: colesterol de lipoproteínas de baja densidad.
a Clase de recomendación.
b Nivel de evidencia.
c Para las definiciones, consulte las categorías de riesgo cardiovascular.
d El término «basal»se refiere al nivel de LDLc en una persona que no toma ningún medicamento para reducir el LDLc. En las personas que toman medicamentos reductores de LDLc, los niveles de LDLc de referencia proyectados (no tratados) deben estimarse en función de la eficacia promedio de reducción de LDLc del medicamento o combinación de medicamentos administrados.
Fuente: Modificado de Mach et al.49.
Esta recomendación es mucho más agresiva que las de guías anteriores, que tenían un objetivo de 1,8mmol/l (<70mg/dl) o una reducción del 50%. La diferencia entre «y» u «o» puede parecer un cambio sutil, pero podría marcar una gran diferencia para algunos pacientes. Por ejemplo, si un paciente de muy alto riesgo tiene un nivel de cLDL no tratado de 1,5mmol/l, que está justo por encima del objetivo de 1,4, entonces la nueva recomendación de necesitar una reducción del 50%, además de estar por debajo de 1,4, requeriría que el nivel de cLDL se reduzca mucho más, a 0,75mmol/l.
Asimismo, se establecen objetivos secundarios de C-no HDL (<85mg/dl, <100mg/dl y <130mg/dl) y ApoB (<65mg/dl, <80mg/dl y <100mg/dl) para las categorías de muy alto, alto y moderado riesgo, respectivamente.
La Asociación Americana de Endocrinología, en una actualización de las recomendaciones para el tratamiento de la dislipemia y prevención de las ECV en el año 2017, ya había creado la categoría de RCV extremo (ECV progresiva y angina inestable en pacientes con cLDL<70mg/dl, ECV establecida en pacientes con diabetes mellitus tipo 2, enfermedad renal crónica estadios 3-5, hipercolesterolemia familiar e historia de ECV prematura) para el que marcaba unos objetivos de cLDL<55mg/dl58, categorías que en las guías europeas de 2019 están englobadas en la categoría de alto riesgo cardiovascular con objetivos de cLDL<50% y <55mg/dl49.
Tratamiento para reducir el cLDLAl igual que las guías de 201618, deberíamos considerar el riesgo del paciente y el nivel de cLDL basal para elegir la estrategia hipolipemiante a seguir. En estas guías de 201949, además de bajar sensiblemente los objetivos terapéuticos, han cambiado las estrategias de intervención para lograr los objetivos de cLDL. Como en anteriores guías se sigue recomendando la modificación del estilo de vida y el tratamiento farmacológico individualizado en función del RCV total y del cLDL basal. La estimación del RCV total no implica que todos los pacientes deban ser tratados farmacológicamente59, pero sí identifica aquellos que se benefician de un mejor control de su perfil lipídico.
Estas guías se han creado para que los profesionales de la salud asesoren a las personas sobre su RCV y los beneficios de adoptar y mantener un estilo de vida saludable; consensúen de forma individual con los pacientes la modificación temprana de su RCV relacionado con los lípidos, aplicando las recomendaciones que las guías hacen sobre el manejo del paciente; lo que debería permitir a más médicos reducir de manera eficiente y segura el RCV a través de la modificación de lípidos.
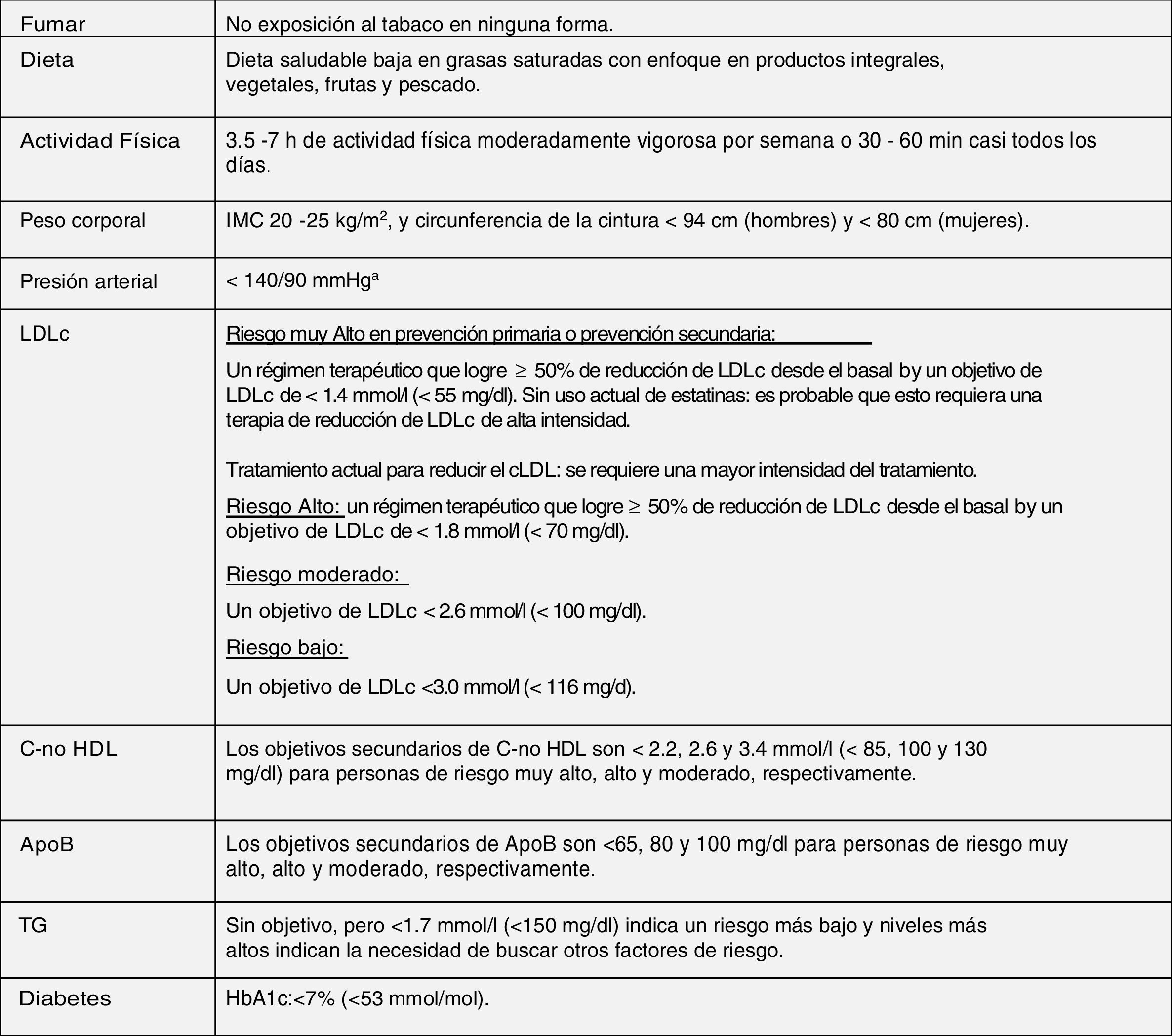
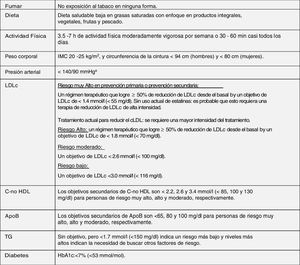
Modificación del estilo de vida y control integral de todos los factores de riesgo cardiovascularLas modificaciones de estilo de vida recomendadas en esta nueva guía para mejorar el perfil lipídico plasmático para la prevención cardiovascular, que básicamente son dejar de fumar, dieta adecuada, actividad física regular, control de peso, reducir el consumo de alcohol, evitar el estrés y control integral de todos los FRCV, se han realizado teniendo en cuenta las últimas evidencias disponibles en este campo, a partir de las cuales se establece una serie de objetivos para la prevención de la ECV (fig. 8).
Objetivos del tratamiento integral para la prevención de ECV.
Apo: apolipoproteína; C-no HDL: colesterol no HDL; ECV: enfermedad cardiovascular; HbA1c: hemoglobina glucosilada; HDLc: colesterol de lipoproteínas de alta densidad; IMC: índice de masa corporal; LDLc: colesterol de lipoproteínas de baja densidad; TG: triglicéridos.
a Se recomiendan objetivos de tratamiento más bajos para la mayoría de los pacientes hipertensos tratados, siempre que el tratamiento sea bien tolerado.
b El término «basal» se refiere al nivel de LDLc en una persona que no toma ningún medicamento hipolipemiante, o al valor de referencia extrapolado para aquellos que están en tratamiento actual.
Fuente: Modificado de Mach et al.49.
Las intervenciones de estilo de vida para reducir los niveles de colesterol total y cLDL con mayor grado de evidencia y mayor impacto son evitar las grasas trans en la dieta, reducir las grasas saturadas en la dieta, aumentar la fibra dietética, consumir alimentos funcionales enriquecidos con fitosteroles, consumir nutracéuticos de arroz de levadura roja, reducir el peso corporal excesivo, reducir el colesterol en la dieta y aumentar la actividad física habitual49.
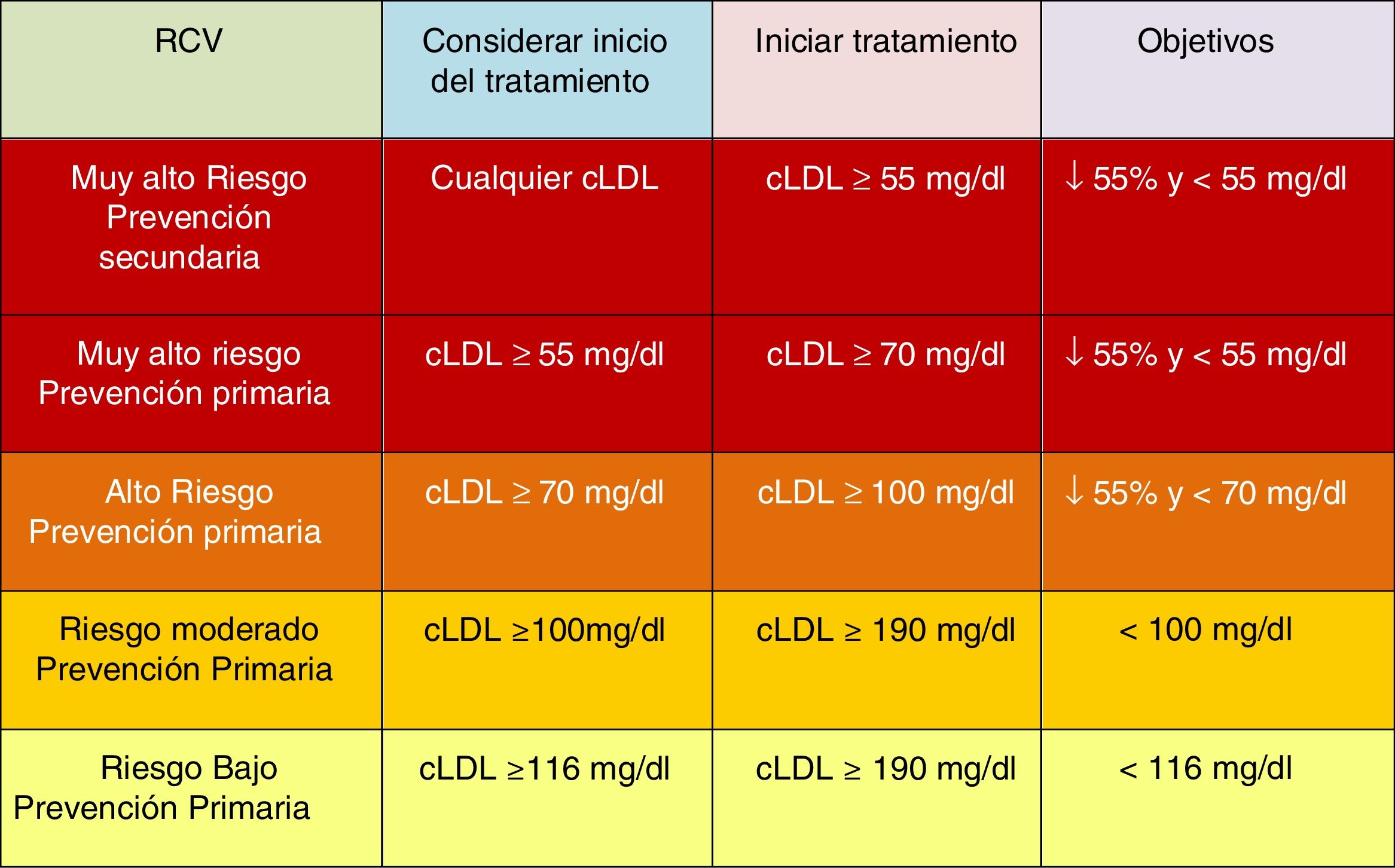
Tratamiento farmacológico para reducir el cLDLAdemás de la modificación del estilo de vida y la recomendación de los hábitos saludables descritos con anterioridad, se recomienda el inicio del tratamiento farmacológico en las situaciones descritas en la figura 9 para cada nivel de RCV.
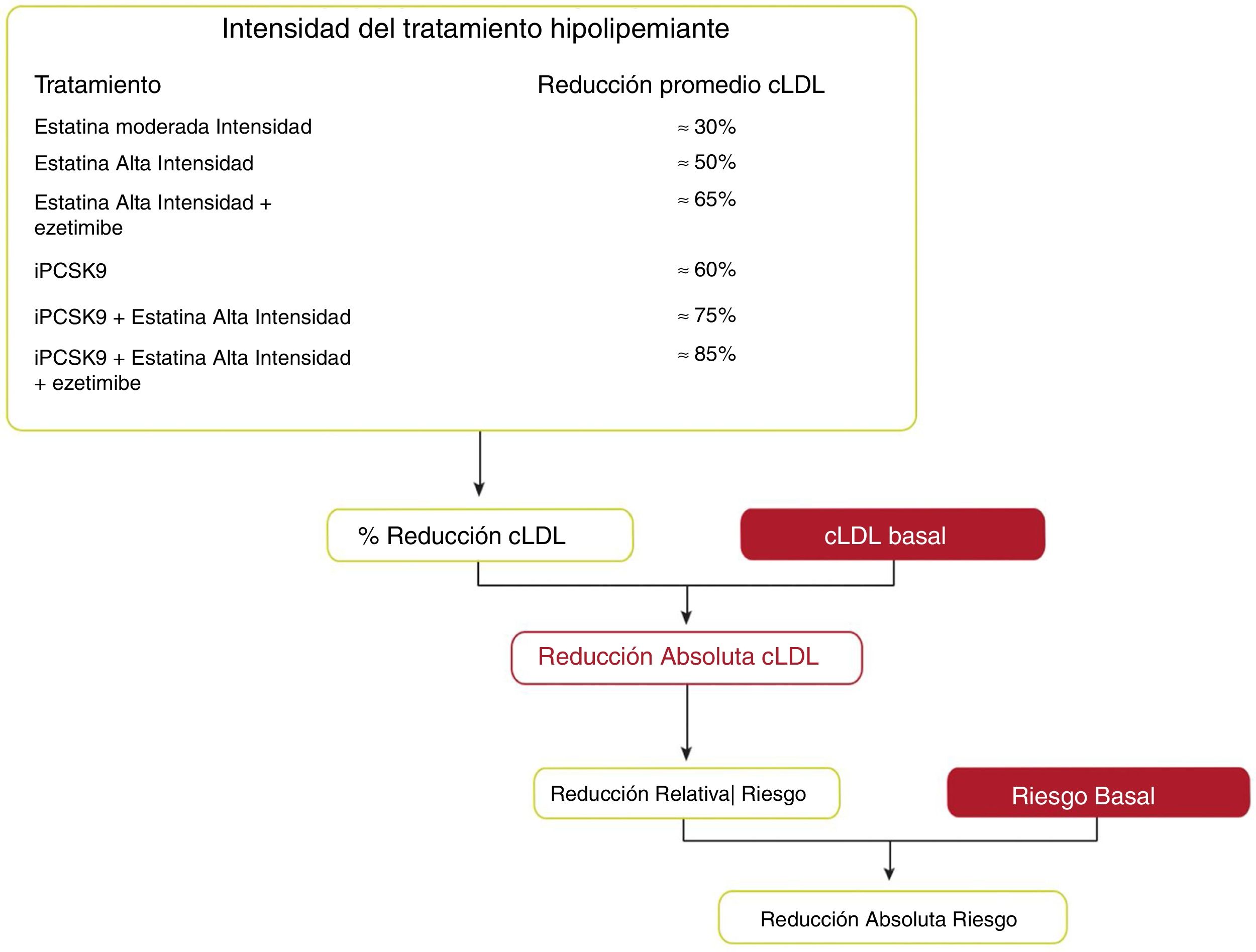
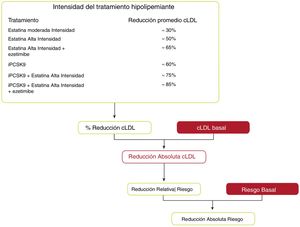
Se pueden estimar los beneficios clínicos esperados del tratamiento para reducir el cLDL para cualquier persona49 (fig. 10), que dependen de la intensidad de la terapia, el nivel basal de cLDL, la reducción absoluta esperada lograda en el cLDL y el riesgo estimado de ECVA.
Beneficios clínicos esperados de las terapias reductoras de colesterol de lipoproteínas de baja densidad.
cLDL: colesterol de lipoproteínas de baja densidad; iPCSK9: inhibidor de proproteína convertasa subtilisina/kexina tipo 9.
Fuente: Modificado de Mach et et al.49.
La intensidad de la terapia debe seleccionarse para lograr la reducción proporcional recomendada en el cLDL en función del riesgo estimado de ECVA de la persona. Multiplicar la reducción proporcional en el cLDL por el nivel de cLDL de referencia de una persona estima la reducción absoluta esperada en el cLDL que probablemente se logrará con esa terapia. Debido a que cada reducción absoluta de 1,0mmol/l (40mg/dl) en el cLDL se asocia con una reducción del 20% en el riesgo de eventos cardiovasculares, las reducciones absolutas más grandes en el cLDL conducen a mayores reducciones proporcionales en el riesgo.
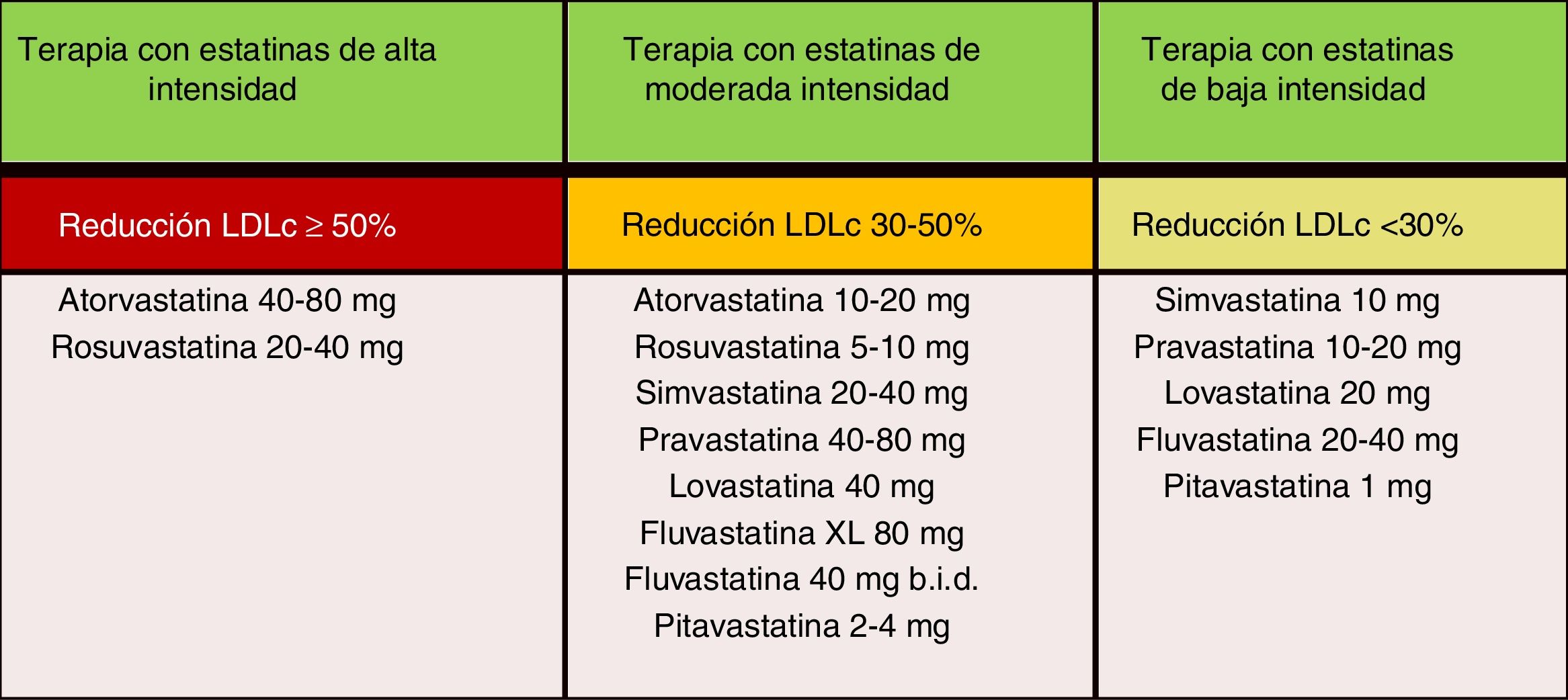
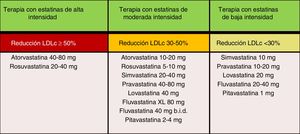
En las nuevas guías ESC/EAS 201949, después de calcular el RCV total en un individuo y conocer los niveles de cLDL basal, se determinan los objetivos de control, se involucra al paciente en las decisiones sobre la gestión de su RCV y se elige un régimen de tratamiento con estatinas con la intensidad necesaria para lograr los objetivos de control (fig. 11). Como la respuesta a las estatinas es variable, puede ser necesario aumentar la dosis de estatinas antes de prescribir fármacos adicionales para la reducción más intensiva del cLDL. Si el objetivo no se cumple con la máxima dosis tolerada de estatinas, administrar ezetimiba.
Intensidad del tratamiento hipolipemiante de las estatinas.
Fuente: Modificado de Stone et al.60.
Para pacientes en prevención primaria de muy alto riesgo sin hipercolesterolemia familiar, si los objetivos no se alcanzan con la máxima dosis tolerada de estatinas y ezetimiba, se podría considerar iPCSK9.
Para pacientes con hipercolesterolemia familiar de muy alto riesgo (con antecedentes vasculares o factores de riesgo mayores asociados), y para pacientes en prevención secundaria, si los objetivos no se alcanzan con la máxima dosis tolerada de estatinas y ezetimiba, se recomienda agregar iPCSK9 al tratamiento para alcanzar los objetivos de tratamiento (porcentaje y valor absoluto).
Si un esquema basado en estatinas no es tolerado (cualquier dosis), debería considerarse administrar ezetimiba y/o iPCSK9. Si el objetivo no se alcanza, podría considerarse la combinación estatinas-resinas.
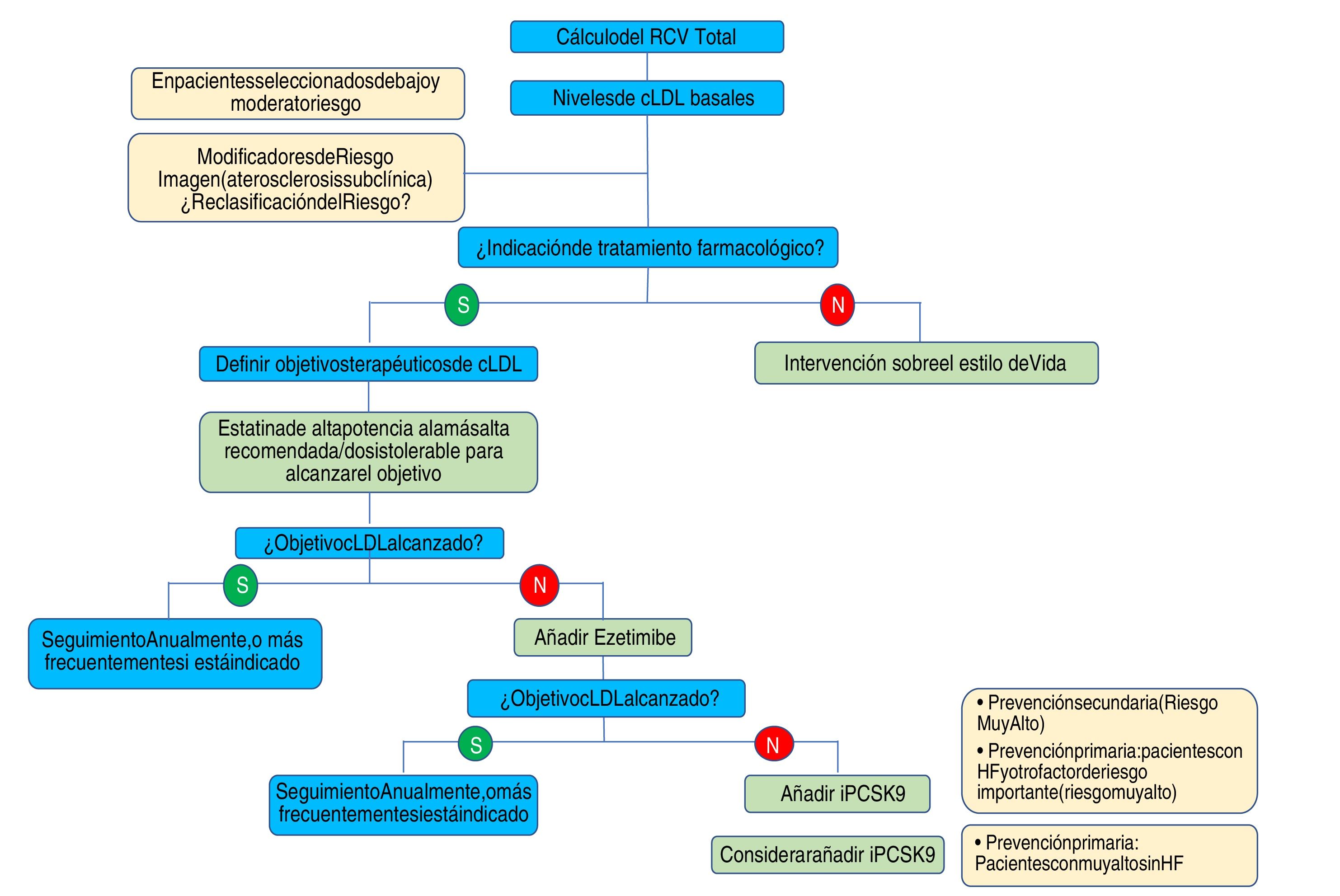
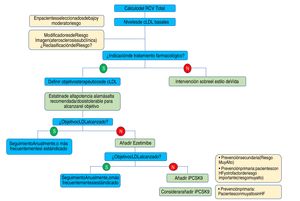
En conjunto, las nuevas guías de la ESC/EAS 201949 refuerzan la importancia de reducir los niveles lipídicos de forma rápida e intensa en pacientes con elevado RCV y resaltan el papel de los iPCSK9 para conseguirlo, para lo que se propone el algoritmo representado en la figura 12. Las recomendaciones de las últimas guías suponen un avance muy importante en la terapia hipolipemiante, pasando del concepto del empleo de estatinas de alta intensidad al empleo de terapia hipolipemiante de alta intensidad61 que incluye, además de estatinas, ezetimiba e iPCSK9.
Algoritmo de tratamiento para la reducción farmacológica del cLDL.
cLDL: colesterol de lipoproteínas de baja densidad; HF: hipercolesterolemia familiar; iPCSK9: inhibidor de proproteína convertasa subtilisina/kexina tipo 9; RCV: riesgo cardiovascular.
Fuente: Modificado de Mach et et al.49.
La implementación de las guías de práctica clínica es de vital importancia, siendo la discordancia entre las recomendaciones y la práctica clínica habitual decepcionante en la actualidad por el escaso porcentaje de consecución de objetivos cLDL62.
Por ello, todas las guías insisten en la importancia de consensuar con el paciente el tratamiento y los objetivos, donde el cLDL juega un papel fundamental, priorizando sobre todo en aquellos de muy alto riesgo, con un tratamiento potente e intensivo, teniendo en cuenta las comorbilidades que presenta ese paciente individual.
Las guías ACC/AHA63 publicadas en 2018 realizaron una serie de recomendaciones cuyos mensajes principales para reducir el riesgo de ECVA a través del control del colesterol son recomendaciones similares a las guías ESC/EAS 201949, pero mucho menos agresivas en los niveles de riesgo alto y muy alto RCV:
- 1.
En todas las personas es necesario recomendar un estilo de vida saludable para el corazón a lo largo del curso de la vida.
- 2.
En pacientes con ECVA clínica, se debe reducir el cLDL tratando con estatinas de alta intensidad o terapia con estatinas a la máxima dosis tolerada para reducir los niveles de cLDL en ≥50%.
- 3.
En ECVA de muy alto riesgo, usar un umbral de cLDL de 70mg/dl para considerar la adición de fármacos no estatínicos al tratamiento con estatinas. En pacientes con un riesgo muy alto cuyo nivel de cLDL sigue siendo ≥70mg/dl con estatinas a la dosis máxima tolerada y ezetimiba, es razonable agregar un iPCSK9.
- 4.
En pacientes con hipercolesterolemia primaria grave (nivel de cLDL ≥190mg/dl), sin calcular el riesgo de ECVA a 10 años, comenzar la terapia con estatinas de alta intensidad. Si el nivel de cLDL permanece ≥100mg/dl, es razonable agregar ezetimiba. Si el nivel de cLDL en estatina más ezetimiba permanece ≥100mg/dl y el paciente tiene múltiples factores que aumentan el riesgo posterior de eventos de ECV, se puede considerar un iPCSK9.
- 5.
En pacientes de 40 a 75 años de edad con diabetes mellitus y cLDL ≥70mg/dl, se aconseja comenzar el tratamiento con estatinas de intensidad moderada sin calcular el riesgo de ECV a 10 años. En pacientes con diabetes mellitus con mayor riesgo, especialmente aquellos con múltiples factores de riesgo o aquellos de 50 a 75 años de edad, es razonable usar una estatina de alta intensidad para reducir el nivel de cLDL en ≥50%.
- 6.
En adultos de 40 a 75 años en prevención primaria de ECV, es necesario asesorar a los pacientes sobre los beneficios potenciales de las terapias de modificación del estilo de vida y estatinas; los potenciales efectos adversos e interacciones farmacológicas; consideración de los costos de la terapia con estatinas; y preferencias y valores del paciente en la toma de decisiones compartidas.
- 7.
En adultos de 40 a 75 años sin diabetes mellitus y con niveles de cLDL ≥70mg/dl, con un riesgo de ECV a 10 años de ≥7,5%, es razonable comenzar con una estatina de intensidad moderada. Si el estado de riesgo es incierto, considerar el uso de calcio en la arteria coronaria (CAC) para mejorar la especificidad. Si las estatinas están indicadas, reducir los niveles de cLDL en ≥30%, y si el riesgo a 10 años es ≥20%, reducir los niveles de cLDL en ≥50%.
- 8.
En adultos de 40 a 75 años sin diabetes mellitus y riesgo a 10 años del 7,5 al 19,9% (riesgo intermedio), los factores que aumentan el riesgo favorecen el inicio de la terapia con estatinas. Estos factores incluyen: antecedentes familiares de ECV prematura; niveles persistentemente elevados de cLDL ≥160mg/dl; síndrome metabólico; enfermedad renal crónica; antecedentes de preeclampsia o menopausia prematura (edad <40 años); trastornos inflamatorios crónicos (p.ej., artritis reumatoide, psoriasis o VIH crónico); grupos étnicos de alto riesgo (p.ej., del sur de Asia); elevaciones persistentes de triglicéridos ≥175mg/dl y, si se mide en individuos seleccionados, ApoB ≥130mg/dl, proteína C reactiva de alta sensibilidad ≥2,0mg/l, índice tobillo-brazo <0,9 y Lp(a) ≥50mg/dl o 125nmol/l, especialmente a valores más altos de Lp(a). Los factores que aumentan el riesgo pueden favorecer el tratamiento con estatinas en pacientes con un riesgo a 10 años del 5-7,5% (riesgo límite).
- 9.
En adultos de 40 a 75 años sin diabetes mellitus y con niveles de cLDL ≥70 a 189mg/dl (≥1,8-4,9mmol/l), con un riesgo de ECV a 10 años del ≥7,5 al 19,9%, si la decisión sobre el tratamiento con estatinas es incierta, considerar medir la CAC. Si la CAC es cero, el tratamiento con estatinas se puede suspender o retrasar, excepto en los fumadores, aquellos con diabetes mellitus y aquellos con un fuerte historial familiar de ECV prematura. Un puntaje CAC de 1 a 99 favorece la terapia con estatinas, especialmente en los ≥55 años de edad. Para cualquier paciente, si el puntaje CAC es ≥100 unidades de Agatston o ≥percentil 75, la terapia con estatinas está indicada a menos que la negociación del riesgo clínico-paciente sugiera lo contrario.
- 10.
Evaluar el cumplimiento y el porcentaje de respuesta a los medicamentos que reducen el cLDL y los cambios en el estilo de vida con la medición repetida de lípidos de 4 a 12 semanas después del inicio de la estatina o el ajuste de la dosis; repetir cada 3-12 meses según sea necesario. Definir las respuestas al estilo de vida y la terapia con estatinas mediante reducciones porcentuales en los niveles de cLDL en comparación con el valor inicial. En los pacientes con ECV con riesgo muy alto, los criterios para asociar una terapia con medicamentos no estatínicos se definen por los niveles umbral de cLDL ≥70mg/dl en los pacientes en terapia con dosis máxima de estatinas.
Los autores declaran no tener ningún conflicto de intereses.
Nota al suplementoEste artículo forma parte del suplemento «Actualidad de la dislipemia aterogénica en 2018», que cuenta con el patrocinio de laboratorios Mylan.