Presentar el primer registro que analiza el perfil clínico de los pacientes tratados en España con evolocumab y la efectividad sobre el perfil lipídico y su seguridad en el «mundo real».
MétodosEstudio multicéntrico, retrospectivo, observacional, de los pacientes que empezaron tratamiento con evolocumab entre febrero de 2016 y mayo de 2017 en la práctica clínica en unidades de cardiología en España.
ResultadosSe incluyó a 186 pacientes de 31 unidades de cardiología (edad media 60,3 ± 9,8 años; 35,5% con hipercolesterolemia familiar y 94,1% con evento cardiovascular previo). Perfil lipídico basal: colesterol total 219,4 ± 52,2mg/dL, colesterol-LDL 144,0 ± 49,0mg/dL, colesterol-HDL 47,7 ± 13,0mg/dL y triglicéridos 151,0 ± 76,2mg/dL. En el momento del inicio de evolocumab, el 53,8% estaba tomando estatinas (el 50% presentaba intolerancia a las estatinas, total o parcial) y el 51,1% ezetimiba. En todos los casos se empleó la dosis de evolocumab de 140mg y, principalmente, cada 2 semanas (97,3%). El cumplimiento terapéutico fue elevado (92,3%). En 6 pacientes (3,2%) se interrumpió el tratamiento, pero solo en uno (0,5%), por posible efecto adverso. Evolocumab redujo significativamente el colesterol total (30,9% a las 2 semanas y 39,3% a las 12 semanas; p < 0,001), colesterol-LDL (44,4 y 57,6%, respectivamente; p < 0,001) y triglicéridos (14,8 y 5,2%; p < 0,001), sin modificar significativamente el colesterol-HDL (6,7 y 2,0%; p = 0,14).
ConclusionesEn la práctica clínica, evolocumab se asocia con reducciones del colesterol-LDL cercanas al 60% tras 12 semanas de tratamiento, con una tasa de retiradas por efectos adversos muy baja y con un elevado cumplimiento terapéutico. Estos resultados son consistentes con los obtenidos en los ensayos clínicos aleatorizados.
To present the first registry used to analyse the clinical profile of patients treated with evolocumab in Spain, including the effectiveness on the lipid profile and safety in the «real world» setting.
MethodsMulticentre, retrospective, and observational study of patients starting treatment with evolocumab from February 2016 to May 2017 in clinical practice in Spanish cardiology units.
ResultsA total of 186 patients (mean age 60.3 ± 9.8 years were included, 35.5% with familial hypercholesterolaemia, and 94.1% with a previous cardiovascular event) from 31 cardiology units. Baseline lipid profile: Total cholesterol 219.4 ± 52.2 mg/dL, LDL-cholesterol 144.0 ± 49.0mg/dL, HDL-cholesterol 47.7 ± 13.0mg/dL, and triglycerides 151.0 ± 76.2mg/dL. At the time of initiating evolocumab, 53.8% of patients were taking statins (50% had partial or total intolerance to statins), and 51.1% ezetimibe. In all cases, the dose of evolocumab used was 140 mg, mainly every 2 weeks (97.3%). Evolocumab compliance was high (92.3%).
Treatment with evolocumab was interrupted in 6 patients (3.2%), with only 1 (0.5%) due to a probable side effect. Evolocumab significantly reduced total cholesterol (30.9% at week 2, and 39.3% at week 12; P<.001), LDL cholesterol (44.4% and 57.6%, respectively; P<.001), and triglycerides (14.8% and 5.2%, respectively; P<001), with no significant changes in HDL-cholesterol (6.7% and 2.0%; P=.14).
ConclusionsIn clinical practice, evolocumab is associated with reductions in LDL cholesterol, with nearly 60% after 12 weeks of treatment, and with low rates of interruptions due to side effects and high medication compliance. These results are consistent with those reported in randomised clinical trials.
Las enfermedades cardiovasculares suponen la causa más importante de morbimortalidad en los países desarrollados, de la que la aterosclerosis es el factor clave subyacente. La hipercolesterolemia no es solo un factor de riesgo para el desarrollo de aterosclerosis, sino un factor etiológico principal1-3. La dislipidemia es muy frecuente en nuestro entorno, tanto en la población como, en particular, en los pacientes que ya han tenido un evento cardiovascular previo4. Se ha demostrado que la reducción del colesterol-LDL (c-LDL) con el tratamiento hipolipidemiante reduce el riesgo de presentar complicaciones cardiovasculares tanto en prevención secundaria como primaria, y que el riesgo de presentar un evento cardiovascular es menor cuanto más intensa sea esta reducción y más precoz sea1,3,5.
A pesar del tratamiento con estatinas o ezetimiba, la realidad es que, en la práctica clínica en España, menos de un 30% de los pacientes con cardiopatía isquémica logran alcanzar los objetivos de control de c-LDL. Aunque existen varios motivos, la inercia terapéutica (no intensificación del tratamiento hipolipidemiante a pesar de un control insuficiente), la intolerancia a las estatinas o ezetimiba o el fracaso en el control de c-LDL a pesar del tratamiento hipolipidemiante son las causas más frecuentes6-8.
Los inhibidores de la proproteína convertasa subtilisina kexina tipo 9 (PCSK9) reducen eficazmente el nivel de c-LDL y el riesgo de presentar eventos cardiovasculares9,10. En el estudio FOURIER, en pacientes con enfermedad cardiovascular aterosclerótica establecida, el tratamiento con evolocumab se tradujo en una reducción significativa de los eventos cardiovasculares10. Pero, dado que pueden existir diferencias importantes entre los pacientes incluidos en los ensayos clínicos y la práctica clínica, es imprescindible determinar si se mantiene la eficacia y la seguridad en los pacientes en la vida real11-13. Desafortunadamente, la información disponible en este momento sobre el papel de evolocumab en condiciones de práctica clínica diaria es escasa y con pocos pacientes14-19.
El estudio RETOSS-CARDIO (RETrospective Observational Study of Evolocumab Use in Spanish Cardiology Units), avalado por la Agencia Española de Investigación de la Sociedad Española de Cardiología, tenía el objetivo de analizar el perfil clínico de los primeros pacientes tratados en España con evolocumab, el efecto sobre el perfil lipídico y la seguridad del fármaco en el «mundo real» de los pacientes tratados en las unidades de cardiología hospitalaria20.
MétodosPara ello se elaboró un estudio multicéntrico, retrospectivo, observacional, de revisión de historias clínicas de pacientes que iniciaron tratamiento con evolocumab en unidades de cardiología hospitalaria en España en condiciones de vida real. El estudio se desarrolló durante los primeros años de la publicación del informe de posicionamiento terapéutico sobre evolocumab (marzo de 2016)21. Los hospitales se seleccionaron de acuerdo con 2 condiciones: distribución geográfica y tipo de hospital (pequeño: <200 camas; mediano: 200-500 camas; grande: >500 camas), con el objetivo de que la población fuese representativa de la población española atendida en diferentes modelos de unidades de cardiología.
Se llevó a cabo una revisión consecutiva de las historias clínicas de los pacientes atendidos en 31 centros de todo el territorio nacional entre el 1 de febrero de 2016 y el 15 de mayo de 2017. Todos aquellos pacientes que iniciaron tratamiento con evolocumab durante dicho periodo y que cumplieron con los criterios de inclusión/exclusión fueron incluidos en el estudio. Cada centro pudo incluir hasta un máximo del 10% de la muestra total, para asegurar una representatividad adecuada. Se incluyó a pacientes con al menos 18 años de edad en los que se prescribió evolocumab en el periodo referido, según el criterio clínico del facultativo responsable, que recibieran al menos una dosis de evolocumab, tuvieran al menos una medición de c-LDL en las 12 semanas previas al inicio de evolocumab y aceptaran participar en el estudio firmando el consentimiento informado. Se excluyó a aquellos pacientes que hubiesen recibido un inhibidor PCSK9 en las 12 semanas previas o que hubiesen sido incluidos en algún estudio clínico durante el tiempo de observación (desde 12 semanas antes del inicio del tratamiento con evolocumab hasta 12 semanas después). El estudio fue aprobado por el Comité Ético del Hospital Universitario La Paz.
Se recogieron los datos de manera retrospectiva desde las 12 semanas previas hasta 12 semanas posteriores al tratamiento y se registraron en un cuaderno de recogida de datos electrónico específicamente diseñado para el estudio. Se recogió la información sobre los datos biodemográficos (edad, sexo, estatus laboral), exploración física (índice de masa corporal, frecuencia cardiaca, presión arterial), factores de riesgo cardiovascular (hipertensión arterial, diabetes, hábito tabáquico, antecedentes familiares de enfermedad cardiovascular prematura, hipercolesterolemia familiar [HF]) y enfermedad cardiovascular (angina, infarto de miocardio, insuficiencia cardiaca, enfermedad arterial periférica, enfermedad renal crónica, enfermedad carotídea y enfermedad cerebrovascular).
Asimismo, se recogió información sobre el tratamiento hipolipidemiante previo al momento de iniciar evolocumab: estatinas, ezetimiba, fibratos, ácidos grasos omega 3 y resinas. Se caracterizaron las estatinas en función de su capacidad para reducir el c-LDL22, así como la presencia de intolerancia total o parcial al tratamiento con estatinas (con cuáles y a qué dosis). Se analizó el motivo del inicio, la forma de administración (autoadministración, dosis, frecuencia), retirada temporal o permanente y el cumplimiento terapéutico (buen cumplimiento si el número de administraciones era ≥80% del total de administraciones teóricas)23. Durante el periodo de tratamiento con evolocumab se examinó si había cambios en la medicación hipolipidemiante concomitante. También se recogieron las visitas rutinarias al médico en el año siguiente al inicio del fármaco y el médico especialista que hizó el diagnóstico inicial de la hipercolesterolemia.
Se recogieron parámetros analíticos sobre el perfil lipídico (colesterol total, c-LDL, c-HDL, colesterol no HDL y triglicéridos) basal (12 semanas previas), así como los resultados de aquellas analíticas que se hubiesen realizado al paciente durante las 12 semanas posteriores de acuerdo con la práctica clínica habitual de cada centro, agrupándose en 4 puntos: 2 semanas (datos obtenidos entre el día 1 y el 21 del inicio de tratamiento con evolocumab); 4 semanas (del día 22 al 35); 8 semanas (del día 36 al 63) y 12 semanas (del día 64 al 112). Se analizaron los cambios en los diferentes parámetros del perfil lipídico, comparando las cifras en los diferentes puntos de seguimiento (2, 4, 8 y 12 semanas) con los valores basales, tanto absolutos como relativos. Asimismo, se calculó el porcentaje de pacientes que alcanzaron cifras de c-LDL < 100mg/dL, c-LDL < 70mg/dL y c-LDL < 50mg/dL. Se analizaron los resultados en la población general y en función de si los pacientes tenían HF o se trataba de prevención primaria o secundaria3. En los casos de HF heterocigota y homocigota el diagnóstico fue genético. Se consideró HF indeterminada en los casos de mutación negativa y el diagnóstico clínico se basó en el criterio DLCN.
Análisis estadísticoLas variables cuantitativas se expresaron como media y desviación típica y las variables cualitativas como valores absolutos (n) y relativos (%). Los cambios en las variables del perfil lipídico a lo largo del estudio se expresaron tanto en términos absolutos como relativos, con un intervalo de confianza del 95%. Las variables cuantitativas (12 semanas vs. basal) se compararon mediante pruebas paramétricas (t de Student) o no paramétricas (U de Mann-Whitney), según las características propias de las variables en estudio (normalidad de las variables) y las variables cualitativas mediante la χ2 o el test exacto de Fisher, según el tamaño muestral.
ResultadosSe incluyó a un total de 186 pacientes. La edad media fue de 60,3 ± 9,8 años, el 72,0% eran varones y el índice de masa corporal medio fue 28,5 ± 4,3kg/m2. El 35,5% de los pacientes tenía HF. El 58,6% tenían hipertensión arterial, el 26,4% diabetes y el 94,1% un evento cardiovascular previo. El c-LDL medio antes del tratamiento fue 144,0 ± 49,0mg/dL (tabla 1). El diagnóstico de hipercolesterolemia lo hizo principalmente cardiología (59,7%), seguido de atención primaria (28,0%). En comparación con los pacientes sin HF, los pacientes con HF eran más jóvenes (61,9 ± 8,8 vs. 57,6 ± 10,9 años; p = 0,004), tenían menos hipertensión arterial (65,0 vs. 47,0%; p = 0,01) y menos diabetes mellitus (33,3 vs. 13,6%; p = 0,004). En comparación con los pacientes en prevención primaria, los pacientes en prevención secundaria eran más frecuentemente varones (45,5 vs. 73,7%; p = 0,04) y tenían menos HF (81,8 vs. 25,7%; p < 0,01) (tabla 2).
Características basales de los pacientes
| Variable | Total (n = 186) |
|---|---|
| Características biodemográficas | |
| Edad (años) n (%) | 60,3 ± 9,8 |
| ≤65 años | 122 (65,6) |
| 65-75 años | 54 (29,0) |
| >75 años | 10 (5,4) |
| Sexo (varón), n (%) | 134 (72,0) |
| Estatus laboral, n (%) | |
| Activo | 71 (38,2) |
| Desempleado | 9 (4,8) |
| Pensionista | 75 (40,3) |
| Otros | 31 (16,7) |
| Hipercolesterolemia no familiar, n (%) | 120 (64,5) |
| Hipercolesterolemia familiara, n (%) | 66 (35,5) |
| Heterocigota | 36 (19,4) |
| Homocigota | 4 (2,2) |
| Indeterminada | 26 (14,0) |
| Tiempo desde diagnóstico hipercolesterolemia familiar (años) | 10,7 ± 10,,9 |
| Prevención primaria (hipercolesterolemia familiar), n (%) | 11 (5,9) |
| Prevención secundaria, n (%) | 175 (94,1) |
| Colesterol LDL basal (mg/dL) n (%) | 144,0 ± 49,0 |
| <100 | 15 (8,1) |
| ≥100-<130 | 72 (38,7) |
| ≥130-<160 | 52 (28,0) |
| ≥160-<190 | 23 (12,4) |
| ≥190 | 24 (12,9) |
| Factores de riesgo cardiovascular | |
| Hipertensión arterial, n (%) | 109 (58,6) |
| Tiempo desde diagnóstico de hipertensión (años) | 8,5 ± 6,3 |
| Diabetes mellitus, n (%) | 49 (26,4) |
| Tipo 2 | 47 (25,3) |
| Tipo 1 | 2 (1,1) |
| Tiempo desde diagnóstico de diabetes (años) | 8,6 ± 10,4 |
| Fumador, n (%) | |
| Nunca | 59 (31,7) |
| Exfumador | 111 (59,7) |
| Activo | 16 (8,6) |
| Antecedentes familiares enfermedad cardiovascular, n (%) | 91 (48,9) |
| Enfermedad vascular | |
| Cardiopatía isquémica, n (%) | |
| Angina | 82 (44,1) |
| Infarto de miocardio | 122 (65,6) |
| Tiempo desde angina n (%) | 7,2±7,3 |
| >2 años | 54 (65,9) |
| Tiempo desde infarto n (%) | 7,3±6,7 |
| >2 años | 90 (73,8) |
| Insuficiencia cardiaca, n (%) | 19 (10,2) |
| Enfermedad arterial periférica, n (%) | 16 (8,6) |
| Enfermedad renal crónica, n (%) | 16 (8,6) |
| Enfermedad carotídea, n (%) | 10 (5,4) |
| Ictus, n (%) | 9 (4,8) |
| Exploración física | |
| Índice de masa corporal (kg/m2) n (%) | 28,5 ± 4,3 |
| Bajo peso (<18,5) | 1 (0,5) |
| Peso normal (18,5-24,9) | 19 (10,2) |
| Sobrepeso (grado I o II) (25,0-29,9) | 47 (25,3) |
| Obesidad grado I (30,0-34,9) | 26 (14,0) |
| Obesidad grado II (35,0-39,9) | 6 (3,2) |
| Obesidad mórbida (grado III o IV) (≥40) | 1 (0,5) |
| Sin datos | 86 (46,2) |
| Frecuencia cardiaca (lpm) | 66,1 ± 10,3 |
| Presión arterial sistólica (mmHg) | 131,6 ± 17,5 |
| Presión arterial diastólica (mmHg) | 76,6 ± 11,3 |
Características basales de los pacientes en función de la presencia de hipercolesterolemia familiar o de si es prevención primaria o secundaria
| Variable | Total (n = 186) | Hipercolesterolemia no familiar (n = 120) | Hipercolesterolemia familiar (n = 66) | p | Prevención primaria (n = 11) | Prevención secundaria (n = 175) | p |
|---|---|---|---|---|---|---|---|
| Características biodemográficas | |||||||
| Edad (años) | 60,3 ± 9,8 | 61,9 ± 8,8 | 57,6 ± 10,9 | 0,004 | 58,0 ± 9,5 | 60,5 ± 9,8 | 0,41 |
| Sexo (varón), n (%) | 134 (72,0) | 89 (74,2) | 45 (68,2) | 0,38 | 5 (45,5) | 129 (73,7) | 0,04 |
| Hipercolesterolemia familiar, n (%) | 66 (35,5) | 0 | 54 (81,8) | <0,01 | 9 (81,8) | 45 (25,7) | <0,01 |
| Exploración física | |||||||
| Índice de masa corporal (kg/m2) | 28,5 ± 4,31 | 28,3 ± 4,1 | 28,7 ± 4,6 | 0,54 | 28,4 ± 3,3 | 28,5 ± 4,4 | 0,94 |
| Frecuencia cardiaca (lpm) | 66,1 ± 10,3 | 66,0 ± 10,0 | 66,2 ± 10,9 | 0,90 | 76,4 ± 12,6 | 65,7 ± 10,1 | 0,001 |
| Presión arterial sistólica (mmHg) | 131,6 ± 17,5 | 129,2 ± 16,5 | 135,3 ± 18,4 | 0,02 | 130,2 ± 12,1 | 131,6 ± 17,7 | 0,78 |
| Presión arterial diastólica (mmHg) | 76,6 ± 11,3 | 76,5 ± 10,0 | 76,7 ± 13,2 | 0,91 | 80,4 ± 7,1 | 76,4 ± 11,4 | 0,25 |
| Factores de riesgo cardiovascular | |||||||
| Hipertensión arterial, n (%) | 109 (58,6) | 78 (65,0) | 31 (47,0) | 0,01 | 4 (36,4) | 105 (60,0) | 0,12 |
| Diabetes mellitus, n (%) | 49 (26,4) | 40 (33,3) | 9 (13,6) | 0,004 | 1 (9,1) | 48 (27,4) | 0,18 |
| Fumador, n (%) | |||||||
| Nunca | 59 (31,7) | 35 (29,2) | 24 (36,4) | 6 (54,5) | 53 (30,3) | ||
| Exfumador | 111 (59,7) | 76 (63,3) | 35 (53,0) | 0,38 | 5 (45,5) | 106 (60,6) | 0,35 |
| Activo | 16 (8,6) | 9 (7,5) | 7 (10,6) | 0 | 16 (9,1) | ||
| Enfermedad renal crónica, n (%) | 16 (8,6) | 11 (9,2) | 5 (7,6) | 0,92 | 0 | 16 (9,1) | 0,67 |
*Incluye pacientes diagnosticados de hipercolesterolemia familiar (N=54) y pacientes diagnosticados de hiperlipidemia familiar combinada (N=12)
En cuanto al tratamiento hipolipidemiante basal, el 53,8% de los pacientes estaba tomando estatinas (el 44,6% de alta intensidad; el 8,1% estatinas de moderada intensidad y el 1,1% de baja intensidad) y el 51,1% ezetimiba. El 50% presentaba intolerancia a las estatinas (total o parcial), con más frecuencia a la atorvastatina (74,2%), seguido de rosuvastatina (45,2%) y simvastatina (26,9%). La mediana de duración del tratamiento con estatinas de alta intensidad fue de 778 días (rango 288-1.520) y con ezetimiba de 763 días (rango 273-1.469) (tabla 3).
Tratamiento hipolipidemiante en el momento del inicio de evolocumab y tras él inicio del mismo
| Tratamiento hipolipidemiante en el momento del inicio de evolocumab | |
|---|---|
| Estatinas, n (%) | |
| Alguna estatina | 100 (53,8) |
| Alta intensidad | 83 (44,6) |
| Moderada intensidad | 15 (8,1) |
| Baja intensidad | 2 (1,1) |
| Ninguna | 86 (46,2) |
| Ezetimiba, n (%) | 95 (51,1) |
| Fibratos, n (%) | 11 (5,9) |
| Ácidos grasos, n (%) | 4 (2,2) |
| Resinas, n (%) | 2 (1,1) |
| Intolerancia a estatinas, n (%)a | 93 (50,0) |
| Atorvastatina | 69 (74,2) |
| Rosuvastatina | 42 (45,2) |
| Simvastatina | 25 (26,9) |
| Pitavastatina | 23 (24,7) |
| Pravastatina | 13 (14,0) |
| Fluvastatina | 4 (4,3) |
| Otras | 6 (6,5) |
| Tiempo intolerancia estatinas, n (%) | |
| ≤1 año | 38 (20,4) |
| 1-5 años | 36 (19,4) |
| >5 años | 15 (8,1) |
| Desconocido | 4 (2,1) |
| Criterios IPT que motivaron el inicio de evolocumab, n (%) | |
| Hipercolesterolemia familiar | 40 (21,5) |
| Enfermedad cardiovascular establecida | 146 (78,5) |
| Tratamiento hipolipemiante tras el inicio de evolocumab | |
|---|---|
| Estatinas, n (%) | |
| Inicio | |
| Estatinas de alta intensidad | 5 (2,7) |
| Estatinas de moderada intensidad | 4 (2,2) |
| Estatinas de baja intensidad | 1 (0,5) |
| Disminución de dosis | |
| Estatinas de alta intensidad | 1/74 (1,4) |
| Estatinas de moderada intensidad | 0 |
| Estatinas de baja intensidad | 0 |
| Retirada | |
| Estatinas de alta intensidad | 10/74 (13,5) |
| Estatinas de moderada intensidad | 5/12 (41,7) |
| Estatinas de baja intensidad | 0 |
| Ezetimiba, n (%) | |
| Inicio | 3 (1,6) |
| Retirada | 22 (22,4) |
| Evolocumab, n (%) | |
| Autoadministrado | 181 (97,3) |
| Dosis 140 mg | 186 (100) |
| Cada 2 semanas | 181 (97,3) |
| Cada 4 semanas | 5 (2,7) |
| Aumento/retirada dosis o interrupción temporal | 0 |
| Retirada permanente | 6 (3,2) |
| Voluntaria por el paciente | 5 (2,7) |
| Mialgias | 1 (0,5) |
| Cumplimiento adecuado | 153 (92,3) |
| Visitas en el año siguiente tras inicio evolocumab | 1,8 ± 1,5 |
En todos los casos la dosis empleada de evolocumab fue la de 140mg y casi en todos se administró cada 2 semanas (97,3%). A lo largo del seguimiento, no se modificó ni la dosis ni la pauta del fármaco en ningún paciente y solo en 6 pacientes (3,2%) se interrumpió el tratamiento, en 5 casos a petición del propio paciente (sin referir efectos secundarios) y en uno por mialgias (0,5%), sin llegar a demostrarse causalidad directa. El cumplimiento terapéutico fue adecuado en la gran mayoría de los pacientes (92,3%). Con respecto a la medicación hipolipidemiante concomitante una vez iniciado el tratamiento con evolocumab, tras 12 semanas de tratamiento se suspendió la ezetimiba en el 22,4% de los pacientes, las estatinas de alta intensidad en el 13,5% y las de moderada intensidad en el 41,7%. El número medio de visitas en el año siguiente tras inicio evolocumab fue de 1,8 ± 1,5 (tabla 3).
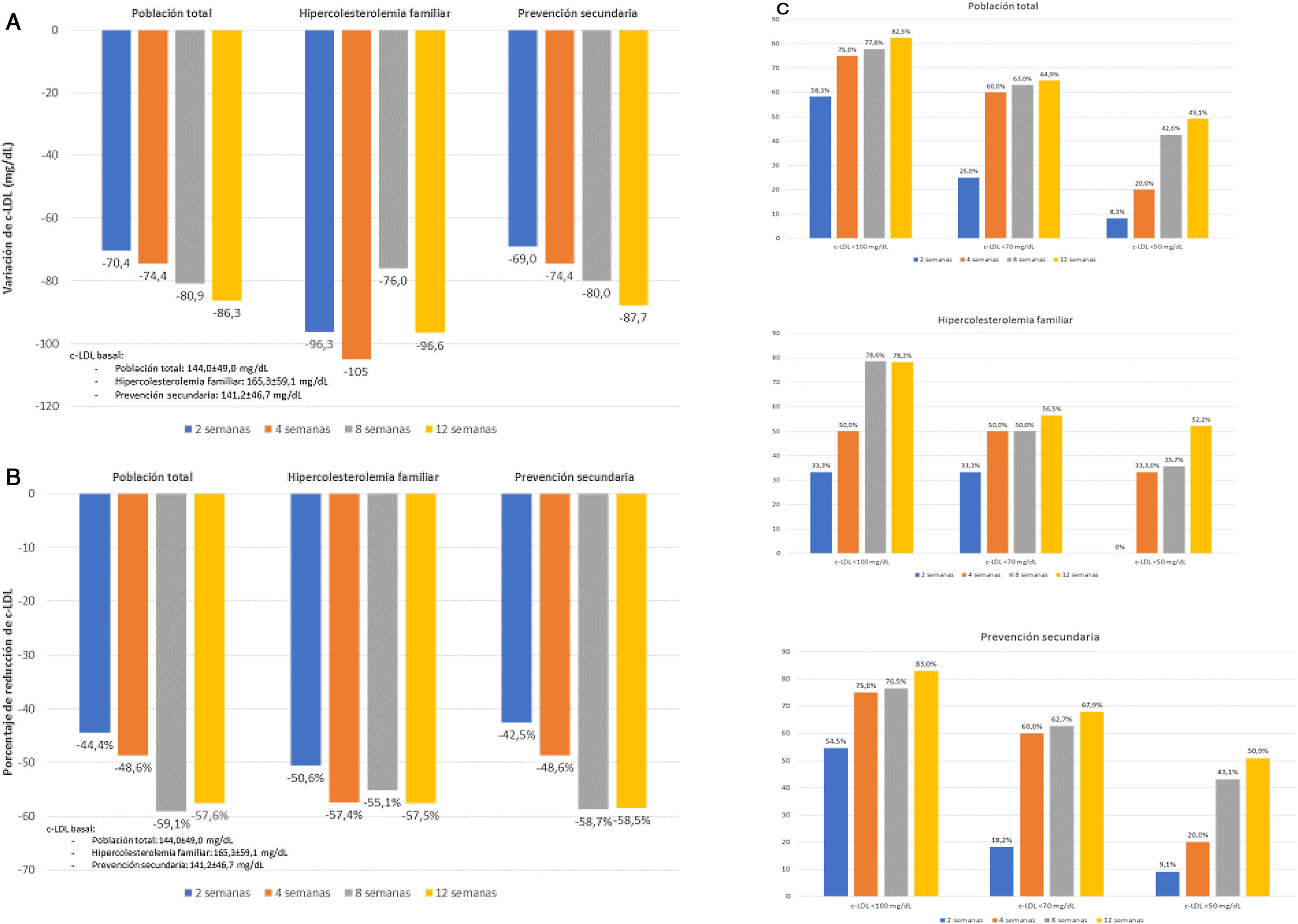
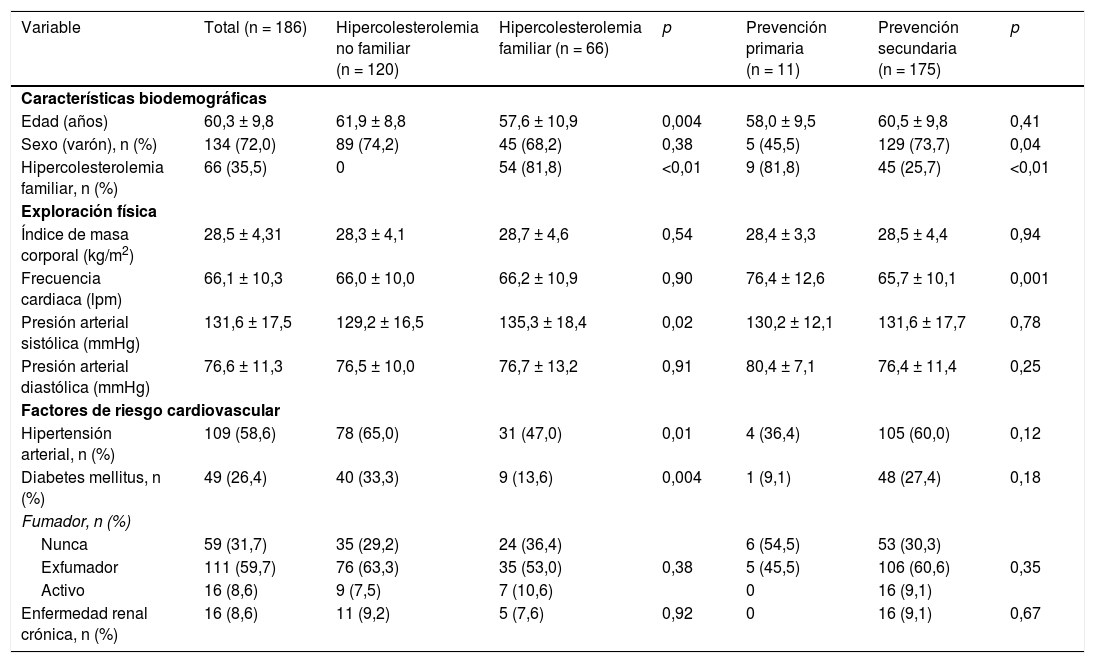
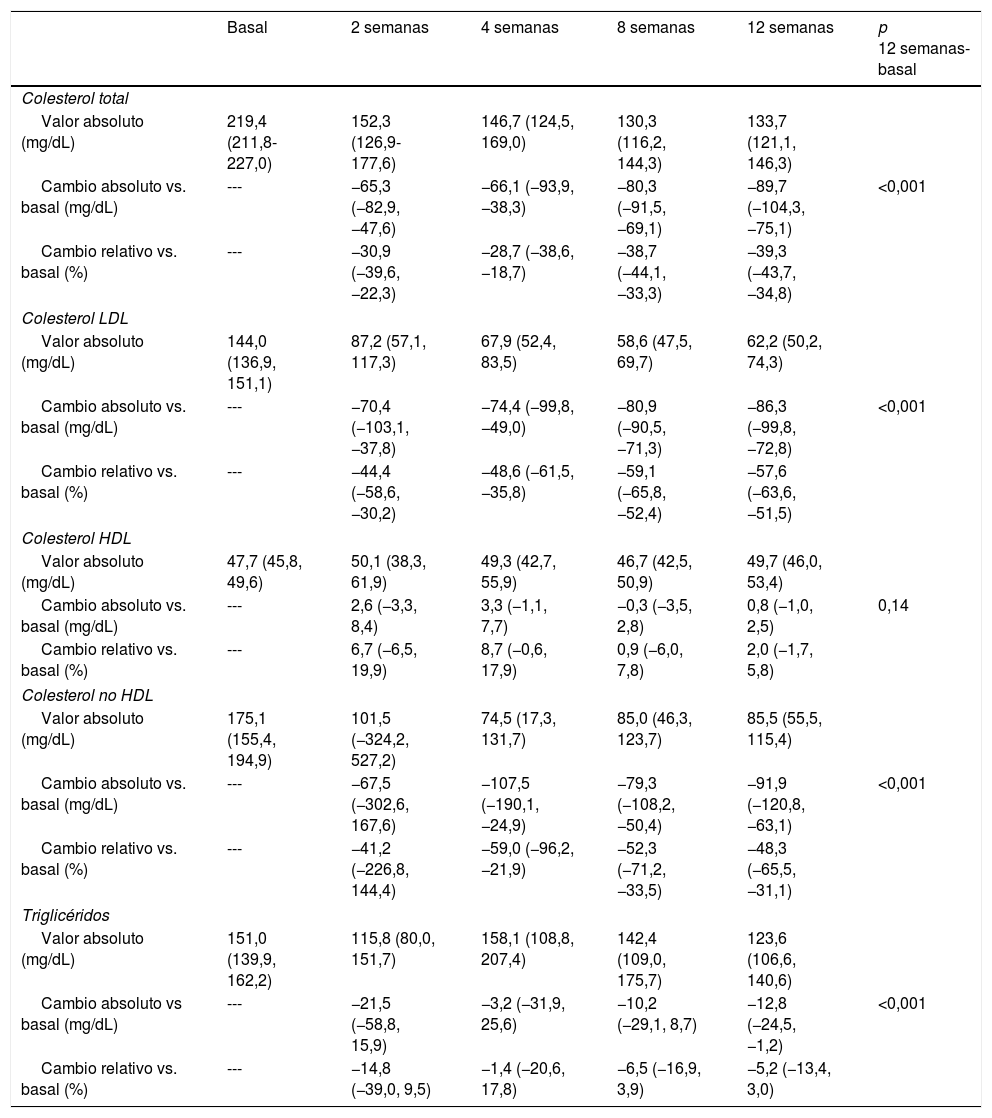
Las modificaciones del perfil lipídico durante el periodo de tratamiento se muestran en la tabla 4 y en la figura 1. El tratamiento con evolocumab se asoció con reducciones significativas del colesterol total (30,9% a las 2 semanas y 39,3% a las 12 semanas; p < 0,001), c-LDL (44,4 y 57,6%, respectivamente; p < 0,001), colesterol no HDL (41,2 y 48,3%; p < 0,001) y triglicéridos (14,8 y 5,2%; p < 0,001). El c-HDL no se modificó significativamente durante el seguimiento. Al final del seguimiento, el c-LDL < 100mg/dL, <70mg/dL y <50mg/dL se alcanzó en el 82,5; 64,9 y 49,1%, respectivamente. En el caso de los pacientes con HF, estos porcentajes fueron del 78,3; 56,5 y 52,2%, respectivamente y en prevención secundaria, del 83,0; 67,9 y 50,9%, respectivamente.
Evolución de los niveles de colesterol total, colesterol LDL, colesterol HDL, colesterol no HDL y triglicéridos durante el tratamiento con evolocumaba
| Basal | 2 semanas | 4 semanas | 8 semanas | 12 semanas | p 12 semanas-basal | |
|---|---|---|---|---|---|---|
| Colesterol total | ||||||
| Valor absoluto (mg/dL) | 219,4 (211,8-227,0) | 152,3 (126,9-177,6) | 146,7 (124,5, 169,0) | 130,3 (116,2, 144,3) | 133,7 (121,1, 146,3) | |
| Cambio absoluto vs. basal (mg/dL) | --- | −65,3 (−82,9, −47,6) | −66,1 (−93,9, −38,3) | −80,3 (−91,5, −69,1) | −89,7 (−104,3, −75,1) | <0,001 |
| Cambio relativo vs. basal (%) | --- | −30,9 (−39,6, −22,3) | −28,7 (−38,6, −18,7) | −38,7 (−44,1, −33,3) | −39,3 (−43,7, −34,8) | |
| Colesterol LDL | ||||||
| Valor absoluto (mg/dL) | 144,0 (136,9, 151,1) | 87,2 (57,1, 117,3) | 67,9 (52,4, 83,5) | 58,6 (47,5, 69,7) | 62,2 (50,2, 74,3) | |
| Cambio absoluto vs. basal (mg/dL) | --- | −70,4 (−103,1, −37,8) | −74,4 (−99,8, −49,0) | −80,9 (−90,5, −71,3) | −86,3 (−99,8, −72,8) | <0,001 |
| Cambio relativo vs. basal (%) | --- | −44,4 (−58,6, −30,2) | −48,6 (−61,5, −35,8) | −59,1 (−65,8, −52,4) | −57,6 (−63,6, −51,5) | |
| Colesterol HDL | ||||||
| Valor absoluto (mg/dL) | 47,7 (45,8, 49,6) | 50,1 (38,3, 61,9) | 49,3 (42,7, 55,9) | 46,7 (42,5, 50,9) | 49,7 (46,0, 53,4) | |
| Cambio absoluto vs. basal (mg/dL) | --- | 2,6 (−3,3, 8,4) | 3,3 (−1,1, 7,7) | −0,3 (−3,5, 2,8) | 0,8 (−1,0, 2,5) | 0,14 |
| Cambio relativo vs. basal (%) | --- | 6,7 (−6,5, 19,9) | 8,7 (−0,6, 17,9) | 0,9 (−6,0, 7,8) | 2,0 (−1,7, 5,8) | |
| Colesterol no HDL | ||||||
| Valor absoluto (mg/dL) | 175,1 (155,4, 194,9) | 101,5 (−324,2, 527,2) | 74,5 (17,3, 131,7) | 85,0 (46,3, 123,7) | 85,5 (55,5, 115,4) | |
| Cambio absoluto vs. basal (mg/dL) | --- | −67,5 (−302,6, 167,6) | −107,5 (−190,1, −24,9) | −79,3 (−108,2, −50,4) | −91,9 (−120,8, −63,1) | <0,001 |
| Cambio relativo vs. basal (%) | --- | −41,2 (−226,8, 144,4) | −59,0 (−96,2, −21,9) | −52,3 (−71,2, −33,5) | −48,3 (−65,5, −31,1) | |
| Triglicéridos | ||||||
| Valor absoluto (mg/dL) | 151,0 (139,9, 162,2) | 115,8 (80,0, 151,7) | 158,1 (108,8, 207,4) | 142,4 (109,0, 175,7) | 123,6 (106,6, 140,6) | |
| Cambio absoluto vs basal (mg/dL) | --- | −21,5 (−58,8, 15,9) | −3,2 (−31,9, 25,6) | −10,2 (−29,1, 8,7) | −12,8 (−24,5, −1,2) | <0,001 |
| Cambio relativo vs. basal (%) | --- | −14,8 (−39,0, 9,5) | −1,4 (−20,6, 17,8) | −6,5 (−16,9, 3,9) | −5,2 (−13,4, 3,0) | |
Este estudio analiza en una muestra amplia a los primeros pacientes que recibieron evolocumab en unidades de cardiología en España. De hecho, el informe de posicionamiento terapéutico se publicó en marzo de 201621. Los resultados más relevantes muestran que evolocumab produjo reducciones importantes del c-LDL, con pocos efectos secundarios, y que alcanzó los objetivos de control de c-LDL en un alto porcentaje de pacientes.
Aunque los resultados de los ensayos clínicos aleatorizados con evolocumab son muy relevantes10, lo cierto es que es muy importante conocer si esos resultados se pueden trasladar a la práctica clínica. Esto no es un tema menor, ya que varios estudios han determinado que, tanto en pacientes con HF como en prevención secundaria, un porcentaje importante de pacientes con dislipidemia va a requerir la terapia con inhibidores PCSK9 para lograr los objetivos de control de c-LDL recomendados en las guías24,25. Nuestro trabajo tiene el interés de ser el primer estudio de ámbito nacional de «vida real» con evolocumab realizado en nuestro país.
En el estudio FOURIER se incluyó a pacientes con enfermedad cardiovascular aterosclerótica, con una edad media de 62,5 años, que con frecuecia tenían otras comorbilidades. En cuanto al tratamiento hipolipidemiante, si bien aproximadamente el 69% de los pacientes tomaba estatinas de alta intensidad y el 30% de moderada intensidad, solo alrededor del 5% tomaba ezetimiba, con un c-LDL basal de 92mg/dL10. Sin embargo, dado que solo un porcentaje de pacientes en la práctica clínica cumplen los criterios de inclusión del estudio FOURIER12, son necesarios los estudios de «vida real» para completar la información proveniente de los ensayos clínicos. En nuestro estudio, la edad media de los pacientes fue de 60 años, la gran mayoría habían tenido un evento cardiovascular previo (94%) y un 35,5% tenían HF. En cuanto al tratamiento hipolipidemiante previo, el 54% tomaba estatinas (el 50% tenían intolerancia a las estatinas, total o parcial) y el 51% ezetimiba. La cifra tan elevada de intolerancia a las estatinas probablemente se deba a que se trata una población seleccionada, al ser de los primeros pacientes en tomar evolocumab. A pesar de que los pacientes llevaban de media más de 2 años tomando estatinas o ezetimiba, el colesterol medio basal era de 144mg/dL, muy lejos de los objetivos recomendados por las guías de práctica clínica3. En un reciente estudio retrospectivo realizado en España con menos de 100 pacientes tratados con inhibidores PCSK9 (56% con evolocumab), la edad media fue algo más joven (57 años), el 82% tenían cardiopatía isquémica, el 56% tomaba estatinas de moderada-elevada intensidad y el 52% ezetimiba. El c-LDL basal era de 159mg/dL14. En otro análisis retrospectivo de pacientes tratados con inhibidores PCSK9, aproximadamente un 35% de los pacientes no tomaba estatinas de manera concomitante16. Aunque al igual que en estos estudios, el grupo poblacional en el que con más frecuencia se prescribe evolocumab son los sujetos con cardiopatía isquémica, seguidos de aquellos con HF14,16, en nuestro trabajo hubo una mayor proporción de pacientes con HF, si bien la mayoría tenían enfermedad cardiovascular previa, y que no tomaban estatinas, muy probablemente porque nuestros pacientes fueron los primeros en ser tratados con evolocumab en unidades de cardiología en España. En cualquier caso, todos estos datos indica que, en la práctica clínica, existe un porcentaje significativo de pacientes que no toleran las estatinas o, al menos, solo a dosis bajas-intermedias, y que a pesar del elevado riesgo que tienen de presentar un nuevo evento cardiovascular, se suele empezar el tratamiento con evolocumab con unas cifras de c-LDL mucho más elevadas que las recomendadas por las guías, y después de esperar un tiempo probablemente demasiado largo con el tratamiento hipolipidemiante estándar, lo que expone a los pacientes a un riesgo elevado y hace que se retrase el beneficio potencial de este tipo de fármacos.
De acuerdo a la ficha técnica, 140mg de evolocumab cada 2semanas o 420mg una vez al mes está indicado en pacientes con hipercolesterolemia primaria, dislipidemia mixta o enfermedad cardiovascular aterosclerótica establecida; y en pacientes con HF homocigótica, 420mg una vez al mes y, si tras 12 semanas de tratamiento no hay un control adecuado, se puede titular a 420mg cada 2semanas26. En nuestro estudio en la gran mayoría de los pacientes se pautó 40mg de evolocumab cada 2 semanas (<3% cada 4 semanas) sin modificarlo durante el seguimiento. El cumplimiento terapéutico fue elevado (>92%) y solo 2 pacientes lo interrumpieron (0,5%) por efectos adversos, en línea con los resultados de los ensayos clínicos, y otros estudios de práctica clínica10,13,14,16,19,27-30. En un reciente estudio en pacientes intolerantes a las estatinas por problemas musculares, la tolerabilidad de evolocumab fue muy buena, en el que el tratamiento persistía en el 95% tras 2 años de seguimiento30, lo que indica que evolocumab se puede emplear de manera segura también en pacientes que no toleran otros fármacos hipolipidemiantes31. En consecuencia, este estudio de «vida real», al igual que otros previos, confirma la seguridad de evolocumab descrita en los ensayos clínicos en la práctica clínica diaria. Sin embargo, algún estudio ha mostrado que a largo plazo podría haber un mayor abandono con evolocumab, que no estaría en relación con la incidencia de efectos adversos o con una menor eficacia18, sino que sería causado por otros motivos, como barreras administrativas o la falta de concienciación de la importancia que tiene el descenso del colesterol en la reducción de los eventos cardiovasculares32-34.
Es interesante señalar que, en nuestro estudio, el tratamiento con evolocumab no supuso un aumento muy significativo de visitas al médico (1,8 de media en el año siguiente), y por lo tanto, no implicó un incremento relevante de la carga asistencial. En definitiva, lo realmente importante es hacer un esfuerzo para identificar qué pacientes se van a beneficiar más del tratamiento con inhibidores PCSK9, asegurar una adecuada adherencia a largo plazo y vencer las trabas administrativas mediante una organización asistencial adecuada32,33,35-37.
En cuanto a los efectos sobre el perfil lipídico, evolocumab se asoció con reducciones muy significativas del c-LDL, que ya se observaron de manera precoz (semana 2), que persistieron e incluso aumentaron en las siguientes semanas del tratamiento y que alcanzaron cerca del 60% a las 12 semanas, tanto en los pacientes con HF como en aquellos sujetos en prevención secundaria, con elevados porcentajes de control. Estas cifras son consistentes con las observadas en el estudio FOURIER10, así como en otros estudios en la práctica clínica13,14,17,27, lo que avala la alta eficacia de evolocumab para reducir las cifras de c-LDL, independientemente del contexto clínico. Llama la atención que, tras el tratamiento con evolocumab, hubo 15 pacientes a los que se retiró el tratamiento con estatinas, ya que la reducción de c-LDL sería menor que si se hubiesen mantenido y, por lo tanto, también el beneficio potencial, sobre todo teniendo en cuenta que no se han descrito efectos secundarios por descensos marcados de c-LDL10.
Este estudio tiene algunas limitaciones que conviene señalar. En primer lugar, las propias limitaciones del diseño retrospectivo, sin un grupo control. Sin embargo, precisamente es este tipo de diseños el que permite conocer de forma objetiva cómo se emplea una determinada alternativa terapéutica en la práctica clínica, sin que médico o paciente modifiquen sus pautas de actuación por estar participando en un estudio clínico. Por otra parte, no hubo imputación por los datos perdidos y los análisis se basaron solo en los datos observados. Para los pacientes con datos incompletos, las variables se incluyeron hasta la última observación recogida. No obstante, el elevado número de pacientes incluidos permite reducir notablemente la relevancia de esta posible limitación. Por último, para evitar posibles sesgos de selección, se incluyó a los pacientes de los centros participantes que iniciaron evolocumab entre el 1 de febrero de 2016 y el 15 de mayo de 2017 (periodo de reclutamiento), con un reclutamiento máximo por centro del 10%, para asegurar una adecuada representatividad de la muestra a nivel nacional.
En conclusión, el estudio RETOSS-CARDIO constituye el primer registro nacional de pacientes tratados con evolocumab en unidades de cardiología hospitalaria en España, con una muestra amplia y representativa de pacientes. La principal indicación del empleo de evolocumab fue la prevención secundaria, seguida de la HF. El tratamiento con evolocumab mostró reducciones del c-LDL muy marcadas durante el seguimiento, con una muy buena tolerabilidad y un alto cumplimiento terapéutico. Los datos de nuestro estudio confirman los resultados de diversos ensayos clínicos sobre el metabolismo lipídico, principalmente el estudio FOURIER, en la población con dislipidemia atendida en las diferentes unidades de cardiología en España.
FinanciaciónEl estudio fue patrocinado por Amgen España, que no ha influido en su desarrollo, y avalado por la Agencia Española de Investigación de la Sociedad Española de Cardiología.
Conflicto de interesesCecilia Roldán trabaja en Amgen España, si bien esto no ha influido en los resultados del estudio. El resto de autores ha recibido honorarios por ponencias/asesoría de Amgen