Evaluar el porcentaje de aclaramiento de la infección por el virus del papiloma humano (VPH) de alto riesgo en las mujeres sometidas a una conización cervical, así como analizar los genotipos de VPH más prevalentes en nuestro medio.
Material y métodosEstudio longitudinal, observacional, retrospectivo, descriptivo y analítico. Se revisaron las conizaciones realizadas en el Área 7 del Hospital Clínico San Carlos de Madrid entre octubre de 2015 y octubre de 2016.
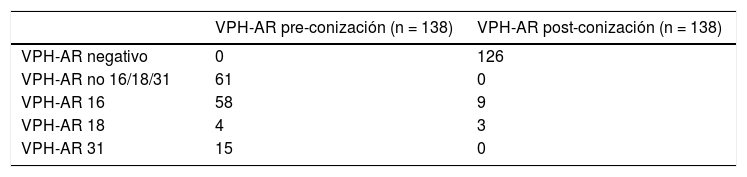
ResultadosDe 291 conizaciones practicadas durante 12 meses, se realizó determinación de VPH-AR pre-conización a 138 pacientes. En 247 pacientes la indicación del tratamiento escisional fue por resultado de biopsia HSIL/CIN 2-3, y en 44 por LSIL/CIN una persistente más de dos años. Sesenta y una de las 138 mujeres presentaron uno o varios VPH-AR distintos al 16/18/31 antes de la conización (61/138), mientras que en 77 pacientes se diagnosticaron VPH-AR 16/18/31 (77/138). Si desglosamos, el VPH 16 estuvo presente en 58/138 de los casos, el VPH 31 en 15/138 y el VPH 18 en 4/138. En el primer control post-conización, en 126 pacientes la determinación de VPH-AR fue negativa (126/138). El VPH 16 se aclaró en 49 pacientes (49/58), el VPH 31 en 15 (15/15) y el VPH 18 en uno (1/4).
ConclusionesEl genotipo 16 fue el VPH-AR más frecuente en mujeres conizadas en nuestro estudio, seguido por el 31 y el 18. Tras la conización cervical, se consigue un aclaramiento de la infección por VPH-AR en un 91,4% de las pacientes.
To evaluate the percentage of clearance of high-risk HPV infection in women undergoing cervical conization, as well as to analyse the most prevalent HPV genotypes in our environment.
Material and methodsLongitudinal, observational, retrospective, descriptive and analytical study. The conizations performed in Area 7 of the Hospital Clínico San Carlos in Madrid between October 2015 and October 2016 were reviewed.
ResultsOf 291 conizations over 12 months, pre-conization HPV-AR determination was made in 138 patients. In 247 patients the indication for excisional treatment was the result of biopsy HSIL/CIN 2-3, and in 44 for persistent LSIL/CIN 1 for more than 2 years. Sixty-one of the 138 women had one or more HPV-AR other than 16/18/31 prior to conization (61/138), while 77 patients were diagnosed with HPV-AR 16/18/31 (77/138). If we break it down, HPV 16 was present in 58/138 of cases, HPV 31 in 15/138 and HPV 18 in 4/138. In the first post-conization control, in 126 patients the determination of HPV-AR was negative (126/138). Clearance of HPV 16 was achieved in 49 patients (49/58), HPV 31 in 13 (13/15) and HPV 18 in 1 (1/4).
ConclusionsGenotype 16 was the most common HPV-AR in conized women in our study, followed by 31 and 18. After cervical conization, a clearance of HPV-AR infection was achieved in 91.4% of patients.
La infección por el virus del papiloma humano (VPH) es la enfermedad de transmisión sexual más frecuente a nivel mundial1.
El VPH es el agente causal de la práctica total de las neoplasias de cérvix, así como de sus lesiones precursoras2. Se ha encontrado que dos virus de alto riesgo oncogénico, 16 y 18, ocasionan el 70% de las lesiones cervicales invasivas y otros 10 explican el 25-35% de los casos restantes1,2.
El modelo de carcinogénesis cervical se basa en la persistencia de la infección por VPH como elemento necesario para el desarrollo de lesiones precursoras y cáncer. En los primeros años de vida sexual hay una elevada incidencia de infección, así como de aclaramiento viral. Se ha objetivado que más del 90% de las infecciones en mujeres jóvenes son transitorias e irrelevantes desde el punto de vista carcinogénico.
Por el contrario, en mujeres de mayor edad, sobre todo las mayores de 30 años tienen una menor prevalencia de infección por el VPH, pero mayor persistencia, por lo que aumenta el riesgo e incidencia de lesiones precursoras.
El cribado entre 30 y 65 años debe realizarse con una prueba de VPH clínicamente validada cada cinco años (opción preferente)1. La prueba de VPH ha demostrado, una mayor sensibilidad que la citología en función del umbral detección elegido (≥ a HSIL/CIN2 o ≥ a HSIL/CIN3) o del punto de corte de la citología (ASC-US o LSIL)3, aunque la especificidad se reduce respecto a la citología. Las pruebas de VPH validadas han demostrado una mejor reproducibilidad respecto a la citología4,5. Además, poseen un elevado valor predictivo negativo (VPN), cercano al 99%, en mujeres mayores de 30 años4,6.
El tratamiento de las lesiones intraepiteliales de alto grado (CIN2-3) es mayoritariamente quirúrgico, sin embargo, en algunos casos determinados también está aceptada la posibilidad de seguimiento sin tratamiento dada la tendencia de regresión espontánea7–9. Diferentes métodos permiten la escisión del tejido, siendo recomendable que la escisión se realice bajo control colposcópico para adaptarla al tamaño y características de la lesión10. El asa de diatermia es la técnica escisional más utilizada11.
Por ello, el objetivo de nuestro estudio ha sido evaluar el porcentaje de aclaramiento de la infección por el VPH de alto riesgo en las mujeres sometidas a una conización cervical en nuestro hospital, así como analizar los genotipos de VPH más prevalentes en nuestra serie.
Material y métodosEl estudio realizado es de tipo longitudinal, observacional, retrospectivo, descriptivo y analítico.
La población objeto del estudio está compuesta por las pacientes con citología sospechosa de infección por VPH y/o lesión escamosa intraepitelial (SIL) que fueron remitidas desde los Centros de Salud y de Especialidades del Área 7 de la Comunidad de Madrid a la Unidad de Patología Vulvo-Cervical del Hospital Clínico San Carlos de Madrid. Las citologías fueron realizadas a una población no seleccionada, dentro del cribado oportunista que se practica en la Comunidad de Madrid. Todas ellas fueron evaluadas en la consulta, realizando colposcopia, estudio de determinación de VPH y biopsia de las zonas sospechosas.
Para la descripción de los hallazgos colposcópicos se utilizó la nomenclatura la Clasificación de Rio 201112. Los citológicos, según el sistema de Bethesda.
La detección y tipado del virus del papiloma humano se realizó mediante método de ampliación genómica. La técnica de reacción en cadena de la polimerasa (PCR) se realiza mediante la extracción de ADN viral de las muestras procedentes de la toma endocervical.
En aquellas pacientes cuyas lesiones histológicas comprendieron lesiones intraepiteliales de alto grado o lesiones persistentes de bajo grado durante dos años, se practicaba conización con asa de diatermia o Large Loop Excision of the Transformation Zone (LLETZ). A los cuatro o seis meses, tras la conización, en función de los márgenes afectos, se le realizaba el primer control post-cono, con la práctica de co-test, junto con colposcopia y cepillado endocervical en caso de márgenes afectos.
Se creó una base de datos recopilando las pruebas realizadas, así como el diagnóstico final y el tratamiento aplicado. Se incluyeron 291 mujeres sometidas a una conización cervical, confirmando a las que se les había realizado determinación de VPH-AR (PCR) pre-conización y cuatro a seis meses después de la cirugía.
El análisis de los datos se ha realizado mediante el programa estadístico SPSS 22.0, empleándose la prueba de McNemar para analizar la relación entre la presencia de la infección por el VPH-AR pre y post-conización, considerándose estadísticamente significativa una p < 0,05.
ResultadosDeterminación de VPH antes de la conizaciónDe 291 conizaciones realizadas durante 12 meses, se practicó determinación de VPH-AR pre-conización a 138 pacientes, no obteniéndose ningún resultado negativo.
En 247 pacientes la indicación del tratamiento escisional fue por resultado de biopsia HSIL/CIN 2-3, y en 44 por LSIL/CIN uno persistente más de dos años.
Sesenta y una de las 138 mujeres presentaron uno o varios VPH-AR distintos al 16/18/31 antes de la conización (61/138), mientras que en 77 pacientes se diagnosticaron VPH-AR 16/18/31 (77/138) (tabla 1).
Si desglosamos, el VPH 16 estuvo presente en 58/138 de los casos, el VPH 31 en 15/138 y el VPH 18 en 4/138.
Determinación de VPH post-conizaciónDespués de la conización cervical a los cuatro o seis meses, en función de la afectación de los márgenes, se realizó la primera revisión después de la conización. En este primer control post-conización en 126 pacientes la determinación de VPH-AR fue negativa (126/138).
En concreto, el VPH 16 se aclaró en 49 pacientes (49/58), el VPH 31 en 15 (15/15) y el VPH 18 en una (1/4) (tabla 1).
ConclusionesEs conocido que la presencia del VPH es el factor de riesgo más importante para el desarrollo de la lesión intraepitelial cervical. La persistencia viral crónica es definitiva para la progresión hacia una lesión preinvasiva. El genotipo de VPH y su capacidad de progresión desde una lesión de bajo grado a una lesión de alto grado han sido estudiadas por diversos trabajos. Khan et al.13 encontraron en mujeres infectadas por un VPH-AR con citología inicial negativa, el 10% de las mujeres infectadas por VPH 16 o 18 presentaron CIN3 a los tres años y el 18-20% a los 10 años.
Sin embargo, la progresión a CIN 3 del resto de tipos virales fue del 1-2%. Por lo tanto, son los genotipos 16 y 18 los que presentan mayor riesgo.
En la literatura14, tanto en el mundo como en Europa y España el genotipo más frecuente en las pacientes que se someten a una conización es el VPH 16, coincidiendo con nuestro estudio. Después del VPH 16, en España los más frecuentes son: 31, 33, 52, 18, 58, 51, 35, 45. En nuestra serie se cumple la misma distribución cuando analizamos la infección por un solo genotipo, aunque cambia que el segundo más frecuente es el 31 y después el 18.
En el estudio de varias cohortes publicado por Kocken et al.15 se investigó la prevalencia del VPH antes de la conización y después de la conización y se realizó un seguimiento mínimo de las pacientes durante cinco años. El 93% de las pacientes tuvieron el VPH positivo pre-conización.
El más prevalente fue el VPH 16 (64%), seguido del VPH 31 (9%), el VPH 33 (11%) y el VPH 18 (9%). De las 399 mujeres positivas para el VPH, el 85% tuvo infección por un sólo genotipo. Nuestros resultados coinciden con este estudio en que el VPH 16 fue el más prevalente (41,8%), sin embargo, objetivamos que el segundo VPH-AR más frecuente fue el VPH 31 (11,2%) en lugar del VPH 33, y encontrando en último lugar el VPH 18 (3%).
En un estudio español de Garcia-Espinosa et al.16 realizado sobre 533 muestras con neoplasia cervical intraepitelial, analizado mediante estudio del VPH con PCR, se encontró una distribución del VPH 16 en el 26%, del VPH 31 en el 10%, del VPH 58 del 8% y del VPH 18 en el 5%.
En el trabajo de Alonso et al.17 el porcentaje de pacientes con VPH positivo después del cono fue de 32,5%. En el trabajo de Lubrano18 et al. el 25% de los pacientes presentaron el VPH positivo después de la conización. Ambos porcentajes de persistencia viral superiores al encontrado en nuestro estudio.
En el trabajo de Costa et al.19, donde la determinación de VPH fue realizada con PCR, la primera determinación de VPH fue positiva en el 70,6% y negativa en el 29,4%. El VPH 16 fue el genotipo hallado con mayor frecuencia, como en nuestra serie, estando sólo en el 50% de los casos de VPH positivo.
En el estudio de Houfflin Debarge20, un total de 34,6% de las pacientes tuvieron positivo el test de VPH después de la conización. El índice de persistencia del VPH varía entre el 6-61% dependiendo de los métodos usados para la detección del ADN de VPH, el tipo de tratamiento, el tiempo de tratamiento y evaluación21–24.
El genotipo 16 fue el VPH-AR más frecuente en mujeres conizadas en nuestro estudio, seguido por el 31 y el 18.
Tras la conización cervical, se consigue un aclaramiento de la infección por VPH-AR en un 91,4% de las pacientes, persistiendo tan sólo en un 8,6% de los casos, a diferencia de lo publicado en otras series como se ha discutido previamente, donde se describe un aclaramiento de aproximadamente un 70%. En la mayoría de los estudios revisados la escisión total de la lesión consigue la negativización del VPH en casi el 70% de las pacientes demostrada en la determinación inmediata post-conización o en el control de los seis a 12 meses posteriores25.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.