Para valorar la viabilidad y precisión de la técnica de SNOLL en la localización de microcalcificaciones mamarias malignas planteamos un estudio prospectivo observacional multicéntrico. Evaluamos la aplicación de la técnica y la evolución de las pacientes en un periodo de 10 años.
Materiales y métodosEntre 2007 y 2010, se reclutaron 64 pacientes. Todas las pacientes habían sido diagnosticadas de neoplasia de mama por microcalcificaciones en mamografía y fueron tratadas con cirugía conservadora y biopsia de ganglio centinela. Las inyecciones de tecnecio-99m se realizaron de forma preoperatoria, con una o varias punciones (en lesiones > 3,5 cm), guiadas por mamografía o ecografía. En todos los casos se realizó una linfogammagrafía preoperatoria para valorar la migración del radiotrazador y una mamografía intraoperatoria para valorar la correcta extirpación de la lesión.
ResultadosEn las 64 pacientes se realizó la inyección de radiotrazador y la linfogammagrafía demostró la correcta migración del contraste al ganglio centinela, permitiendo la exéresis de la lesión mamaria y del ganglio centinela en el 100% de los casos.
La mamografía intraoperatoria mostró la exéresis completa de la lesión en el 100% de los casos. La anatomía patológica mostró radicalidad en la primera cirugía en el 84,4% y supervivencia libre de enfermedad a los 10 años en el 84%.
ConclusiónLa técnica SNOLL es una técnica factible y precisa para la localización y tratamiento quirúrgico de microcalcificaciones malignas con supervivencia libre de enfermedad y porcentaje de recidiva comparable a otras técnicas. Asimismo, proponemos el afeitado sistemático de la cavidad para reducir la necesidad de reintervención.
To evaluate the feasibility and accuracy of the ROLL technique to localize malignant mammary microcalcifications and the risk of local recurrence, we performed a multicentre prospective observational study to assess the application of the technique and progress of patients with a 10year follow-up.
Materials and methodsBetween 2007 and 2010, 64 patients were recruited. All the patients had been diagnosed with breast neoplasm due to microcalcifications on mammography and were treated with conservative surgery and sentinel lymph node biopsy. A technetium-99m injection was performed preoperatively, with a single or several punctures (> 3.5 cm lesions), guided by mammography or by ultrasound. In all cases, we performed a preoperative lymphoscintigraphy, to assess contrast migration, and intraoperative mammogram to assess correct removal of the lesion.
ResultsIn the 64 patients, contrast injection could be confirmed, and lymphoscintigraphy proved correct migration of the contrast to the sentinel node, allowing excision of the mammary lesion and of the sentinel lymph node in 100%.
The intraoperative mammogram showed complete lesion excision in 100% cases. The pathology showed radicality in the first surgery of 84.4% and showed a disease-free survival of 84% at 10 years.
ConclusiónThe SNOLL technique (ROLL + SNB) is a feasible and accurate technique for the localization and surgical treatment of malignant microcalcifications with disease-free survival and a relapse rate comparable to the rest of the techniques. Likewise, we propose systematic cavity shave to reduce the need for reinterventions.
El excelente pronóstico de las neoplasias mamarias no palpables, que se detectan mayoritariamente gracias a los programas de cribado, depende de conseguir una localización óptima de las lesiones para su correcta escisión.
El desarrollo de la técnica SNOLL (ROLL: localización de lesiones ocultas radioguiadas + SN: ganglio centinela) permite la localización de la lesión mamaria y el estudio del ganglio centinela mediante un único acto de manipulación de la paciente.
A pesar de que hay múltiples artículos que validan la aplicación de la técnica de SNOLL1–10, la revisión bibliográfica no muestra artículos que valoren su aplicación en función de los hallazgos radiológicos.
La idoneidad de la técnica de SNOLL respecto a la guía metálica está validada en la mayoría de las lesiones mamarias, a excepción de aquellas lesiones mamarias malignas que debutaron como microcalcificaciones.
Por este motivo, nuestro objetivo es implementar y valorar la técnica SNOLL (ROLL + BGC) en microcalcificaciones mamarias malignas. Este artículo presenta la viabilidad de la técnica, los resultados quirúrgicos y la evolución de los pacientes tras un mínimo de ocho años de seguimiento.
Material y métodosCriterios de inclusiónSe inscribieron 64 pacientes entre 2007 y 2010 para realizar un estudio observacional prospectivo multicéntrico, incluyendo los cinco centros del área de influencia del Servicio de Medicina Nuclear del Hospital Universitari Germans Trias i Pujol (HUGTIP): HUGTIP (24 casos), Hospital de Mataró (14 casos), Hospital Sant Jaume de Calella (nueve casos), Hospital de l’Esperit Sant (ocho casos) y Hospital Municipal de Badalona (nueve casos). En cada hospital participaron entre dos y tres cirujanos.
Todas las pacientes habían sido diagnosticadas de neoplasia mamaria por microcalcificaciones mamográficas y fueron tratadas con cirugía conservadora y biopsia de ganglio centinela.
Técnica preoperatoriaLa inyección de 74 MBq de radiofármaco coloide con tecnecio-99m se realizó preoperatoriamente, con una única punción o distribuyendo la dosis en varios puntos de las lesiones extensas (> 3,5 cm). La punción fue guiada por mamografía analógica (MammoDiagnost UC, Philips Medical Systems, Eindhoven, Países Bajos) con un sistema estereotáctico (Cytoguide, Smith-Roentgen, Frankfurt, Alemania) o por ultrasonido (Sequoia 512, Imgegate, Acuson Corporation, Mountain View, CA, EE. UU.) con una sonda de 13 Mhz. Se utilizó como radiocoloide una molécula de estaño coloidal grande de 0,05 a 0,6 nm. En los casos de pacientes obesos, mayores de 60 años o en caso de detección con estereotaxia se utilizó en cambio una pequeña molécula de albúmina coloide < 80 m para mejorar la migración.
La linfogammagrafía preoperatoria se realizó al menos dos horas después de la inyección utilizando una cámara gamma CamStar (3000 BC/T, General Electric Company, Londres, Reino Unido) para localizar el nódulo mamario y el ganglio centinela.
Técnica quirúrgicaEl acto quirúrgico se realizó entre las tres y las 22 h posteriores a la inyección. En todos los casos, se realizó un procedimiento quirúrgico conservador estándar para el tratamiento del cáncer de mama con la paciente bajo anestesia general.
La incisión mamaria cutánea se realizó en el hotspot detectado por una sonda gamma portátil (Navigator GPS, USSC-Tyco, Norwalk CT, EE. UU.) con un detector de 11 mm. La actividad se revisó sistemáticamente en los cuatro cuadrantes, se confirmó la eliminación completa más allá del foco de actividad. Tras la eliminación de la lesión, se comprobó el tejido restante con la sonda gamma para extraer cualquier foco de actividad residual (> 10% de la actividad máxima encontrada en la pieza). Se utilizó la misma técnica para detectar el ganglio centinela, utilizando la misma incisión mamaria o una incisión separada según la localización de la lesión.
Tras la biopsia del ganglio centinela, la pieza resecada se envió al Servicio de Patología para valoración intraoperatoria. En aquellos casos en los que la biopsia intraoperatoria del ganglio centinela fue positiva, se realizó linfadenectomía axilar en el mismo procedimiento quirúrgico, siguiendo el protocolo habitual en nuestro centro en aquel momento.
La pieza de tumorectomía se orientó espacialmente y se envió al Servicio de Radiología, donde se realizó una radiografía para confirmar la inclusión de la neoplasia en la muestra extirpada. En aquellos casos en los que la radiografía de la pieza quirúrgica mostró que alguno de los márgenes era inferior al protocolizado (menos de 10 mm en radiología), se realizó una nueva resección de tejido mamario, sin esperar la confirmación patológica de la afectación de estos. Además, si el cirujano detectaba áreas sospechosas mediante la palpación, los márgenes también se ampliaban. Se referenciaron los márgenes ampliados y se marcó con puntos de sutura el área de contacto del nuevo tejido extirpado con la lesión neoplásica.
SeguimientoSe realizó seguimiento de todos los casos tras la cirugía según el protocolo habitual.
En aquellos casos en que alguna paciente demoraba sus controles médicos, se contactaba con ella telefónicamente o se buscaban sus datos en el sistema informático del sistema nacional de salud.
Recogida y análisis de datosLas variables de estudio analizadas se dividen en:
- 1)
Datos relativos a la localización de la lesión no palpable (lateralidad, método diagnóstico y método de localización) y medida de los hallazgos radiológicos (tamaño en el diagnóstico mamográfico/ecográfico, realización o no de resonancia magnética [RM] y tamaño de la lesión en RM, correlación entre tamaño por resonancia y mamografía). Los resultados se reflejan en la tabla 1.
Tabla 1.Características radiológicas de la lesión
Edad (años) 54,63 (52-57,25) Lateralidad (%) Derecha 48,4% Izquierda 51,6% Método diagnóstico (%) PAAF 6,3% BAG 93,8% Método de administración de radiotrazador Estereotaxia 73,4% Ecografía 26,6% Tamaño por mamografía 21,58 mm (5-55) Tamaño por RMN 20,5 mm (0-52) Correlación entre tamaño por RMN y mamografía correlación 0,309 significación 0,185 BAG: biopsia con aguja gruesa; PAAF: punción con aguja fina; RMN: resonancia magnética nuclear.
- 2)
Datos quirúrgicos (tasa de localización de la lesión, consecución de márgenes quirúrgicos correctos, necesidad de operaciones posteriores y necesidad de mastectomía) y datos relacionados con la biopsia de ganglios linfáticos (tasa de detección, número de ganglios por paciente, ubicación del ganglio centinela, necesidad para linfadenectomía, y los resultados de la misma). Los resultados se reflejan en la tabla 2.
Tabla 2.Resultados quirúrgicos respecto a la lesión mamaria
Índice de localización de la lesión 100% Logro de márgenes correctos en tumorectomía inicial 30 (46,87%) Logro de márgenes correctos en primera cirugía 54 (84,4%) Necesidad de segunda cirugía - Innecesaria 55 (85,9%) - No hallazgos de malignidad 4 (6,3%) - Hallazgo de malignidad 5 (7,8%) Necesidad de mastectomía 2 (3.125%) - 3)
Datos anatomopatológicos de la lesión y del ganglio centinela (histología en la biopsia diagnóstica, histología en la pieza quirúrgica, tamaño de la lesión, índice de concordancia entre el tamaño de la lesión y tamaño en la mamografía, tamaño de la pieza quirúrgica y estadio tumoral). Los resultados se reflejan en la tabla 3.
Tabla 3.Resultados estudios axilar y anatomopatológicos
Índice de detección ganglionar gammagrafía/cirugía 100%/100% Número de ganglios/caso 1-3 (1,4) Adenopatías extraaxilares 0 Ganglio centinela no afectado 54 (83,1%) Micrometástasis en ganglio centinela 4 (6,2%) Macrometástasis en ganglio centinela 6 (9,4%) Linfadenectomía Núm. casos 8 casos N1/N2 /N3 8 casos (4 solo GC)/0 casos/ 0 casos Histología en cirugía / biopsia CDIS 30 (46,9%)/24 (40,7%) CDI 2 (3,1%)/8 (13,6%) CDIS + CDI 28 (43,8%)/15 (25,4%) CLI 2 (3,1%)/0 Otros 2 (3,1%)/12 (20,3%) Volumen pieza quirúrgica, cc (X x Y x Z) 130 cc (18-512 cc) Volumen total primera cirugía, cc 144,75 (18-515) Tamaño tumoral (mm) 18,20 (3-60) Índice de concordancia entre tamaño de la lesión y tamaño en la mamografía t = 1.138 gl = 46 p = 0,261 Estadio tumoral Estadio 0 21 (32,8%) Estadio I 27 (42,18%) Estadio IIA 13 (20,3%) Estadio IIB 3 (4,6%) Estadio IIIA 0 CDI: carcinoma ductal infiltrante; CDIS: carcinoma ductal in situ; CLI: carcinoma lobulillar infiltrante.
- 4)
Datos de seguimiento (en caso de muerte, causa y fecha de la muerte; cualquier resultado: recaídas locales, metástasis o un segundo cáncer de mama). Los resultados se reflejan en las tablas 4 y 5.
Tabla 4.Revisión exitus
Márgenes en primera cirugía Necesidadsegunda cirugía Causa de exitus Supervivencia (meses) Caso 4 Ampliados sanos No Cáncer de recto 27 m Caso 5 No ampliado No Glioblastoma 73 m Caso 13 Ampliados sanos No Colitis isquémica 120 m Caso 35 Ampliados afectos/ márgenes definitivos correctos No Síndrome mielodisplásico 36 m Caso 46 Ampliados sanos No Cáncer de mama 48 m Caso 51 Ampliados sanos No Supuesto (86 años) 12 m Tabla 5.Revisión recidivas
Márgenes en primera cirugía Necesidadsegunda cirugía TNM recidiva Situación actual Caso 10 Ampliados sanos No pT1cN0 3 años tras DX → mastectomía 7 años LE Caso 23 no ampliado No pTisN0 7 años tras DX → angiosarcoma radioinducido Enfermedad en progresión Caso 42 Ampliados sanos No pT1bN0 6 años tras DX → recidiva local + metástasis Enfermedad en progresión Caso 64 Ampliados afectos/márgenes definitivos correctos No pT1bN1mic 10 años tras DX → cáncer de mama izquierda2 años tras estudio → recidiva cáncer de mama izquierda Enfermedad en progresión LE: libre de enfermedad.
El análisis estadístico se realizó con el paquete estadístico SPSS versión 19 para Windows (IBM Corp., Armonk, NY, EE. UU.).
Se realizó un estudio descriptivo de los datos, incluyendo una evaluación de la asociación entre las variables mediante la prueba de χ2 con corrección de Fisher entre variables cualitativas, y prueba t de Student con corrección en función de varianza para la comparación entre cualitativa y cuantitativa. variables. La significación estadística se marcó en el valor p de menos de 0,05 para todos los análisis.
ResultadosTécnica preoperatoriaEn nuestro estudio, las 64 pacientes incluidas pudieron ser inyectadas en un solo acto radiológico, con la administración del todo el contraste en una única inyección en las lesiones de tamaño moderado o varias inyecciones en puntos alejados en los casos de lesiones extensas.
En todos los casos se pudo confirmar la inyección de contraste intralesional, y en todos los casos la linfogammagrafía demostró una correcta migración del contraste al ganglio centinela.
Se pudo realizar la escisión de la lesión mamaria y del ganglio centinela en el 100% de los casos, por lo que consideramos que la técnica de SNOLL es factible para la localización de las lesiones que debutan como microcalcificaciones.
Técnica quirúrgica y hallazgos anatomopatológicosLa verificación radiológica de la pieza quirúrgica mostró la resección completa de las microcalcificaciones en todos los casos, por lo que consideramos que con la técnica SNOLL logramos una tasa de detección de lesión del 100%, por lo que el ROLL en estos casos es una técnica precisa.
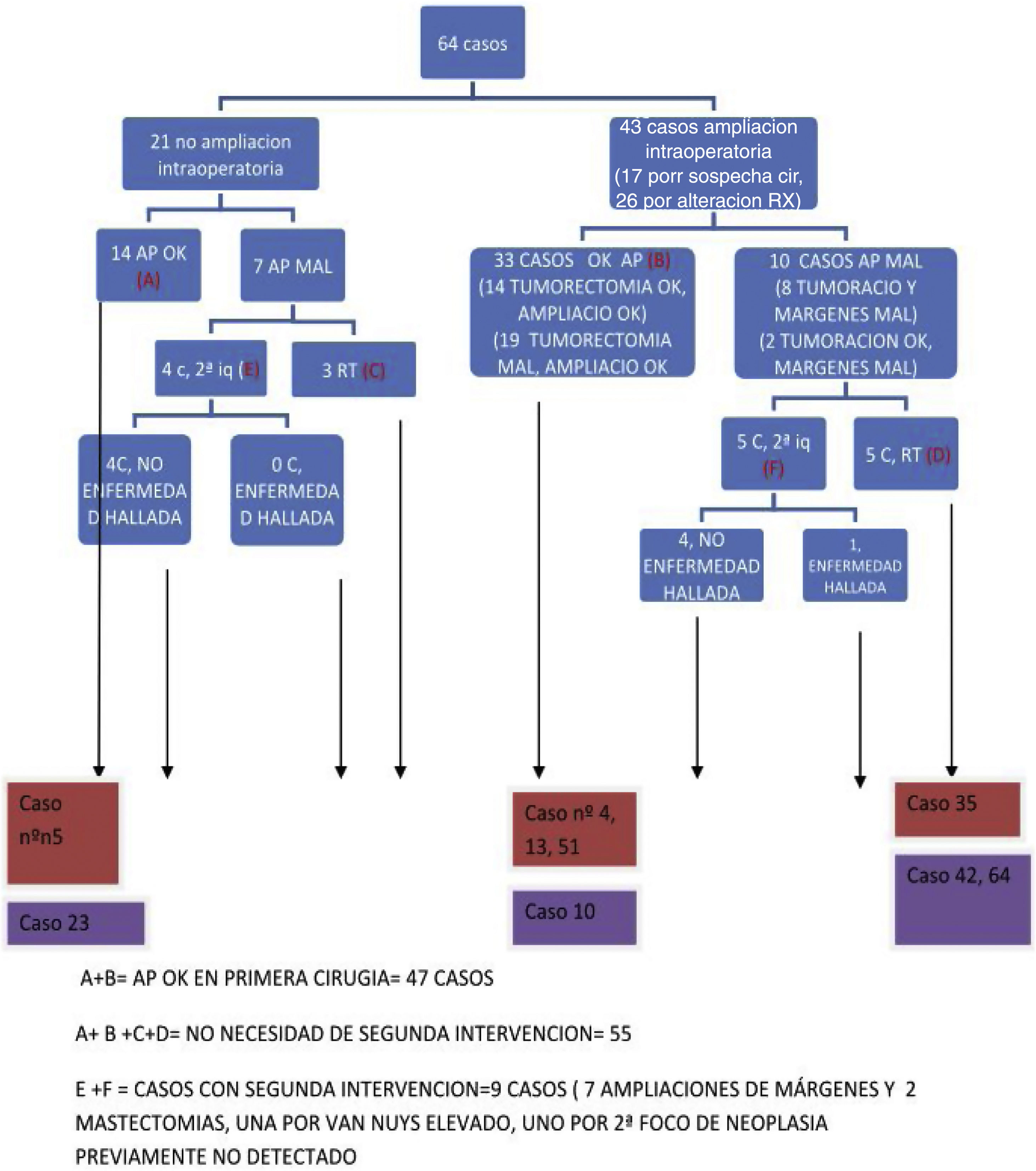
En 43 casos se realizó una reescisión intraoperatoria del margen en el mismo acto quirúrgico, por indicación radiológica (26 casos), o a criterio del cirujano en función de los hallazgos quirúrgicos (17 casos). En 21 casos, no se realizó una reescisión del margen en la primera cirugía.
De los 43 casos con ampliaciones intraoperatorias, en 33 casos, el estudio histológico no halló afectación por células malignas, mientras que en los otros 10 casos los márgenes presentaban afectación por células malignas. De los 21 casos en los que no se realizó reescisión de márgenes, en 14 casos la tumorectomía alcanzó la radicalidad en la primera intervención.
Se indicó una segunda intervención en nueve casos. En siete7 casos se ampliaron los márgenes y en dos casos se realizó mastectomía: uno por DCIS con índice de Van Nuys de 10 y el otro por detección de un nuevo foco de neoplasia no detectado previamente. (fig. 1).
Por tanto, la aplicación de la técnica SNOLL (ROLL + BGC) para la exéresis de microcalcificaciones malignas consiguió radicalidad quirúrgica en la primera cirugía en el 86% de los casos con una tasa de reintervención del 14%.
La tasa de detección del ganglio centinela fue del 100%, identificando entre uno y tres ganglios por caso, todos ellos localizados a nivel axilar ipsilateral. Cabe destacar que el 84% de los ganglios linfáticos no mostró afectación. En seis casos (9,3%) se realizó linfadenectomía en el primer acto quirúrgico; en dos casos (3%) se realizó linfadenectomía en un segundo tiempo quirúrgico por micro afectación, mientras que en otros dos casos con microafectación se descartó linfadenectomía.
Los resultados no mostraron diferencias significativas estratificándolos, ni según la histología (lesiones infiltrantes y no infiltrantes), ni según la forma de presentación radiológica (microcalcificaciones aisladas o asociadas a otra lesión).
SeguimientoLos 64 casos incluidos se han seguido durante 10 años para evaluar los resultados a largo plazo.
En el momento de la revisión, 58 pacientes sobreviven a los 10 años de la cirugía, 54 pacientes no habían presentado ningún evento en los 10 años de control postoperatorio.
De las pacientes que presentaron eventos en el control:
- •
Un caso presentó recidiva local a los tres años de la primera cirugía, fue tratada con cirugía radical (mastectomía) y actualmente está libre de enfermedad.
- •
Dos casos presentan en la actualidad progresión de la enfermedad: una recidiva local y una metástasis ósea.
- •
Una paciente está en tratamiento por angiosarcoma radioinducido ispilateral a la neoplasia inicial.
- •
Seis casos fueron exitus en el periodo de control: uno de ellos por neoplasia mamaria, otro por isquemia intestinal en una paciente de edad avanzada, un caso se presume fallecido por tratarse de una paciente de edad muy avanzada que abandonó controles y no pudo ser localizada, las tres pacientes restantes fallecieron por tumores malignos de diferentes estirpes.
Estos resultados implican una supervivencia libre de enfermedad de 10 años del 84%, con una mortalidad del 9% en un solo caso directamente atribuible a la neoplasia de mama (presentó dos recidivas locales y metástasis a distancia siendo exitus cuatro años después del primer tratamiento. Cinco pacientes (incluido el fallecido) presentaron recidiva local asociada o no a enfermedad a distancia (7,8%). Estos resultados también se estratificaron según la histología y la imagen radiológica sin observar diferencias estadísticamente significativas. No pudimos valorar los resultados en base a la clasificación molecular, que podría haber aportado información y tratamientos más específicos que podrían haber modificado la historia natural de la enfermedad. Cabe señalar que no existió relación entre la afectación de márgenes y las recurrencias posteriores, por lo que concluimos que estas recurrencias no estaban relacionadas a los resultados del tratamiento local realizado en tales casos.
DiscusiónEl diagnóstico y el tratamiento del cáncer de mama están evolucionando para mejorar la supervivencia y reducir la morbilidad de la principal causa de muerte por cáncer entre las mujeres en todo el mundo10.
Gracias a la optimización de las técnicas de cribado, un tercio de estas neoplasias no son palpables, coincidiendo con estadios tempranos del cáncer, en el momento del diagnóstico, permitiendo una mayor supervivencia de los pacientes, pero complicando su correcta localización en el acto quirúrgico.
La que durante años se consideró la técnica gold standard, la localización mediante guía metálica, ha sido sustituida en un número significativo de casos por la técnica ROLL desarrollada por el Instituto Europeo de Oncología de Milán11 Múltiples estudios indican que la técnica ROLL es superior a la guía porque permite la localización del tumor y el ganglio centinela en un solo acto y disminuye el tiempo de localización, lo que conlleva una mejora en la comodidad del paciente1–9,11–13.
A pesar de los múltiples resultados a favor de la técnica ROLL, una revisión sistemática no encontró estudios que evalúen su aplicación en el subgrupo de pacientes que presentan microcalcificaciones en la mamografía.
El estudio de las microcalcificaciones conlleva dificultades adicionales: las microcalcificaciones no son visibles por ecografía, frecuentemente no están relacionadas con un nódulo identificable y, aunque tienden a presentarse en carcinomas in situ, suelen atribuirse a casos con mayor agresividad del subtipo comedón y, en el carcinoma infiltrante, con tumores de alto grado y mal pronóstico. Algunos estudios identifican las microcalcificaciones mamográficas como factor de riesgo (p < 0,0001) de márgenes positivos de la mama.
Asumimos que para conseguir un tratamiento óptimo es muy importante disponer de toda la información posible sobre la extensión de la lesión. Para completar el estudio preoperatorio y minimizar los márgenes afectados, se suele realizar una resonancia magnética. En este estudio, la resonancia magnética se realizó en solo 20 casos porque no estaba disponible en todos los centros participantes.
El hecho de que las lesiones estén mal delimitadas y en ocasiones extensas comprenden los principales riesgos de la aplicación de la técnica ROLL: que el radiotrazador no delimitará la lesión a extirpar o ni siquiera migrará al ganglio centinela.
La linfogammagrafía preoperatoria muestra la ubicación del radiotrazador en ambos campos quirúrgicos, por lo que ninguna de estas complicaciones ocurrió en este estudio.
Para evitar la necesidad de una segunda cirugía en aquellos casos en que se detectaron márgenes positivos, se implementaron un conjunto de medidas de seguridad:
- •
Se verificó la resección de toda actividad nuclear residual significativa.
- •
Se verificó la resección de toda la lesión sospechosa a criterio del cirujano.
- •
Se verificó la extirpación completa de todas las calcificaciones sospechosa con la realización de mamografía intraoperatoria.
No se realizó estudio citológico intraoperatorio de márgenes dada su baja sensibilidad en estos casos.
Con todas estas medidas de seguridad, logramos márgenes libres en 47 pacientes (73%), y 55 casos (86%) se resolvieron mediante cirugía única. La diferencia en ambos números se debe a los pacientes tratados con radioterapia. En nuestra experiencia, la tasa de reintervención SNOLL fue del 14%, similar a las descritas en la literatura.
La baja sensibilidad (31%) y especificidad (37%) que muestra la mamografía intraoperatoria para confirmar márgenes oncológicamente seguros nos hace abogar por el afeitado cavitario sistemático de los márgenes14–16 de toda la superficie de contacto, pero sin requerir un gran volumen, lo que no conlleva un aumento significativo en la cantidad de mama resecada.
Consideramos que la necesidad de ampliar los márgenes está relacionada con las características intrínsecas de las lesiones con microcalcificaciones. En estos casos, la extensión de la afectación histológica a menudo va más allá de la imagen mamográfica y requiere una exéresis amplia, independientemente de la técnica de localización. Hay que recordar que estudios multicéntricos otorgan un riesgo de recidiva que se multiplica por dos en caso de márgenes afectos, considerando que este riesgo no se corrige con la aplicación de radioterapia adyuvante.
Sin embargo, cabe recordar que los últimos estudios consideraron margen libre de carcinoma ductal infiltrante (CDI) cuando el cáncer no está en contacto con la tinta, y los márgenes libres de carcinoma ductal in situ (CDIS) necesitan más de 2 mm entre cáncer y tinta17,18. Sin embargo, en nuestro estudio consideramos que los márgenes libres fueron de 2 mm en CDIS y de 10 mm en CDI, por lo que aplicando el protocolo actual nuestro porcentaje de márgenes libres habría sido aún mayor.
En cuanto al estudio del ganglio centinela, en todos los casos se detectaron entre uno y tres ganglios linfáticos, todos a nivel axilar. Entonces, el SNOLL tuvo éxito en el 100% de los casos en la identificación del ganglio centinela. Se realizó linfadenectomía en seis casos; sin embargo, en todos los pacientes en la actualidad no se habría realizado la linfadenectomía aplicando los criterios del estudio ACOSOG Z011 como lo hacemos actualmente19–21.
El tamaño de las lesiones (mayor diámetro en mm) en el análisis anatomopatológico correspondió al observado en las pruebas de diagnóstico por imagen (mamografía y ecografía) (mayor diámetro en mm) y al volumen total extirpado en la pieza quirúrgica (volumen calculado mediante la tres dimensiones indicadas en el resultado de la anatomía patológica). Los volúmenes mamarios extirpados y la relación entre estos y las dimensiones histológicas y radiológicas son comparables a los descritos en la literatura.
La principal preocupación en cuanto a la afectación de los márgenes es la repercusión que tiene en la supervivencia de los pacientes y la aparición de recaídas. Para evaluar la evolución de los pacientes tratados con la técnica SNOLL, programamos el seguimiento durante 10 años. La tasa de supervivencia esperada entre nuestros pacientes, todos ellos con cáncer en estadio temprano, es de aproximadamente el 99%21. La tasa de supervivencia global observada en este estudio fue del 91% y la tasa de supervivencia específica de la enfermedad fue del 98,5%. Así pues, la aplicación SNOLL no afecta la supervivencia de los pacientes.
Todo esto nos lleva a concluir que la técnica SNOLL permite la localización precisa tanto del ganglio centinela como de la lesión mamaria sin resecar en exceso el tejido mamario sano y los consiguientes efectos sobre la seguridad oncológica a largo plazo.
ConclusiónPor todo lo anterior, creemos que la técnica SNOLL es una técnica factible y precisa para la localización y tratamiento quirúrgico del cáncer de mama diagnosticado como microcalcificaciones con supervivencia libre de enfermedad y un porcentaje de recidivas comparable al resto de técnicas. La aplicación de cualquier técnica en la detección de lesiones no palpables requiere una mamografía intraoperatoria para confirmar la extirpación completa de la lesión. Asimismo, proponemos la posibilidad de ampliar sistemáticamente los márgenes de la tumorectomía (shaving cavity) para reducir la necesidad de reintervenciones incluso a expensas de un aumento mínimo del tejido mamario extirpado.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.