La determinación de cortisol sérico los primeros días tras la cirugía hipofisaria ha demostrado predecir la insuficiencia adrenal (IA) posquirúrgica. Sin embargo, es controvertida la conveniencia de administrar empíricamente glucocorticoides (GC) para prevenirla. El objetivo es analizar la utilidad del cortisol en el postoperatorio temprano como predictor de la función corticotropa a largo plazo, siguiendo el protocolo periquirúrgico hipofisario con reemplazo de corticoides establecido en nuestro centro.
MétodosSe incluyeron 118 pacientes intervenidos en un único centro entre diciembre 2012 y enero 2020 por un adenoma hipofisario. De estos, se excluyeron 54 pacientes por IA previa, enfermedad de Cushing o aquellos que precisaron tratamiento con GC a altas dosis. Se estableció un protocolo de tratamiento con GC que consistía en su administración empírica a dosis rápidamente descendentes y se determinó el cortisol sérico al tercer día poscirugía. Se realizaron sucesivas reevaluaciones de la función adrenal según criterios clínicos y bioquímicos.
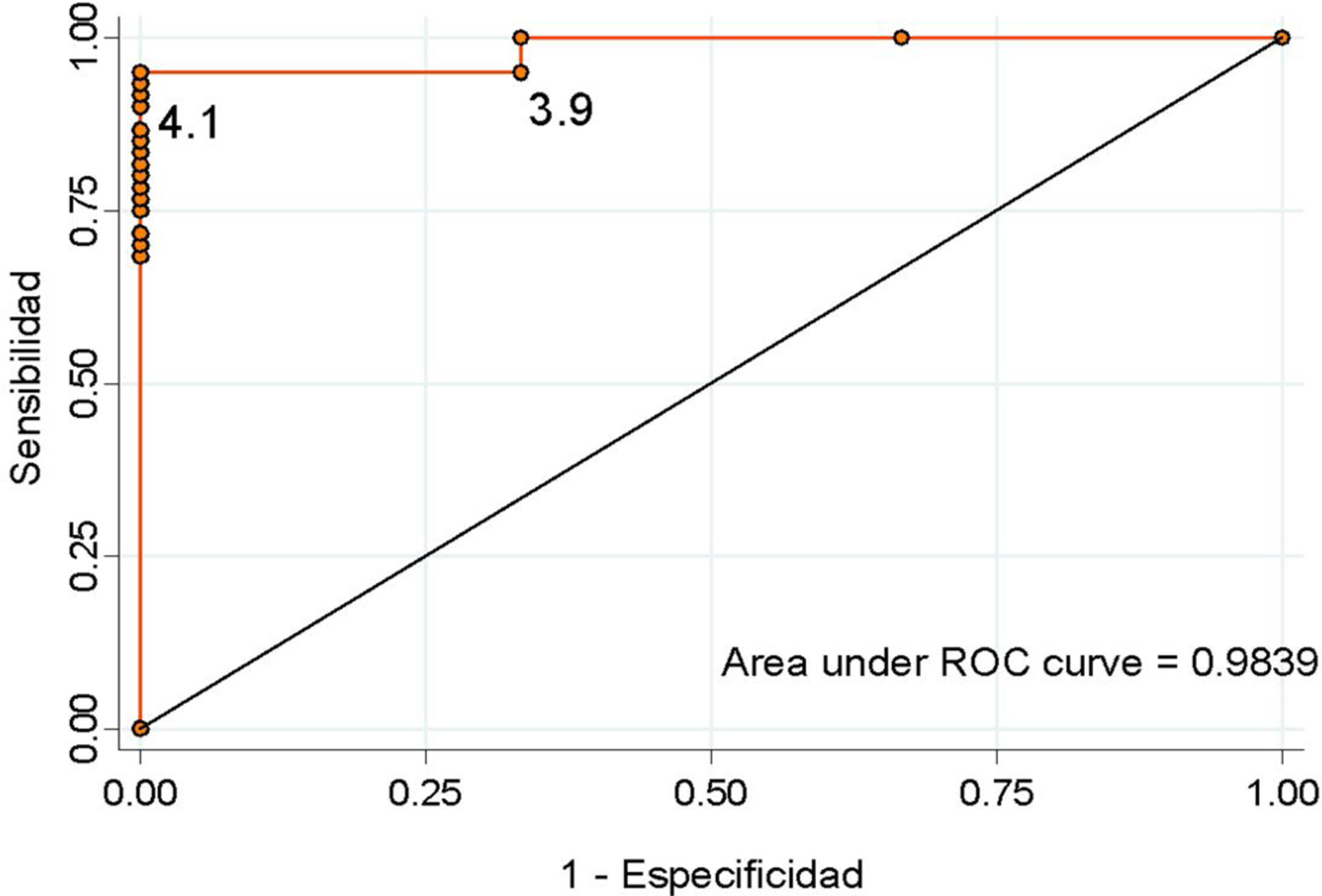
ResultadosDe 64 pacientes, 56 presentaban macroadenomas y 8 microadenomas. La incidencia de IA tras cirugía hipofisaria fue del 4,7%. El valor de corte óptimo que predijo una adecuada reserva corticotropa, teniendo en cuenta la mejor relación de especificidad y sensibilidad, fue de ≥4,1μg/dl para el cortisol sérico al tercer día (sensibilidad 95,1%, especificidad 100%).
ConclusiónEl cortisol sérico al tercer día predice el desarrollo de IA. Sugerimos un punto de corte de cortisol sérico al tercer día de la cirugía de ≥4,1μg/dl como predictor de una adecuada reserva adrenal a largo plazo.
Serum cortisol levels within the first days after pituitary surgery have been shown to be a predictor of post-surgical adrenal insufficiency. However, the indication of empirical glucocorticoids to avoid this complication remains controversial.
The objective is to assess the role of cortisol in the early postoperative period as a predictor of long-term corticotropic function according to the pituitary perisurgical protocol with corticosteroid replacement followed in our center.
MethodsOne hundred eighteen patients who underwent surgery in a single center between December 2012 and January 2020 for a pituitary adenoma were included. Of these, 54 patients with previous adrenal insufficiency (AI), Cushing's disease, or tumors that required treatment with high-dose glucocorticoids (GC) were excluded. A treatment protocol with glucocorticoids was established, consisting of its empirical administration at rapidly decreasing doses, and serum cortisol was determined on the third day after surgery. Subsequent adrenal status was assessed through follow-up biochemical and clinical evaluations.
ResultsOut of the 64 patients treated, there were 56 macroadenomas and 8 microadenomas. The incidence of adrenal insufficiency after pituitary surgery was 4.7%. The optimal cut-off value that predicted an adequate corticotropic reserve, taking into account the best relationship of specificity and sensitivity, was ≥4.1μg/dl for serum cortisol on the third day (sensitivity 95.1%, specificity 100%).
ConclusionSerum cortisol on the third day predicts the development of adrenal insufficiency. We suggest a cortisol cut-off point of ≥4.1μg/dl on postoperative on the third day after surgery as a predictor of the adrenal reserve in the long-term.
Los tumores hipofisarios representan el 16,5% de los tumores intracraneales, siendo la segunda neoplasia intracraneal más frecuente1, y se pueden hallar de forma incidental hasta en el 20% de la población2. El tratamiento quirúrgico de estas lesiones está indicado generalmente en adenomas secretores (excepto prolactinomas cuyo tratamiento de primera línea es farmacológico) y no secretores clínicamente sintomáticos. Se debe valorar en caso de apoplejía hipofisaria, quistes de la bolsa de Rathke, así como en craneofaringiomas y otros tumores paraselares.
Hoy en día, la técnica de elección es la cirugía transesfenoidal. Solo en casos muy seleccionados (grandes tumores, consistencia fibrótica, invasión supraselar…) puede ser necesario un abordaje transcraneal3. El acceso vía endoscópica permite la visualización de estructuras que podrían permanecer ocultas a la luz directa de la microscopía, lo que le convierten en el abordaje más empleado, sin embargo, su superioridad está actualmente por determinar4. Una de las complicaciones endocrinológicas posquirúrgicas más frecuentes es el desarrollo de insuficiencia adrenal (IA), con una incidencia reportada del 5,5%5.
La determinación de cortisol sérico los primeros días tras la cirugía ha demostrado predecir el desarrollo de una IA posquirúrgica6. Sin embargo, es discutida hoy en día la conveniencia de administrar empíricamente glucocorticoides (GC) para prevenir síntomas y complicaciones derivadas del hipocortisolismo. Inder y Hunt7 en 2002 ya recomendaron evitar los GC en las adenoimectomías selectivas y adecuada función adrenal prequirúrgica, reservándolos para resecciones más extensas o con IA previa. Sin embargo, la American Association of Clinical Endocrinology (AACE) sigue reconociendo como alternativa igualmente válida la administración empírica de GC en todos los casos8. En muchos hospitales se sigue empleando protocolos de tratamiento con GC a dosis muy variables, debido probablemente a la falta de ensayos que comparen ambas opciones.
El objetivo del presente trabajo es evaluar la capacidad discriminatoria del cortisol sérico al tercer día poscirugía como predictor de la función corticotropa a largo plazo, en pacientes sometidos a cirugía hipofisaria, siguiendo el protocolo periquirúrgico de reemplazo de corticoides establecido en nuestro centro.
Material y métodosSe evaluaron 118 pacientes intervenidos mediante cirugía transesfenoidal vía endoscópica en el Complejo Hospitalario de Navarra, entre diciembre 2012 y enero 2020, con al menos un año de seguimiento posterior.
Se excluyeron pacientes con enfermedad de Cushing (n=11), con IA previa (n=15), apoplejía hipofisaria (n=4) y los que precisaron mayores dosis de GC por complicaciones periquirúrgicas (n=7). Tampoco se incluyó a 15 pacientes con tumores hipofisarios de otras estirpes diferentes a los adenomas hipofisarios (4 craneofaringiomas, 4 meningiomas, 3 quistes de la bolsa de Rathke, 2 cordomas, un germinoma y un osteosarcoma) y a 2 pacientes por falta de datos al año tras la intervención. Finalmente, la población incluida fue de 64 pacientes.
Estudio preoperatorio y tratamiento quirúrgicoSe realizó preoperatoriamente en todos los pacientes una evaluación de la integridad del eje hipotálamo-hipofisario. En algunos casos, la evaluación del eje corticotropo y somatotropo precisó de pruebas funcionales, según práctica clínica habitual.
Se realizó una adenoimectomía transesfenoidal con acceso transnasal en todos los casos, realizada por un mismo equipo quirúrgico. El material resecado fue evaluado por anatomía patológica para el estudio histológico e inmunohistoquímico. El grado de resección tumoral realizado se definió como total o parcial en función de los hallazgos de la RMN posquirúrgica.
Manejo quirúrgico y postoperatorioSe estableció un protocolo de tratamiento con GC que consistía en su administración empírica a dosis rápidamente descendentes y una reevaluación temprana con criterios de indicación de tratamiento sustitutivo al alta en función del nivel de cortisol posquirúrgico.
Todos los pacientes recibieron cobertura periquirúrgica con hidrocortisona. El día de la intervención (día 0) recibieron 50mg de hidrocortisona intravenosa/cada 8h, el día 1 postintervención 25mg/cada 8h y el segundo día 30mg de hidrocortisona oral a las 8am. Se analizó el cortisol basal al tercer día tras la intervención, administrándose tras la determinación, de nuevo 30mg de hidroaltesona oral. Si el valor de cortisol era <5μg/dl, se continuaba con 30mg de hidrocortisona diarios repartidos en 2 tomas, entre 5 y <10μg/dl 20mg de hidrocortisona en toma única matinal, entre 10 y <16μg/dl 10mg y ≥16μg/dl, no se indicó tratamiento. Este tratamiento se mantuvo al alta. En todos los casos, recibieron instrucciones verbales y escritas sobre el manejo de la IA en situaciones de estrés e indicaciones para el reconocimiento de los síntomas. La determinación de cortisol sérico se realizó mediante el sistema ARCHITECT Cortisol® (Abbott, Illinois, EE. UU.), que utiliza la tecnología de inmunoanálisis quimioluminiscente de macropartículas (CMIA).
Posteriormente se reevaluó el eje corticotropo de forma ambulatoria a las 4 semanas y cada 3 meses durante el primer año, valorando individualmente la suspensión del tratamiento con hidrocortisona. Se realizaba en cada visita una determinación de cortisol sérico basal. Si este era inferior a 5μg/dl se continuaba tratamiento, y se suspendía si era superior a 12μg/dl. En caso de que la cortisolemia se situara entre 5 y 12μg/dl, se realizaba un test de ACTH, con un valor de corte >18μg/dl para suspender el tratamiento. Definimos IA si continuaba la indicación de tratamiento sustitutivo pasado un año tras la intervención.
Análisis estadísticoLas variables cualitativas se describen mediante frecuencias y porcentajes para cada una de sus categorías, y las cuantitativas mediante medidas centrales (media, mediana) con medidas de dispersión (desviación estándar y rango inter-cuartil). La normalidad de las variables se evaluó mediante el test de Shapiro-Wilk. Se empleó la prueba U de Mann-Whitney para comparar variables cuantitativas. Se calculó la curva ROC para definir los valores de corte. Para el análisis estadístico se empleó el programa STATA® versión 12. Valores de p<0,05 se consideraron estadísticamente significativos.
ResultadosCaracterísticas basales de la muestraSe incluyeron un total de 64 pacientes, de los cuales 31 eran varones (48,4%). Presentaban una edad media de 55,3±14,1 años y 56 eran macroadenomas (87,5%). De acuerdo con el tipo de lesión, 34 (53,2%) eran adenomas no funcionantes, 21 (32,8%) somatotropos, 5 (7,8%) tirotropos y 4 (6,2%) lactotropos. Otras características basales se reflejan en la tabla 1.
Características basales de la muestra
| Número de pacientes | 64 |
| Sexo varón | 31/64 |
| Edad, media±DE | 55,3±14,1 |
| Tipo de tumor (%) | |
| Adenoma no funcionante | 34 (53,2%) |
| Somatotropo | 21 (32,8%) |
| Tirotropo | 5 (7,8%) |
| Lactotropo | 4 (6,2%) |
| Tamaño (mm), media±DE | 21,8±10,4 |
| Macroadenoma | 56/64 |
| Invasión del seno cavernoso | 27/64 |
| Alteraciones hormonales prequirúrgicas (%) | |
| Hiperprolactinemia | 22 (34,4%) |
| Déficit de GH | 4 (6,2%) |
| Hipogonadismo secundario | 13 (20,3%) |
| Hipotiroidismo secundario | 5 (7,8%) |
| Diabetes insípida | 0 |
| Déficit visual prequirúrgico (%) | 24/64 |
| Reintervención (%) | 3/64 |
| Tipo de cirugía | |
| Endoscópica | 59/64 |
| Microscópica | 5/64 |
| Complicaciones periquirúrgicas (%) | |
| Fistula de LCR | 3 (4,7%) |
| Meningitis | 1 (1,6%) |
| Hemorragia intracraneal | 0 |
| Diabetes insípida permanente | 2 (3,1%) |
| Déficit de GH | 0 |
| Hipogonadismo secundario | 0 |
| Hipotiroidismo secundario | 3 (4,7%) |
DE: desviación estándar; GH: hormona del crecimiento; LCR: líquido cefalorraquídeo.
Respecto a la intervención quirúrgica, se empleó la técnica endoscópica en 59 pacientes (92,2%), tan solo en 5 pacientes se accedió mediante microscopía. La resección fue total en 38 pacientes (59,4%) y subtotal o parcial en 26 (40,6%). Presentaban afectación visual antes de la cirugía 24 pacientes (37,5%). De ellos, se objetivó una mejoría parcial de la clínica oftalmológica en 12 casos (50%), la resolución completa en 6 (25%) y permaneció sin cambios en los 6 casos restantes (25%). En ninguno de los pacientes empeoró a consecuencia de la cirugía o surgió como una nueva complicación en pacientes sin afectación previa. El estudio histológico e inmunohistoquímico de los adenomas intervenidos se detalla en la tabla 2.
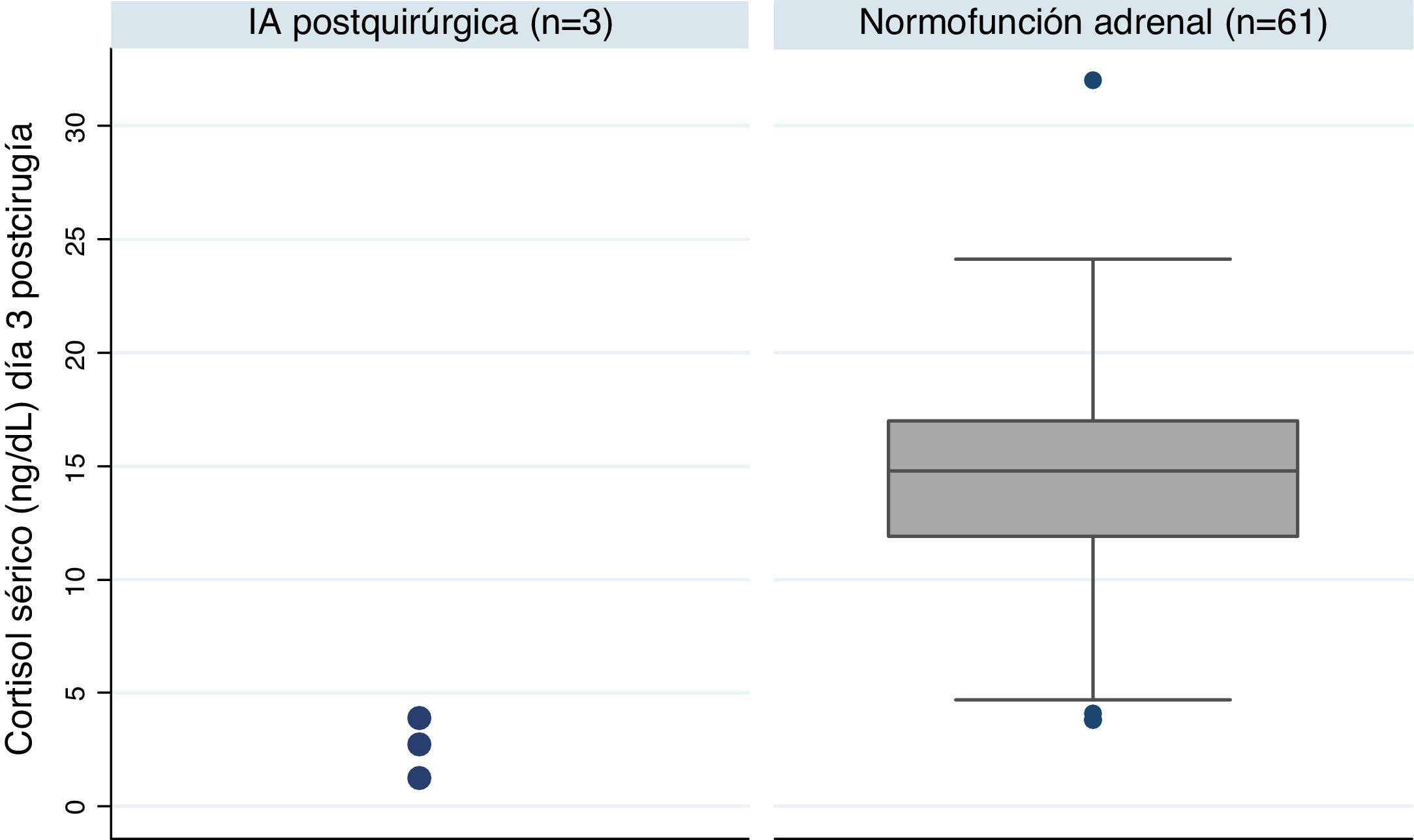
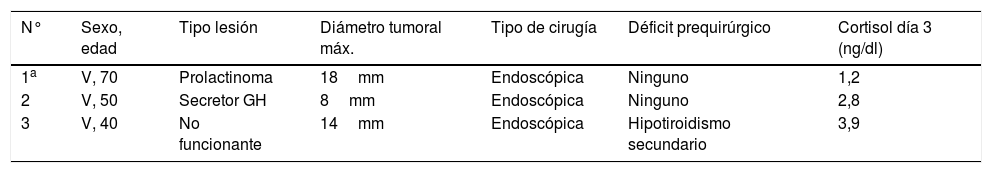
Insuficiencia adrenal posquirúrgicaDe los 64 pacientes, 3 continuaban bajo tratamiento con hidrocortisona al año de la intervención, lo que supone una tasa de IA del 4,7% en nuestro centro. Estos pacientes presentaban un cortisol basal posquirúrgico muy inferior a los pacientes con reserva adrenal (mediana [IQ]; 2,8 [1,2-3,9] vs. 14,8 [11,9-17,0] p=0,005) (fig. 1). Las características de estos pacientes quedan resumidas en la tabla 3. Uno de los 3 casos recibió tratamiento con radioterapia hipofisaria un mes tras la intervención por datos de agresividad.
Resumen de las características de los pacientes con desarrollo de IA
| N° | Sexo, edad | Tipo lesión | Diámetro tumoral máx. | Tipo de cirugía | Déficit prequirúrgico | Cortisol día 3 (ng/dl) |
|---|---|---|---|---|---|---|
| 1a | V, 70 | Prolactinoma | 18mm | Endoscópica | Ninguno | 1,2 |
| 2 | V, 50 | Secretor GH | 8mm | Endoscópica | Ninguno | 2,8 |
| 3 | V, 40 | No funcionante | 14mm | Endoscópica | Hipotiroidismo secundario | 3,9 |
GH: hormona del crecimiento; IA: insuficiencia adrenal; V: varón.
Siguiendo el protocolo de nuestro centro, 45 pacientes (70,3%) mantuvieron la hidrocortisona al alta hasta reevaluación ambulatoria. En 30 casos de los 45 la dosis indicada fue de 10mg, en 6 pacientes de 20mg y en 9 se pautó 30mg de hidrocortisona por niveles <5μg/dl. En ningún caso los pacientes desarrollaron síntomas o signos compatibles con IA durante el tratamiento o tras la suspensión de este.
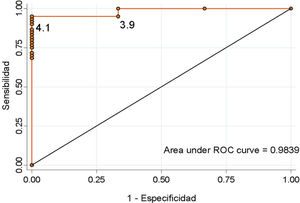
Si consideramos como punto de corte los valores propuestos por nuestro protocolo, una cortisolemia ≥5μg/dl tiene una sensibilidad del 90,1% y una especificidad del 100% para detectar la adecuada funcionalidad del eje HA (valor predictivo positivo [VPP] 100%; valor predictivo negativo [VPN] 33,3%). Por el contrario, un punto de corte de ≥16μg/dl, tiene una sensibilidad del 31,1% y una especificidad del 100% (VPP 100% y VPN 6,7%). Ningún paciente dado de alta sin tratamiento desarrolló una IA durante el seguimiento. Se calculó la curva ROC (fig. 2), que mostró que el valor de corte óptimo para asegurar la normalidad del eje corticotropo, teniendo en cuenta la mejor relación de especificidad y sensibilidad, fue de ≥4,1μg/dl (sensibilidad 95,1%, especificidad 100%, VPP 100% y VPN 50%).
DiscusiónEl presente trabajo pone de manifiesto que la cortisolemia al tercer día tras la cirugía es un adecuado predictor de la reserva adrenal, con una sensibilidad del 95,1% y una especificidad del 100% para un punto de corte de ≥4,1μg/dl..
En los años 1950, Lewis et al y Fraser et al.9,10 publicaron los casos de pacientes con alteración del eje hipofisario-adrenal que fueron sometidos a cirugía sin haber recibido tratamiento con GC, presentando un desenlace fatal. Desde entonces, se introdujeron protocolos de GC a dosis de estrés para todos los pacientes sometidos a cirugía hipofisaria. En 2002 Inder y Hunt7 publicaron una guía sobre el manejo perioperatorio con GC, en la cual recomendaban no administrarlos en adenomectomías selectivas y función adrenal preoperatoria normal. Tras esta guía, numerosos estudios han demostrado la seguridad de esta alternativa. McLaughlin et al.11 solo administraban GC en caso de cortisolemias el día 1 o 2 poscirugía inferiores a 4μg/dl; mientras que Wentworth et al.12 iniciaban tratamiento si la cortisolemia los días 1, 2 o 3 era inferior a 9μg/dl. El reciente protocolo para el manejo de la cirugía hipofisaria de un centro español de referencia en tumores hipofisarios también propone dejar su administración únicamente para casos en los que no se pueda testar prequirúrgicamente la funcionalidad del eje, apoplejía hipofisaria o pacientes con GC administrados crónicamente13. En nuestro estudio a todos los pacientes se les ha administrado GC y carecemos de grupo control con el que sacar conclusiones, por lo que no se puede demostrar ninguna evidencia en este sentido. Sin embargo, tan solo el 4,7% de los pacientes han desarrollado IA y en todos los casos han presentado cortisolemias <4,1μg/dl, lo que permite una detección temprana del hipocortisolismo y un tratamiento precoz. Estos datos podrían apoyar esta línea de no tratar empíricamente.
Otra controversia en estos protocolos es cuál es el mejor momento para realizar la determinación de cortisol sérico. Marko et al.14 investigaron la utilidad de la cortisolemia inmediatamente después de la cirugía (entre 60 y 180min tras la intervención). Encontraron que valores >15μg/dl predecían la funcionalidad del eje (sensibilidad 98%, VPP 99%), y que el cortisol en la sala de reanimación era más preciso que la cortisolemia del día 1 poscirugía 15. Posteriormente Qaddoura et al.16 compararon las mediciones en la sala de reanimación y la de los días 1, 2 y 3 poscirugía. De nuevo, la determinación del día de la intervención era la que mejor discriminaba la funcionalidad del eje. Valores determinados en la sala de reanimación por encima de 27,46μg/dl tenían un 100% de sensibilidad y un 70% de especificidad. Se determinaron umbrales de cortisol sérico diferentes para cada día.
Estos estudios argumentan que la medición del cortisol en condiciones de gran estrés es el mejor momento para objetivar la diferencia entre pacientes que conserven una adecuada respuesta adrenal y aquellos cuya función haya sido dañada. La semivida de la ACTH es de 10min, mientras que la del cortisol es de unos 66min. La cortisolemia se debe medir tras 1-2 semividas medias del cortisol para detectar la respuesta hipofisaria, lo que supone al menos una hora tras la resección tumoral. Estrategias similares se están empleando para predecir la remisión tras la cirugía en la enfermedad de Cushing17. Esta medición temprana es una ventaja además para favorecer el alta precoz del paciente. En nuestro estudio, el cortisol sérico al tercer día es un buen predictor del desarrollo de una IA, con una sensibilidad del 95,1% y una especificidad del 100% para un cortisol sérico <4,1μg/dl. Estos datos son similares a los estudios realizados incluso en la sala de reanimación.
Tampoco hay acuerdo en los diferentes estudios para determinar cuál es el punto de corte que predice una adecuada reserva adrenal. Según nuestro protocolo, 9 pacientes recibieron como tratamiento 30mg de hidrocortisona por niveles de cortisol <5μg/dl, lo cual resulta adecuado porque de estos 9 pacientes, 3 presentaron IA que no recuperaron a largo plazo. Si los valores de cortisol se situaron entre 5-10μg/dl, recibieron 20mg de hidrocortisona y entre 10-16μg/dl 10mg de hidrocortisona. En estos 2 grupos, el tratamiento podría haberse omitido puesto que ninguno de estos pacientes desarrolló IA. Este sobretratamiento no está exento de riesgos, incluyendo la hiperglucemia, la hipertensión y el retraso en la cicatrización de la herida quirúrgica. Una alternativa válida sería la vigilancia clínica de estos pacientes, y tratar en caso de hipotensión, náuseas, vómitos, cefalea o anorexia. Sugerimos un valor de ≥4,1μg/dl en pacientes asintomáticos como predictor de adecuada reserva adrenal.
Por otro lado, el hipopituitarismo tardío es una de las complicaciones reconocidas de la cirugía hipofisaria18, bien sea en relación directa con la intervención o secundaria al crecimiento continuado del adenoma. Por lo que no se puede excluir la posibilidad de que un paciente que demuestre adecuada reserva adrenal en el postoperatorio temprano, desarrolle posteriormente una IA. En todos los casos es preciso una educación al paciente sobre signos y síntomas de la IA y un seguimiento posterior.
La principal fortaleza del estudio es que recoge a todos los pacientes intervenidos en nuestro centro durante un periodo de tiempo relativamente largo, lo que refleja la población con la que trabajamos diariamente. Sin embargo, el estudio tiene varias limitaciones. La baja incidencia de IA de nuestra muestra impide valorar factores predictores que se asocien al desarrollo de esta complicación. Por otro lado, carecemos de grupo control sin administración de glucocorticoides, que hubiera permitido valorar síntomas de IA.
En conclusión, la incidencia de IA posquirúrgica en nuestro centro es del 4,7%. El desarrollo de esta complicación se puede predecir mediante valores de cortisol sérico al tercer día poscirugía <4,1μg/dl con una sensibilidad del 95,1% y una especificidad del 100%. Valores <4,1μg/dl precisan tratamiento con GC aunque en la mitad de los casos se podrá suspender posteriormente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a todos los componentes del Comité Multidisciplinar de Patología Hipotálamo Hipofisaria del Complejo Hospitalario de Navarra, compuesto por el Servicio de Endocrinología y Nutrición, Neurocirugía, Anatomía patológica, Radiodiagnóstico y Oncología Radioterápica, porque a lo largo de este tiempo han seguido y tratado a los pacientes incluidos en este estudio.