El tratamiento antirretroviral (TAR) ha supuesto un aumento en la esperanza de vida de los pacientes con infección por VIH, siendo actualmente similar a la de la población general1. El incremento de comorbilidades asociadas a la edad y la necesidad de añadir tratamientos ha hecho que las interacciones farmacológicas supongan un reto en su manejo. El cobicistat es un inhibidor de la isoenzima del citocromo hepático P450 3A4 (CYP3A4) empleado habitualmente como potenciador de fármacos usados en el tratamiento del VIH. El uso concomitante de fármacos que se metabolizan a través de esta vía favorece la aparición de interacciones medicamentosas potencialmente perjudiciales.
A continuación, presentamos el caso clínico de un varón de 49 años con antecedentes personales de tabaquismo activo, dislipidemia, asma bronquial, cardiopatía isquémica e infección por VIH conocida desde hace más de 10 años. En este tiempo el paciente ha recibido varias terapias, inicialmente fue tratado con efavirenz, emtricitabina y tenofovir, con fracaso virológico a los pocos meses, por lo que se modificó a darunavir/ritonavir, raltegravir y etravirina, manteniendo este tratamiento durante 5años con carga viral indetectable y LT-CD4 en descenso. Posteriormente se simplificó la terapia a daruvanir/ritonavir más raltegravir y un año antes de nuestra valoración se pasó a la combinación actual con darunavir, cobicistat y raltegravir. Además del TAR, se encontraba en tratamiento por vía oral con omeprazol, bisoprolol, ramipril, ácido acetilsalicílico, ezetimiba y rosuvastatina. La terapia inhalada para el asma bronquial consistía en salbutamol a demanda y fluticasona 500 μg y salmeterol 50 μg cada 12h, que había requerido incremento a dosis máxima unos 5meses antes, por mal control de la enfermedad.
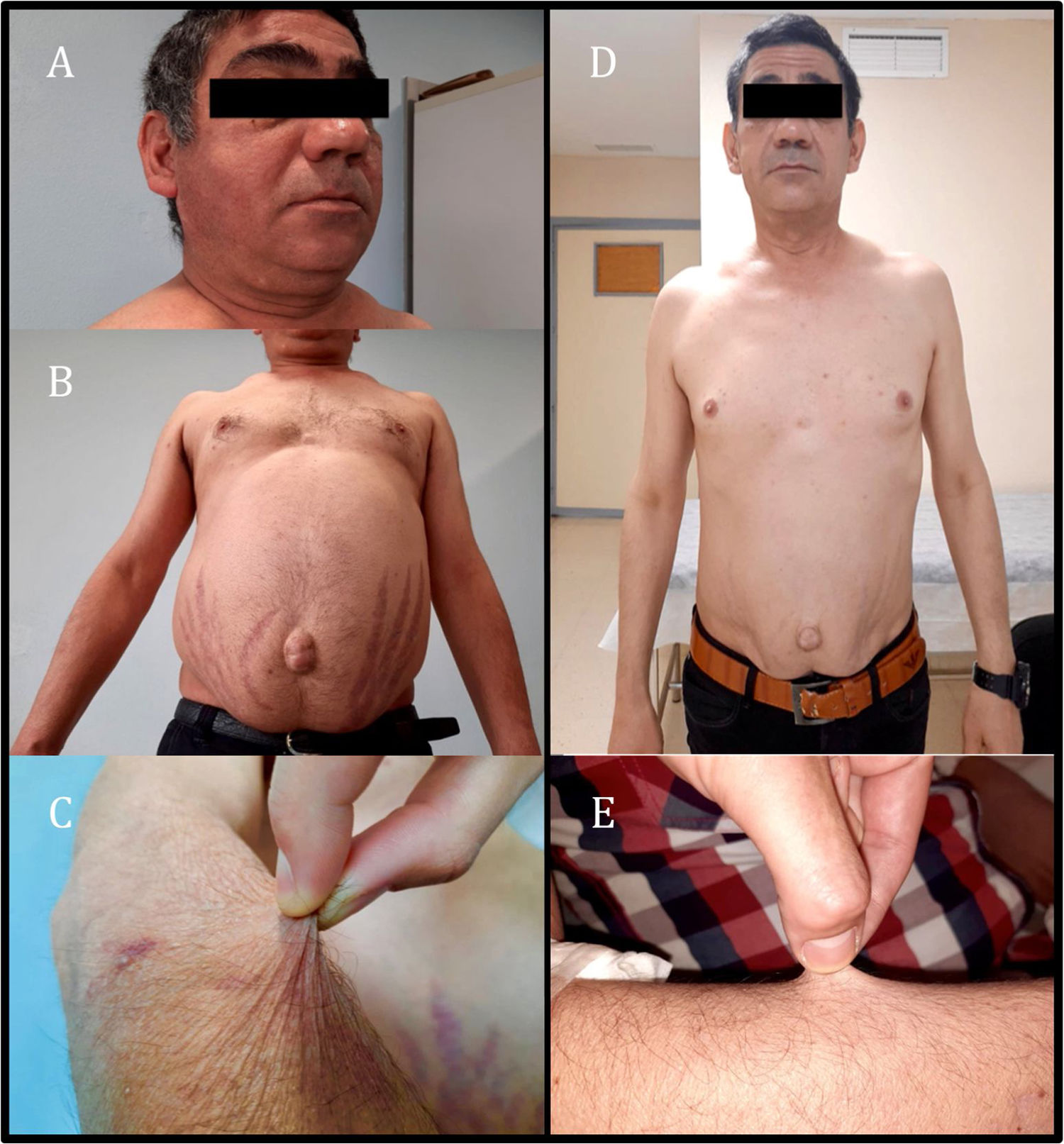
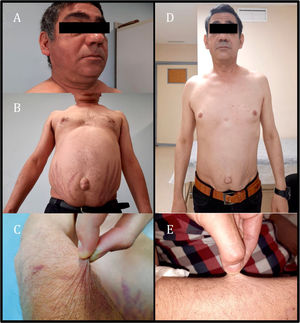
El paciente fue valorado por presentar astenia, peor tolerancia al ejercicio, aumento de la grasa abdominal con estrías rojas en dicha localización, acompañado de adelgazamiento de extremidades y aparición de hematomas con facilidad de un mes y medio de evolución. En la exploración física tenía un peso de 74,9kg, índice de masa corporal de 24,73kg/m2, presión arterial de 113/71mmHg, facies redondeada con aumento de la grasa supraclavicular bilateral (fig. 1A), obesidad abdominal de predominio periumbilical con estrías rojo-vinosas de unos 3cm de grosor (fig. 1B), atrofia cutánea y adelgazamiento de extremidades con hematomas en fase de resolución (fig. 1C). En las pruebas complementarias destacaba ACTH inferior a 2 pg/ml (valores normales 10-46 pg/ml) y cortisol plasmático basal de 0,4 μg/dl (valores normales 7-25 μg/dl), además de glucemia basal alterada (114mg/dl).
Ante los hallazgos clínicos de síndrome de Cushing y analíticos de ACTH y cortisol suprimidos, se sospechó un síndrome de Cushing iatrogénico. Tras descartar la administración de glucocorticoides por otras vías, solo se objetivó exposición a fluticasona inhalada. Existen datos de supresión del eje adrenal en el 20,5% de los pacientes que están recibiendo corticoides inhalados; además, algunos estudios sugieren que la supresión del eje adrenal está sujeta a variabilidad individual en la acción y metabolismo de los glucocorticoides, incluyendo la actividad del CYP3A4, la principal vía de inactivación de la mayoría de los glucocorticoides prescritos2. Entre los fármacos que recibía el paciente se encontraba el cobicistat, un potente inhibidor de esta vía metabólica. Ante la sospecha de interacción entre fluticasona y cobicistat, se retiraron ambos fármacos, se inició beclometasona y se modificó la terapia antirretroviral a bictegravir, emtricitabina y tenofovir alafenamida. Al cabo de 2meses se objetivó la práctica resolución del hábito cushingoide descrito (fig. 1D y E), con pérdida de 8kg de peso y normalización de la glucemia. En el estudio hormonal presentaba ACTH de 52 pg/ml y cortisol plasmático basal de 5,6 μg/dl, por lo que se realizó el test de estimulación corta con 250μg de ACTH, en el que se obtuvo un pico máximo de cortisol plasmático de 8,49 μg/dl. Los cambios clínicos y analíticos objetivados tras la retirada de ambos fármacos permitieron establecer el diagnóstico de síndrome de Cushing iatrogénico secundario a la interacción de fluticasona y cobicistat y posterior insuficiencia suprarrenal terciaria debido a supresión del eje adrenal. Se inició tratamiento sustitutivo con hidroaltesona 30mg/día y se entregaron recomendaciones sobre el uso de glucocorticoides en caso de cirugía o enfermedad intercurrente.
Los corticoides inhalados, como la budesonida, la ciclesonida, la flunisolida, la fluticasona, la mometasona y la triamcinolona, son sustratos del CYP3A4, por lo que tienen potencial para interaccionar con inhibidores de este citocromo como el ritonavir o el cobicistat. Estas interacciones resultan en un aumento de la exposición al corticoide exógeno con riesgo de desarrollar síndrome de Cushing y supresión adrenal3. La beclometasona, a pesar de ser también sustrato del CYP3A4, es hidrolizada principalmente por esterasas y presenta una baja afinidad por el receptor glucocorticoide, así como una vida media corta, por lo que debe considerarse como una alternativa en estos pacientes4. Existen casos publicados de síndrome de Cushing iatrogénico secundario a la interacción de cobicistat y ritonavir con corticoides por vía oral e inhalados5,6. En una serie de 139 casos se demostró que la fluticasona inhalada estaba implicada en el 20,1% de estos cuadros7.
El caso expuesto pone de manifiesto la importancia de las interacciones farmacológicas con el uso de los inhibidores del CYP3A4. Se debe evitar prescribir esteroides potentes sustrato de la vía CYP3A4, como la fluticasona, la budesonida y la triamcinolona, en pacientes en tratamiento con inhibidores de esta vía. Si esto es inevitable en el caso de un paciente con VIH, se aconseja emplear combinaciones de TAR alternativas que no incluyan cobicistat ni ritonavir antes de introducir los esteroides. Si aun así no es posible, se debe monitorizar estrechamente al paciente en los 2 o 3 meses posteriores, ante la posibilidad de aparición de un síndrome de Cushing iatrogénico como el descrito, y utilizar algoritmos de manejo específicos para ello8.