Estudiar la distribución espacio-temporal de los casos de enfermedad neumocócica invasora (ENI) por serotipos resistentes a eritromicina y su relación con el consumo comunitario de macrólidos y la cobertura vacunal infantil.
MétodosSe seleccionaron los casos de ENI en mayores de 59 años residentes en la Comunidad de Madrid (CM) notificados en el periodo de 2007 a 2016. Las variables estudiadas fueron obtenidas de los sistemas de información vacunal y de Prestación Farmacéutica. Se utilizó el punto de corte (concentración mínima inhibitoria de eritromicina > 0,5 mg/L) de la clasificación de EUCAST para definir los serotipos resistentes a eritromicina. Mediante JointPoint se estimaron las tendencias de las incidencias de casos por serotipos resistentes a eritromicina incluidos en la vacuna trecevalente (STVCN13) y no incluidos (STnoVCN13). La asociación de esas incidencias con el consumo comunitario de macrólidos y la cobertura vacunal se hizo mediante modelos de Poisson. Para la detección de clústeres espacio-temporales se utilizó el estadístico Satscan.
ResultadosSe identificaron 1.936 casos, de ellos, se detectó que 427 serotipos eran resistentes a la eritromicina. La incidencia de todos los casos por serotipos resistentes fue descendente (AAPC: -5,40%). La incidencia de casos por STVCN13 resistentes a la eritromicina fue descendente con un porcentaje anual del cambio (APC: -13,8) y estuvo asociada inversamente a la cobertura vacunal infantil (IRR 0,641), mientras que la de casos por STnoVCN13 resistentes a eritromicina fue ascendente (APC: 4,5) y no se asoció con la cobertura. Se detectó un clúster por STnoVCN13 y ninguno por STVCN13 tras la inclusión de la trecevalente en el calendario vacunal infantil.
ConclusionesEl descenso de ENI por STVCN13 resistentes se asoció con el incremento de la cobertura vacunal infantil. La presencia de clústeres de casos por STnoVCN13, en el periodo posterior a la inclusión de la VCN13, indica reemplazo de serotipos. El aumento de los casos por STnoVCN13 resistentes podría estar relacionado por el reemplazo de los serotipos vacunales en la colonización nasofaríngea, facilitada por el consumo de macrólidos todavía a niveles altos en la CM.
To study the spatio-temporal distribution of cases of invasive pneumococcal disease (IPD) due to serotypes resistant to erythromycin and its relationship with community consumption of macrolides and childhood vaccination coverage.
MethodsWe selected IPD cases in adults over 59 years old, residents in the Community of Madrid (MC), notified in the period 2007-2016. The variables studied were obtained from the Vaccination Information Systems and the Pharmaceutical Service. The cut-off point (minimum inhibitory erythromycin concentration > 0.5 mg/L) of the EUCAST classification was used to define erythromycin resistant serotypes. We used JointPoint to estimate the incidence trends by erythromycin resistant serotypes included in the 13-valent vaccine (STPCV13) and not included in it (STnoPCV13). The association of these incidences with the community consumption of macrolides and vaccination coverage was made using Poisson models. Statistical scanning was used for the detection of temporal-spaces clusters of cases.
Results1936 cases were identified, of which 427 erythromycin resistant serotypes were identified. The incidence of all cases due to resistant serotypes was decreasing (AAPC: -5,40%). During the period studied, the incidence of cases due to erythromycin resistant STPCV13 was decreasing with an annual percentage change (APC): -13.8 and was inversely associated with childhood vaccination coverage (IRR 0.641), while that of cases due to erythromycin resistant STnoPCV13 was ascending (APC): 4.5; and was not associated with coverage. 1 cluster was detected by STnoPCV13 and none by STPCV13 after the date of inclusion of the 13-valent in the childhood vaccination calendar.
ConclusionsThe decrease in IPD due to resistant STPCV13 was associated with an increase in childhood vaccination coverage. The presence of clusters due to STnoPCV13 after the date of inclusion of the 13-valent vaccine in the childhood vaccination calendar indicates serotypes replacement. The increase in cases of resistant STnoPCV13 could be related to the replacement of vaccine serotypes in nasopharyngeal colonization, facilitated by the consumption of macrolides still at high levels in MC.
La resistencia antibiótica es un importante problema de Salud Pública, con un impacto clínico todavía no definido1. El Streptococcus pneumoniae es la causa más frecuente de infecciones respiratorias. Existen más de 100 serotipos, de los cuales aproximadamente 20 ocasionan más del 90% de casos de enfermedad neumocócica invasora (ENI)2. Los primeros serotipos resistentes aparecieron en las áreas con mayor consumo de antibióticos de Sudáfrica a finales de 19703. Las resistencias iniciales a betalactámicos pronto se extendieron a otros antibióticos, como los macrólidos, considerados tratamientos de primera línea frente a las infecciones respiratorias altas.
En Europa, los primeros neumococos resistentes aparecieron en la década de 1980. La incidencia de casos por serotipos resistentes a macrólidos ha permanecido estable en los últimos años, en España la proporción de casos (21,6% en 2017) es menor que la de otros países europeos, como Francia (23,35%), Rumania (27,6%), Bulgaria (27,6%) o Italia (23,4%)4.
El factor de riesgo poblacional más importante de la resistencia antibiótica es el consumo comunitario de antimicrobianos. Los estudios indican que las áreas con mayor consumo de antibióticos tienen un incremento en la incidencia de casos resistentes5. Otro factor influyente es la vacunación sistemática infantil por la vacuna antineumocócica conjugada (VCN)6,7. La VCN actuaría disminuyendo la colonización faríngea de Streptococcus pneumoniae en los niños menores de dos años, considerados los principales reservorios y transmisores al resto de la población8.
En 2006 se incluyó en el calendario de vacunación infantil, de la Comunidad de Madrid (CM), la vacuna heptavalente (VCN7), que cubre los serotipos 4, 6 B, 9 V, 14, 18C, 19F y 23F. Como consecuencia del reemplazo de serotipos observado, en 2010 fue sustituida por la vacuna trecevalente (VCN13), con seis serotipos adicionales (1, 5, 7 F, 3, 6 A y 19A)9.
Aunque la incidencia de ENI es decreciente en los últimos 10 años10, cabría esperar una distribución geográfica similar entre los casos por serotipos resistentes a la eritromicina y el consumo de macrólidos11, así como distinta distribución espacial y temporal entre los casos por serotipos resistentes y sensibles a la eritromicina.
El objetivo de este estudio es analizar la distribución espacio-temporal de los casos de ENI por serotipos resistentes a la eritromicina en la CM en el periodo comprendido entre 2007 y 2016 y su relación con el consumo comunitario de macrólidos y la cobertura vacunal infantil.
MétodosÁmbito y periodo de estudioCasos de ENI mayores de 59 años, residentes en la CM notificados en el periodo 2007-2016. Dicho periodo se subdividió en los periodos: pre-VCN13 (2007-2009) y VCN13 (2011-2016). En el año 2010 se incluyó la VCN13 en el calendario vacunal infantil de la CM.
Definición de casoSe utilizó la definición de caso de ENI de la Red de Vigilancia Epidemiológica, que requiere que se cumpla alguno de los criterios de laboratorio: aislamiento, detección de ADN o de antígeno de S. pneumoniae en muestras procedentes de sitios normalmente estériles. El criterio que se cumplió para definir un caso de ENI en el presente estudio fue el aislamiento del S. pneumoniae en una muestra estéril. Se definió como resistencia a eritromicina el incremento de la concentración mínima inhibitoria de eritromicina superior a 0,5 mg/L en el antibiograma.
Fuentes de datos y variablesSe incluyeron los casos notificados al Sistema de Vigilancia de enfermedades de declaración obligatoria. Este sistema recoge variables demográficas, clínicas, epidemiológicas y microbiológicas mediante un formulario estandarizado. El laboratorio Regional de Salud Pública realizó la identificación de los serotipos mediante la reacción de Quellung y el análisis de sensibilidad antibiótica de acuerdo con la clasificación del European Committee on Antimicrobial Susceptibility Testing (EUCAST)12. Los casos se clasificaron en cuatro grupos según el tipo de serotipo: 1) cualquier serotipo (ST total), 2) serotipos incluidos en la VCN13 (STVCN13), 3) serotipos adicionales a la VCN7, incluidos en la VCN13 (STVCN13no7) y 4) serotipos no incluidos en la VCN13 (STnoVCN13).
El Sistema de Información Vacunal aportó el número de casos vacunados por año. La cobertura vacunal anual (CV13) se calculó como la proporción de niños primovacunados de la cohorte de dos años de edad y se categorizó en tres niveles (< 85%, 86-90% y > 90%).
Por otra parte, el Sistema de Información y Análisis de la Prestación Farmacéutica aportó el consumo comunitario de antibióticos, que se expresó como dosis diaria definida (DDD) perteneciente a la población madrileña mayor de 59 años. La DDD agrupa el consumo por principio activo prescrito (ATC) de una familia de antibióticos (macrólidos)13. Posteriormente se calculó la DDD por 1.000 habitantes día (DHD) de los mayores de 59 años13. Se utilizó la siguiente fórmula: DHD = (DDD*1000) /población*365. La población de referencia se obtuvo del Padrón Continuo del Instituto de Estadística de la CM.
Análisis de los datosEl análisis de la tendencia se realizó mediante modelos JoinPoint Trend Analysis, que calculó el porcentaje anual del cambio (APC) entre la incidencia acumulada de un año y el siguiente. También se estimó la media del porcentaje anual del cambio (AAPC) de las incidencias acumuladas en todo el periodo estudiado. Ambas estimaciones fueron realizadas para los cuatro grupos de casos definidos según serotipo.
Las incidencias medias anuales de los periodos pre-VCN13 y VCN13 se compararon para cada grupo de casos mediante los índices de razón de tasas (IRR) obtenidos de los modelos Poisson.
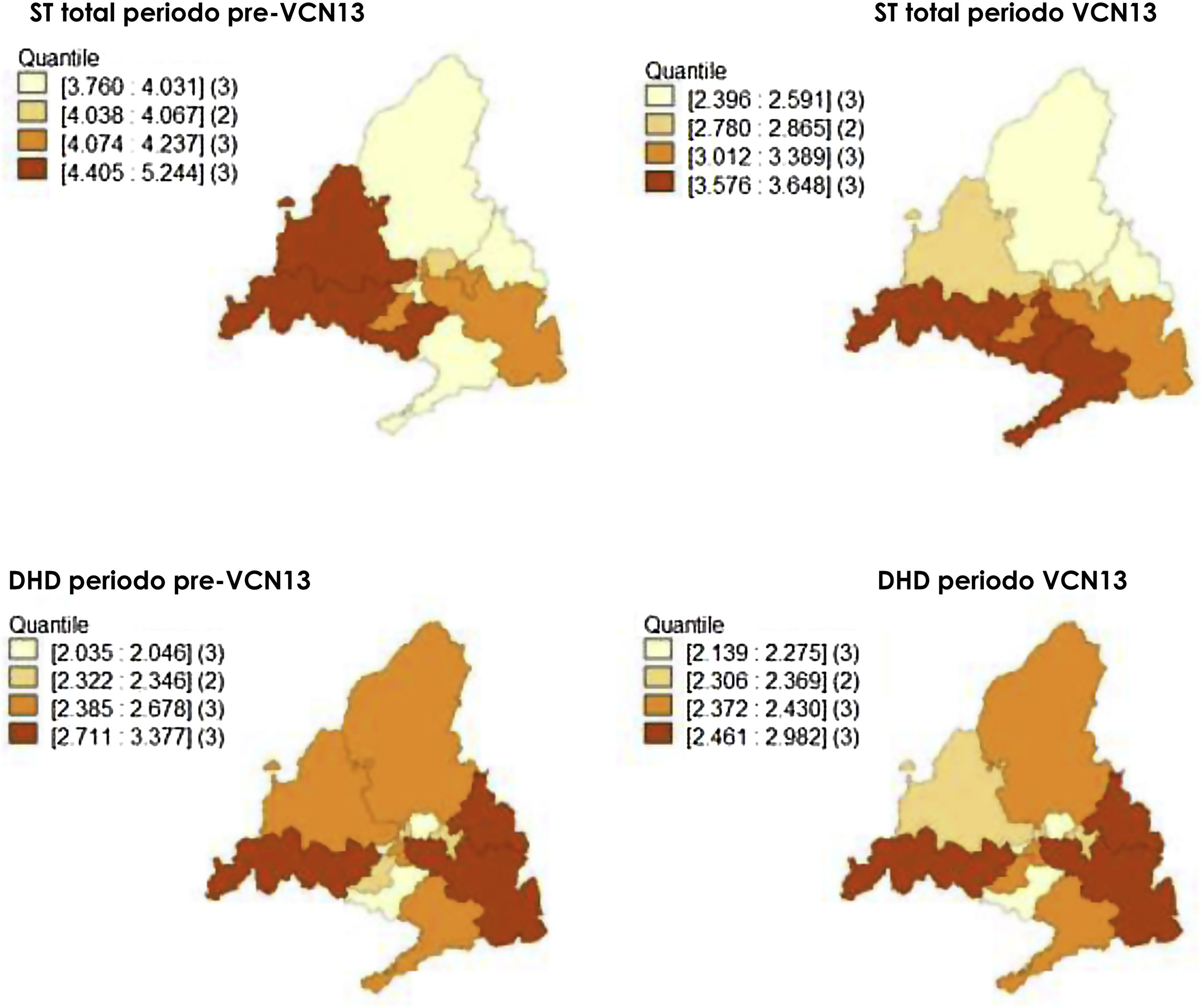
Para llevar a cabo el análisis espacial se calculó la incidencia acumulada de casos de cada una de las 11 áreas de salud históricas (fig. 1) en los periodos pre-VCN13 y VCN13 para los cuatro grupos de casos definidos. Las incidencias se suavizaron mediante la técnica «empirical bayes» y se representaron en mapas. Esta técnica calcula la media ponderada entre la incidencia acumulada bruta de cada área y la incidencia acumulada media global de forma proporcional al tamaño de la población. De esta manera, las áreas con poblaciones pequeñas tienen valores más cercanos a la media y las de poblaciones grandes valores más cercanos a su incidencia cruda. El consumo de macrólidos (DHD) también se calculó por área de salud para ambos periodos.
La detección de clústeres de casos se realizó mediante el estadístico SatScan, desarrollado por Kulldorff, siguiendo una distribución de Poisson14. Este método consiste en crear una ventana cilíndrica que cambia constantemente de centro, radio y altura, escaneando las áreas de Madrid. Restringimos el radio de la ventana a la distancia promedio entre los centroides de las áreas. Para cada centroide de un área, el radio varió desde cero a 25 km. La altura del cilindro representó la dimensión de tiempo, entre uno y 10 años. El clúster más probable fue el que tenía más casos de lo esperado en las dimensiones espacio–temporales establecidas. El valor p fue obtenido a través de las simulaciones de Monte Carlo (999 repeticiones) con un intervalo de confianza del 95%.
La asociación de Incidencia acumulada anual de ENI con la CV13 y la DHD se estudió para los cuatro grupos de casos mediante un modelo de Poisson. Este análisis comprende el periodo de 2010 a 2016, ya que la VCN13 se incluyó en 2010 en el calendario vacunal infantil.
Los programas estadísticos utilizados fueron STATA v. 14, Geoda, SatScan y JointPoint Trend Analysis.
ResultadosSe notificaron por el Sistema de Vigilancia de Enfermedades de Declaración Obligatoria (EDO) 4.678 casos. Se aislaron e identificaron los serotipos de 4.466 casos (95,4%) en el Laboratorio Regional de Salud Pública, 1.936 casos en mayores de 59 años, de los cuales el 22,1% (427 casos) fueron por serotipos resistentes a eritromicina.
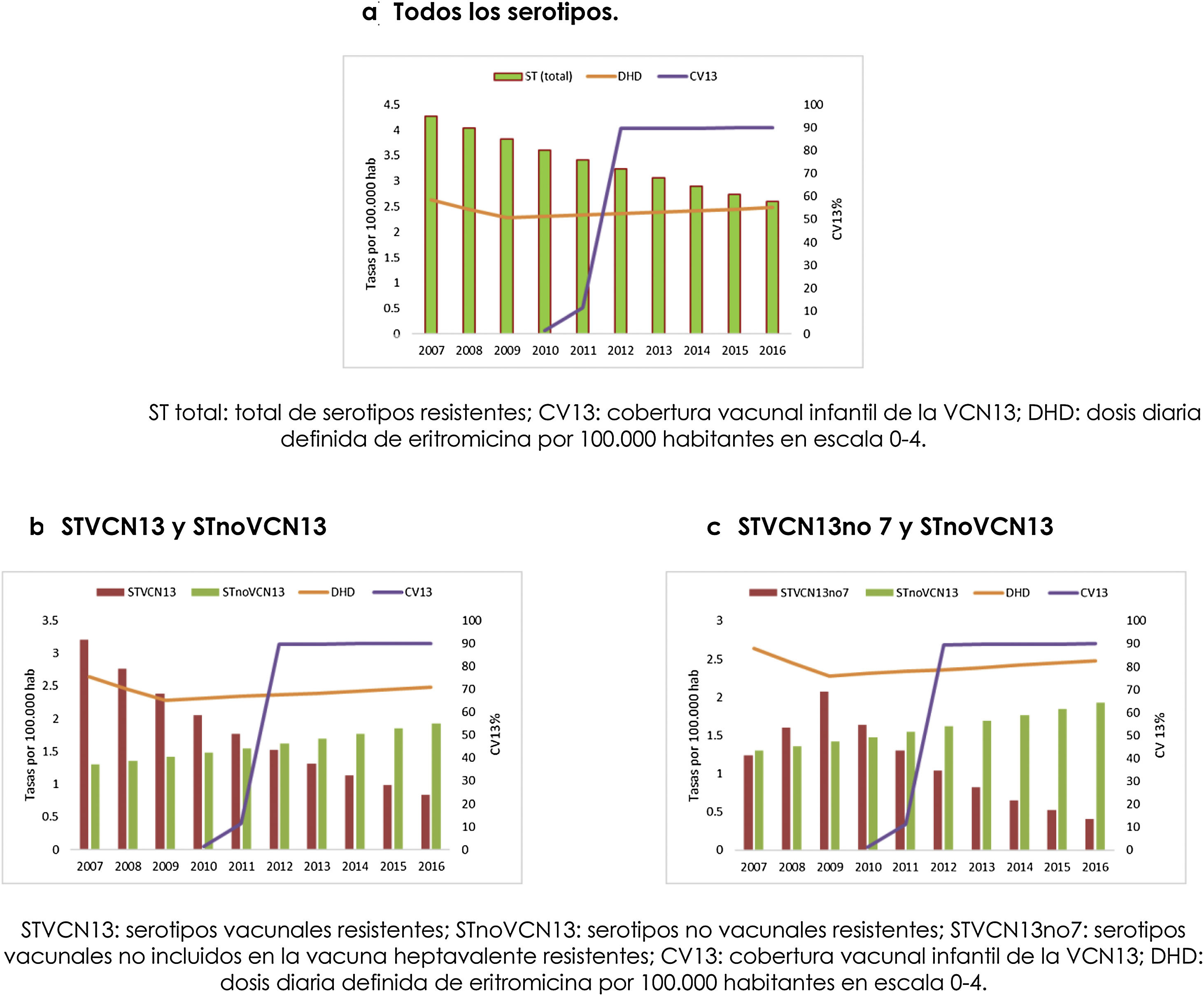
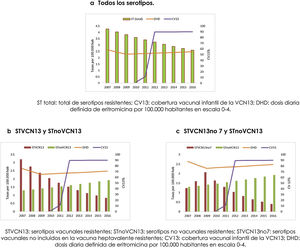
En la figura 2a, b y c se representa la evolución de la cobertura de VCN13, el consumo de macrólidos y la incidencia de ENI por serotipos resistentes a eritromicina por grupo de serotipo.
La incidencia de casos de ENI por serotipos resistentes a eritromicina fue decreciente para el conjunto de serotipos y para los serotipos vacunales. Sin embargo, la incidencia de casos por STVCN13no7 fue ascendente hasta el año 2009, a partir del cual empezó a descender, coincidiendo con el incremento de la cobertura de la VCN13. Por otra parte, la tendencia de los casos por STnoVCN13 fue ascendente durante todo el periodo.
La cobertura vacunal fue creciente desde que se incluyó en el calendario infantil en el año 2010 y alcanzó el máximo en 2012. El consumo de macrólidos descendió entre 2007 y 2009, manteniéndose estable hasta finalizar el periodo estudiado.
Las tendencias de las incidencias fueron estimadas mediante JoinPoint. La tendencia de los casos por STVCN13 fue descendente a lo largo de todo el periodo estudiado (AAPC: -13,8%) y el descenso de los casos por STVCN13no7 sólo lo fue en el periodo VCN13 (APC: -20,6%), ambas tendencias fueron estadísticamente significativos. La CV13 describió una tendencia ascendente y estadísticamente significativa, desde el año de su inclusión en el calendario vacunal infantil (AAPC: 98,6%). La tendencia del consumo comunitario de macrólidos describió un primer periodo descendente seguido de uno ascendente, ambos estadísticamente no significativos.
La incidencia anual media para los grupos de casos de ENI fue menor en el periodo VCN13, excepto para los casos por STnoVCN13 (tabla 1).
Incidencia acumulada de ENI resistentes a eritromicina por grupos de serotipos. Comparación entre los periodos: preVCN13 (2007-2009) y VCN13 (años 2011-2016)
| Grupos de serotipos | Incidencia acumulada | IRR5 | p | |
|---|---|---|---|---|
| Pre-VCN13 | VCN13 | |||
| ST total1 | 4,27 | 2,76 | 0,65 | 0,00 |
| STVCN132 | 2,88 | 1,10 | 0,38 | 0,00 |
| STVCN13no73 | 1,64 | 0,74 | 0,45 | 0,00 |
| STnoVCN134 | 1,39 | 1,67 | 1,20 | 0,13 |
1: todos los serotipos; 2: serotipos vacunales; 3: serotipos adicionales a la VCN7; 4: serotipos no vacunales; 5: Indice de razón de tasas.
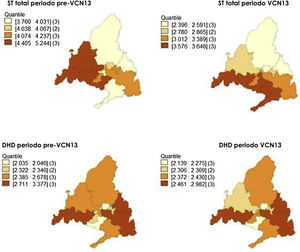
En el periodo pre-VCN13, las áreas de salud con incidencias medias suavizadas más altas de los ST totales, STVCN13 y STnoVCN13 fueron la 6, la 8 y la 10, mientras que en el periodo posVCN13 fueron la 8, la 10 y la 1. Con respecto a los casos por STVCN13no7, fueron las áreas 6, l 8 y 9 en el periodo pre-VCN13 y 8, 10 y 11 en el periodo VCN13 (fig. 3).
Con relación a los macrólidos, las áreas con mayor consumo fueron la 1, la 3 y la 8 en ambos periodos. El consumo aumentó en el área 9 y descendió en el área 6 en el periodo VCN13 (fig. 3).
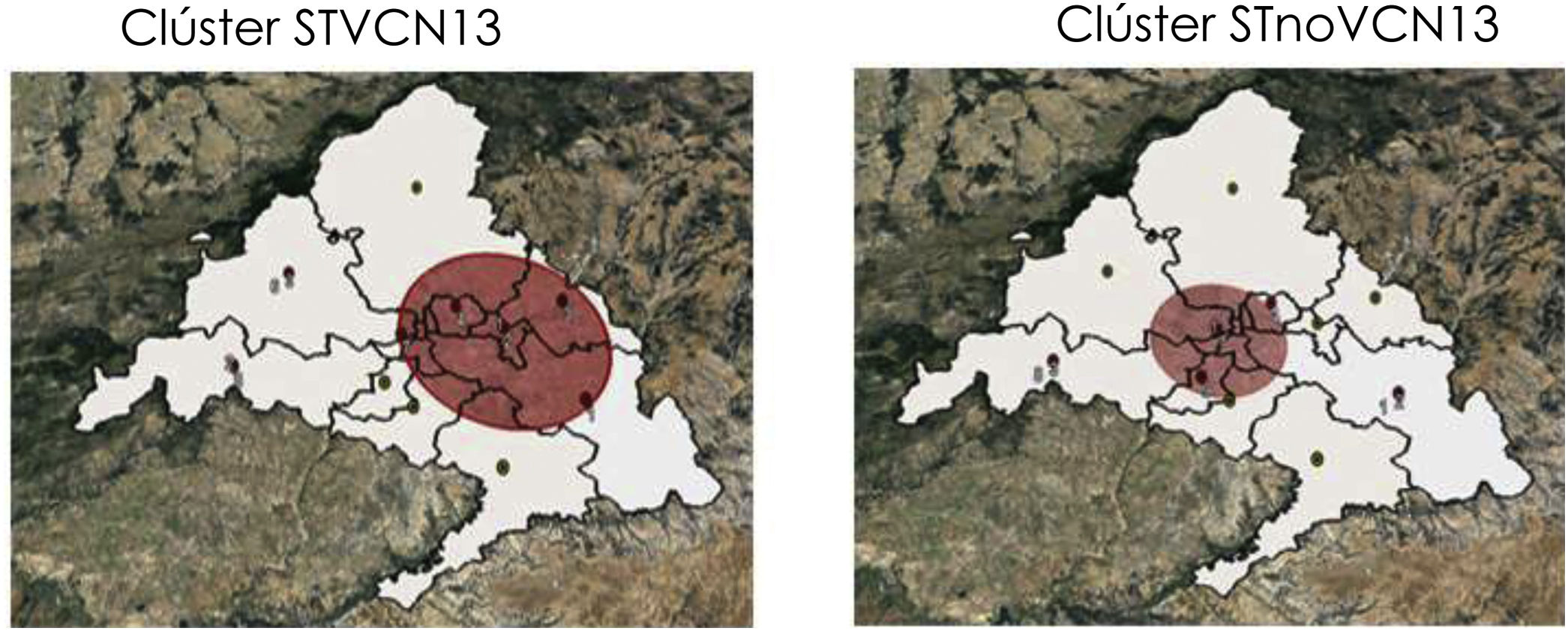
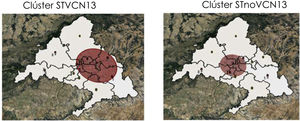
Se detectaron dos clústeres por STVCN13 en los periodos pre-VCN13 y un clúster por STnoVCN13 en el periodo VCN13. Las áreas de salud 4 y 7 coincidieron en los clústeres por STVCN13 y STnoVCN13 (tabla 2 y fig. 4).
Clústeres espacio- temporales de casos de ENI por serotipos resistentes a eritromicina
| ENI por serotipo | Clúster | Áreas | Fecha (inicio/ final) | Observados | Esperados | RR5 | p | |
|---|---|---|---|---|---|---|---|---|
| ST total1 | 1 | 1 | 2007 | 2012 | 57 | 30,76 | 1,98 | 0,001 |
| 2 | 8 | 2008 | 2009 | 19 | 6,03 | 3,25 | 0,003 | |
| STVCN132 | 1 | 2, 4, 3, 7, 1 | 2007 | 2010 | 81 | 49,94 | 1,98 | 0,001 |
| 2 | 8 | 2008 | 2009 | 14 | 3,13 | 4,70 | 0,002 | |
| STVCN13no73 | 1 | 2, 4, 3, 7, 1 | 2008 | 2010 | 47 | 25,6 | 2,24 | 0,005 |
| STnoVCN134 | 1 | 7, 9, 4 | 2014 | 2015 | 25 | 11,16 | 2,41 | 0,045 |
1: total de serotipos; 2: serotipos vacunales; 3: serotipos adicionales a la VCN7; 4: serotipos no vacunales; 5: riesgo relativo.
La cobertura de VCN13 infantil se asoció inversamente con la incidencia de casos por serotipos vacunales, pero no con la de casos por STnoVCN13. El consumo comunitario de macrólidos no se asoció con la incidencia de ninguno de los grupos de serotipos, pero la IRR fue mayor de 2 para los grupos de ST total y STnoVCN13 (tabla 3).
Asociación de la incidencia de ENI por serotipos resistentes a eritromicina con la cobertura VCN13 infantil y el consumo comunitario de macrólidos. Periodo 2010-2016
| IRR5 | IC 95% | ||
|---|---|---|---|
| ST total1 | |||
| CV13* | 0,829 | 0,708 | 0,972 |
| DHD | 2,185 | 0,651 | 7,329 |
| STVCN132 | |||
| CV13* | 0,641 | 0,501 | 0,821 |
| DHD | 1,849 | 0,281 | 12,181 |
| STVCN13no73 | |||
| CV13* | 0,535 | 0,395 | 0,724 |
| DHD | 0,422 | 0,040 | 4,434 |
| STnoVCN134 | |||
| CV13 | 1,004 | 0,814 | 1,239 |
| DHD | 2,455 | 0,501 | 12,025 |
1: total de serotipos; 2: serotipos vacunales; 3: ST no vacunales; 4: Serotipos adicionales a la VCN7; 5: IRR: Índice de razón de tasas.
La incidencia de casos de ENI por serotipos resistentes a eritromicina, incluidos en la VCN, disminuyó en los adultos mayores de 59 en el periodo estudiado. Durante el cual la VCN7 y después la VCN13 estuvieron incluidas en el calendario de vacunación infantil. El mecanismo de acción de la VCN consiste en disminuir la portación faríngea de S. pneumoniae en los niños menores de dos años, considerados los reservorios y transmisores del microorganismo a la población adulta6,7,15. De esta manera la vacunación sistemática infantil reduce la propagación de los serotipos vacunales sensibles y resistentes. Este efecto indirecto vacunal también lo hemos visto en países de nuestro entorno, que presentaron descensos de las tasas de incidencia en adultos16–18. Por el contrario, en países con bajas coberturas vacunales infantiles, la incidencia se mantuvo alta (Vietnam 72%)19.
En los Estados Unidos, los serotipos con resistencia a macrólidos pasaron de representar el 18% de casos aislados en el año 1998 al 45% en 201120. En algunos países europeos, como Malta o Rumania, también se registraron altas prevalencias (40%), aunque en otros como Holanda la prevalencia fue menor (4,3%)21. En Madrid el aumento de la incidencia de casos por serotipos vacunales resistentes a los macrólidos se observó antes de la inclusión de la VCN13 en el calendario vacunal sistemático.
Para valorar el efecto indirecto y específico de la VCN13, hemos estudiado la incidencia de casos por serotipos incluidos en la vacuna y dentro de ellos de los STVCN13no7, que fueron los serotipos diana de la vacuna. Una particularidad de la evolución de estos serotipos fue el corto ascenso de su incidencia hasta el año 2010, fecha de inclusión de la VCN13 en el calendario de vacunación infantil. Esto podría deberse a la presión del consumo comunitario de macrólidos, a pesar de la ligera disminución observada en ese periodo, y al reemplazo de serotipos provocado por la cobertura de la VCN711,22,23. A pesar de ello, en nuestro estudio no hemos observado asociaciones significativas entre la incidencia de casos y el consumo de macrólidos. Situación que podría explicarse por la estabilidad del consumo de macrólidos a lo largo del periodo estudiado y al efecto contrario y neutralizante de la cobertura vacunal infantil.
Las áreas con mayor consumo de macrólidos tuvieron mayor incidencia de casos. Estas áreas fueron similares en el periodo pre-VCN13 y VCN13 y se localizaron en el sur de la CM. Según el estudio MEDEA, las áreas mencionadas agrupan las zonas básicas de salud con mayores índices de privación24,25. Es de destacar que el empeoramiento de las condiciones socioeconómicas es un factor de riesgo poblacional de resistencia antibiótica26,27.
Por otra parte, la incidencia de casos por serotipos no vacunales aumentó en el periodo vacunal superando el descenso de los casos por serotipos vacunales. Constituyendo un comportamiento similar al reemplazo de serotipos tras la inclusión de la VCN728–30. En países occidentales con programas de vacunación sistemática infantil, también se ha observado el aumento de la prevalencia de los casos por serotipos resistentes no incluidos en la vacuna21. Otro factor que puede explicar el incremento de los casos por serotipos no vacunales tiene relación con la diseminación de linajes con mecanismos de resistencia a macrólidos como es el caso de serotipos 24F-CC23031.
El análisis espacio-temporal también indica la posibilidad de reemplazo de serotipos vacunales por los no vacunales. Los clústeres de ENI por serotipos vacunales se presentaron sólo en el periodo pre-VCN13, lo que es indicativo del efecto inhibidor de la cobertura vacunal infantil durante el periodo VCN13. Por lo contrario, los clústeres por serotipos no vacunales se notificaron en el periodo VCN13, considerándose serotipos emergentes. Nuevamente, los clústeres para ambos grupos de serotipos se identificaron en áreas con peor situación socioeconómica.
Una de las limitaciones del estudio es la ausencia de datos de cobertura vacunal infantil por área de salud, aunque se estima que no hubo diferencias geográficas importantes. Otra limitación es no haber incluido variables socioeconómicas en el análisis, que podrían estar asociadas a la distribución de la incidencia. Por otra parte, la naturaleza del estudio ecológico impide extrapolar los resultados a nivel individual. A pesar de ello, las fuentes de información utilizadas aportan validez al estudio, debido a la alta calidad de los datos aportados por el Sistema de Enfermedades de Declaración Obligatoria, entre los que cabe destacar la elevada proporción de casos con el serotipo identificado.
Podemos concluir que la incidencia de ENI por serotipos resistentes a eritromicina ha descendido en mayores de 59 años a expensas de los casos por STVCN13. Al mismo tiempo, el aumento de la incidencia de casos por serotipos no vacunales y su detección como clúster en el periodo VCN13 nos indican reemplazo de los serotipos vacunales. Finalmente, el consumo comunitario de macrólidos se mantuvo estable en todo el periodo de estudio y no parece haber influido decisivamente en la evolución de los casos por serotipos resistentes.
Los resultados obtenidos apoyan la necesidad de fomentar las políticas de vacunación y de uso racional de antibióticos. La introducción de vacunas que incluyan a los serotipos resistentes más frecuentes podría ser de gran valor para controlar la ENI causada por los mismos. En todo caso, es imprescindible continuar con los programas de vigilancia activa, epidemiológica y microbiológica.
FinanciaciónNo se recibió financiación para la elaboración del presente trabajo de investigación.
Conflicto de interesesLos autores declaran que no tener ningún conflicto de intereses.