El aumento de la sensibilidad a penicilina en Staphylococcus aureus (SA-PenS) podría tener relevancia terapéutica. Pretendemos conocer esta situación en nuestro medio.
Material y métodosSe analizaron bacteriemias por SA en un hospital durante 2,5 años (2015-2017). Estudiamos la sensibilidad a antimicrobianos, genes de resistencia a beta-lactámicos (blaZ, mecA) y presencia de leucocidina de Panton-Valentine. En aislados SA-PenS-blaZnegativo se determinó el tipo de spa, MLST y genes de resistencia a antimicrobianos no-beta-lactámicos.
ResultadosHubo 84 pacientes con bacteriemia por SA (35,7% SARM y 64,3% SASM), se analizaron 77. El 22% de los SASM estudiados (n=11) fueron PenS-blaZnegativo (CMI-Pen≤0,3μg/ml), correspondiendo al 14,3% del total de SA. En SASM-PenS-blaZnegativo se detectaron 8 tipos-spa y 7 complejos clonales.
ConclusiónDetectamos alta prevalencia de SARM/SA y de SASM-PenS-blaZnegativo/SASM en hemocultivos. Una CMI-Pen≤0,3μg/ml se correspondió con SASM-PenS-blaZnegativo. Esta situación plantea opciones terapéuticas que deberán reevaluarse con estudios más amplios y ensayos clínicos.
The increase in penicillin susceptibility among Staphylococcus aureus (SA-PenS) might have therapeutic relevance. We aimed to study the current situation in our environment.
Material and methodsOver a 2.5 years period, all SA isolates from bacteraemia in one hospital were analysed. For all isolates, antimicrobial susceptibility profile, beta-lactam resistance genes (blaZ, mecA) and Panton-Valentine leucocidine encoding-genes were studied. For SA-PenS-blaZnegative isolates, spa-type, MLST and the presence of other resistance genes were studied.
ResultsAmong 84 patients with SA bacteraemia (35.7% MRSA and 64.3% MSSA), 77 were analysed; 22.2% of MSSA isolates were PenS and blaZnegative (Pen-MIC≤0.03μg/ml) corresponding to 14.3% of the total SA. In MSSA-PenS-blaZnegative isolates, eight spa-types and 7 clonal-complexes were detected.
ConclusionA high prevalence of MRSA/SA and MSSA-PenS-blaZnegative/MSSA was detected in blood cultures. Pen-MIC≤0,3μg/ml corresponded to MSSA-PenS-blaZnegative. This situation raises therapeutic options which should be further evaluated in larger studies and clinical trials.
La bacteriemia por Staphylococcus aureus (SA) es una entidad de especial relevancia por su frecuencia y gravedad, presentando una elevada mortalidad. En el tratamiento de la bacteriemia por SA sensible a meticilina (SASM), la precocidad del tratamiento adecuado es muy importante. En la terapia dirigida hay controversias entre el uso de diferentes beta-lactámicos, con cloxacilina y cefazolina en primera línea, y peores resultados con cefalosporinas de segunda y tercera generación y beta-lactámicos con inhibidores de betalactamasas1. En cuanto a penicilina, debido a su elevada resistencia, no se utiliza generalmente para estos tratamientos, especialmente en bacteriemia. No obstante, además de la amplia experiencia con este antibiótico durante décadas, trabajos recientes indican que sigue teniendo muchas ventajas para erigirse incluso como tratamiento de elección en infecciones por SA sensibles a este antibiótico (SA-PenS)2–4. Algunas de estas ventajas son: 1) valores de CMI 10-50 veces más bajos y un menor porcentaje de unión a proteínas que cloxacilina; 2) el tiempo por encima de la CMI es más prolongado que en otros antimicrobianos, incluyendo cefazolina5; 3) menor espectro que otras opciones, incluyendo las cefalosporinas de primera generación (relacionado con menos infecciones por Clostridiumdifficile, por tanto)6, y 4) menor selección de resistencia a meticilina mediada por mecA y mecC7.
En diversos países del mundo se observa una tendencia creciente en la sensibilidad a penicilina de SA, especialmente en infecciones invasivas como bacteriemias. Datos de EE. UU.6,8–10, Canadá4, Europa (Suecia5,11, Finlandia12 y Dinamarca2) o de Australia y Nueva Zelanda3 ejemplifican este fenómeno, incluyendo a la penicilina, en una suerte de «segunda oportunidad»4.
La resistencia a penicilina en cepas SA mecA-negativas es debida a la producción de beta-lactamasas codificadas por el gen blaZ. Hay varios métodos fenotípicos para su detección, como la prueba de nitrocefina o la lectura del borde del halo de la penicilina en disco-difusión, pero comparados con la detección del gen blaZ por PCR tienen menor sensibilidad7,9,11.
El objetivo de este trabajo fue conocer en nuestro medio la situación de la sensibilidad a penicilina en casos de bacteriemia causada por SA y sus características.
Material y métodosDurante el periodo de estudio (julio 2015-diciembre 2017) se analizaron cepas de SA aisladas de bacteriemias (tanto SASM como SA resistente a meticilina [SARM]), en pacientes adultos en el Hospital Royo Villanova, Zaragoza. Los hemocultivos (Bactec, Beckton Dickinson®) y el estudio de sensibilidad (panel Combo 31, Microscan, Beckman®) se realizaron siguiendo protocolos habituales y puntos de corte del European Committe for Antimicrobial Susceptibility Testing.
En todas las cepas SA (una por paciente) se analizó la presencia de los genes blaZ y mecA, así como del gen de la leucocidina de Panton-Valentine (LPV)13.
Se realizó la caracterización de los aislados blaZ-negativo (blaZnegativo) obtenidos mediante: 1) tipado spa por PCR y secuenciación13; 2) determinación de la secuencia tipo (ST) y el complejo clonal (CC) por la técnica de multilocus-sequence typing (MLST) de un aislado representativo de cada uno de los diferentes tipo-spa detectados, asumiéndose el ST para todos los aislados del mismo tipo-spa13, y 3) estudio por PCR de los genes de resistencia a antibióticos no betalactámicos: macrólidos (ermA/ermB/ermC/msrA/msrB y ermT), tobramicina (ant(4)’-Ia) o mupirocina (mupA)13.
ResultadosEn los 30 meses de estudio hubo 84 pacientes con bacteriemia por SA (30 con SARM [35,7%] y 54 con SASM [64,3%]). De los aislados SASM, 12 fueron sensibles a penicilina (SASM-PenS), representando el 22,2% de SASM y el 14,3% de SA.
Del total de 84 SA se pudieron recuperar para su caracterización 77 aislados (27 SARM y 50 SASM). Los 27 aislados SARM fueron resistentes a penicilina (CMI: >0,12mcg/m), portaban los genes mecA y blaZ, y fueron negativos para el gen de LPV.
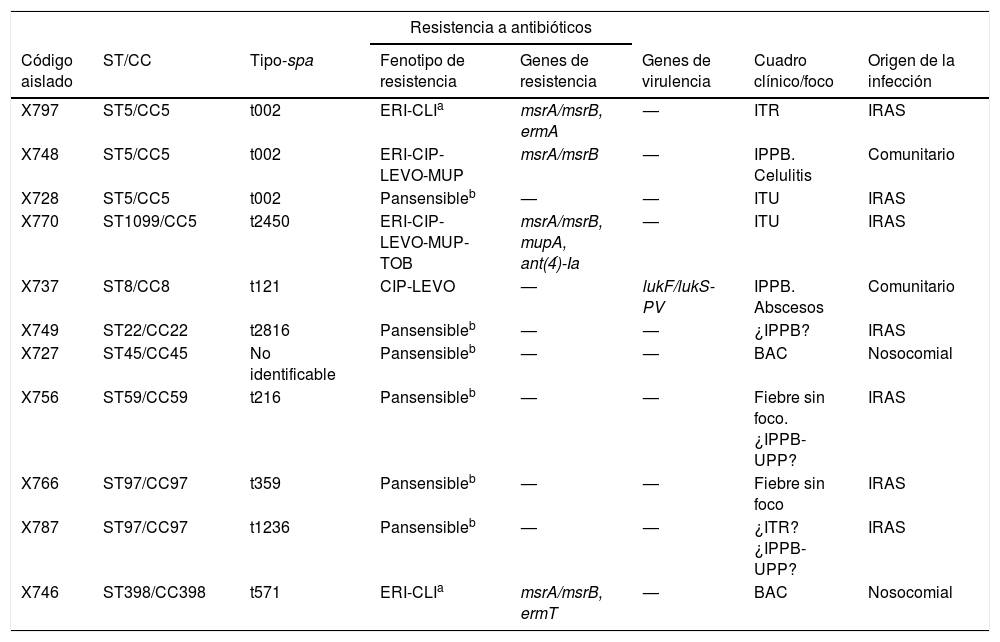
Los 50 aislados SASM carecían de mecA, y con relación a la penicilina: a) 39 de ellos mostraron resistencia fenotípica a penicilina (CMI: >0,25μg/ml) y contenían el gen blaZ (SASM-PenR-blaZpositivo), y b) 11 fueron sensibles a penicilina y carecían del gen blaZ (SASM-PenS-blaZnegativo), mostrando todos ellos una CMI-Pen≤0,3μg/ml (tabla 1).
Características fenotípicas y genéticas de 11 cepas de Staphylococcus aureus Pen-S-blaZnegativo aisladas de hemocultivos
| Resistencia a antibióticos | |||||||
|---|---|---|---|---|---|---|---|
| Código aislado | ST/CC | Tipo-spa | Fenotipo de resistencia | Genes de resistencia | Genes de virulencia | Cuadro clínico/foco | Origen de la infección |
| X797 | ST5/CC5 | t002 | ERI-CLIa | msrA/msrB, ermA | — | ITR | IRAS |
| X748 | ST5/CC5 | t002 | ERI-CIP-LEVO-MUP | msrA/msrB | — | IPPB. Celulitis | Comunitario |
| X728 | ST5/CC5 | t002 | Pansensibleb | — | — | ITU | IRAS |
| X770 | ST1099/CC5 | t2450 | ERI-CIP-LEVO-MUP-TOB | msrA/msrB, mupA, ant(4́)-Ia | — | ITU | IRAS |
| X737 | ST8/CC8 | t121 | CIP-LEVO | — | lukF/lukS-PV | IPPB. Abscesos | Comunitario |
| X749 | ST22/CC22 | t2816 | Pansensibleb | — | — | ¿IPPB? | IRAS |
| X727 | ST45/CC45 | No identificable | Pansensibleb | — | — | BAC | Nosocomial |
| X756 | ST59/CC59 | t216 | Pansensibleb | — | — | Fiebre sin foco. ¿IPPB-UPP? | IRAS |
| X766 | ST97/CC97 | t359 | Pansensibleb | — | — | Fiebre sin foco | IRAS |
| X787 | ST97/CC97 | t1236 | Pansensibleb | — | — | ¿ITR? ¿IPPB-UPP? | IRAS |
| X746 | ST398/CC398 | t571 | ERI-CLIa | msrA/msrB, ermT | — | BAC | Nosocomial |
¿?: infección probable, no probada; BAC: bacteriemia asociada a catéter; CIP: ciprofloxacina; CLI: clindamicina; ERI: eritromicina; IPPB: infección de piel y partes blandas; IRAS: infección relacionadas relacionada con la atención sanitaria; ITR: infección del tracto respiratorio; ITU: infección del tracto urinario; LEVO: levofloxacina; MUP: mupirocina; TOB: tobramicina; UPP: infección de úlceras por presión.
Los 11 aislados SASM-PenS-blaZnegativo fueron adscritos a 8 tipos-spa diferentes (el más frecuente el t002), asociados a 8 STs y 7 CCs (CC5, CC8, CC22, CC45, CC59, CC97 y CC398). Seis de los 11 aislados SASM-PenS-blaZnegativo fueron sensibles a todos los antibióticos testados y los 5 restantes presentaron resistencia a macrólidos, lincosamidas, tobramicina, mupirocina y/o fluoroquinolonas (detectándose los genes ermA, ermT, msrA, msrB, ant(4)’-Ia o mupA). Por último, una de las cepas SASM-PenS-blaZnegativo fue portadora del gen de la LPV (t121-ST8/CC8), y resistente solo a fluoroquinolonas.
DiscusiónEn este estudio de bacteriemias por SA se ha detectado una prevalencia de SARM del 35,7% y un porcentaje del 22,2% de sensibilidad a penicilina entre los aislados de SASM (14,3% del total de SA). El porcentaje de SARM es más elevado que el de otros países europeos y que el de la mayoría de los hospitales españoles (https://ecdc.europa.eu/en/about-us/partnerships-and-networks/disease-and-laboratory-networks/ears-net).
En cuanto a los aislados SASM-PenS, hay cifras publicadas entre el 20 y el 33% en países del norte de Europa5,11, EE. UU.9,14 o Canadá4,10. En España no hemos encontrado datos recientes, pero en un trabajo multicéntrico15 con datos de evolución de 20 años (1986-2006) se analizaron los resultados de 6 estudios de prevalencia en hospitales españoles y se observa que existe un aumento en la sensibilidad global a penicilina en los aislados de SA de diferentes muestras clínicas, con las cifras más bajas en 1991 (2,9%) y un aumento sostenido hasta 2006 (11,0%). Los datos de nuestra serie del 14,3% global y del 22,2% en SASM irían en la línea de un aumento de la sensibilidad global a penicilina en SA.
Del total de las cepas PenS caracterizadas (n=11), todas presentaron valores de CMI-Pen≤0,3μg/ml y carecían del gen blaZ. Esta observación contribuye a simplificar el diagnóstico microbiológico de la determinación de sensibilidad a penicilina, ya que la detección del gen blaZ por PCR no está disponible en la mayoría de los laboratorios, la interpretación de la sensibilidad mediante disco-difusión es poco objetiva y otras pruebas como la nitrocefina no se aconsejan. Nuestros datos coinciden con otros autores que demuestran que en cepas con elevada sensibilidad a penicilina (<0,03μg/ml) se puede descartar con fiabilidad la presencia de betalactamasas mediadas por blaZ1,9. Los complejos clonales CC5, CC8, CC45 y CC22 asociados a nuestros aislados SASM-PenS-blaZnegativo también se detectaron en un estudio similar en Suecia, siendo también predominante el CC5-t00211.
Una explicación al aumento de sensibilidad a penicilina en SA podría atribuirse a una menor presión selectiva por su menor utilización. De hecho, existe una tendencia en este sentido en los primeros años del siglo XXI respecto a años previos, especialmente marcada en EE. UU. o Canadá6,10. El único país que refiere una tendencia descendente es Suecia5, país con una política antibiótica que lleva priorizando antibióticos de espectro reducido hace años, que pasa de sensibilidades de 57% en 2008-09 al 29% en 2014-15. Quizá, podría interpretarse como un fenómeno al alza en países donde no se consume penicilina y a la baja en aquellos en los que se usa, hasta coincidir en cifras del 20-30% en ambas situaciones en el momento actual. Otra posible explicación es que se esté produciendo la entrada de nuevos clones de SA más exitosos epidemiológicamente, que sustituyan a los anteriores, y entre los que se puedan encontrar algunos carentes de blaZ. Este aspecto debe ser monitorizado en un futuro.
Una de las limitaciones de nuestro estudio es la de ser unicéntrico. Sería interesante ver si esta prevalencia de sensibilidad a penicilina (con ausencia de blaZ) en SA está presente en otros hospitales de nuestro país.
No hay estudios randomizados que comparen bencilpenicilina con otras penicilinas antiestafilocócicas (cloxacilina.) o con cefazolina, y su uso ha sido tan bajo desde finales del siglo pasado (por el aumento de resistencia) que en los estudios retrospectivos no se recogen datos suficientes. En algunos trabajos que analizan el uso de penicilina, no se ha observado una mayor mortalidad frente a comparadores como la dicloxacilina2,6. En un estudio6, el uso de penicilina pasó del 0 al 50% de los casos sensibles, con buenos resultados. Otro artículo reciente3 muestra una ligera mayor mortalidad de flucloxacilina frente a bencilpenicilina, aunque con limitaciones metodológicas.
La sensibilidad a penicilina en SASM amplía las opciones de tratamiento dirigido. Los escasos datos sobre su utilidad son favorables, pero se necesitan estudios randomizados para determinar el tratamiento más adecuado. El menor espectro es uno de los aspectos que debe primar en el tratamiento de las infecciones, sin descartar otros aspectos como las dificultades posológicas de administración.
FinanciaciónEste trabajo ha sido financiado en parte por el proyecto SAF2016-76571-R de la Agencia Estatal de Investigación (AEI) de España y del Fondo Europeo de Desarrollo Regional (FEDER) de la UE.
O.M. Mama tiene una beca predoctoral de Mujeres por África-Universidad de La Rioja y L. Ruiz-Ripa tiene una beca predoctoral de la Universidad de La Rioja.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido presentado en el XXIII Congreso Nacional de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), celebrado en Madrid, 23-25 de mayo de 2019.