La vacunación, los avances en el tratamiento frente al virus de la hepatitis B (VHB) y los cambios epidemiológicos producidos en España en las últimas décadas han podido modificar las características y el pronóstico de la hepatitis crónica B (HCB) en personas que viven con VIH (PVIH).
MétodosEstudio observacional retrospectivo donde se incluyeron PVIH-HCB en seguimiento en una unidad de referencia madrileña hasta el año 2019. Se comparó la incidencia y las características epidemiológicas y clínicas según el momento del diagnóstico (antes del año 2000 y posteriormente en periodos de cinco años). Además, se realizó un estudio longitudinal retrospectivo evaluando la tasa de mortalidad, descompensación hepática y factores asociados.
ResultadosDe 5.452 PVIH, 160 presentaban HCB en el momento basal (prevalencia 2,92%, IC 95%: 2,5-3,4), 85,6% hombres, edad mediana al diagnóstico 32,1 (27-37,2) años. La incidencia (2,4/100 pacientes-año) no varió en los diferentes periodos. Los pacientes diagnosticados antes del 2000 (n = 87) comparados con los diagnosticados entre 2015-2019 (n = 11) con mayor frecuencia eran nativos españoles (90,8 vs. 18,2%), habían consumido drogas intravenosas (55,2 vs. 0), tenían antecedentes de hepatitis C (40 vs. 9,1%) y delta (30,4 vs. 0) y mayor afectación hepática (24,1% cirróticos vs. 0). Tras un seguimiento de 20,4 años, 23 pacientes murieron (7,1/1.000 pacientes-año) y 19 presentaron descompensación hepática (4,9/1.000 pacientes-año), todos diagnosticados antes del año 2010. La mortalidad se asoció con mayor fibrosis hepática basal estimada por Fibroscan® (HR 1,06; IC 95%: 1,03-1,09).
ConclusiónLas PVIH-HCB con diagnóstico previo al año 2000 son más frecuentemente de nacionalidad española, infectadas por vía parenteral y con mayor prevalencia de otras coinfecciones. Los pacientes diagnosticados antes del 2010 tienen peor pronóstico condicionado por presentar mayor grado de fibrosis hepática.
Due to hepatitis B virus (HBV) treatment and vaccination during the last decades in Spain, epidemiological and prognosis of chronic hepatitis B (CHB) may have changed.
MethodsRetrospective review of CHB–HIV coinfected patients in a single reference center in Madrid until year 2019. We compared incidence, epidemiological and clinical characteristics according diagnosis period (before 2000, 2000–2004, 2005–2009, 2010–2014, 2015–2019). A retrospective longitudinal study was done to assess mortality, related risk factors and hepatic decompensation.
ResultsOut of 5452 PLHIV, 160 had CHB (prevalence 2.92%; 95% CI: 2.5–3.4), 85.6% were men, median age 32.1 (27–37.2). Incidence rate did not change over the years (2.4/100 patients-year). PLHIV with CHB diagnosed before year 2000 (n = 87) compared with those diagnosed between 2015 and 2019 (n = 11) were more often native-Spanish (90.8% vs. 18.2%), had infected using intravenous drugs (55.2% vs. 0), were coinfected with hepatitis C (40% vs. 9.1%) or hepatitis delta virus (30.4% vs. 0) and had more severe liver disease (cirrhosis 24.1% vs. 0). After a median follow-up of 20.4 years, 23 patients died (7.1/1000 patients-year) and 19 had liver decompensation (4.9/1000 patients-year). All deaths and liver decompensation occurred in patients diagnosed before year 2010. Mortality was associated with higher liver fibrosis in Fibroscan® (HR 1.06, 95% CI: 1.03–1.09).
ConclusionThe epidemiology of CHB in PLHIV in our cohort is changing with less native Spanish, more sexually transmitted cases and less coinfection with other hepatotropic virus. Patients diagnosed before 2010 have worst prognosis related to higher grades of liver fibrosis.
Casi 37 millones de personas en todo el mundo están infectadas por el virus de inmunodeficiencia humana (PVIH), de las cuales, entre 5 y 10% presentan además hepatitis crónica B (HCB)1. La prevalencia de coinfección varía geográficamente, siendo mayor en África subsahariana o Asia. En Europa Occidental la prevalencia se encuentra en torno a 5%. Diferentes estudios han demostrado prevalencias de coinfección más altas en usuarios de drogas por vía parenteral (UDVP) y hombres que tienen sexo con hombres (HSH)2,3.
Existen varios factores que han podido modificar la prevalencia de la coinfección por el VIH y el virus de la hepatitis B (VHB) en la última década en nuestro país. En primer lugar, en España, la recomendación de iniciar la vacunación frente al VHB comenzó en personas en riesgo (incluyendo PVIH) en el año 1982 y se fue generalizando al resto de la población hasta que en 2002 se incluyeron los recien nacidos3. Además, la epidemiología de la infección por VIH ha cambiado ampliamente. Mientras que hasta el año 2000, más del 50% de los PVIH eran UDVP, en la primera década del siglo XXI los UDVP no superaban 1/3 de los nuevos diagnósticos de VIH. Por otro lado, se observa un aumento de población inmigrante natural de países con tasas más elevadas de HCB y con menores tasas de vacunación4.
La introducción de tenofovir como parte del tratamiento antirretroviral (TAR) ha supuesto un mejor control del VHB en paciente coinfectados, con menor evolución a cirrosis y menor morbimortalidad. Sin embargo, los estudios realizados hasta la fecha muestran discrepancias tanto en las tasas de respuesta al tratamiento del VHB como en morbimortalidad5–8. Estas diferencias se pueden deber a variaciones en las tasas de mortalidad subyacentes en las cohortes estudiadas y a diferencias en las estrategias de tratamiento y manejo tanto de la infección VIH como de la HCB.
Los objetivos de nuestro estudio fueron dos. En primer lugar, evaluar los cambios a lo largo de los años en las características epidemiológicas y en el grado de fibrosis hepática en los pacientes coinfectados de nuestro centro. En segundo lugar, evaluar la mortalidad, tasa de descompensaciones hepáticas y la respuesta al tratamiento tras la introducción de tenofovir.
MétodosSe trata de estudio retrospectivo donde se incluyeron todos los pacientes coinfectados por VHB en el momento de la inclusión en nuestra cohorte. Se definió HCB como la presencia de HBsAg + por un periodo mayor de seis meses.
Para el primer objetivo, evaluar los cambios en las características epidemiológicas y clínicas de los PVIH con HCB a lo largo de los años, se realizó un estudio longitudinal retrospectivo comparando incidencia, características sociodemográficas y clínicas en el momento basal de inclusión en nuestra cohorte, en diferentes periodos desde el inicio de la epidemia por VIH: antes del año 2000, del 2000 al 2004, del 2005 al 2009, del 2010 al 2014 y del 2015 al 2019. Se recogieron variables sociodemográficas (edad, sexo, procedencia y factor de riesgo para contraer VIH), clínicas (coinfección por virus de la hepatitis C [VHC] o D [VHD]). Se recogió la primera estimación realizada de fibrosis hepática estimada mediante elastografía de transición (Fibroscan® [FS]). Se consideró fibrosis avanzada un valor de elasticidad hepática > 12 kPa)9.
Para el segundo objetivo se analizó la tasa de mortalidad, la aparición de descompensación hepática y parámetros microbiológicos de VHB como la presencia de una carga viral de VHB (DNA-VHB) menor de 20 unidades/mL al fin de seguimiento, negativización del antígeno E (HBeAg) y aclaramiento del antígeno S (HBsAg).
Análisis estadísticoLas variables cualitativas se presentaron como número absoluto y porcentaje respecto al total y las variables cuantitativas con la mediana y el rango intercuartílico (RI = P25-P75). Las comparaciones entre variables cualitativas se realizaron con los test estadísticos de χ2 (asociación lineal). Las variables cuantitativas se compararon con el test no paramétrico de Wilcoxon.
Se realizó un análisis de regresión lineal uni y multivariante para determinar las variables asociadas con tener mayor grado de fibrosis en FS.
Para el análisis longitudinal, se realizó seguimiento de cada paciente hasta desarrollar cada objetivo (muerte, descompensación, negativización del HBeAg o HBsAg) o hasta su última visita en nuestro centro. Se calculó la incidencia en casos por 1.000 pacientes-año. La censura de los datos fue en diciembre del año 2020. Se calculó la incidencia de cada evento en 1.000 pacientes-año. Por último, se realizó un análisis de regresión de Cox uni y multivariante para determinar los factores asociados a mortalidad.
Consideraciones éticasEl estudio fue aprobado por el Comité Ético del Hospital Universitario La Paz en enero del año 2022 (Código de aprobación PI-5065), siguiendo la legislación vigente de estudios observacionales con medicamentos (Real decreto 1090/2015). Todos los datos fueron incluidos en una base de datos anonimizada. Debido a las características retrospectivas del mismo y a que los datos recogidos no fueron identificativos, el comité local eximió la necesidad de consentimiento informado. Toda la investigación se ha realizado de conformidad con el Reglamento del Parlamento Europeo, ley 2016/679 del 2 de abril de 2016, relativo a la protección de las personas en lo que respecta al tratamiento de datos personales y la Declaración de Helsinki.
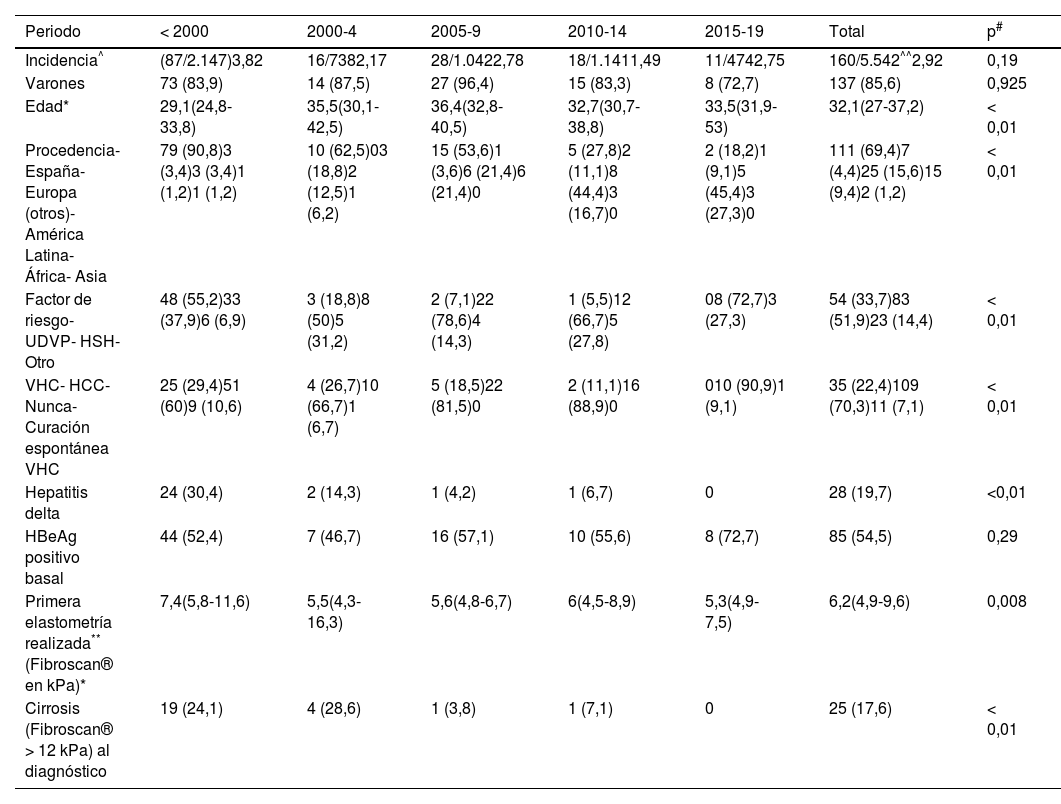
ResultadosComparación de las características basales a lo largo de los añosDe los 5.542 pacientes en seguimiento en la consulta monográfica de VIH, 160 tenían además HCB en el momento de entrar en nuestra cohorte (prevalencia 2,92%, IC 95%: 2,5-3,4). La incidencia no varió en los diferentes periodos [tabla 1]. La mediana de edad al diagnóstico fue de 32,1 (27-37,2) años, siendo la mayoría varones. En el último periodo (del año 2015 al 2020), los pacientes diagnosticados de HCB eran mayores (33,5 años en el último periodo vs. 29,1 si el diagnóstico era antes del año 2000), población inmigrante (más de la mitad de los diagnósticos fueron en personas procedentes de Latinoamérica) y con vía de transmisión sexual (sobre todo HSH). La coinfección por otros virus hepatótropos disminuyó a lo largo de los periodos: 40% y un 30,4% de los pacientes infectados antes del 2000 tenían o habían tenido hepatitis C y delta, respectivamente; mientras que a partir del año 2015 solo se observó un caso de coinfección por VHC. Por último, los pacientes diagnosticados antes del año 2000 presentaban mayor afectación hepática, observando casi un cuarto de pacientes con fibrosis avanzada (tabla 1).
Características de los pacientes según año de diagnóstico
| Periodo | < 2000 | 2000-4 | 2005-9 | 2010-14 | 2015-19 | Total | p# |
|---|---|---|---|---|---|---|---|
| Incidencia^ | (87/2.147)3,82 | 16/7382,17 | 28/1.0422,78 | 18/1.1411,49 | 11/4742,75 | 160/5.542^^2,92 | 0,19 |
| Varones | 73 (83,9) | 14 (87,5) | 27 (96,4) | 15 (83,3) | 8 (72,7) | 137 (85,6) | 0,925 |
| Edad* | 29,1(24,8-33,8) | 35,5(30,1-42,5) | 36,4(32,8-40,5) | 32,7(30,7-38,8) | 33,5(31,9-53) | 32,1(27-37,2) | < 0,01 |
| Procedencia- España- Europa (otros)- América Latina- África- Asia | 79 (90,8)3 (3,4)3 (3,4)1 (1,2)1 (1,2) | 10 (62,5)03 (18,8)2 (12,5)1 (6,2) | 15 (53,6)1 (3,6)6 (21,4)6 (21,4)0 | 5 (27,8)2 (11,1)8 (44,4)3 (16,7)0 | 2 (18,2)1 (9,1)5 (45,4)3 (27,3)0 | 111 (69,4)7 (4,4)25 (15,6)15 (9,4)2 (1,2) | < 0,01 |
| Factor de riesgo- UDVP- HSH- Otro | 48 (55,2)33 (37,9)6 (6,9) | 3 (18,8)8 (50)5 (31,2) | 2 (7,1)22 (78,6)4 (14,3) | 1 (5,5)12 (66,7)5 (27,8) | 08 (72,7)3 (27,3) | 54 (33,7)83 (51,9)23 (14,4) | < 0,01 |
| VHC- HCC- Nunca- Curación espontánea VHC | 25 (29,4)51 (60)9 (10,6) | 4 (26,7)10 (66,7)1 (6,7) | 5 (18,5)22 (81,5)0 | 2 (11,1)16 (88,9)0 | 010 (90,9)1 (9,1) | 35 (22,4)109 (70,3)11 (7,1) | < 0,01 |
| Hepatitis delta | 24 (30,4) | 2 (14,3) | 1 (4,2) | 1 (6,7) | 0 | 28 (19,7) | <0,01 |
| HBeAg positivo basal | 44 (52,4) | 7 (46,7) | 16 (57,1) | 10 (55,6) | 8 (72,7) | 85 (54,5) | 0,29 |
| Primera elastometría realizada** (Fibroscan® en kPa)* | 7,4(5,8-11,6) | 5,5(4,3-16,3) | 5,6(4,8-6,7) | 6(4,5-8,9) | 5,3(4,9-7,5) | 6,2(4,9-9,6) | 0,008 |
| Cirrosis (Fibroscan® > 12 kPa) al diagnóstico | 19 (24,1) | 4 (28,6) | 1 (3,8) | 1 (7,1) | 0 | 25 (17,6) | < 0,01 |
* Cualitativo: test lineal by lineal. Cuantitativo: Prueba de Wilcoxon.
^ Incidencia: casos nuevos que entran en la cohorte con HCB/casos nuevos totales.
^^ Prevalencia.
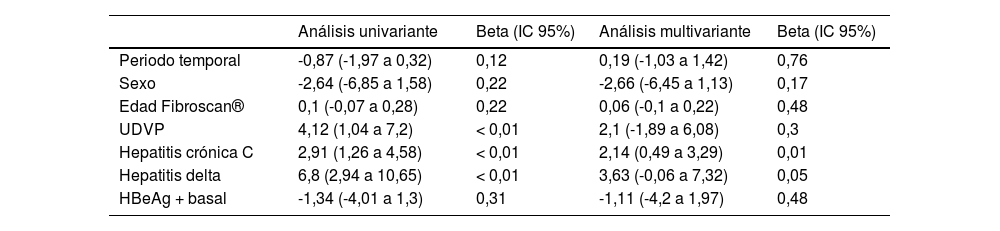
Desde el diagnóstico de la infección por VIH hasta la realización del primer FS pasó una mediana de 10,3 años (1,42-16,87). El valor mediano del FS fue 6,2 kPa (4,9-9,6); 25 pacientes (17,6%) presentaban fibrosis avanzada. El único factor asociado con mayor fibrosis fue la coinfección VHC. Los pacientes coinfectados con VHD presentaban mayor fibrosis pero sin diferencia estadísticamente significativa (p = 0,05) (tabla 2).
Factores asociados con mayor fibrosis en Fibroscan®
| Análisis univariante | Beta (IC 95%) | Análisis multivariante | Beta (IC 95%) | |
|---|---|---|---|---|
| Periodo temporal | -0,87 (-1,97 a 0,32) | 0,12 | 0,19 (-1,03 a 1,42) | 0,76 |
| Sexo | -2,64 (-6,85 a 1,58) | 0,22 | -2,66 (-6,45 a 1,13) | 0,17 |
| Edad Fibroscan® | 0,1 (-0,07 a 0,28) | 0,22 | 0,06 (-0,1 a 0,22) | 0,48 |
| UDVP | 4,12 (1,04 a 7,2) | < 0,01 | 2,1 (-1,89 a 6,08) | 0,3 |
| Hepatitis crónica C | 2,91 (1,26 a 4,58) | < 0,01 | 2,14 (0,49 a 3,29) | 0,01 |
| Hepatitis delta | 6,8 (2,94 a 10,65) | < 0,01 | 3,63 (-0,06 a 7,32) | 0,05 |
| HBeAg + basal | -1,34 (-4,01 a 1,3) | 0,31 | -1,11 (-4,2 a 1,97) | 0,48 |
Beta: cambio en una unidad de Fibroscan® por cada factor.
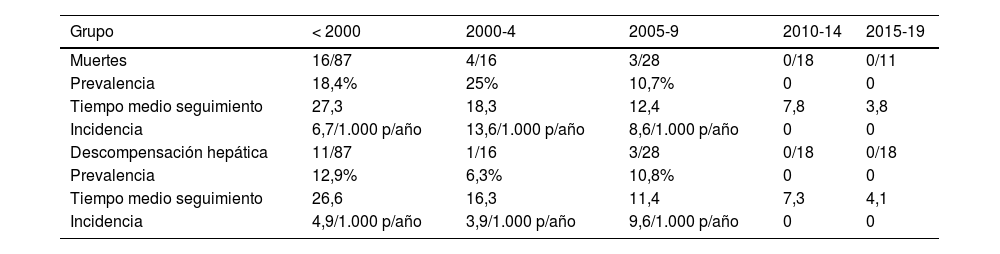
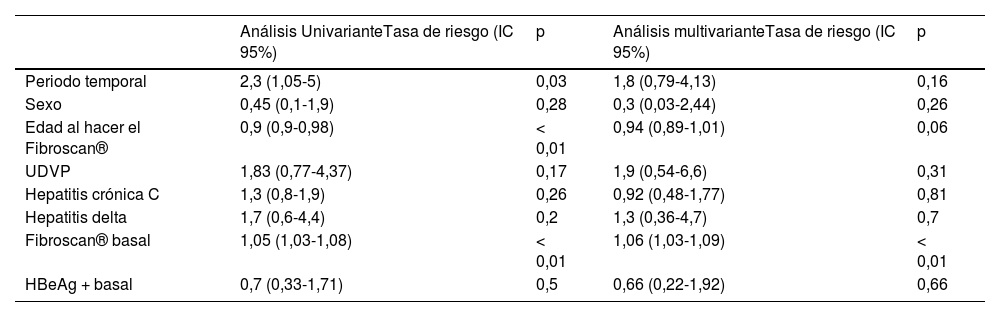
El tiempo mediano de seguimiento fue de 20,4 años (RIC 11-28,2). En este periodo fallecieron 23 pacientes (tasa de mortalidad: 7,1 por 1.000 pacientes-año). En nueve casos la causa fue hepática, seis de ellos por hepatocarcinoma. Se objetivó mayor mortalidad en los tres primeros periodos de estudio, sin objetivarse fallecimientos en los pacientes diagnosticados después del año 2010 (tabla 3). En el análisis multivariante, un mayor grado de fibrosis basal (medida por FS) se asoció a una mayor mortalidad (tabla 4).
Mortalidad y descompensación hepática entre periodos de años
| Grupo | < 2000 | 2000-4 | 2005-9 | 2010-14 | 2015-19 |
|---|---|---|---|---|---|
| Muertes | 16/87 | 4/16 | 3/28 | 0/18 | 0/11 |
| Prevalencia | 18,4% | 25% | 10,7% | 0 | 0 |
| Tiempo medio seguimiento | 27,3 | 18,3 | 12,4 | 7,8 | 3,8 |
| Incidencia | 6,7/1.000 p/año | 13,6/1.000 p/año | 8,6/1.000 p/año | 0 | 0 |
| Descompensación hepática | 11/87 | 1/16 | 3/28 | 0/18 | 0/18 |
| Prevalencia | 12,9% | 6,3% | 10,8% | 0 | 0 |
| Tiempo medio seguimiento | 26,6 | 16,3 | 11,4 | 7,3 | 4,1 |
| Incidencia | 4,9/1.000 p/año | 3,9/1.000 p/año | 9,6/1.000 p/año | 0 | 0 |
Factores asociados con mortalidad en pacientes con hepatitis crónica B (regresión de Cox)
| Análisis UnivarianteTasa de riesgo (IC 95%) | p | Análisis multivarianteTasa de riesgo (IC 95%) | p | |
|---|---|---|---|---|
| Periodo temporal | 2,3 (1,05-5) | 0,03 | 1,8 (0,79-4,13) | 0,16 |
| Sexo | 0,45 (0,1-1,9) | 0,28 | 0,3 (0,03-2,44) | 0,26 |
| Edad al hacer el Fibroscan® | 0,9 (0,9-0,98) | < 0,01 | 0,94 (0,89-1,01) | 0,06 |
| UDVP | 1,83 (0,77-4,37) | 0,17 | 1,9 (0,54-6,6) | 0,31 |
| Hepatitis crónica C | 1,3 (0,8-1,9) | 0,26 | 0,92 (0,48-1,77) | 0,81 |
| Hepatitis delta | 1,7 (0,6-4,4) | 0,2 | 1,3 (0,36-4,7) | 0,7 |
| Fibroscan® basal | 1,05 (1,03-1,08) | < 0,01 | 1,06 (1,03-1,09) | < 0,01 |
| HBeAg + basal | 0,7 (0,33-1,71) | 0,5 | 0,66 (0,22-1,92) | 0,66 |
UDVP: usuarios de drogas por vía parenteral.
En total, 19 pacientes presentaron descompensación hepática (tasa de incidencia 4,9 por 1.000 pacientes-año). Todos los casos de descompensación se produjeron en pacientes diagnosticados antes del año 2010.
Respecto a la respuesta al tratamiento del VHB, todos los pacientes iniciaron en algún momento de su seguimiento tratamiento con tenofovir (asociado siempre a emtricitabina). La mediana de inicio desde el diagnóstico fue de 9,7 años (0,7-15,5). Al final del seguimiento, 135 de 153 (88,2%) tenían DNA-VHB < 20 copias/mL, 31 pacientes de los 87 HBeAg + basales habían negativizado el HBeAg (48,1 por 1.000 pacientes-año) y 13 de 159 pacientes habían negativizado el HBsAg (8,2 por 1.000 pacientes-año). Los tiempos medios de seguimiento para la negativización del HBeAg y HBsAg fueron 7,4 y 9,8 años, respectivamente.
DiscusiónLa primera observación de nuestro estudio es que las características epidemiológicas de las PVIH con HCB han ido cambiando desde el comienzo de la epidemia por VIH. Hemos pasado de un perfil de pacientes UDVP, nativos españoles y coinfectados por otros virus hepatótropos, a pacientes infectados por transmisión sexual, inmigrantes y sin otras hepatitis crónicas. En España, la vacunación frente al VHB en grupos de riesgo se inició en 1982 y desde el año 2002 es universal provocando una disminución de la incidencia a lo largo de los años en nativos españoles3. Sin embargo, la incidencia global de HCB en PVIH no ha descendido debido a un incremento de PVIH que vienen de países con mayor incidencia de HCB sin programas de vacunación universal10. Recientemente nuestro grupo publicó una disminución en la incidencia de hepatitis B aguda (HBA) en PVIH. Los pocos diagnósticos se daban en HSH jóvenes procedentes de países latinoamericanos11. Es importante conocer estos datos para organizar estrategias de prevención y manejo en estos grupos de población.
Con la mejoría del tratamiento antirretroviral y en concreto con la introducción de tenofovir en los primeros años del siglo XXI, se ha producido una disminución importante de la morbimortalidad en los pacientes coinfectados por VIH-VHB12. En nuestro estudio los pacientes diagnosticados a partir del 2010 presentaban menor grado de fibrosis y no observamos muertes ni casos de descompensación hepática. Además, los pacientes diagnosticados en las primeras etapas presentaban más tasas de coinfección por VHC o VHD, lo que se asoció con mayores índices de fibrosis. En el estudio de supervivencia el grado de fibrosis medido por FS fue el único factor que se relacionó de forma independiente con mayor mortalidad.
Desde la introducción de tenofovir y tras un seguimiento medio de casi diez años, cerca de 90% de nuestros pacientes presentaban DNA-VHB indetectable, 35,6% negativizaron HBeAg y 8,2% lograron una cura funcional (aclaramiento del HBsAg). Estos resultados son similares a los descritos por Dezanet et al.13, aunque algunos estudios han descrito tasas más elevadas de cura funcional, entre 10 y 15%14,15, mayores también a 1% anual descrito en monoinfectados16. Chicota et al. encontraron una asociación entre el aclaramiento del HBsAg y un menor recuento de CD4+, relacionándose con un fenómeno de reconstitución inmune14. La menor tasa de cura funcional en nuestro estudio se puede deber a múltiples factores. En primer lugar, se trata de un estudio retrospectivo sin haberse realizado la medición del HBsAg de forma reglada, por lo que el aclaramiento del AgS puede estar infraestimado. Además, se trata de una población diferente, no siempre naïve y posiblemente con mejor inmunidad, lo que disminuiría los fenómenos de reconstitución inmune. A pesar de ello, es importante recalcar la importancia de la realización de controles periódicos para descartar serorreversión, lo que conlleva menor mortalidad y menor riesgo de hepatocarcinoma17. Por otro lado, actualmente las PVIH podrían querer beneficiarse de biterapias con fármacos que no tienen efecto frente al VHB18. En todas las cohortes de pacientes coinfectados las tasas de supresión de la carga viral del VHB con tenofovir son elevadas (en nuestro caso por encima de 90%).
Nuestro estudio presenta varias limitaciones. En primer lugar, es un estudio observacional retrospectivo de la práctica clínica habitual. Mientras que la medición de la carga viral del VHB es una práctica constante en nuestra rutina, la determinación de otros marcadores (HBsAg y HBeAg) no es tan constante. Por tanto, los datos de aclaramiento de dichos antígenos pueden estar infravalorados. En segundo lugar, en nuestro estudio incluimos los pacientes registrados en nuestra base de datos electrónica, que se empezó a generar a partir del año 2000. Se incluyeron, por tanto, los pacientes diagnosticados antes, pero que seguían activos en el año 2000, sin embargo pacientes perdidos o fallecidos anteriormente no se han podido incluir, luego es de esperar que la mortalidad sea aún mayor en el primer grupo de estudio. Por otro lado, en pacientes diagnosticados después del año 2010, el seguimiento es todavía corto para valorar la mortalidad. Entre el diagnóstico y la realización del FS pasó de mediana 10 años, habría sido más correcto que a todos los pacientes se les realizase esta prueba al diagnóstico, pero hasta después del año 2005 no estuvo disponible en nuestro centro como práctica clínica habitual. Por último, debemos resaltar que aunque en la consulta monográfica se encuentran en seguimiento pacientes de otras regiones españolas, la mayoría de los integrantes son residentes en la Comunidad de Madrid, por lo que los resultados podrían no ser completamente extrapolables a nivel nacional.
En conclusión, las características de las PVIH coinfectadas por el VHB en España están cambiando. Los pacientes diagnosticados antes del año 2010 tienen un peor pronóstico en cuanto a mortalidad y descompensación hepática que se debe principalmente a tener un mayor grado de fibrosis. En pacientes con control del VHB la fibrosis está asociada principalmente con historia previa de otras hepatopatías víricas.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores comunican no tener ningún conflicto de intereses relacionados con este trabajo
Nos gustaría agradecer a todos los profesionales de la salud por sus esfuerzos sobresalientes y su dedicación al cuidado del paciente. Nos gustaría dedicar este trabajo a nuestro paciente y su familia que han padecido la enfermedad.