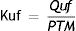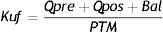Actualización en terapias renales
More infoLa posibilidad de filtrar agua y solutos de la sangre está determinada, en gran parte, por la naturaleza de las membranas que forman el filtro en las técnicas depurativas. Se describen aquí algunas características importantes como su superficie, su hidrofilia, su capacidad adsortiva, entre otras.
No todos los pacientes responden igual a todos los tipos de membrana y es necesario conocer por qué. Quizás una patología concreta precisa de una membrana determinada. Según el coeficiente de Sieving de las moléculas, obtendremos unos resultados u otros. El cálculo de la permeabilidad de la membrana al inicio del tratamiento convectivo ayuda a valorar cuánta superficie queda libre a lo largo de las horas de tratamiento.
The possibility of filtering water and solutes from the blood is conditioned by the nature of the filter membranes in purification techniques. Some important characteristics such as its surface, its hydrophilicity, its adsorptive capacity, among others, are described here.
Not all patients respond equally to all types of membrane, and it is necessary to know why. Perhaps a specific pathology needs a specific membrane. The Sieving coefficient help to know the depuration of the molecules. The calculation of the membrane permeability in convective treatments helps to assess how much surface is left free for the depuration.
El filtro que se utiliza en las terapias depurativas continuas es algo más que una simple membrana, pero esta es, sin duda, la parte más fundamental del mismo1. La membrana es aquella parte del filtro por cuyo interior pasa la sangre que se quiere depurar. Está distribuida a modo de cilindros dispuestos longitudinalmente y tiene una naturaleza «semipermeable», de forma que la sangre no pierde células, pero sí agua y algunos solutos2. Gracias a la nanotecnología se consiguen unos poros en las membranas de un tamaño determinado, uniformes y numerosos3.
La primera diálisis en humanos se realizó en Alemania, en 1924, por G. Haas, utilizando tubos de celoidina. Esta tecnología fue evolucionando durante todo el siglo xx, ofreciendo membranas celulósicas como el Cuprophan a finales de los años 50 y mejorándose posteriormente4.
El interés de las empresas por los tratamientos depurativos se remonta hasta 1965, cuando se empiezan a comercializar monitores y filtros con mejores prestaciones. La rápida evolución de las membranas ha ofrecido mayor biocompatibilidad, con menos reacciones adversas. Actualmente se comercializan las membranas sintéticas que se han venido desarrollando en las últimas décadas5. Este tipo de membranas han ido dando la oportunidad de tratar a pacientes verdaderamente lábiles.
ObjetivoOfrecer los conocimientos esenciales sobre membranas y su aplicación en terapias depurativas continuas.
Desarrollo del temaMorfologíaLas membranas están dispuestas, actualmente, a modo de finos capilares, distribuidos longitudinalmente a lo largo de la parte interna de los filtros y recogidos dentro de la carcasa que los mantiene sellados en sus extremos, de forma que no tienen contacto directo con el baño de diálisis, tal como vemos en la figura 1.
Un filtro es la parte fundamental de un equipo de depuración. Sin él no pueden separarse de la sangre ni el agua ni los solutos necesarios para lograr los objetivos de tratamiento que precisa el paciente. La distribución de las diferentes partes del filtro viene dada de la siguiente forma:
Compartimento hemático: es la parte más interna de la estructura del filtro. La constituyen las entradas superior e inferior del filtro y se encuentran selladas de tal forma que la sangre se reconduce hacia el interior de los capilares. Solo si alguno de estos capilares se fisurara podría pasar parte de la sangre al compartimento de baño. En ese caso el sensor de pérdidas hemáticas, situado en la línea del efluente, avisaría del cambio de tonalidad.
Compartimento de baño: es la estructura más externa del filtro. Tiene 2 entradas laterales, una por donde se introduce el líquido de baño y la otra que conectamos al efluente y que constituye el líquido de desecho.
Estas membranas, vistas al microscopio electrónico, presentan el aspecto que se muestra en la figura 2:
Los poros de las membranas presentan una estructura irregular y tienen un papel fundamental según la técnica que elijamos1. Las membranas más asimétricas son, por ejemplo, las de polisulfona. Por su parte, las más simétricas son las de acrilonitrilo y las celulósicas.
El tamaño de poro utilizado habitualmente en técnicas continuas es de alrededor de 40.000Da. Además de la superficie y morfología de sus poros, es importante el grosor de los capilares. Cuanto más gruesos son, más dificultad presentarán en el transporte de sustancias.
Propiedades de las membranasLas membranas de los filtros se diferencian por el tipo de material, por la carga eléctrica que se genera en su interior y por su permeabilidad al agua, entre otras características. No todas las membranas tienen el mismo comportamiento.
Inicialmente (a mediados del siglo pasado) se utilizaron membranas celulósicas que eran más finas, con mucha capacidad difusiva. El material sintético actual es más grueso, aunque a lo largo de los años se ha ido haciendo más delgado. Actualmente se utiliza el acrilonitrilo (AN69) y la polisulfona. El mecanismo difusivo en general es bueno en cualquier tipo de membrana. La eficacia convectiva en las membranas sintéticas es mejor que en las celulósicas. Esto último parece relacionarse también con beneficios en la supervivencia en algunos casos6.
Otro material interesante es el polimetil metacrilato, con capacidad adsortiva1 y ciertos beneficios para algunas enfermedades7. Algunos estudios recientes demuestran, aunque con poca muestra, que ciertas citoquinas se depuran mejor con este tipo de membrana8, pero para otras es mejor la AN69ST (acrilonitrilo con superficie tratada). Otros autores muestran trabajos en cuanto a supervivencia, comparando estas 2 membranas y mostrando curvas de Kaplan Meier claramente diferentes a favor de la AN69ST9.
Algunos pacientes han sufrido reacciones de hipersensibilidad durante los procesos dialíticos. Los materiales ya comentados en el párrafo anterior tienen muy pocas reacciones de hipersensibilidad, aunque estas también se han visto relacionadas con el proceso de esterilización y no tanto con la naturaleza de la membrana. También parece estar relacionada con la activación del complemento otra propiedad de los materiales denominada hidrofilia. Cuanto más hidrofílica es una membrana, más bioincompatible y mayor capacidad difusiva. Por el contrario, cuanto más hidrofóbica (no interacciona con el agua), mayor coeficiente de ultrafiltración y más biocompatible5.
En cuanto a la polaridad de la membrana, se refiere a la carga eléctrica de su superficie. Si tiene polaridad la membrana siempre es negativa, con variaciones en el potencial. Las membranas de acrilonitrilo, como la AN69, tienen un potencial de superficie de –100mV y la polisulfona de 20mV. La polaridad es la responsable, en parte, del proceso difusivo. Otra característica de esta polaridad es la creación de bradiquinina, que puede ocasionar reacciones anafilácticas a los pacientes que toman IECA. No sería aconsejable para estos pacientes las membranas AN6910.
La permeabilidad a los solutos viene determinada por el KoA; es el llamado coeficiente de transferencia de masas del dializador. Es el producto de la permeabilidad de dializador (Ko) por su superficie (A). Sus unidades son ml/min. Está modulado por la porosidad y el espesor de la membrana y depende del tamaño del soluto, del flujo de sangre y del líquido de diálisis11.
Otro factor importante en las características de las membranas es su superficie. Este parámetro se mide en metros cuadrados. Cuanta más superficie mayor capacidad depurativa. Se calcula la superficie de membrana necesaria en un tratamiento según el peso del paciente. Es interesante el trabajo realizado por Lorenzin et al.12, donde estudian membranas de 0,1-0,2 y 0,35m2 aplicadas a pacientes pediátricos de bajo peso con el monitor pediátrico CARPEDIEM® (iniciado por la empresa Bellco, asumida actualmente por Medline).
En adultos se suelen utilizar membranas por encima de 1m2, que es extrapolable a la superficie de «membrana» del riñón adulto.
Se recoge (tabla 1) un ejemplo de los diversos tamaños de filtros y superficies de membrana, de una empresa que distribuye en nuestro país, que se aplicarán a pacientes muy diversos.
Coeficiente de cribado o de SievingEs la relación que existe entre la concentración del soluto en el líquido ultrafiltrado y en el plasma. Cuanto más cercano a 1 sea, indicará que es más fácil depurar ese soluto.
Este coeficiente nos ayuda en el control de la terapia, ya que si alguna molécula, con un coeficiente de cribado elevado, no queremos perderla, habremos de procurar reponerla o velar por su contenido en la bolsa de tratamiento. Por ejemplo: si nuestro objetivo para el potasio del paciente es de 4 no podemos poner bolsas con potasio menor de 4 si el del paciente ha llegado a esa cifra, ya que seguiría bajando. El coeficiente de Sieving para esta molécula es de 0,9.
Hay sustancias como la urea y la creatinina cuyo coeficiente de Sieving es muy cercano a 1, y eso ya interesa de cara a la depuración de estas moléculas, pero hay otras que también tienen este valor y no interesa depurarlas. En estos casos deben reponerse a la sangre de nuevo si sus cifras en plasma bajan en exceso.
En cuanto a los fármacos que recibe un paciente es importante conocer qué parte de un fármaco puede asociarse a proteínas plasmáticas. El poro de la membrana no permitirá que se elimine la fracción del fármaco unida a proteínas. En esta línea se centran algunos estudios como los realizados por Maynar13 y más recientemente por Körtge14, por poner algunos ejemplos.
Se puede ver en la tabla 2 algún ejemplo de coeficientes de cribado.
Constante de ultrafiltradoSegún la naturaleza de la membrana la temperatura de la sangre, su hematocrito y la cantidad de agua que queramos extraer desde el interior del capilar hacia fuera, se genera lo que se ha llamado «constante de ultrafiltrado» (Kuf). Este parámetro indica la permeabilidad al agua de una membrana en unas condiciones determinadas.
Se define la Kuf como la cantidad de líquido ultrafiltrado que sale por los capilares de una membrana de 1m2, por unidad de tiempo y por cada mmHg de presión transmembrana generada. Veamos cómo calcularlo:
Donde Quf es el flujo convectivo, es decir, la suma de todos los líquidos de sustitución (pre y pos) y el balance. Todos estos líquidos han de salir de dentro del capilar hacia el efluente. No se contabiliza el baño de diálisis, ya que este solo pasa por la superficie externa del capilar, no saldrá del interior de este hacia fuera. La PTM sería la presión transmembrana que nos indica el propio monitor. Quedaría, por tanto:
Si este valor lo conocemos al inicio del tratamiento podremos calcularlo a lo largo de las horas y nos dará idea de si la superficie de la membrana va perdiendo capacidad. De ser así la PTM irá subiendo y el tratamiento (convectivo) tiene dificultad para ser obtenido al otro lado de la membrana. La Kuf será cada vez más baja a medida que avanzan las horas.
Se ejemplifica aquí: iniciamos una terapia con 2.500ml/h de ultrafiltrado en un filtro con 1m2 de membrana y la PTM que nos da el monitor es de 90mmHg.
Kuf=2.500/90=22ml/mmHg/h/m2
A las 10horas de tratamiento, con los mismos parámetros, la PTM ha subido a 120mmHg.
Kuf=2.500/120=20ml/mmHg/h/m2
Cuando han pasado 3horas más volvemos a calcularlo y vemos que la PTM ha subido a 250mmHg.
Kuf=2.500/250=10ml/mmHg/h/m2
Vemos aquí un tratamiento convectivo que, en un inicio, tenía una PTM de 90 y se ha pasado a una PTM de 250. El criterio de retornar o no la sangre al paciente podría ser el cálculo de la constante de ultrafiltrado que, como vemos, ha pasado de ser 22 (en una permeabilidad del 100% de la membrana) a ser 10 (equivalente a una permeabilidad del 45%).
En este punto sería oportuno tomar una decisión frente al recambio del circuito, ya que el filtro ha perdido una buena parte de su funcionalidad. La evolución de los parámetros objetivo (urea, potasio…u otras sustancias) será mucho más lenta si prolongamos este filtro e incluso exponemos la sangre del circuito a la situación de no poder ser retornada al paciente en breve tiempo.
Este parámetro no es constante ni sirve el mismo dato para todas las membranas del mercado, cada una de ellas tiene un valor de inicio. Incluso la Kuf depende del tratamiento (ml/kg/h), como publicaron en 2011 Ficheux et al.15, aunque esta publicación no estaba exenta de controversias16 que indicaban mejorar las mediciones de la PTM, entre otros problemas.
Lo que sí es cierto es que, si queremos utilizarlo, hemos de calcularlo a pie de cama, con el paciente conectado y el circuito ya estabilizado con la sangre en su interior, e ir calculándolo a lo largo del tiempo que dure el tratamiento convectivo.
Un matiz importante aquí es que, si un tratamiento convectivo se programa con un flujo muy elevado en una membrana con poca permeabilidad al agua, la PTM será alta. Ya se ha dicho que no todas las membranas tienen el mismo valor de Kuf, por su propia naturaleza. Si queremos hacer tratamientos convectivos con volumen elevado deberíamos elegir las membranas que generen menos PTM, de entrada. Este es el caso de la polisulfona.
De aquí se deduce que una cifra de PTM aislada no es indicativa de nada concluyente. Podemos iniciar un tratamiento convectivo con una PTM de 200 y estar en una permeabilidad de filtro del 100%. Por tanto, todos los datos importantes deben ser tenidos en cuenta a la hora de valorar estos tratamientos.
ConclusionesLa optimización de un tratamiento depurativo incluye muchos ítems, pero uno de ellos y sumamente importante es la membrana del filtro. Si conocemos bien su naturaleza, su capacidad depurativa, su hidrofilia, entre otros parámetros, podremos llevar la terapia del paciente grave a una situación más óptima.
No todos los hospitales pueden disponer de variedad de materiales y han de estar condicionados a lo que la oferta de la zona les proporcione, entre otros condicionantes. No obstante, el conocer lo que tenemos a nuestra disposición ayuda mucho a valorar la terapia y a ajustar el tratamiento según la evolución del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.