A pesar del desarrollo y de la incorporación de nuevas estrategias terapéuticas, como son la terapia biológica y las moléculas pequeñas, los corticoides aún cumplen un papel importante en la inducción de la remisión de la enfermedad inflamatoria intestinal (EII). Variables como la indicación en el momento apropiado, la dosis correcta, la duración en intervalos adecuados, la seguridad de estos fármacos y las alternativas farmacológicas disponibles deben ser siempre consideradas por el equipo tratante al momento de su indicación en pacientes con EII. Aunque el uso de corticoides es considerado un marcador de calidad de atención en pacientes con EII, en la actualidad el uso de estos fármacos en la práctica clínica de la EII dista mucho de ser el más correcto. Este artículo de revisión no pretende ser solamente una revisión clásica de las indicaciones de los corticoides, sino que explicamos aquí los escenarios en los que en nuestra opinión no serían una opción adecuada para nuestros pacientes, así como los errores más frecuentes que cometemos en nuestra práctica clínica diaria al utilizarlos.
Despite the development and incorporation of new therapeutic strategies, such as biologic therapy and small molecules, corticosteroids still play an important role in inducting inflammatory bowel diseases (IBD) remission. Variables like indicating the right doses at the right time, in adequate intervals, the security of these drugs and the pharmacological alternatives available must be considered by the providers when they are indicated to patients with IBD. Although the use of corticosteroids is considered as a marker of quality of care in patients with IBD, the use of these drugs in the clinical practice of IBD is far from being the correct one. This review article is not intended to be just a classic review of the indications for corticosteroids. Here we explain the scenarios in which, in our opinion, steroids would not be an appropriate option for our patients, as well as the most frequent mistakes we make in our daily practice when using them.
Prácticamente tras su introducción en la terapéutica, como tratamiento de la artritis reumatoide hace más de 70años, los corticoides se transformaron en fármacos esenciales en el tratamiento de las enfermedades inmunomediadas. La enfermedad inflamatoria intestinal (EII) no fue una excepción, y tras numerosas observaciones clínicas y el primer ensayo aleatorizado y controlado llevado a cabo en Gastroenterología por Sidney Truelove, Lloyd Witts y un grupo de pioneros ingleses, se situaron como el tratamiento de elección de los brotes moderados a graves, primero de la colitis ulcerosa (CU) y luego de la enfermedad de Crohn (EC). Después de 6semanas, el 41,3% de los pacientes con CU tratados con cortisona 25mg cuatro veces al día estaban en remisión clínica, comparado con 15,8% en el grupo tratado con placebo (p<0,001). Además, la evaluación con sigmoidoscopia también mostró una diferencia significativa en el logro de remisión o respuesta endoscópica (p<0,02)1. Por otra parte, el National Cooperative Crohn's Disease Study (NCCDS) mostró que, en 250 pacientes con EC activa, el uso de prednisona 0,5 a 0,75mg/kg/día con disminución por esquema durante 17semanas permitió una remisión clínica del 60% de los pacientes en comparación al 30% en el grupo tratado con placebo2. Sin embargo, casi 70años después de la publicación de estos ensayos, el uso de corticoides en la práctica clínica de la EII dista mucho de ser el más correcto. Un estudio que incluyó 2.385 pacientes reportó que el 14,8% cumplían la definición de exceso o corticodependencia, siendo el uso de corticoides evitable en el 50,7% de los casos (incidencia anual: 6,2%)3. Además, recientemente un estudio español retrospectivo, que incluyó 392 pacientes con EII que estaban en remisión en tratamiento inmunosupresor, mostró que el 23% recibieron al menos un curso de corticoides durante el período de seguimiento4; sin embargo, esta estrategia fue eficaz a largo plazo tan solo en un tercio de los pacientes. Variables como la indicación en el momento apropiado, la dosis correcta, la duración en intervalos adecuados y la seguridad de estos fármacos deben ser siempre consideradas por el equipo tratante al momento de su indicación en pacientes con EII5. Sin duda, una educación constante a los pacientes, a los médicos de familia y a los subespecialistas por parte de los integrantes del Programa de EII es fundamental para disminuir el uso excesivo y prolongado de corticoides6. Pensamos que revisar los conceptos básicos, con la evidencia actualmente disponible, puede llevarnos a evitar errores que son, todavía, demasiado comunes.
Para esta revisión, se realizó una búsqueda electrónica de la literatura utilizando la base de datos MEDLINE (Pubmed), Google Scholar y ResearchGate. Solo se incluyeron artículos publicados en inglés y en español. Las palabras clave utilizadas en la búsqueda fueron: enfermedad inflamatoria intestinal, enfermedad de Crohn, colitis ulcerosa, corticoesteroides, corticoides, terapia y seguridad. Se incluyeron tanto estudios retrospectivos como prospectivos y con diseño transversal, además de revisiones sistemáticas.
Corticoides: conceptos generales y formulacionesLos corticoides son agentes antiinflamatorios indicados para el tratamiento de los pacientes con CU y EC que presenten una actividad inflamatoria intestinal moderada a grave o un brote leve refractario a mesalazina en dosis adecuadas7-9. Estos fármacos son compuestos altamente lipofílicos, por lo que son ampliamente biodisponibles y son transportados a nivel sanguíneo por la globulina transportadora de corticoides y, en menor medida, por la albúmina. Los corticoides tienen la capacidad de difundir a través de las membranas celulares e interactuar con el receptor de glucocorticoides. Respecto de su modo de acción, se han sugerido diversos mecanismos, destacando la inhibición de proteínas proinflamatorias como el factor nuclear ?ß y el dominio de transactivación independiente del ligandoAP-1; disminución de la expresión de citoquinas proinflamatorias como IL-1α, IL-1ß e IL-8, y de mediadores como el factor de crecimiento transformante-ß3 e IL-10; inhibición de la proliferación de linfocitosT yB, y promover un perfil de macrófagos tolerantes10.
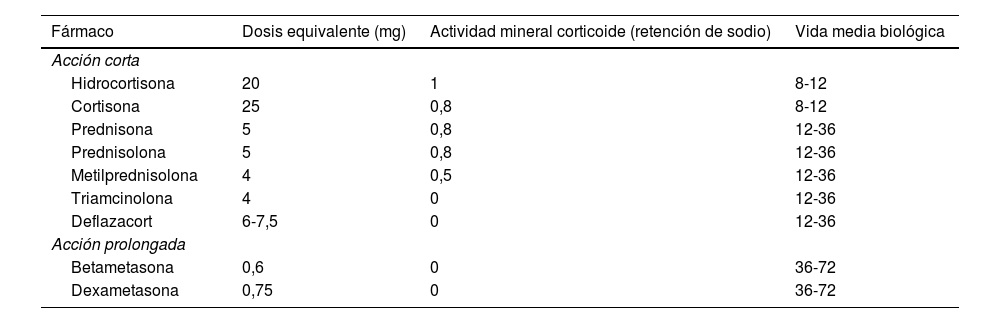
Las formulaciones de los corticoides en la EII incluyen fármacos intravenosos (hidrocortisona, metilprednisolona y dexametasona); orales con efecto sistémico (prednisona, prednisolona y deflazacort) y acción tópica (budesonida, budesonida multimatrix [MMX] y beclometasona dipropionato), y de administración rectal con efecto sistémico (hidrocortisona, prednisolona, triamcinolona, metilprednisolona y betametasona) y acción tópica (budesonida, beclometasona y prednisolona-metasulfobenzoato)9. Las equivalencias en las dosis de los corticoides sistémicos se aprecian en la tabla 1. Antes de indicar cualquiera de estos fármacos en un brote de EC o CU, debemos considerar no solo la gravedad de la actividad inflamatoria sino también la extensión afectada, los antecedentes del paciente y las alternativas farmacológicas disponibles7-9. Es este enfrentamiento el que permitirá definir la mejor estrategia terapéutica con el fin de mejorar la calidad de vida de los pacientes con EII.
Equivalencias en las dosis de los corticoides sistémicos utilizados en pacientes con enfermedad inflamatoria intestinal
| Fármaco | Dosis equivalente (mg) | Actividad mineral corticoide (retención de sodio) | Vida media biológica |
|---|---|---|---|
| Acción corta | |||
| Hidrocortisona | 20 | 1 | 8-12 |
| Cortisona | 25 | 0,8 | 8-12 |
| Prednisona | 5 | 0,8 | 12-36 |
| Prednisolona | 5 | 0,8 | 12-36 |
| Metilprednisolona | 4 | 0,5 | 12-36 |
| Triamcinolona | 4 | 0 | 12-36 |
| Deflazacort | 6-7,5 | 0 | 12-36 |
| Acción prolongada | |||
| Betametasona | 0,6 | 0 | 36-72 |
| Dexametasona | 0,75 | 0 | 36-72 |
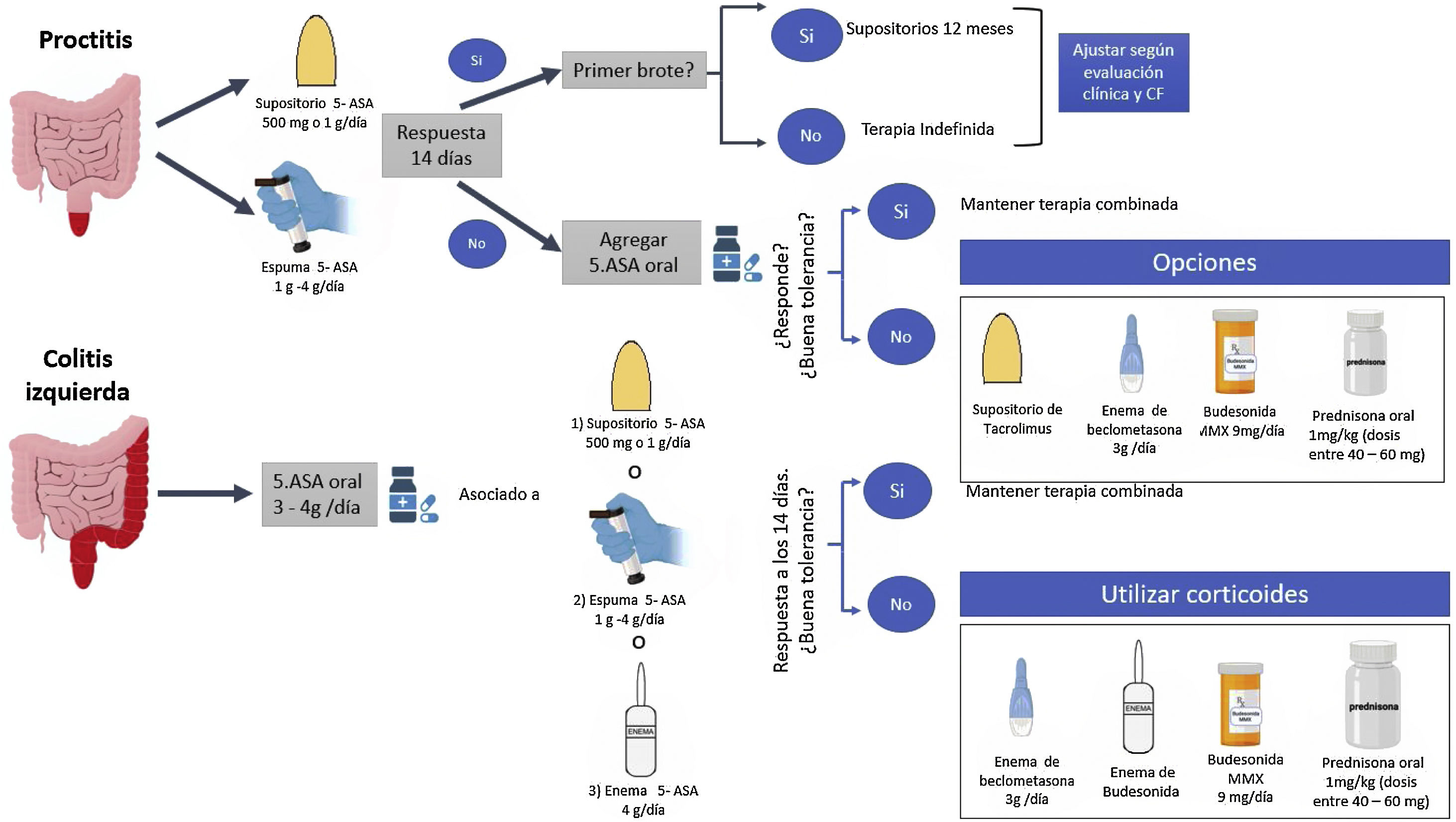
Diferentes guías han señalado que, debido a la mayor efectividad y tolerancia por parte del paciente, la mesalazina debe ser la primera opción para inducir la remisión en brotes de CU leve a moderada, reservando los corticoides por vía oral o tópicos en caso de refractariedad a la mesalazina, alergia o intolerancia a la misma7-9 (tabla 2; fig. 1).
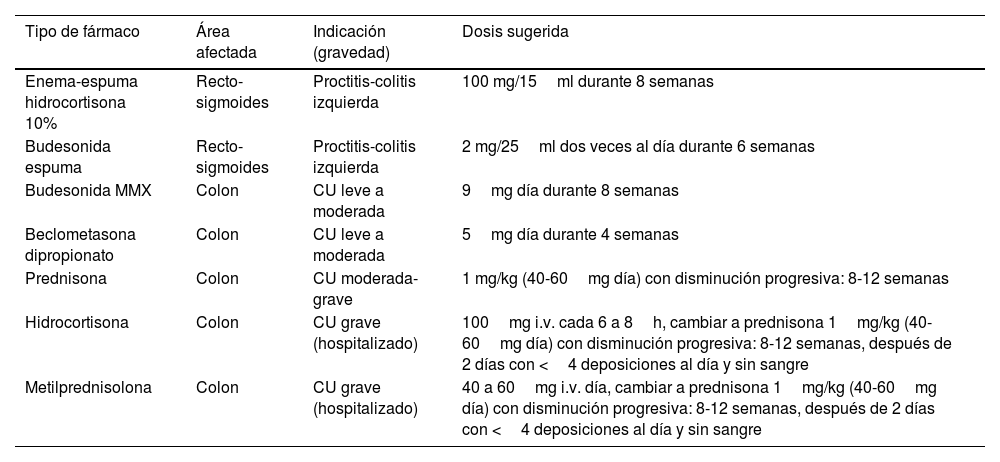
Indicaciones de uso de corticoides en la colitis ulcerosa
| Tipo de fármaco | Área afectada | Indicación (gravedad) | Dosis sugerida |
|---|---|---|---|
| Enema-espuma hidrocortisona 10% | Recto-sigmoides | Proctitis-colitis izquierda | 100 mg/15ml durante 8 semanas |
| Budesonida espuma | Recto-sigmoides | Proctitis-colitis izquierda | 2 mg/25ml dos veces al día durante 6 semanas |
| Budesonida MMX | Colon | CU leve a moderada | 9mg día durante 8 semanas |
| Beclometasona dipropionato | Colon | CU leve a moderada | 5mg día durante 4 semanas |
| Prednisona | Colon | CU moderada-grave | 1 mg/kg (40-60mg día) con disminución progresiva: 8-12 semanas |
| Hidrocortisona | Colon | CU grave (hospitalizado) | 100mg i.v. cada 6 a 8h, cambiar a prednisona 1mg/kg (40-60mg día) con disminución progresiva: 8-12 semanas, después de 2 días con <4 deposiciones al día y sin sangre |
| Metilprednisolona | Colon | CU grave (hospitalizado) | 40 a 60mg i.v. día, cambiar a prednisona 1mg/kg (40-60mg día) con disminución progresiva: 8-12 semanas, después de 2 días con <4 deposiciones al día y sin sangre |
En la CU izquierda leve a moderada refractaria a dosis adecuadas de mesalazina (tópica y por vía oral), agregar corticoides tópicos podría ofrecer un beneficio al combinarlos. Sin embargo, la evidencia de añadir corticoide tópico a mesalazina tópica es escasa11. En 60 pacientes con CU izquierda se observó que el uso combinado de enemas de beclometasona dipropionato (3mg/100ml) y enemas de mesalazina (2g/100ml) por 28días fue más efectivo en alcanzar una mejoría endoscópica e histológica comparado con cada uno de estos fármacos como monoterapia (mejoría endoscópica 100% vs. 75% vs. 71%, p=0,021; mejoría histológica 0% vs. 50% vs. 48%, p=0,009 para terapia combinada, beclometasona dipropionato y mesalazina monoterapia, respectivamente)11. Sin embargo, la mayor efectividad de la combinación corticoides/mesalazina tópica no ha sido confirmada en la proctitis ulcerosa12. La budesonida tópica ha demostrado tener un perfil de seguridad adecuado para inducir la remisión en pacientes con proctitis ulcerosa o CU izquierda, considerando incluso los efectos clínicos sobre el eje hipotálamo-hipófisis-adrenal13. Dado la tolerancia a la espuma y la facilidad con la cual puede aplicarse, un mayor porcentaje de pacientes prefieren esta vía de administración14. El uso de enema de hidrocortisona puede ser una estrategia en pacientes con CU izquierda; sin embargo, deben considerarse los efectos adversos15.
Revisiones sistemáticas han sugerido el uso de budesonida MMX (budesonida de liberación prolongada)16 y beclometasona dipropionato17 en pacientes con CU leve a moderada que sean intolerantes a la mesalazina o presenten un brote de actividad inflamatoria refractaria a la mesalazina oral en dosis adecuadas (fig. 1). Un estudio aleatorizado controlado que incluyó 230 pacientes tratados con budesonida MMX y 238 con placebo mostró que un mayor porcentaje de pacientes tratados con este fármaco alcanzaron la combinación de remisión clínica y endoscópica a las 8semanas al compararlo con placebo (13% vs. 7.5%, p=0,049)18. Un metaanálisis que incluyó 31 estudios con un total de 5.689 pacientes mostró que la budesonida MMX estaba asociada a una menor presencia de eventos adversos secundarios a corticoides que con el uso de corticoides sistémicos (OR: 0,25; IC95%: 0,13-0,49)19. Este menor efecto sistémico podría evitar los efectos secundarios de los corticoides, reduciendo de manera sustancial el costo económico de la atención médica en pacientes con CU leve a moderada20. El análisis por subgrupos en los estudios COREI y COREII mostró que, comparada con placebo, la eficacia de la budesonida MMX en obtener la remisión clínica y endoscópica fue significativamente mayor en la CU izquierda pero no en pacientes con actividad inflamatoria extensa21,22. Estos resultados han sido confirmados en un metaanálisis Cochrane16. Es importante mencionar que otras formulaciones de budesonida no han mostrado ser efectivas en el tratamiento de la CU, tal vez por no conseguir una distribución adecuada en la superficie del colon izquierdo16. Por otra parte, una revisión sistemática que incluyó 5 estudios controlados y aleatorizados con 888 pacientes con CU leve a moderada comparó la efectividad de la beclometasona dipropionato 5mg/día versus un grupo tratado con mesalazina (4estudios) y prednisona (1estudio)21. Los resultados mostraron que a las 4 semanas de tratamiento la beclometasona dipropionato fue más efectiva que la mesalazina en inducir la remisión clínica (OR: 1,55; IC95%: 1,00-2,40; p=0,05). Además, la beclometasona no sería inferior a la prednisona sistémica en términos de la respuesta clínica y la curación endoscópica, manteniendo además un adecuado perfil de seguridad17. Estudios realizados hace aproximadamente cinco décadas también demostraron la superioridad de la prednisona sobre la sulfapiridina en brotes leve a moderados de CU23,24, siendo una opción en pacientes que presenten alergia o intolerancia a la mesalazina, sean refractarios a la misma o no respondan a corticoides de segunda biodisponibilidad (budesonida MMX o dipropionato de beclometasona).
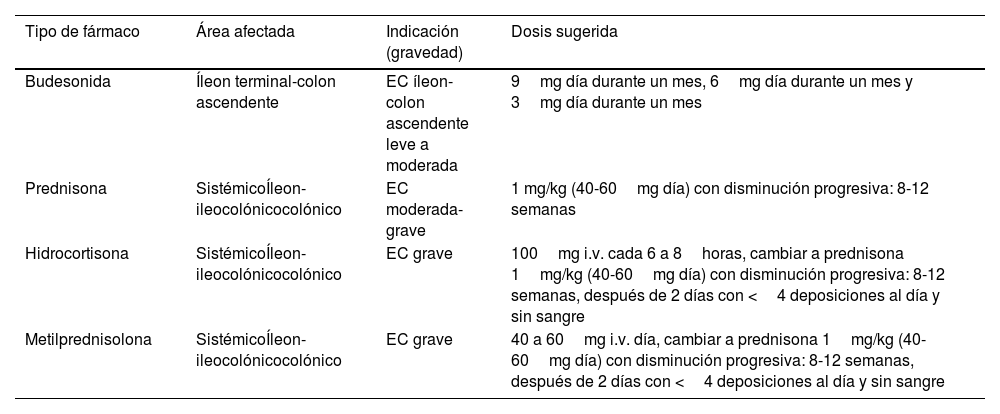
Inducción de la remisión brote leve a moderado de enfermedad de CrohnSimilar a lo mencionado para la CU, antes de indicar el uso de corticoides en pacientes con EC debemos considerar no solo la gravedad del brote sino también la extensión afectada y los antecedentes del paciente. Con estos factores pronósticos y la estrategia Top-down, los corticoides cada vez tienen menos indicación, quedando tan solo indicados en el debut de brote leve ileal o íleon-colon ascendente o en el debut de brote moderado de cualquier localización asociado a inmunosupresores (tiopurínicos o metotrexato) en pacientes sin factores de riesgo7,25.
Aunque la budesonida puede ser menos efectiva que los corticoides sistémicos, su mejor perfil de seguridad permite su uso en pacientes con EC de localización ileal o íleon-colon ascendente con actividad inflamatoria leve a moderada (tabla 3)7,25. Una revisión sistemática Cochrane que incluyó tres estudios aleatorizados y controlados mostró que en este escenario la budesonida fue superior a placebo en inducir la remisión clínica (RR: 1,93; IC95%: 1,37-2,73)26. Esta revisión, así como un estudio posterior que incluyó 112 pacientes, mostraron que budesonida 9mg no es inferior a mesalazina en dosis de 3 a 4,5g en obtener la remisión clínica en pacientes con EC ileal o ileocólica26,27. Un estudio que incluyó 201 pacientes con EC leve a moderada (100 pacientes tratados con budesonida oral y 101 con prednisona sistémica) mostró que la remisión clínica fue similar en ambos grupos (51% y 52%, respectivamente). Sin embargo, el desarrollo de eventos adversos fue significativamente menor en el grupo tratado con budesonida (14% vs. 30%; p=0,006)28. A pesar de estos resultados, otro estudio demostró que solo el 11,5% de los pacientes con EC habían sido tratados con budesonida durante los primeros 5años de diagnóstico29. El acceso y el costo económico de estos fármacos podrían explicar su subutilización30. Aunque, que sepamos, no existen estudios de budesonida MMX ni de dipropionato de beclometasona en pacientes con EC de localización cólica, su uso podría ser planteado en pacientes con actividad inflamatoria leve y de esta manera evitar los eventos adversos a los corticoides sistémicos.
Indicaciones de uso de corticoides en la enfermedad de Crohn
| Tipo de fármaco | Área afectada | Indicación (gravedad) | Dosis sugerida |
|---|---|---|---|
| Budesonida | Íleon terminal-colon ascendente | EC íleon-colon ascendente leve a moderada | 9mg día durante un mes, 6mg día durante un mes y 3mg día durante un mes |
| Prednisona | SistémicoÍleon-ileocolónicocolónico | EC moderada-grave | 1 mg/kg (40-60mg día) con disminución progresiva: 8-12 semanas |
| Hidrocortisona | SistémicoÍleon-ileocolónicocolónico | EC grave | 100mg i.v. cada 6 a 8horas, cambiar a prednisona 1mg/kg (40-60mg día) con disminución progresiva: 8-12 semanas, después de 2 días con <4 deposiciones al día y sin sangre |
| Metilprednisolona | SistémicoÍleon-ileocolónicocolónico | EC grave | 40 a 60mg i.v. día, cambiar a prednisona 1mg/kg (40-60mg día) con disminución progresiva: 8-12 semanas, después de 2 días con <4 deposiciones al día y sin sangre |
En pacientes con EC que presenten un brote leve a moderado los corticoides sistémicos (prednisona) podrían ser considerados en pacientes con enfermedad ileocecal que no responda a budesonida o en aquellos con enfermedad colónica que sean alérgicos, intolerantes o no respondan a sulfasalazina en dosis altas31,32.
Inducción de la remisión brote moderado a grave de colitis ulcerosaEl uso de corticoides por vía oral ha demostrado su efectividad en inducir la remisión en CU moderada a grave y varias guías han recomendado su uso7-9. El primer estudio controlado que validó el uso de corticoides frente a placebo fue publicado en 19551. Este estudio, que incluyó 103 pacientes, reportó que el 41,3% de los pacientes tratados con cortisona alcanzaron la remisión clínica, frente al 15,8% en el grupo tratado con placebo (p<0,001). Un metaanálisis que incluyó 5 estudios aleatorizados y controlados confirmó la efectividad de los corticoides sistémicos sobre placebo para inducir la remisión en pacientes con CU (RR de remisión: 0,65; IC95%: 0,45-0,93), con un número necesario a tratar (NNT) de 333. La dosis de inicio de prednisona debe ser ajustada de acuerdo al peso del paciente (1mg/kg de peso), con un rango de 40-60mg día (tabla 2), evaluando la respuesta clínica dentro de los primeros 7días8,34. Dosis de inicio <15mg no han demostrado ser efectivas33,35. Aunque dosis >60mg de prednisona han demostrado ser efectivas, estas no son superiores a la reportadas con dosis entre 40 y 60mg36. Un estudio italiano mostró que el 22% de los gastroenterólogos utilizaban la dosis de inicio de prednisona de acuerdo al peso del paciente, mientras que el 50% usaban una dosis fija, predeterminada, siendo en la mayoría de los casos 50-60mg/día37. Aunque las guías recomiendan disminuir la prednisona de manera progresiva, el esquema a utilizar varía considerablemente, siendo el rango entre las 8 y las 12 semanas7,8,33. Esta uniformidad en el retiro de los corticoides también ha sido observada en los diferentes estudios clínicos5,38. La velocidad de disminución de la dosis de este fármaco debería estar guiada por la evolución de los síntomas clínicos, la exposición acumulada a los corticoides y el inicio de acción de las terapias a usar para mantener la remisión (mesalazina, tiopurínicos, terapia biológica y moléculas pequeñas). Un estudio demostró que solo el 40% de los gastroenterólogos utilizan un régimen personalizado definido por las características del paciente37. Aunque el régimen de reducción gradual de los corticoides utilizado no parece alterar la evolución de los pacientes39, sí nos parece importante recalcar dos puntos: para iniciar la disminución de la dosis el paciente debe estar en remisión sintomática, y eso sucede generalmente en las primeras 1-2semanas. Sin embargo, podría mantenerse la dosis plena una tercera semana. En cuanto al segundo punto, el corticoide no debería, a ser posible, mantenerse más allá de 12 a 16semanas, y habría que buscar alternativas en este escenario.
Inducción de la remisión brote grave de colitis ulcerosaAproximadamente el 25% de los pacientes con CU desarrollarán ya sea al debut o durante su evolución un episodio de actividad inflamatoria grave con manifestaciones sistémicas y síntomas gastrointestinales que pueden poner en riesgo su vida, con la eventual necesidad de cirugía40. El manejo inicial con corticoides intravenosos (i.v.) sigue siendo de primera elección, cambiando la historia natural de la CU grave no tratada con una disminución de la mortalidad de 24% al 7%41,42. Los fármacos sugeridos en este escenario son hidrocortisona 100mg cada 6 a 8horas o metilprednisolona 40-60mg día (tabla 2)7,38. Este último fármaco podría ser utilizado como primera opción en pacientes con hipopotasemia, dado su menor efecto mineralocorticoide al compararlo con hidrocortisona43. Sin embargo, cerca del 30% al 40% de los pacientes con CU grave tienen una respuesta parcial o no responden a los corticoides i.v., cursando con tasas de colectomía que van desde el 25% al 30%44, porcentajes que se mantienen en la actualidad a pesar de la introducción de los fármacos biológicos. El manejo protocolizado y multidisciplinario de esta entidad con una evaluación temprana (día3 a5) de la respuesta a corticoides y el uso de terapias de rescate de segunda línea ha permitido mejorar el pronóstico de estos pacientes7-9. Una cohorte retrospectiva recientemente publicada que incluyó 50 episodios de CU grave observó que el 88% de los brotes fueron tratados con corticoides i.v. como terapia de primera línea (mediana: 3días; rango: 1-7). El 59% evolucionaron de manera favorable, sin presentar un nuevo brote o sin necesidad de hospitalización o de colectomía en los siguientes tres meses45. Sin embargo, es importante considerar que la exposición previa a corticoides podría afectar la efectividad de esta terapia de primera línea. Este estudio mostró que pacientes sin exposición previa a corticoides i.v. presentaron una mayor respuesta a corticoides que el grupo con antecedentes de uso previo de este fármaco (100% vs. 19%, p=<0,001)45. Estos resultados sugieren que en este grupo de pacientes el inicio del tratamiento del brote grave debería ser directamente con alguna estrategia de segunda línea (inhibidores calcineurínicos, infliximab o cirugía). Por otra parte, otra cohorte, con el 26% de pacientes expuestos a terapia biológica (19% anti-TNF y 7% anti-integrinas), documentó un 41% de corticorrefractariedad aplicando criterios de Oxford, reportando un mayor riesgo de colectomía en este grupo de pacientes versus los no expuestos a terapia biológica (32% y 16%, respectivamente)46. Futuros estudios podrían confirmar estos resultados y, con ello, personalizar el tratamiento de la CU grave. Con esta evidencia y con dichos porcentajes, deberíamos pensarnos dos veces la utilización de corticoides i.v. en brote grave de pacientes con CU que ya hayan tenido un brote grave rescatado con corticoides i.v. o que hayan estado expuestos o estén en tratamiento con fármacos biológicos. Es importante considerar que, a diferencia de la terapia biológica anti-TNF, el uso de corticoides se ha asociado a un mayor riesgo de tromboembolismo venoso y arterial en pacientes con EII47-49. Este riesgo debe ser considerado cuando decidimos entre el uso de corticoides o de infliximab para el manejo de la CU grave.
Finalmente, si al 3.er-5.o día existe una respuesta favorable al tratamiento con corticoides i.v., este debe ser mantenido hasta que el paciente presente menos de 4 deposiciones por día sin sangre durante dos días consecutivos. Una vez alcanzado este escenario, los corticoides parenterales se pueden cambiar a prednisona oral 1mg/kg (dosis total rango de 40-60mg) con una disminución gradual. Si el brote grave ha respondido a corticoides y el paciente es naïve a todo tipo de tratamiento (por ejemplo, debut), una opción es iniciar tiopurínicos. La mesalazina también podría ser una estrategia en este escenario, sobre todo en pacientes que presenten una respuesta rápida a los corticoides9. Sin embargo, su grado de éxito a los 6meses es inferior al 20% y, por tanto, serían pacientes a vigilar estrechamente para activar una vía de rescate de forma rápida si existen evidencias de actividad inflamatoria. En pacientes que tengan una respuesta parcial o no respondan a los corticoides i.v. es necesario plantear terapias de segunda línea o de rescate, como el uso de anti-calcineurínicos (ciclosporina o tacrolimus) o terapia biológica con infliximab40.
Inducción de la remisión brote moderado a grave de enfermedad de CrohnLos corticoides sistémicos, ya sea por vía oral o i.v., pueden ser indicados en pacientes con EC moderada-grave o grave, respectivamente (tabla 3)7,25. Sin embargo, considerando las nuevas opciones terapéuticas (terapia biológica anti-TNF, anti p-40 IL-12/23 y anti-integrinas) y la efectividad de la estrategia Top-down, los corticoides solo deberían ser indicados al debut de un brote moderado de cualquier localización asociado a inmunosupresores (tiopurínicos o metotrexato) en pacientes sin factores de riesgo.
La dosis de prednisona y el esquema de disminución son similares a lo descrito en pacientes con CU. Recientemente, un metaanálisis que incluyó 14 estudios controlados (4.354 pacientes) sugiere que la combinación de corticoides y un anti-TNF no aumentaría la probabilidad de alcanzar la remisión clínica comparado con el uso de este biológico en monoterapia (32% vs. 35,5%, respectivamente; OR: 0,93; IC95%: 0,74-1,17)50, sugiriendo nuevamente que la utilización de corticoides no estaría indicada en pacientes que ya se encuentren en tratamiento inmunosupresor o que necesiten iniciar terapia biológica, y solo aumentaría la morbilidad.
Inducción de la remisión en reservoritisLa proctocolectomía con reservorio ileoanal es el tratamiento quirúrgico de elección en pacientes con CU refractarios a los diferentes fármacos51,52. Aunque esta estrategia mejora la calidad de vida de los pacientes y mantiene la ruta defecatoria (comparado con la ileostomía permanente), esta no está exenta de complicaciones anatómicas o inflamatorias durante su evolución51. La budesonida por vía oral o tópica ha sido sugerida en distintos escenarios en pacientes con reservoritis. La budesonida tópica puede ser una opción en pacientes con reservoritis aguda. Un estudio aleatorizado que incluyó 26 pacientes con reservoritis aguda mostró que budesonida en enemas (2mg/100ml) durante 6 semanas tiene la misma eficacia clínica que metronidazol 500mg dos veces al día (58% vs. 50%). Sin embargo, la presencia de eventos adversos fue menor en el grupo tratado con budesonida tópica (25% vs. 57%)53. Un estudio que incluyó 20 pacientes con reservoritis crónica que no habían respondido a un mes de tratamiento antibiótico mostró que budesonida clásica en dosis de 9mg durante 8semanas es efectiva en lograr la remisión clínica y en mejorar la calidad de vida de los pacientes con reservoritis crónica refractaria a antibióticos54. Otros también han mostrado la efectividad de la budesonida en inducir y mantener la remisión en pacientes con reservoritis crónica refractaria a antibióticos y asociada a colangitis esclerosante primaria55. Aunque los estudios deben confirmar su efectividad, la budesonida por vía oral ha sido sugerida como tratamiento de inducción de la remisión en pacientes con ileítis pre-reservorio o reservoritis secundarias a EC51. Por otra parte, los corticoides tópicos pueden ser utilizados para inducir la remisión en pacientes con cuffitis (remanente rectal) que no responde a mesalazina tópica. En un estudio que incluyó 120 pacientes con cuffitis, el tratamiento con mesalazina y/o corticoides tópicos fue efectivo en el 33,3% de los pacientes, siendo además el 18,3% dependientes a estos dos tratamientos56.
Errores en el uso de corticoidesDiferentes autores han manifestado que el uso de corticoides debería ser un indicador de calidad de atención de los Programas de EII57-60. A pesar de esta sugerencia, un porcentaje importante de pacientes aún son tratados de manera inadecuada con corticoides61-64. Un estudio que incluyó 16.512 pacientes con CU mostró que el 41% de los pacientes recibieron a lo menos una prescripción de corticoides orales. En pacientes con EC, el 57% recibieron por los menos una vez corticoides dentro de los 5años de diagnóstico63. Creemos que los principales errores que deben ser erradicados en el manejo de los pacientes con EII son:
- •
Error 1: «corticoides de mantenimiento», bien porque no se suprimen o porque se pautan muchas veces sin tener una estrategia como terapia de mantenimiento. Existe suficiente información para señalar que los corticoides no tienen ninguna indicación como tratamiento de mantenimiento en la EII7-9,65, y que deben ser evitados dado los eventos adversos a corto, mediano y largo plazo (tabla 4)5,66. A pesar de esta sugerencia, un estudio mostró que de los 9.456 pacientes con CU diagnosticados durante el período 2002-2010, el 13% tuvieron una exposición muy prolongada (>6meses de duración) a los corticoides y el 17,8% recibieron una exposición repetida a estos fármacos (un nuevo uso de corticoides antes de los 3meses del término del tratamiento previo). Por otra parte, de los 4.274 pacientes con EC diagnosticados durante este mismo período, el 24,6% tuvieron una exposición muy prolongada a los corticoides y el 31,3% recibieron una exposición repetida a estos fármacos63. Otros también han confirmado la exposición prolongada y repetida de corticoides sistémicos en pacientes con EII67. Un estudio multicéntrico que auditó el tratamiento de 1.176 pacientes con EII mostró que el 14,9% cumplían criterios de corticodependencia o exceso en el uso de corticoides. Más importante aún es que el 50% de las indicaciones eran totalmente evitables67.
Tabla 4.Eventos adversos a los corticoides
Efectos a corto plazo Efectos a largo plazo Efectos post suspensión • Aumento del apetito• Aumento de peso• Trastorno del sueño y ánimo• Dermatológicos: acné, cara de luna, edema, hirsutismo• Intolerancia a la glucosa • Cataratas subcapsular posterior• Osteoporosis• Osteonecrosis de la cabeza femoral• Miopatía• Mayor susceptibilidad a infeccionesHipertensión arterial • Insuficiencia suprarrenal aguda• Síndrome pseudo-reumatismo• Aumento de la presión intracraneana Fuente: Grennan y Wang66.
La atención por un médico no especialista, la automedicación, el enfrentamiento en el tratamiento de pacientes >65años, el uso de tiopurínicos en CU y de mesalazina en EC han sido asociados a corticodependencia o exceso en el uso corticoides sistémicos67-69.
Diferentes guías han definido corticodependencia como la imposibilidad de reducir la dosis de prednisona a <10mg/día (o budesonida por debajo de los 3mg/día) dentro de los 3meses de comenzar los corticoides, sin enfermedad activa recurrente o la presencia de recaída dentro de los 3meses de suspender estos fármacos7,52,70. En este escenario es necesario plantear la introducción precoz de fármacos ahorradores de corticoides, como son los inmunomoduladores (tiopurínicos y metotrexato), la terapia biológica (anti-TNF, anti-integrina, anti-p40 IL-12/23) o el uso de uso de moléculas pequeñas (anti-janus kinasas y los agonistas fosfato-1-esfingosina).
- •
Error 2: utilizar corticoides en pacientes que YA se encuentren en tratamiento con inmunomoduladores o asociados a biológicos. Poca evidencia existe en este escenario específico, y de hecho, en los ensayos clínicos de los nuevos fármacos, entre el 30% y el 40% de los pacientes entran con corticoides. Un metaanálisis que incluyó 4.354 pacientes sugirió que la combinación de corticoides y un anti-TNF solo aumentaría la morbilidad por la presencia de eventos adversos50. Por otra parte, no hay ninguna evidencia respecto a la eficacia de la utilización de corticoides cuando el paciente ya está en tratamiento inmunosupresor sin aumentar de escalón terapéutico o evitar la cirugía. Tan solo un estudio retrospectivo proporciona cifras del 35% de efectividad en este escenario4. En este estudio se analiza también la eficacia de corticoides de acción tópica como fármacos con menor efecto secundario en brotes de pacientes con CU en tratamiento con inmunomoduladores, sin encontrar tampoco diferencias en los porcentajes de éxito.
- •
Error 4: Creer que los corticoide son más seguro en >65años y no utilizar biológicos en este subgrupo de pacientes. Un estudio que incluyó 393 pacientes con EII >65años mostró que el 31,6% habían sido tratados con prednisona por un período ≥6 meses. A pesar de la disponibilidad de terapia biológica, el uso de corticoides sistémicos aumentó del 36,3% durante el período 1991-2000 al 63,7% durante el período 2001-201071. Otros también han confirmado el elevado porcentaje de pacientes >65años expuestos al uso prolongado de corticoides72. En este grupo de pacientes, solo un pequeño porcentaje recibieron tratamiento inmunomodulador o terapia biológica: el 39,5% y el 21,1%, respectivamente. Dado que la seguridad y la efectividad de los distintos biológicos ha sido demostrada en pacientes con EII >65años73 y que los eventos adversos por el uso prolongado de corticoides son mayores que con la terapia biológica74,75, el enfrentamiento terapéutico en este grupo de pacientes debe ser modificado.
- •
Error 5: Desconocimiento de complicaciones asociadas al uso de corticoides y del tratamiento de estas. El equipo tratante no solo debe considerar la dosis y la duración del tratamiento con corticoides, sino también los eventos secundarios a su uso (tabla 4)5,66. La EII está asociada a un mayor riesgo de osteoporosis y de fracturas. Estas manifestaciones extraintestinales son el resultado de cambios en la remodelación ósea secundarios no solo al uso de corticoides, sino también a las alteraciones inmunológicas que llevan al desarrollo y a la evolución de la EII76. Una revisión sistemática que incluyó 12 estudios demostró que la prevalencia de osteoporosis en pacientes con EII es del 4% al 9%, siendo mayor en la EC (7-15% EC vs. 2-9% en CU)77. La pérdida de la densidad mineral ósea puede aumentar con los corticoides, alcanzando valores del 22,6% en pacientes con EC tratados con estos fármacos78. Esta densidad mineral ósea puede mejorar de manera significativa con el aporte de vitaminaD y calcio79. Todos los pacientes con EII que se encuentren en tratamiento con corticoides, incluidos los corticoides orales de baja biodisponibilidad, deben recibir 800-1.000mg de calcio y 800UI de vitaminaD7. Pese a ello, un estudio que incluyó 131 gastroenterólogos mostró que solo el 38% indicaban vitaminaD y calcio en este grupo de pacientes. Este porcentaje es incluso menor en pacientes >40años (31% en >40años vs. 49% en <40años; p=0,03737.
El uso de corticoides puede aumentar en dos veces la necesidad de requerir fármacos hipoglucemiantes comparado con la población no expuesta a esta terapia80. Parece prudente, por lo tanto, que este riesgo sea evaluado antes de iniciar este tratamiento. Debemos recordar que el riesgo de hipoglucemia secundario a estos fármacos es mayor en pacientes de la tercera edad81, un argumento más para no considerar a los corticoides como un buen fármaco en estos pacientes para evitar los presuntos eventos adversos de la terapia biológica y las moléculas pequeñas.
Eventos adversos psiquiátricos son frecuentes en pacientes en tratamiento con corticosteroides82. Esto no deja de ser importante si consideramos que estudios recientes han confirmado que los pacientes con EII tienen una elevada comorbilidad psiquiátrica, la cual puede afectar su calidad de vida83.
Aunque una discusión de todos los eventos adversos secundarios al uso de los corticoides va más allá del objetivo de esta revisión (tabla 4), nos parece prudente mencionar que en la actual pandemia por virus SARS-CoV-2 los corticoides sistémicos son los únicos fármacos utilizados en el manejo de la EII que han demostrado un efecto negativo en la pandemia por COVID-1984. Es por este motivo que el equipo tratante debe intentar evitar el uso de corticoides sistémicos para inducir la remisión, priorizando otras terapias como mesalazina, budesonida, terapia biológica y moléculas pequeñas.
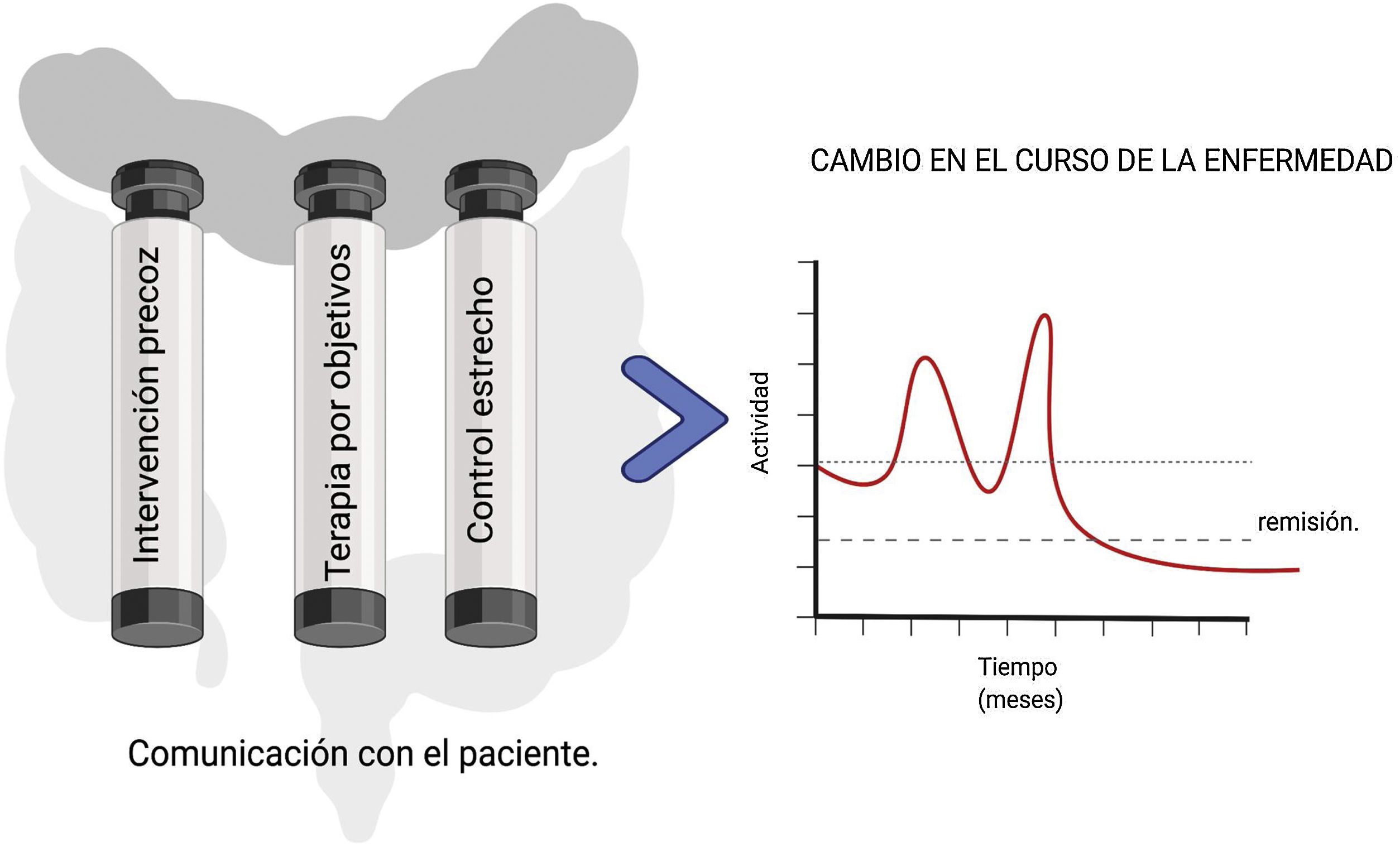
En conclusión, en la actualidad los corticoides siguen formando parte del manejo de los pacientes con EII. Sin embargo, con el arsenal terapéutico disponible en la actualidad parece razonable replantearse en la EC la necesidad de usar corticoides más allá del primer brote. Deberíamos plantearnos, en realidad, si no sería más adecuado empezar directamente el tratamiento con los nuevos fármacos y dejar los corticoides para el rescate de algunos pacientes con enfermedad más refractaria. En la CU es necesario un control estricto de la corticodependencia, evitando al menos el uso de corticoides sistémicos en pacientes que ya se encuentren en tratamiento con inmunomoduladores. Con esto en mente, parece prudente plantear que el uso adecuado de estos fármacos debería ser considerado un indicador de calidad de atención en pacientes con EII. Es este enfrentamiento el que nos permitirá modificar la evolución de la EII y, con ello, la calidad de vida de esos pacientes (fig. 2).
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Contribución de los autoresTodos los autores contribuyeron igualmente a esta revisión: concepción y diseño del estudio, revisión y análisis de la literatura, redacción, revisión crítica y edición, y aprobación de la versión final.