Código Sepsis (CS) es un sistema integral multidisciplinar cuyo objetivo es optimizar los tiempos de identificación y actuación de los pacientes con sepsis, mejorando su monitorización y los ajustes de tratamiento para disminuir su mortalidad.
ObjetivosDescribir los resultados del primer año de implantación del CS en el servicio de urgencias de un hospital terciario.
Material y métodosEstudio observacional descriptivo retrospectivo unicéntrico de todos los pacientes en los que se activó el CS en el servicio de urgencias de un hospital terciario durante el primer año de implantación. Variables: demográficas, activación CS, comorbilidades, foco de infección, microbiología, tratamiento antibiótico y mortalidad.
ResultadosSe activó el CS en 555 pacientes de los cuales 302 (54,4%) tuvieron diagnóstico definitivo de sepsis o shock séptico al alta de urgencias. El grado de cumplimentación de las variables del protocolo fue variable (41,8-95%).
El 86,1% de los pacientes recibieron antibiótico en la primera hora y en el 76,2% se recogieron hemocultivos previos al antibiótico. El 13,3% de los gérmenes aislados fueron multirresistentes y el grado de contaminación de hemocultivos fue 9,1%. Todos los pacientes recibieron tratamiento empírico y se siguieron las recomendaciones en pacientes con shock séptico en el 28,3%. Durante el seguimiento, en 64,4% se dirigió el tratamiento antibiótico y el 39,5% recibieron terapia secuencial. La mortalidad intrahospitalaria fue de 32,2%.
ConclusionesSe detectan áreas de mejora en la cumplimentación de las variables, contaminación de hemocultivos y tratamiento empírico recibido, siendo puntos fuertes la administración precoz del antibiótico y la recogida de hemocultivos.
A Sepsis Code (CS) is a comprehensive multidisciplinary system which has the aim of optimising the identification and intervention times of patients with sepsis, as well as improving their monitoring and treatment adjustments in order to reduce their mortality.
ObjectivesTo present the outcomes of the first year of introducing the CS in the emergency department of a tertiary hospital.
Material and methodsA single-centre retrospective descriptive observational study was conducted on all patients in whom the CS was activated in the emergency department of a tertiary hospital during the first year of implementation. The variables included: demographics, CS activation, comorbidities, focus of infection, microbiology, antibiotic treatment, and mortality.
ResultsCS was activated in 555 patients, of which 302 (54.4%) had a definitive diagnosis of sepsis or septic shock on discharge from the emergency department. The degree of completion of the protocol variables was variable (41.8-95%).The large majority (86.1%) of the patients received antibiotics in the first hour, and in 76.2% blood cultures were collected prior to the antibiotic. Of the blood cultures performed, 13.3% of the isolated germs were multi-resistant and the level of contamination of blood cultures was 9.1%. All patients received empirical treatment and recommendations were followed in patients with septic shock in 28.3%. During follow-up, 64.4% the antibiotic treatment was targeted, and 39.5% received sequential therapy. In-hospital mortality was 32.2%.
ConclusionsAreas of improvement in the completion of the variables, contamination of blood cultures, and empirical treatment received were detected, with the strong points being the early administration of the antibiotic and the collection of blood cultures.
La sepsis es una disfunción orgánica potencialmente mortal causada por una alteración grave de la respuesta del huésped a la infección, que puede complicarse debido a la disfunción aguda de más de un órgano acompañado de hipoperfusión tisular o hipotensión arterial desencadenando shock séptico1,2.
En España, hay aproximadamente 50.000-100.000 casos al año de sepsis, de los cuales un 30% evolucionarán a shock séptico y 13.000 casos no superarán la sepsis2,3, y su incidencia está aumentando a un ritmo de 7-9% anual superando al ictus y al infarto agudo de miocardio2,4.
La aplicación precoz de medidas diagnóstico-terapéuticas como el tratamiento antibiótico empírico y el soporte hemodinámico mejoran significativamente la supervivencia de los pacientes con sepsis3-5, ya que es una enfermedad tiempo-dependiente y un retraso en la administración del tratamiento antibiótico empírico puede condicionar la mortalidad, situándose el valor de la mortalidad entre 17-74% en función de si el antibiótico se administra en los primeros 30 minutos o en las primeras 9-12 h respectivamente, influyendo negativamente en su evolución3,4,6.
Ante esta situación, basándose en Surviving Sepsis Campaign (2002), en España distintas sociedades científicas junto con la administración sanitaria elaboraron el Código Sepsis (CS), un sistema integral, multidisciplinar y transversal para el manejo de la sepsis y shock séptico5,6 cuyo objetivo es mejorar su asistencia, optimizando los tiempos de identificación y actuación, monitorizando su respuesta y ajustando el tratamiento para disminuir la mortalidad del proceso6. Es fundamental disponer de sistemas informáticos de detección precoz y tener un protocolo de manejo inicial en los servicios de urgencias hospitalarias3,5,6.
La terapia antibiótica debe instaurarse precozmente en la primera hora desde el diagnóstico, previa recogida de hemocultivos por duplicado, y es primordial tener en cuenta el foco de sospecha de infección, las características basales de los pacientes y los patrones locales de resistencia a antibióticos. Con relación a las resistencias, factor primordial en el manejo de la sepsis, es fundamental seguir las guías de tratamiento empírico elaboradas por cada hospital. Otro factor importante es desescalar el tratamiento antibiótico en función del resultado microbiológico de los hemocultivos extraídos previos al antibiótico y dirigirlo según el antibiograma1,3,5,6.
En nuestro hospital, el CS se instauró en junio de 2017, en el Servicio de Urgencias, como objetivo principal del PROA (Programa de Optimización del Uso de Antimicrobianos) para mejorar los resultados clínicos de estos pacientes siguiendo las recomendaciones de la guía Surviving Campaing Sepsis (2016).
Por la experiencia de otros centros, a pesar de la difusión y formación, el grado de cumplimiento de estas medidas suele ser variable, por eso es fundamental evaluar su implantación para conocer sus dificultades y tomar conciencia de qué se necesita mejorar3,4.
El objetivo del estudio es describir los resultados del primer año de implantación del CS en el Servicio de Urgencias de un hospital terciario.
Material y métodosEstudio observacional descriptivo retrospectivo unicéntrico de todos los pacientes en los que se activó el CS en el Servicio de Urgencias de un hospital terciario, entre el 22 de junio de 2017 al 22 de junio de 2018.
En el programa informático del Servicio de Urgencias, Puesto Clínico Hospitalario de Urgencias (PCH-Urgencias), se implementaron alarmas/alertas automáticas de sospecha de sepsis basadas en los criterios mayores y menores del Qsofa (Quick SOFA) y SIRS (Síndrome de Respuesta Inflamatoria Sistémica) (Anexo 1), pudiendo ser el caso detectado y activado desde triaje por enfermería, o por el facultativo durante el proceso asistencial del paciente en Urgencias.
Para homogeneizar las medidas diagnóstico-terapéuticas, un grupo multidisciplinar de profesionales del hospital elaboró y difundió un tríptico destinado a facultativos para el abordaje de la sepsis con criterios de detección precoz, protocolo de actuación inicial ante sospecha (Anexo 2) y tratamiento empírico según foco para shock séptico (Anexo 3), y un tríptico para enfermería sobre cómo actuar cuando se activa el CS.
De la base de datos de PCH-Urgencias, del total de activaciones registradas se seleccionaron los pacientes que tuvieron diagnóstico definitivo en el informe al alta de Urgencias de sepsis o shock séptico (codificado según CIE-9 MC) y se analizaron las siguientes variables: demográficas, modo de detección de sepsis/shock séptico, prioridad (nivel de urgencia) asignada en triaje, constantes vitales (frecuencia cardiaca [FC], frecuencia respiratoria [FR], saturación de oxígeno [SO2] y temperatura [Tª]), parámetros analíticos cumplimentados en el protocolo que se activa con el CS (leucocitosis, ácido láctico, hipoxemia [PO2 < 75 mmHg], encefalopatía/Glasgow < 14).
Consultando informes de Urgencias, informes de alta hospitalaria y de microbiología, se recogieron las siguientes variables: administración de antibiótico en la primera hora desde el diagnóstico, hemocultivos por duplicado previos al antibiótico, necesidades de fármacos vasoactivos, foco de infección, muestra microbiológica recogida y germen aislado, antibiótico empírico recibido, tratamiento dirigido/desescalado y/o terapia secuencial (dosis y duración en todos ellos), servicio responsable del paciente, necesidad de ingreso en UCI, tiempo de estancia hospitalaria y fecha de fallecimiento del paciente (exitus), detallando si es en el ingreso hospitalario del episodio de sepsis (en Urgencias o durante ingreso) o posteriormente.
Se consideraron pacientes candidatos a desescalado del tratamiento antibiótico a aquellos pacientes en los que se aisló germen en la muestra microbiológica solicitada y tenían antibiograma disponible para dirigir su tratamiento antibiótico.
La terapia secuencial es la sustitución de un antibiótico intravenoso por un antibiótico oral con biodisponibilidad alta, de la misma clase o equivalente terapéutico, cuando los pacientes presentan vía oral viable7.
Para estudiar la mortalidad, se siguió a los pacientes tras el alta hospitalaria, un máximo de 485 días para los primeros pacientes diagnosticados, hasta un mínimo de 120 días para los diagnosticados en junio de 2018.
Las variables se recogieron en Microsoft Excel® y el análisis estadístico se realizó con SPSS Statistics22®. En las variables cualitativas se detallan porcentajes y se realiza la prueba χ2 o test exacto de Fisher. Si existiese significación estadística, para conocer el grado de asociación de las variables se detalla Q de Yule. Todas las variables analizadas estadísticamente eran cualitativas. En las variables cuantitativas se detallan medidas de tendencia central.
El estudio ha sido aprobado por el Comité Ético de Investigación Clínica de Aragón (CEICA).
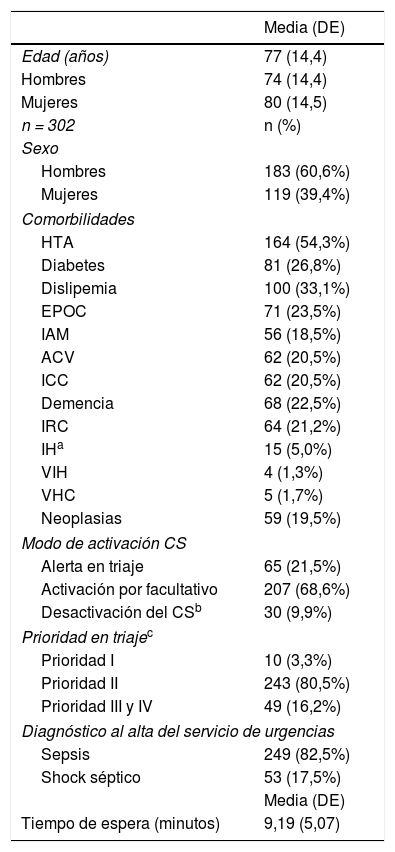
ResultadosSe activó el CS en 555 pacientes, de los cuales 302 (54,4%) tuvieron un diagnóstico definitivo de sepsis o shock séptico al alta de Urgencias. La media de edad de estos 302 pacientes fue 77 años (desviación estándar [DE] 14,4) siendo el 60,6% hombres.
En la tabla 1 se detallan las características de los pacientes en los que se activó el CS y tuvieron un diagnóstico al alta de Urgencias de sepsis o shock séptico, y las variables relacionadas con su activación.
Características de los pacientes en los que se activó el CS y variables relacionadas con la activación del mismo
| Media (DE) | |
|---|---|
| Edad (años) | 77 (14,4) |
| Hombres | 74 (14,4) |
| Mujeres | 80 (14,5) |
| n = 302 | n (%) |
| Sexo | |
| Hombres | 183 (60,6%) |
| Mujeres | 119 (39,4%) |
| Comorbilidades | |
| HTA | 164 (54,3%) |
| Diabetes | 81 (26,8%) |
| Dislipemia | 100 (33,1%) |
| EPOC | 71 (23,5%) |
| IAM | 56 (18,5%) |
| ACV | 62 (20,5%) |
| ICC | 62 (20,5%) |
| Demencia | 68 (22,5%) |
| IRC | 64 (21,2%) |
| IHa | 15 (5,0%) |
| VIH | 4 (1,3%) |
| VHC | 5 (1,7%) |
| Neoplasias | 59 (19,5%) |
| Modo de activación CS | |
| Alerta en triaje | 65 (21,5%) |
| Activación por facultativo | 207 (68,6%) |
| Desactivación del CSb | 30 (9,9%) |
| Prioridad en triajec | |
| Prioridad I | 10 (3,3%) |
| Prioridad II | 243 (80,5%) |
| Prioridad III y IV | 49 (16,2%) |
| Diagnóstico al alta del servicio de urgencias | |
| Sepsis | 249 (82,5%) |
| Shock séptico | 53 (17,5%) |
| Media (DE) | |
| Tiempo de espera (minutos) | 9,19 (5,07) |
HTA: hipertensión arterial; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio; ACV: accidente cerebro vascular; ICC: insuficiencia cardiaca congestiva; IRC: insuficiencia renal crónica; IH: insuficiencia hepática; VIH: virus de inmunodeficiencia humana; VHC: virus de hepatitis C.
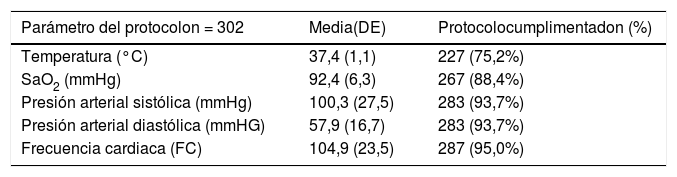
Los parámetros analíticos relacionados con los criterios de alerta que los facultativos cumplimentaban al activar el CS y los criterios de alerta que lo activaron se muestran en la tabla 2.
Parámetros relacionados con criterios de alerta que se deben cumplimentar al activar el CS y criterios de alerta que lo activaron
| Parámetro del protocolon = 302 | Media(DE) | Protocolocumplimentadon (%) |
|---|---|---|
| Temperatura (°C) | 37,4 (1,1) | 227 (75,2%) |
| SaO2 (mmHg) | 92,4 (6,3) | 267 (88,4%) |
| Presión arterial sistólica (mmHg) | 100,3 (27,5) | 283 (93,7%) |
| Presión arterial diastólica (mmHG) | 57,9 (16,7) | 283 (93,7%) |
| Frecuencia cardiaca (FC) | 104,9 (23,5) | 287 (95,0%) |
| Parámetro del protocolon = 302 | Mediana (rango) | Protocolocumplimentado n (%) |
| Frecuencia respiratoria (FR) | 40 (32-113) | 3 (1,0%) |
| Parámetro analíticon = 302 | Cumplen criterio/cumplimentadosn (%) | ProtocoloCumplimentadon (%) |
| Leucocitosis (> 12.000/mm3) | 144/188 (76,6%) | 188 (62,3%) |
| Ácido láctico (> 2 mmol/L) | 88/107 (82,2%) | 107 (35,4%) |
| Hipoxemia (PO2 < 75 mmHg o SaO2 < 90%) | 81/178 (45,5%) | 178 (58,9%) |
| Encefalopatía/Glasgow < 14 | 79/189 (41,8%) | 189 (62,6%) |
| Criterios de alertaan = 302 | n | % |
| Por el facultativo | ||
| 2 criterios SIRS | 111 | 36,8% |
| > 2 criterios SIRS | 26 | 8,6% |
| 2 criterios Qsofa | 9 | 3% |
| Por enfermería en triaje | ||
| 1 criterio mayor + 2 criterios menores | 32 | 10,6% |
| ≥ 2 criterios mayores | 32 | 10,6% |
| 1 criterio mayor + 1 menor + sospecha de infección | 23 | 7,6% |
| 2 criterios menores + sospecha de infección | 9 | 3% |
En 59 pacientes (19,5%) con diagnóstico final de sepsis no se cumplimentó totalmente el protocolo CS o faltaron parámetros para que el sistema se activara automáticamente, así que, manualmente, en 43 (72,9%) pacientes fue activado por el facultativo durante el proceso asistencial, 7 (11,9%) en triaje por enfermería y en 9 (15,3%) se desactivó el CS, a pesar de tener un diagnóstico al alta de Urgencias de sepsis.
El destino más habitual de los pacientes ingresados fue el Servicio de Medicina Interna, incluida la Unidad de Infecciosos, con 104 (34,4%) pacientes, seguido de las Unidades de Cuidados Intensivos (UCI) con 39 pacientes (12,9%), aunque 16 pacientes más (5,4%) necesitaron ser trasladados a UCI durante su ingreso. La mediana de días de ingreso fue de 11,0 (1-136).
De los 302 pacientes, 120 (39,7%) necesitaron la administración de fármacos vasoactivos, siendo 45 de ellos (37,5%) los que precisaron ingreso en UCI.
En 230 (76,2%) se realizaron hemocultivos por duplicado previos al antibiótico y en 260 (86,1%) se administró el antibiótico en la primera hora.
En el estudio del foco de infección, el perfil microbiológico y la terapia antibiótica se excluyeron a 10 pacientes de los 302 diagnosticados (239 (81,8%) sepsis y 53 (18,2%) shock séptico) por falta de información en su historia clínica.
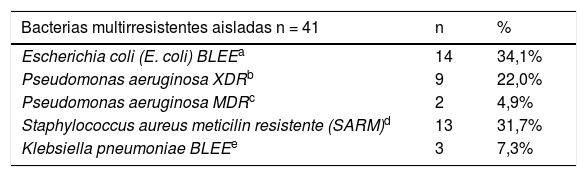
Se solicitaron 669 muestras microbiológicas con una mediana de dos muestras por paciente (1-8). En la tabla 3 se muestra foco de infección, muestras solicitadas mencionando hemocultivos y urocultivos por ser las mayoritarias, y perfil microbiológico-gérmenes aislados. De los 308 gérmenes aislados, 41 (13,3%) fueron bacterias multirresistentes (tabla 4).
Foco de infección, muestras solicitadas y perfil microbiológico
| Foco de infección n (%) | n = 292 |
|---|---|
| Urinario | 117 (40,1%) |
| Respiratorio | 92 (31,5%) |
| Abdominal | 46 (15,8%) |
| Sin foco | 20 (6,8%) |
| Otro foco o más de un foco | 17 (5,8%) |
| Muestras microbiológicas solicitadas n (%) | n = 669 |
| Muestras positivas | 308 (46,0%) |
| Hemocultivos solicitados | 253 (37,8%) |
| Hemocultivos positivos | 121 (47,8%) |
| Hemocultivos contaminados | 23 (9,1%) |
| Urocultivos solicitados | 227 (33,9%) |
| Urocultivos positivos | 114 (50,2%) |
| Urocultivos contaminados | 1 (0,4%) |
| Gérmenes aislados n (%) | n = 308 |
| Bacterias grampositivas | 88 (28,6%) |
| Bacterias gramnegativas | 142 (46,1%) |
| Polimicrobia | 51 (16,5%) |
| Virus | 8 (2,6%) |
| Hongos | 19 (6,2%) |
| Gérmenes más prevalentes aislados en hemocultivosa | n = 121 |
| E. coli | 39 (32,2%) |
| Klebsiella pneumoniae | 12 (9,9%) |
| Polimicrobiana: dos gérmenes gramnegativosb | 10 (8,3%) |
| Staphylococcus aureus | 8 (6,6%) |
| Gérmenes más prevalentes aislados en urocultivosa | n = 114 |
| E. coli | 38 (33,3%) |
| Polimicrobiana: gramnegativo + grampositivoc | 13 (11,4%) |
| Klebsiella pneumoniae | 7 (6,2%) |
| Pseudomonas aeruginosad | 7 (6,2%) |
Dos gérmenes gramnegativos: E.coli + Klebsiella pneumoniae (n = 2), E.coli + Proteus mirabilis (n = 2), E.coli + Klebsiella oxytoca (n = 1), E.coli + Enterobacter cloacae complex (n = 1), Klebsiella pneumoniae + Proteus mirabilis (n = 1), Pseudomonas aeruginosa + Enterobacter cloacae complex (n = 1), Pseudomonas aeruginosa + Klebsiella pneumoniae (n = 1), Pseudomonas aeruginosa + Serratia marcescens (n = 1).
Gramnegativo + grampositivo: E.coli + Enterococcus faecalis (n = 4), E.coli + Streptococcus gallolyticus (n = 2), E.coli + Streptococcus pneumoniae (n = 1), E.coli + Staphylococcus agalactiae (n = 1), Acinetobacter baumanii + Enterococcus faecalis (n = 1), Klebsiella pneumoniae + Enterococcus faecalis (n = 1), Klebsiella pneumoniae BLEE + Enterococcus faecalis (n = 1), Proteus mirabilis + Enterococcus faecalis (n = 1), Klebsiella oxytoca + Staphylococcus aureus (n = 1).
Bacterias multirresistentes aisladas y estudio de multirresistencia
| Bacterias multirresistentes aisladas n = 41 | n | % |
|---|---|---|
| Escherichia coli (E. coli) BLEEa | 14 | 34,1% |
| Pseudomonas aeruginosa XDRb | 9 | 22,0% |
| Pseudomonas aeruginosa MDRc | 2 | 4,9% |
| Staphylococcus aureus meticilin resistente (SARM)d | 13 | 31,7% |
| Klebsiella pneumoniae BLEEe | 3 | 7,3% |
| Bacterias aisladas en la muestra | n | % de multirresistencia |
|---|---|---|
| E. coli BLEE | 14 | 13,1% |
| E. coli | 93 | |
| Total | 107 | |
| Pseudomonas aeruginosa XDR | 9 | 45,8% |
| Pseudomonas aeruginosa MDR | 2 | |
| Pseudomonas aeruginosa | 13 | |
| Total | 24 | |
| SARM | 13 | 38,2% |
| Staphylococcus aureus | 21 | |
| Total | 34 | |
| Klebsiella pneumoniae BLEE | 3 | 10,3% |
| Klebsiella pneumoniae | 26 | |
| Total | 29 |
BLEE: betalactamasas de espectro extendido; XDR: extremadamente resistente; MDR: multirresistente.
El tratamiento antibiótico empírico recomendado en el tríptico, según foco de infección en shock séptico (n = 53), consiste en mínimo dos antibióticos y según la situación clínica, incluso tres. Se cumplieron las recomendaciones en 15 (28,3%) pacientes. En 38 (71,7%) no se cumplió porque en 24 de ellos (63,2%) se prescribe tratamiento en monoterapia y en 14 (36,8%) se prescribe otra combinación distinta a la recomendada.
El estudio del tratamiento antibiótico (empírico, dirigido y secuencial) se detalla en la tabla 5.
Tratamiento antibiótico recibido
| Tratamiento empírico (n = 292) | n (%) |
|---|---|
| Prescripción tratamiento empírico en Urgencias | 292 (100,0%) |
| Antibióticos más prescritosa | |
| Meropenem | 57 (19,5%) |
| Piperacilina/tazobactam | 38 (13,0%) |
| Ceftriaxona | 36 (12,3%) |
| Ceftriaxona + levofloxacino | 22 (7,5%) |
| Meropenem + amikacina | 20 (6,8%) |
| Amoxicilina - clavulánico | 11 (3,8%) |
| Tratamiento dirigido (n = 269)b | n (%) |
|---|---|
| Candidatos a desescalado | 177 (65,8%) |
| Prescripción de tratamiento dirigido | 114 (64,4%) |
| Terapia secuencial (n = 281)b | n (%) |
|---|---|
| Prescripción de terapia secuencial | 111 (39,5%) |
| Finalizan en domicilio | 79 (71,2%) |
| Antibióticos más prescritosa | |
| Amoxicilina - clavulánico | 26 (23,4%) |
| Ciprofloxacino | 18 (16,2%) |
| Cefixima | 15 (13,5%) |
| Cefditoreno | 12 (10,8%) |
| Levofloxacino | 12 (10,8%) |
| Media (DE) | |
| Duración tratamiento antibiótico (días) | 10,9 (6,6) |
En cuanto a mortalidad durante el episodio de sepsis o shock séptico, de los 292 pacientes, 94 (32,2%) fallecieron, de los cuales 30 (31,9%) lo hicieron en Urgencias y 64 (68,1%) durante su ingreso.
Cincuenta y siete pacientes (19,5%) fallecieron tras el alta hospitalaria de su episodio de sepsis o shock séptico, concretamente, 12 (21,1%) fallecieron entre 0-30 días después del alta, 13 (22,8%) entre 30-60 días, 8 (14%) entre los 60-90 días y 24 (42,1%) en un tiempo mayor de tres meses tras el alta.
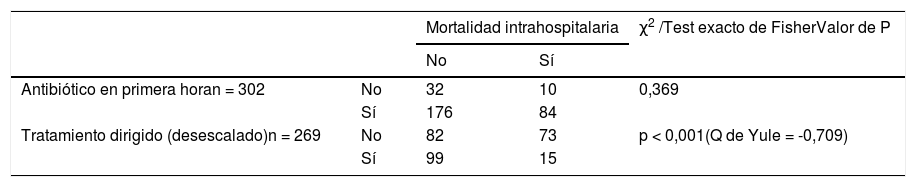
No se observaron diferencias estadísticamente significativas (p = 0,369) en la mortalidad intrahospitalaria en los pacientes que recibieron tratamiento antibiótico en la primera hora, en cambio, sí que se observaron diferencias estadísticamente significativas (p < 0,0001) en la mortalidad intrahospitalaria en los pacientes en los que se dirigió el tratamiento antibiótico tras resultado microbiológico (tabla 6).
Estudio estadístico de la relación mortalidad con la administración precoz del antibiótico, el tratamiento dirigido y la duración del tratamiento antibiótico
| Mortalidad intrahospitalaria | χ2 /Test exacto de FisherValor de P | |||
|---|---|---|---|---|
| No | Sí | |||
| Antibiótico en primera horan = 302 | No | 32 | 10 | 0,369 |
| Sí | 176 | 84 | ||
| Tratamiento dirigido (desescalado)n = 269 | No | 82 | 73 | p < 0,001(Q de Yule = -0,709) |
| Sí | 99 | 15 | ||
La sepsis es una enfermedad tiempo dependiente muy frecuente en los servicios de Urgencias y su identificación precoz es fundamental para el pronóstico del paciente4,8.
Implantar un nuevo protocolo en un servicio de Urgencias es complicado ya que es necesario que los profesionales estén adecuadamente informados de qué y cómo tienen que hacerlo, además de que comiencen a integrarlo en su práctica diaria9. En nuestro servicio de Urgencias el principal problema es la rotación de profesionales, principalmente en horarios de guardia y con profesionales con distintos niveles de formación sobre este tema (enfermería, médicos de urgencias hospitalarias y médicos internos residentes de diferentes años y especialidades). Esta situación también se observó en el estudio de Aguirre et al., donde confirman que tuvieron una mayor activación del CS en días laborales, coincidiendo con un equipo fijo de médicos y enfermeras de Urgencias8,9. Por eso, existe la necesidad de formar continuamente a los profesionales para recordar y difundir la importancia del CS.
En nuestro estudio, las dificultades de la implantación observadas fueron: desactivación del CS en 30 pacientes (9,9%), pensamos que este hecho está relacionado con el trabajo adicional que supone la recogida de variables y la falta de incorporación en su práctica diaria en los inicios de la implantación; y grado de cumplimentación de las variables del protocolo CS, observándose diferencias en su recogida: FC y TA se cumplimentaron en el 95% y 93,7% respectivamente, pero el nivel de lactato se registró en el 35,4%, a pesar de realizarse en todos los pacientes mediante gasometría en el área de signos vitales de Urgencias.
La FR solo se completó en tres (1,0%) pacientes, variable fundamental de los criterios Qsofa, SIRS y criterios menores. Esta constante no es recogida por enfermería de manera habitual al no realizarse automáticamente, y afecta a la activación del CS disminuyendo las alertas y falseando los porcentajes de los criterios detectados, sobre todo Qsofa, ya que es la tercera variable de activación. En nuestro estudio solo se activaron nueve pacientes (3%) con dos criterios Qsofa y ningún paciente con tres. Por lo tanto, se trata de una limitación del estudio. Este problema también lo observaron Ferreras et al., y afirman que la baja cumplimentación de la FR pudo interferir en la menor aplicación de las medidas al no ser detectado en triaje10. Es cierto que en la práctica clínica, en ocasiones, los pacientes se activan sin tomar la FR porque entran en el grupo sin necesidad de ella. En relación a esto, existe evidencia de que la escala SIRS detecta un alto porcentaje de pacientes (> 50%) y que los criterios Qsofa pueden retrasar la identificación de pacientes con sepsis, como comprobamos en nuestro estudio donde los criterios SIRS detectaron al 45,4% de los pacientes y Qsofa solo al 3%, por eso es fundamental la combinación de ambos para mejorar la identificación de estos pacientes11.
Además, en el 19,5% de los pacientes no se cumplimentó el protocolo adecuadamente, faltaban datos para activar el CS automáticamente siendo el facultativo el que lo activó en el 72,9% durante el proceso asistencial, de modo que, es necesario mejorar el registro de las variables concienciando a los profesionales de su importancia.
La administración del antibiótico en la primera hora y la recogida de hemocultivos previos al antibiótico son puntos clave del CS y en nuestro estudio se realizó en el 86,1% y 76,2%, respectivamente. En la administración de antibiótico en la primera hora obtuvimos un cumplimiento mayor al 75%, como en el estudio de Robert Boter et al.8, y comparando con otros estudios nuestro cumplimiento fue mayor (Gao et al. 74%12, Ferreras et al. 62,9%13 y Aguirre et al. 72,5%9). Aunque no observamos diferencias estadísticamente significativas (p = 0,369) entre la administración precoz del antibiótico y la mortalidad, existe evidencia sobre su relación14,15, como en la serie de Kumar et al.16, donde el antibiótico era administrado en las primeras seis horas en solo un 50% de los casos, y cada hora de retraso produjo un aumento de la mortalidad del 7,6%8,9,11. En la recogida de hemocultivos previos al antibiótico, obtuvimos resultados intermedios a otros estudios (Aguirre et al. 90%9 y Gao et al. 74%12). Respecto al porcentaje de hemocultivos contaminados (9,1%), tenemos un valor superior al de la literatura ya que no debe exceder el 3%17. Este es un punto en el que se está intentando mejorar, formando al personal de enfermería en la toma de muestras.
El porcentaje de bacterias multirresistentes aisladas en las muestras es bajo (13,3%) comparando con otros estudios, como el de Labelle et al., donde suponían 20,1-22,6%18. Es fundamental que ante la sospecha de multirresistentes, el tratamiento empírico recibido en Urgencias tenga cobertura para ellos y esto se evidencia en el estudio de Filbin et al.19 donde más del 50% de los tratamientos empíricos prescritos cubrían bacterias multirresistentes. En nuestro hospital, existe una elevada incidencia de Pseudomonas aeruginosa multirresistentes según nuestra epidemiología local y lo confirmamos ya que el 45,8% de P. aeruginosa aisladas fueron MDR (multirresistente) o XDR (extremadamente resistente).
Todos los pacientes recibieron tratamiento empírico en Urgencias, observándose que el 26,3% recibieron tratamiento empírico con meropenem en monoterapia (19,5%) o en combinación con amikacina (6,8%), un porcentaje elevado de carbapenémicos. Actualmente se está trabajando en su adecuación ya que tenemos tasas elevadas de Pseudomonas aeruginosa resistentes a carbapenémicos.
El 28,3% de pacientes diagnosticados con shock séptico recibieron tratamiento empírico recomendado según PROA en el tríptico del CS, valor muy inferior al de otros estudios como el de Pérez-Moreno et al. (74,9%)20.
Durante la implantación del CS no estaban disponibles las guías de tratamiento empírico del hospital, elaboradas y difundidas por el PROA durante 2019, en las que diferencian el tratamiento, según se sospeche o no de infección por multirresistentes21,22. Con las guías, se pretende homogeneizar el tratamiento siguiendo la mejor evidencia disponible según el foco de infección y la epidemiología local, mejorando así la antibioticoterapia que reciben los pacientes y evitando resistencias antimicrobianas23-25.
El desescalado del tratamiento en función del resultado microbiológico es fundamental en el CS1,3,5,6. En la práctica clínica se ha demostrado su importancia. En el estudio de Garnacho-Montero et al. se desescaló y dirigió la terapia antibiótica en un 34,9% relacionándose con una menor tasa de mortalidad intrahospitalaria a los 28 días4,15,24. En nuestro estudio, un 65,8% de los pacientes eran candidatos a desescalar/dirigir su tratamiento antibiótico, realizándose en el 64,4% de los mismos, resultado superior al mencionado. Se obtuvo una relación estadísticamente significativa (p < 0,05) entre el desescalado y la mortalidad (Q de Yule = -0,709, asociación fuerte e inversamente proporcional), aunque con los datos disponibles desconocemos si los pacientes partían inicialmente del mismo riesgo de mortalidad.
Tras 48-72 h de situación clínica estable y vía oral viable, se recomienda terapia secuencial, realizándose en el 39,5% de los pacientes, de modo que tenemos una oportunidad de mejora en este punto, siendo fundamental revisar entre los días 3-5 de tratamiento antibiótico si es posible el paso a vía oral y si no es posible, ir revisándolo periódicamente.
La duración media del tratamiento antibiótico completo (empírico, dirigido y secuencial) fue 10,9 días (± 6,6). Actualmente, se recomiendan tratamientos más cortos que los estándares ya que existe evidencia de que cuánto más tiempo está un paciente con tratamiento antibiótico, mayor es la posibilidad de seleccionar bacterias resistentes; además varios estudios muestran que se obtienen los mismos resultados clínicos con esquemas acortados25-27.
La mortalidad intrahospitalaria fue inferior en todos los estudios donde se aplicó el CS4,10,13,28. En nuestro estudio, la mortalidad intrahospitalaria fue 32,2%, valor superior al de la bibliografía10,13,19,20,28 y la mortalidad a los 30 días del alta hospitalaria fue 4,1%, cifra que coincide con el estudio de Robert Boter et al.8, siendo superior en otros estudios (17-26%)4,8-10,13.
Como ya se ha comentado, el proyecto forma parte de los objetivos del grupo PROA del hospital, en cuyo núcleo participan un farmacéutico, un infectólogo, un microbiólogo y un preventivista, junto a una enfermera. Con los resultados del estudio, microbiología, a través de la enfermera del grupo ha coordinado una formación específica para mejorar la toma de hemocultivos (elevado porcentaje de hemocultivos contaminados en la unidad) y, aunque las tasas de multirresistentes no han sido elevadas, el Servicio de Preventiva ha propuesto a través del grupo PROA autonómico la creación de una base de datos de pacientes colonizados por determinados gérmenes multirresistentes para que siempre que reciban asistencia sanitaria, los profesionales sean advertidos al inicio de la misma.
La principal limitación es que se trata de un estudio retrospectivo y se requieren estudios futuros para confirmar cuál es la causa de la mortalidad, porque en ocasiones es posible que la causa sea una enfermedad concomitante. Otra limitación es que se trata de un estudio unicéntrico, de modo que en un futuro se podría realizar un estudio multicéntrico incluyendo tanto los hospitales terciarios como los primarios/secundarios con el fin de obtener una visión más global de la implantación del CS en nuestra Comunidad Autónoma, analizando las fortalezas y debilidades encontradas en distintos entornos hospitalarios para mejorar las medidas diagnóstico-terapéuticas en este grupo de pacientes. Además, como ya se ha hecho en otros estudios4,8,10,13, sería interesante evaluar el efecto de la mortalidad, comparando la tasa de mortalidad antes y después de implantar el CS.
ConclusionesLa implantación del CS es necesaria para seguir las recomendaciones del PROA y mejorar los resultados clínicos. La existencia de un sistema automatizado de alertas desde triaje es una mejora importante, que influye en la toma de decisiones vitales en la primera hora, pero es preciso ir mejorando su rendimiento con la experiencia obtenida. Así mismo, se ha detectado un bajo grado de cumplimiento del protocolo que debe mejorarse para optimizar las medidas diagnóstico-terapéuticas y reducir la mortalidad del proceso.
Se detectan áreas de mejora en la cumplimentación de las variables, tasa de contaminación de hemocultivos y seguimiento de las recomendaciones de tratamiento empírico, pero en los puntos clave se han obtenido resultados satisfactorios que se deben mantener y, en medida de lo posible, mejorar.
FinanciaciónNo existe financiación del artículo presente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.