El carcinoma hepatocelular (CHC) es la neoplasia primaria de hígado más frecuente y una de las causas de muerte más común en los pacientes afectos de cirrosis hepática. Simultáneamente al reconocimiento de la relevancia clínica de esta neoplasia, en los últimos años han aparecido novedades importantes en el diagnóstico, evaluación pronóstica y, especialmente, en el tratamiento del CHC. Por tal motivo, desde la Asociación Española para el Estudio del Hígado (AEEH) se ha impulsado la necesidad de actualizar las guías de práctica clínica, invitando de nuevo a todas las sociedades involucradas en el diagnóstico y tratamiento de esta enfermedad a participar en la redacción y aprobación del documento: Sociedad Española de Trasplante Hepático (SETH), Sociedad Española de Radiología Médica (SERAM), Sociedad Española de Radiología Vascular e Intervencionista (SERVEI), Asociación Española de Cirujanos (AEC) y Sociedad Española de Oncología Médica (SEOM). Se han tomado como documentos de referencia las guías de práctica clínica publicadas en 2016, aceptadas como Guía de Práctica Clínica del Sistema Nacional de Salud, incorporando los avances más importantes que se han obtenido en los últimos años. La evidencia científica y la fuerza de la recomendación se basa en el sistema GRADE.
Hepatocellular carcinoma (HCC) is the most common primary liver neoplasm and one of the most common causes of death in patients with cirrhosis of the liver. In parallel, with recognition of the clinical relevance of this cancer, major new developments have recently appeared in its diagnosis, prognostic assessment and in particular, in its treatment. Therefore, the Spanish Association for the Study of the Liver (AEEH) has driven the need to update the clinical practice guidelines, once again inviting all the societies involved in the diagnosis and treatment of this disease to participate in the drafting and approval of the document: Spanish Society for Liver Transplantation (SETH), Spanish Society of Diagnostic Radiology (SERAM), Spanish Society of Vascular and Interventional Radiology (SERVEI), Spanish Association of Surgeons (AEC) and Spanish Society of Medical Oncology (SEOM). The clinical practice guidelines published in 2016 and accepted as National Health System Clinical Practice Guidelines were taken as the reference documents, incorporating the most important recent advances. The scientific evidence and the strength of the recommendation is based on the GRADE system.
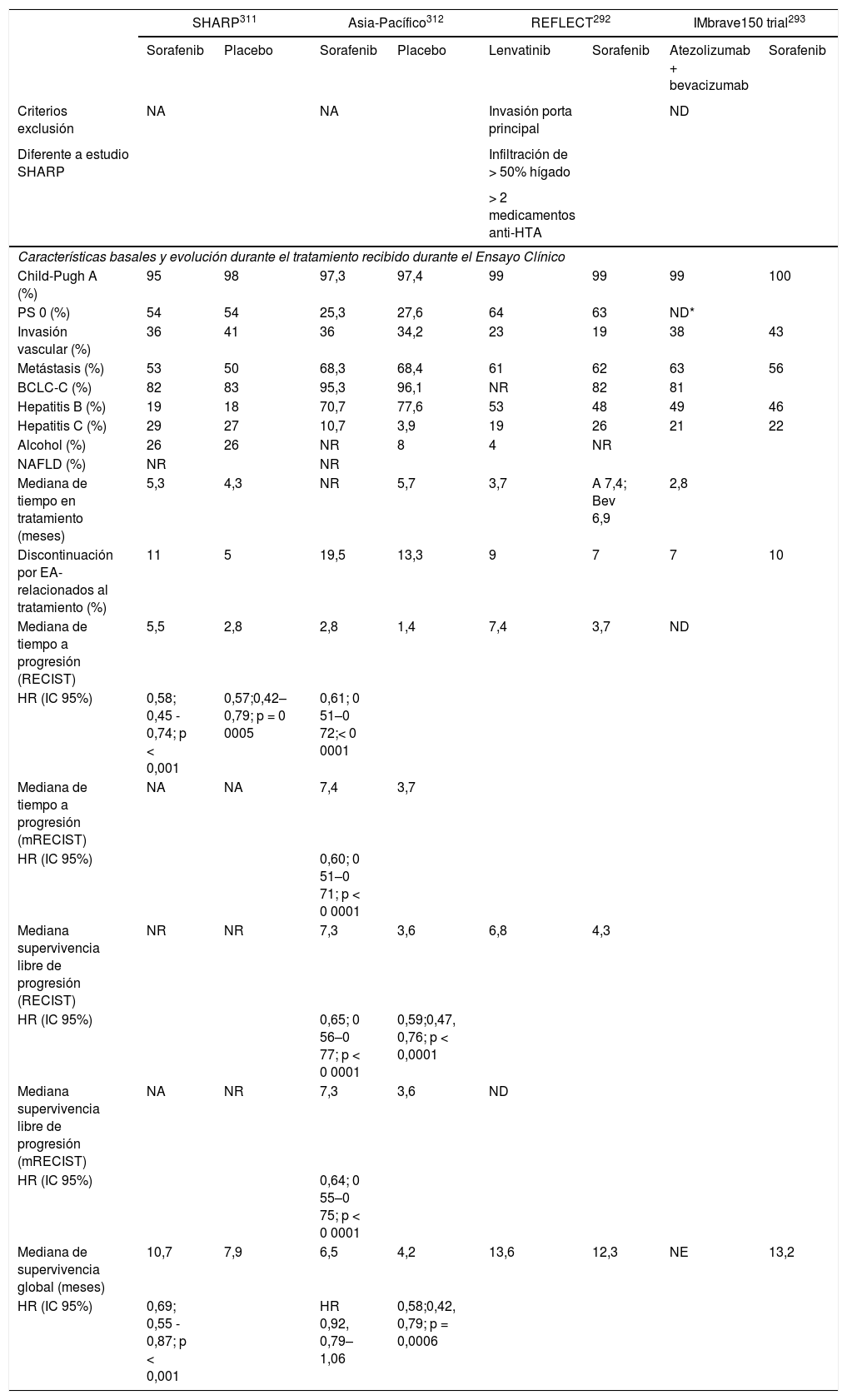
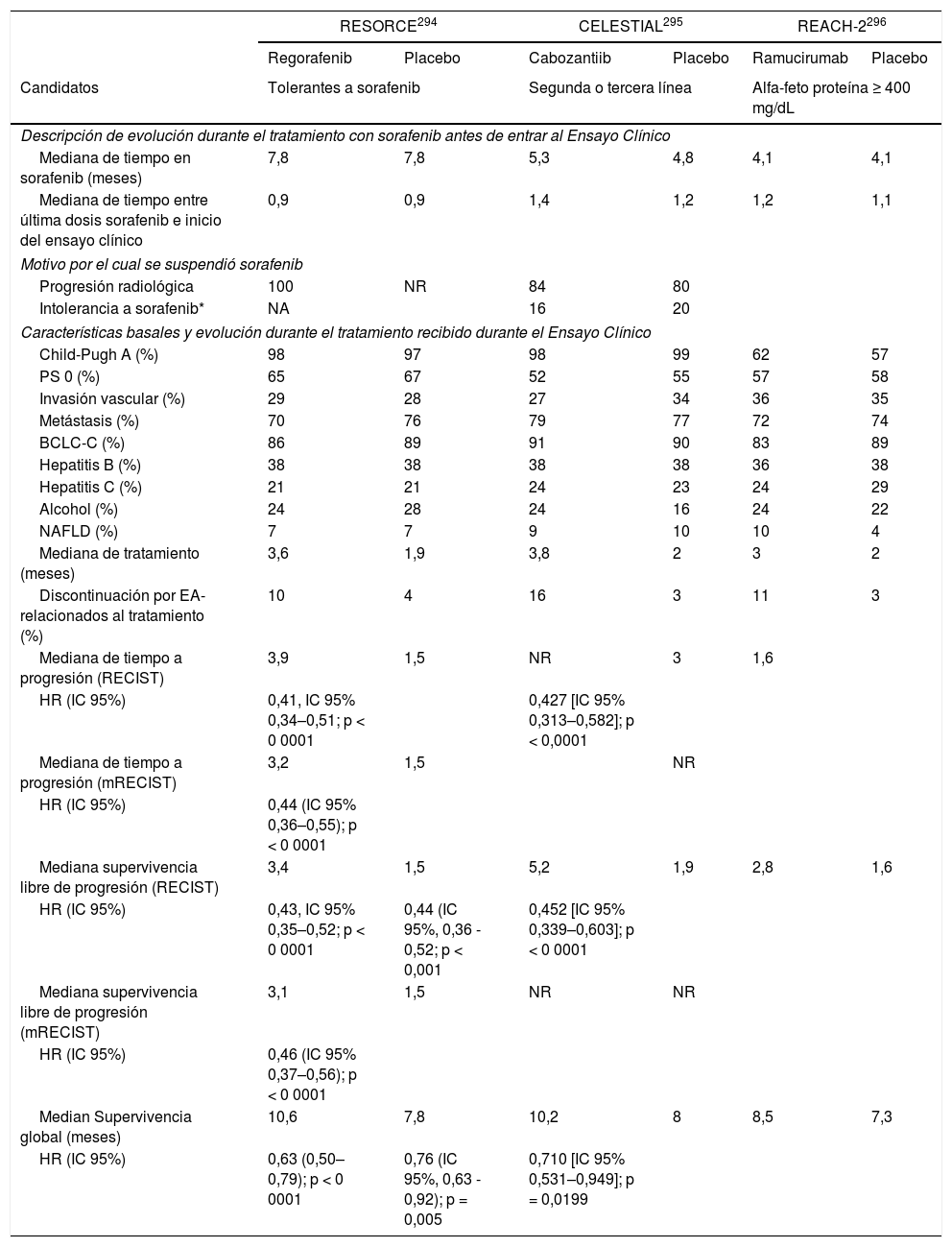
Desde la publicación de las guías del manejo del carcinoma hepatocelular (CHC) en el año 20161, los cambios epidemiológicos relacionados con la curación del virus de la hepatitis C y el aumento de otros factores de riesgo, como el síndrome metabólico asociado con la enfermedad hepática por depósito de grasa, han determinado nuevos retos en el manejo clínico de estos pacientes. Adicionalmente, se han propuesto nuevos criterios diagnósticos y/o nuevas recomendaciones para la indicación de tratamientos quirúrgicos que han sido adoptadas de una forma heterogénea por las asociaciones americana (AASLD)2 y europea (EASL)3 para el estudio de la enfermedades del hígado o por las distintas sociedades científicas involucradas en el manejo del CHC. Sin embargo, el mayor cambio se ha producido en el tratamiento sistémico del CHC avanzado. Cinco nuevos fármacos (lenvatinib y la combinación atezolizumab con bevacizumab en primera línea, regorafenib, cabozantinib y ramucirumab en segunda línea) han demostrado que mejoran la supervivencia de pacientes con CHC y han sido aprobados por la Agencia Europea del Medicamento (EMA).
Por todo ello, las sociedades científicas que formaron parte de estas guías de manejo del CHC en 2016 han decidido actualizarlas e incorporar a la Asociación Española de Cirujanos en el panel de expertos. La actualización de las guías se ha efectuado mediante la colaboración de grupos de trabajo y cada uno de ellos ha sido liderado por un coordinador (ver Material Suplementario).
Estas guías son complementarias a las publicadas en 20161, se centran en la actualización de los temas mencionados previamente, e incorporan aspectos moleculares que están en fase de investigación. Dichos aspectos no tienen traslación en la práctica clínica actual.
Epidemiología y prevención del CHCActualmente el CHC constituye la sexta neoplasia más frecuente en el mundo y la tercera causa de muerte por cáncer4. Su distribución mundial es muy heterogénea y está estrechamente relacionada con la prevalencia variable de los diferentes factores de riesgo asociados al desarrollo de esta enfermedad. De acuerdo a la International Agency for Research on Cancer(IARC), la tasa de incidencia específica por edad en 2018 en el Este Asiático fue de 17,7 x 100.000 habitantes, seguido de Micronesia (15,2 x 100.000 habitantes), Norte de África (14,1 x 100.000 habitantes), Sudeste Asiático (13,3 x 100.000 habitantes) y Melanesia (11,4 x 100.000 habitantes). En este caso, teniendo en cuenta la estimación de la IARC, el Sur de Europa presenta una tasa de incidencia específica por edad de 6,8 x 100.000 habitantes, Europa Occidental 5,3 x 100.000 habitantes y Norteamérica 6,6 x 100.000 habitantes (Tabla suplementaria 1). En España, según la RED de Registros de Cáncer REDECAN.org, la estimación de casos nuevos de cáncer hepático en 2019 fue 6.499 (4.869 en varones y 1.630 en mujeres).
En todas las áreas geográficas, el riesgo de CHC varía según el grado de fibrosis hepática, siendo menor al 1% anual en pacientes con hepatitis crónica sin fibrosis, incrementándose a 3-7% anual cuando el paciente desarrolla cirrosis5.
El riesgo relevante se adquiere al establecerse la cirrosis hepática y la intensidad de la inflamación hepática (relacionada con carga viral o genotipo en el caso de las hepatitis) es la responsable del proceso crónico de necrosis/regeneración que evoluciona a cirrosis, siendo éste el parámetro que debe utilizarse para establecer la adquisición de riesgo clínicamente significativo. En este sentido, una vez instaurada la cirrosis hepática, el riesgo de desarrollo de CHC se mantiene a pesar de obtener una respuesta viral sostenida tanto tras regímenes basados en interferón como con antivirales de acción directa en el caso del VHC, así como tras la inhibición de la replicación con análogos de los nucleó(t)sidos en la infección crónica por el VHB, posiblemente debido al daño estructural y molecular que ya presenta el hígado a pesar de la eliminación de la infección6-12.
Se ha demostrado que la diabetes mellitus13-15 y otros factores asociados al síndrome metabólico como la obesidad o la dislipidemia16-18 se asocian a incremento de muerte relacionada con CHC, al igual que el tabaquismo19,20. El consumo de café disminuye el riesgo21,22 mientras que no hay suficiente evidencia para recomendar los suplementos vitamínicos, soja o medicinas alternativas como elementos preventivos del CHC23,24. Estudios preliminares muestran que el uso prolongado de metformina en pacientes diabéticos25 o de propranolol en pacientes infectados por el VHC26 podrían asociarse a un descenso de la incidencia de CHC. Asimismo, una revisión sistemática y metaanálisis ha mostrado que el uso de estatinas se asocia a una reducción de la incidencia de CHC27. Por último, estudios recientes han sugerido que el uso de aspirina podría asociarse a una disminución de la incidencia de CHC28.
A continuación detallamos las actualizaciones en relación a cada una de las etiologías más frecuentes:
Hepatitis BVarios estudios han demostrado que la replicación del VHB incrementa el riesgo de CHC29-31. Estudios retrospectivos realizados predominantemente en Asia indican una reducción del riesgo del 30% de CHC en cirróticos con el uso de entecavir y tenofovir, y del 80% en pacientes sin cirrosis, aunque la evidencia en pacientes occidentales aún es limitada32-34. Hay que destacar que los antivirales actuales contra el VHB no eliminan de forma completa el riesgo de CHC, especialmente en pacientes con cirrosis, en los que incluso una muy baja carga viral (< 2.000 UI/mL) supone un aumento de riesgo de CHC (HR 2,20) comparado con pacientes con DNA del VHB indetectable35. El score PAGE-B se ha validado en población caucásica bajo tratamiento antiviral. Valores ≥ 10 predicen una incidencia acumulada de CHC a cinco años en torno al 4% y PAGE-B ≥ 18 una incidencia acumulada de 17% a cinco años36. Asimismo, un estudio reciente sugiere que los scores PAGE-B y PAGE-B modificado podrían utilizarse para no considerar el cribado en paciente con VHB bajo tratamiento antiviral y muy bajo riesgo de desarrollar CHC37.
Hepatitis CEl desarrollo de una vacuna profiláctica como prevención primaria es aún un reto debido a la alta variabilidad de la genética viral, aunque hay avances prometedores38. Por ello, la prevención se basa fundamentalmente en evitar la trasmisión, en particular por vía parenteral a través de transfusión de hemoderivados o agujas contaminadas. Cuando la infección ya se ha adquirido, el riesgo de complicaciones y la mortalidad asociada al desarrollo de una cirrosis, así como el riesgo de desarrollar CHC, es menor en pacientes que alcanzan respuesta viral sostenida (RVS), independientemente del grado de fibrosis de la enfermedad hepática del paciente7.
A pesar de la mejora en la tasa de RVS con los antivirales de acción directa (AAD), se prevé que la incidencia de CHC aumente aún más hasta 206039 y se estima que la infección por VHC no diagnosticada representa el 50% o más del total de los pacientes infectados.
En pacientes con cirrosis ya establecida, la RVS reduce el riesgo de CHC en comparación con aquellos pacientes que no logran RVS40,41. Sin embargo, el corto seguimiento de los pacientes tratados con AAD y la falta de estudios destinados a estudiar el cribado de CHC de forma prospectiva en estos pacientes, imposibilitan realizar conclusiones robustas respecto a la tasa de CHC en pacientes tratados con AAD. Se han descrito múltiples factores de riesgo para el desarrollo de CHC de novo después de tratamiento con AAD tales como el fallo del tratamiento, el consumo de alcohol, la edad avanzada (> 65 años), el sexo masculino, la presencia de cirrosis, el genotipo 3, la diabetes, el síndrome metabólico, un índice MELD alto, niveles bajos de albúmina y/o plaquetas y niveles altos de alfa-fetoproteína (AFP)12,42-44. Sin embargo, en la actualidad, no se dispone de ningún criterio/score predictivo de la tasa de CHC antes de iniciar el tratamiento con AAD.
Un estudio realizado en España analizó la incidencia de CHC en pacientes cirróticos que lograron la RVS y no tenían nódulos en la ecografía realizada dentro de los 30 días previos a iniciar el tratamiento con AAD. Este estudio demostró que en esta población la incidencia de CHC es de 3,04 (IC 95% 1,45-6,37) por cada 100 personas/año45 y que la mediana de aparición de CHC observada va más allá de los 24 meses. Otro estudio multicéntrico español concluye que el CHC es la complicación más frecuente tras la obtención de RVS con AAD46.
Cabría esperar que la erradicación del VHC se tradujera en una disminución del riesgo de CHC, tanto de novo como del de recurrencia. Esta expectativa ha sido cuestionada en el contexto de los pacientes con antecedente de CHC previo el inicio de AAD47. Las observaciones clínicas y experimentales sugieren que existen modulaciones AAD-específicas de la inmunidad del huésped y de la oncogénesis48. Además, hay estudios que sugieren la presencia de un efecto tiempo-dependiente en la aparición de CHC tras AAD, especialmente en los pacientes con nódulos no caracterizados en la ecografía de cribado42,49.
Algunos de los factores que se sugieren que podrían tener impacto en el desarrollo de CHC de novo en pacientes tratados con AAD son conocidos como factores de riesgo de CHC (edad, sexo masculino, diabetes o elevación de la AFP). También se sugiere que tanto microARN50 como marcadores séricos diferentes a la AFP, como la angiopoietina-251, podrían condicionar el riesgo de CHC en esta población de pacientes.
Abuso de alcoholNo se ha modificado la importancia del alcohol como factor de riesgo de CHC52 y ésta es la causa más importante de CHC en España53. Existen dos metaanálisis de estudios de cohortes, uno que incluyó 19 estudios demostró un aumento del riesgo de CHC dependiente de la dosis (HR 1,16)54 y el segundo, de cuatro estudios, mostró que la abstinencia redujo el riesgo de CHC un 6-7% anual. Aún, con alto nivel de incertidumbre, se cree que se precisan más de dos décadas para reducir el riesgo de CHC al nivel de los que nunca han consumido alcohol cuando ya existe cirrosis establecida55. Los pacientes con CHC por alcohol suelen diagnosticarse con más frecuencia en fase avanzada, en el seno de cirrosis descompensada, y en menor proporción en programas de vigilancia, comparado con los de etiología viral52.
Enfermedad de hígado graso no alcohólico (EHGNA)La EHGNA es una entidad de incidencia creciente y que implica riesgo de evolucionar a cirrosis y cáncer hepático56. Un 25% de la población mundial presenta EHGNA; el 60% de los pacientes con EHGNA biopsiados presentan esteatohepatitis no alcohólica (EHNA) con una tasa de CHC de 5,29 por 1.000 personas-año18.
Según el estudio de Markov realizado con datos provenientes de China, Francia, Alemania, Italia, España y Reino Unido, se estima que la prevalencia de CHC por EHNA aumentará en todos los países, predominando en Estados Unidos, donde se prevé que el incremento llegue a un 130% (10.820 casos en 2016 que se incrementaran a 24.860 en 2030)56. Sin embargo, los datos publicados hasta la fecha provienen de análisis conjuntos de pacientes cirróticos y no cirróticos57. Los datos de incidencia/prevalencia de CHC en pacientes no cirróticos provienen mayoritariamente de trabajos retrospectivos en los cuales el objetivo primario de los mismos no fue el desarrollo del CHC57,58.
Recomendaciones- •
La vacunación universal contra el VHB reduce la incidencia de CHC (evidencia alta, recomendación fuerte).
- •
En pacientes con hepatitis crónica viral se recomienda el tratamiento antiviral ya que ha demostrado su impacto en prevenir la evolución a cirrosis y, por tanto, prevenir el desarrollo de CHC (evidencia alta, recomendación fuerte).
- •
Una vez establecida la lesión hepática asociada a riesgo clínicamente relevante (cirrosis, o incluso sin alcanzar la cirrosis en pacientes con infección por el VHB), la eliminación del agente etiológico disminuye, pero no elimina, el riesgo de aparición de CHC (evidencia alta, recomendación fuerte).
- •
Los pacientes con cirrosis asociada a VHC mantienen tanto el riesgo de CHC de novo como de recurrencia de CHC, incluso después de alcanzar respuesta viral sostenida. Se recomienda mantener la estrategia de vigilancia convencional en estos pacientes (evidencia moderada, recomendación fuerte).
- •
Se ha demostrado que el consumo de café disminuye el riesgo de CHC en pacientes con enfermedad hepática crónica (evidencia moderada, recomendación fuerte).
El cribado en oncología se define como la realización de un test de forma repetida con el objetivo de disminuir la mortalidad asociada a la neoplasia59. Teniendo en cuenta que la única posibilidad de aplicar tratamientos con intención curativa es diagnosticando la enfermedad en una fase asintomática y dado que esta opción es únicamente factible si se efectúa cribado en la población en riesgo, se recomienda ofrecer cribado en pacientes con cirrosis que serían tratados si fueran diagnosticados de CHC. El cribado debe realizarse mediante ecografía (US). Múltiples estudios de cohortes60-62 y de coste eficacia63-65 refuerzan la utilidad de establecer seguimiento mediante US cada seis meses. Idealmente, el beneficio de las técnicas de cribado debería ser evaluado mediante estudios prospectivos y aleatorizados. Se dispone de un único estudio prospectivo y aleatorizado efectuado en China. Incluyó aproximadamente 20.000 pacientes con infección crónica por VHB y los aleatorizó a recibir cribado mediante ecografía (US) cada seis meses y determinación de AFP versus no cribado. A pesar de la baja adherencia (< 60%), la supervivencia de los pacientes incluidos en el programa de cribado fue de 66% a un año, 53% a tres años y 46% a cinco años vs. 31%, 7%, y 0%, respectivamente, en pacientes sin cribado66. La eficacia del programa se relacionó con la capacidad de la US, mientras que la determinación de AFP no fue eficiente67. La realización de un nuevo ensayo clínico de validación en países desarrollados no es viable; la US es parte de la evaluación rutinaria de los pacientes afectos de hepatopatía crónica y la percepción de beneficio del cribado por parte de los facultativos y los pacientes impiden el reclutamiento68. Con toda la evidencia disponible, existe consenso generalizado en recomendar programas de cribado periódico en pacientes cirróticos que fueran a ser tratados en caso de ser diagnosticados de CHC. En general, deben considerarse para cribado los pacientes cirróticos en clase funcional Child-Pugh A y B. Los pacientes con mala función hepática o con descompensaciones que condicionan mal pronóstico vital (encefalopatía hepática recurrente, ascitis refractaria, hemorragia variceal no controlada, peritonitis bacteriana espontánea, malnutrición, etc.) deben evaluarse para trasplante hepático. En ellos, la detección de CHC no cambiará la indicación de trasplante, a menos que se excedan los criterios de inclusión en lista de espera y el CHC constituya una contraindicación al trasplante. Dado que en estos pacientes el trasplante se debe considerar por insuficiencia hepática con mal pronóstico a corto plazo, la detección de CHC y su posible tratamiento no tendrá impacto clínicamente significativo en la supervivencia. Por tanto, no tiene sentido efectuar cribado para detección precoz si el trasplante no es factible.
Intervalo de exploraciónLos datos referentes a velocidad de crecimiento tumoral y progresión hasta un tamaño detectable por técnicas de imagen son limitados. Series antiguas sugieren que el tiempo para doblar volumen tumoral oscila entre dos y cuatro meses69,70 y estos resultados aportan la base racional para efectuar cribado cada seis meses. Asimismo, este intervalo fue el que se utilizó en el único ensayo clínico aleatorizado que ha demostrado el beneficio del cribado de CHC con ecografía en pacientes con hepatopatía crónica66. Algunos autores sugieren que los pacientes de alto riesgo deberían examinarse más frecuentemente71, pero no existen datos que demuestren que mayor riesgo se asocie a mayor velocidad de crecimiento tumoral. Un estudio sugirió que un intervalo de 12 meses entre exploraciones se asociaba a menor supervivencia y menor capacidad de detección que el intervalo de seis meses72 y un ensayo clínico aleatorizado realizado en Francia e incluyendo 1.200 pacientes cirróticos concluyó que el cribado mediante ecografía cada tres meses no mejora el diagnóstico ni el tratamiento del CHC respecto a realizarlo cada seis meses73. Finalmente, estudios coste-eficacia sugieren que el intervalo de seis meses es más coste-eficaz respecto otras alternativas74. Por lo tanto, con la evidencia científica actual se considera que el intervalo recomendado debe ser de seis meses.
Instrumentos para cribadoLas técnicas de cribado de CHC pueden dividirse en radiológicas y serológicas. La prueba radiológica recomendada es la ecografía abdominal. Se trata de una técnica no invasiva, aceptada por la población, con una sensibilidad de 60-80% y una especificidad superior al 90% para la detección precoz de CHC75. Además, se dispone de una estrategia diagnóstica bien definida tras la detección de un nódulo sospechoso de CHC. Por tanto, la ecografía abdominal, realizada por personal experto, es actualmente la técnica de cribado más adecuada para la realización de detección precoz de CHC. En la práctica clínica real, un número relevante de pacientes no se diagnostican en estadios iniciales debido a la aplicación deficiente de programas de cribado o a la falta de detección de la lesión53,76-79. Con objeto de asegurar el conocimiento y experiencia para efectuar cribado basado en ecografía, sería importante considerar el establecimiento de programas de formación para certificar la capacitación para llevar a cabo esta actividad. La realización de tomografía computarizada (TC) como técnica de cribado debe desaconsejarse por el riesgo asociado a la irradiación80 así como por motivos de coste-eficacia basado en la excesiva detección de falsos positivos y menor disponibilidad. Este aspecto también afecta a la resonancia magnética (RM).
Respecto a las pruebas serológicas, se disponen en la actualidad de multitud de marcadores tumorales. El más evaluado ha sido la AFP, que hasta hace poco tiempo era la única herramienta disponible. Sin embargo, la AFP ha mostrado un bajo rendimiento dado que sus valores en muchos casos son normales en tumores iniciales81 y es bien sabido que los pacientes con cirrosis hepática pueden presentar elevaciones transitorias de AFP en ausencia de CHC82,83. Diferentes análisis retrospectivos evaluando el rendimiento diagnóstico mediante curvas ROC han mostrado que usando diferentes puntos de corte entre 10-20 ng/mL, considerados como óptimos para realizar cribado, la sensibilidad es de 60% y la especificidad de 80%84-86. Cuando se consideran estudios prospectivos donde específicamente se evalúa el rendimiento diagnóstico de las pruebas de cribado, la AFP con el mismo punto de corte muestra una sensibilidad inferior al 25% y una especificidad de 79%81. Un estudio retrospectivo ha sugerido que el incremento progresivo de AFP sería de mayor utilidad87, pero debe validarse prospectivamente. Además, no se dispone de ningún estudio que establezca que incremento de AFP debe llevar a sospechar un CHC si la US es negativa. En este sentido, estudios en explantes demuestran que puede no existir CHC aunque la AFP supere 500 ng/mL88. Estudios recientes en pacientes con cirrosis por VHB tratadas con éxito reportan mayor rendimiento de la AFP, pero aún no existen estudios que muestren que el uso de AFP en esa población sea coste-eficaz89-93. Por último, existe una correlación entre niveles de AFP y estadio tumoral, siendo la AFP un marcador de enfermedad avanzada. Por tanto, la AFP no es una herramienta de cribado eficaz para detección precoz y debe desaconsejarse su uso94,95. Se han propuesto otros marcadores como la fracción de AFP ligada a lectina85,96, des-gamma-carboxiprotrombina (DGCP)85, Golgi protein-73 (GP73)97, glypican-398 o Dickkopf-1 (DKK1)99, pero presentan los mismos inconvenientes que la AFP y en general no pueden competir con la fiabilidad de la US.
Candidatos a cribado de CHCDado que el principal factor de riesgo de CHC es la presencia de cirrosis, deben considerarse candidatos a cribado todos los pacientes con cirrosis independientemente de la etiología. En pacientes afectos de hepatopatía crónica por VHC con cirrosis establecida, la obtención de respuesta viral persistente tras tratamiento con interferón o con AAD no elimina el riesgo de desarrollar CHC7,49,100-103. Por tanto, en estos pacientes también se debe recomendar cribado de CHC. En pacientes con hepatitis crónica por VHB, el cribado se considera coste-eficaz si el riesgo de CHC es superior a 0,2%/año. En este escenario es necesario modelos coste beneficio para valorar la indicación de cribado. La incidencia de CHC en adultos asiáticos o africanos con infección activa por VHB, con o sin historia familiar de CHC, excede claramente este punto de corte104, mientras que la incidencia de CHC oscila entre 0,1-0,4%/año en pacientes occidentales105. La carga viral elevada también se asocia a un aumento del riesgo de CHC; en pacientes asiáticos, niveles de DNA del VHB superiores a 10.000 copias/mL se asocian a un riesgo de CHC superior al 0,2%104. Respecto al VHC, estudios de USA y Japón sugieren que existe riesgo de desarrollar CHC en pacientes con fibrosis en puente en ausencia de cirrosis106,107. Dado que la transición desde fibrosis avanzada a cirrosis no puede definirse correctamente, existe acuerdo para ofrecer cribado de CHC a esta población. En el momento actual no disponemos de información respecto a la incidencia de CHC en pacientes con fibrosis avanzada por infección por VHC con RVS tras AAD, lo que impide poder hacer una recomendación en esta población. La elastografía hepática parece ser una herramienta útil para determinar de forma no invasiva la presencia de fibrosis avanzada108 y de hipertensión portal109,110, siendo capaz de estratificar pacientes con diferente riesgo de desarrollar CHC111-116. No obstante, la mayoría de estudios provienen de pacientes con infección activa por VHC y no se ha validado en pacientes que han obtenido RVS. Recientemente se ha sugerido que es posible estratificar el riesgo mediante estudios genéticos117,118 y que esta información se podría asociar a los parámetros clínicos anteriormente discutidos.
Los pacientes con cirrosis hepática alcohólica no presentan un riesgo de desarrollo de CHC homogéneo. Estudios del Norte de Europa reportan una incidencia reducida pero datos del resto del mundo, incluyendo Francia117 y España, indican lo contrario119. En el caso de la colangitis biliar primaria, se ha establecido una incidencia de 3,4 casos/1.000 pacientes-año y los principales factores predictivos de desarrollo de CHC son la ausencia de respuesta bioquímica tras tratamiento médico120 y la presencia de un estadio iv de la enfermedad121. Por último, existe escasa información respecto al riesgo de CHC en pacientes afectos de EHGNA, particularmente en aquellos que aún no han desarrollado cirrosis, por lo que no es posible realizar ninguna recomendación de cribado en esta población57. A pesar de que no existen valores del porcentaje de pacientes con EHGNA que desarrollan CHC, probablemente aquellos que ya han desarrollado una cirrosis deberían ser considerados para cribado, aunque la existencia de comorbilidad cardiovascular con riesgo competitivo de muerte puede impedir un impacto positivo en la supervivencia global de los pacientes. El mismo concepto aplica a hemocromatosis hereditaria y otras entidades que evolucionan a cirrosis.
Recomendaciones- •
Los pacientes afectos de cirrosis hepática de cualquier etiología deben ser considerados para participar en programas de cribado (evidencia moderada, recomendación fuerte).
- •
La técnica de cribado más adecuada es la ecografía abdominal realizada por personal experto (evidencia moderada, recomendación fuerte).
- •
No se recomienda el uso de AFP como técnica de cribado (evidencia moderada, recomendación débil).
- •
La ecografía abdominal de cribado se debe realizar cada seis meses. El intervalo de cribado no necesita ser acortado en pacientes con mayor riesgo de desarrollar CHC (evidencia moderada, recomendación débil).
- •
No existen datos para poder realizar una recomendación en pacientes con enfermedad hepática por hígado graso (EHGNA) sin cirrosis y en pacientes VHC sin fibrosis avanzada que han conseguido RVS (evidencia baja, recomendación débil).
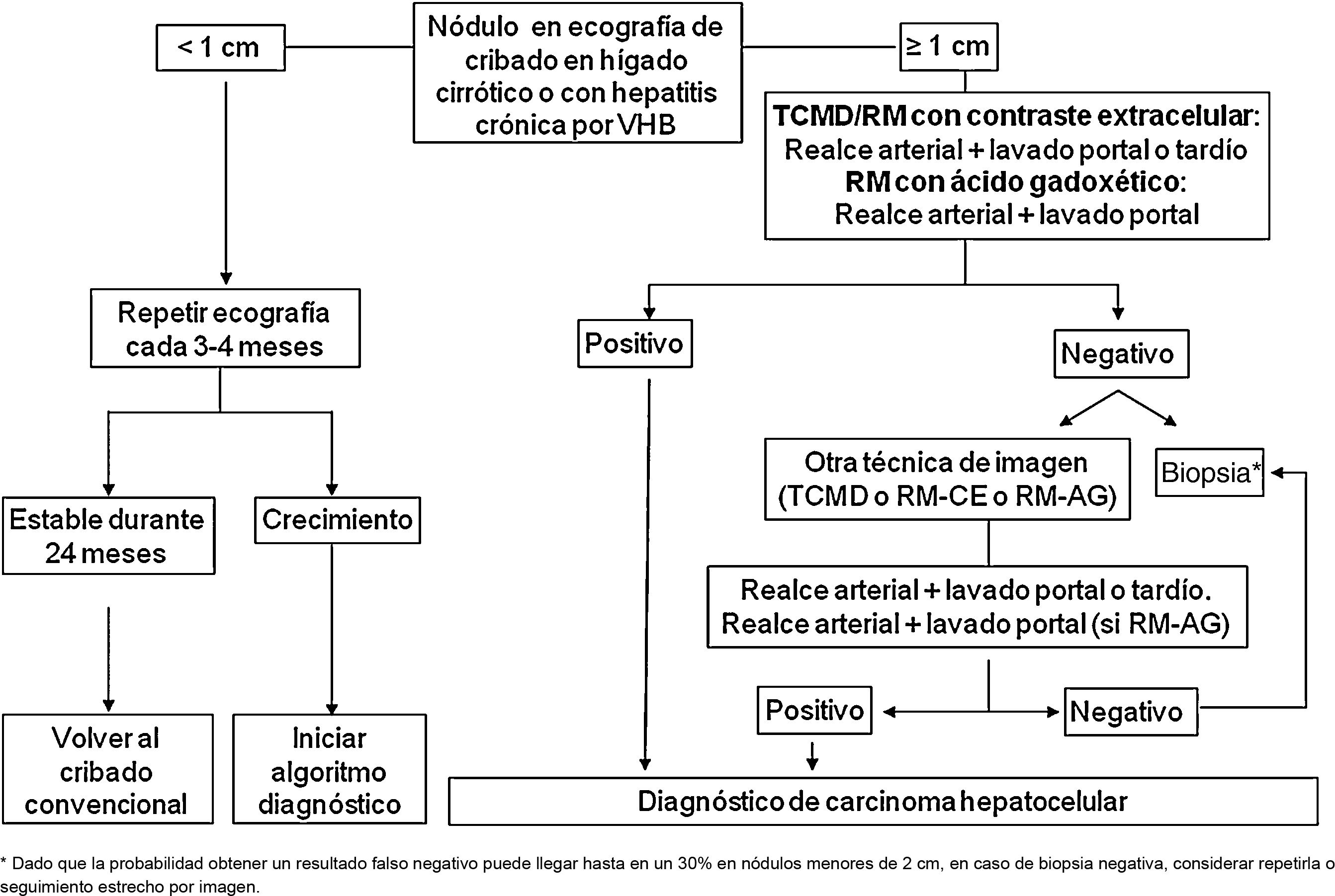
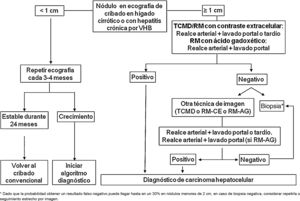
En los pacientes afectos de cirrosis hepática, la probabilidad de que un nódulo de nueva aparición detectado mediante ecografía sea un CHC es muy elevada, especialmente si su diámetro excede los 10 mm81. Por tanto, si el nódulo detectado alcanza o supera este límite, es recomendable proseguir los estudios para llegar a un diagnóstico definitivo. El CHC presenta una vascularización predominantemente arterial (neovascularización), así como una disminución progresiva de radicales portales a medida que avanza el proceso de hepatocarcinogénesis122, a diferencia del parénquima hepático en donde la vascularización es mixta: arterial y portal. Esto determina el patrón vascular típico del CHC, caracterizado por una intensa captación de contraste en la fase arterial tardía, seguida de un lavado de la lesión en fases venosas. Esto se manifiesta en las técnicas de imagen por una mayor densidad/intensidad de señal de la lesión en la fase dinámica arterial tardía del estudio (washin) y una menor densidad/intensidad de señal de la lesión con respecto al parénquima hepático de vecindad en la fase portal y/o tardía (washout). Este patrón característico, favorecido por la alta probabilidad pre-test del CHC en pacientes con hepatopatía crónica, ha mostrado una especificidad próxima al 100% para el diagnóstico de CHC, cuando se ha correlacionado con el análisis anatomopatológico de explantes, piezas de resección quirúrgica o biopsias percutáneas81,123-129. No obstante, este patrón vascular está penalizado por una sensibilidad del 60-70% en lesiones de pequeño tamaño y se ha descrito que alrededor de un 15% de los CHC de pequeño tamaño son hipovasculares al no haber desarrollado aún su neovascularización, sin que ello indique que estas lesiones tengan un comportamiento menos agresivo130. Desde la primera propuesta de diagnóstico no invasivo del CHC en la conferencia de consenso de la EASL celebrada en 2000 en Barcelona131, los criterios diagnósticos se han ido refinando en lo que hace referencia al tamaño y características de imagen de la lesión, con la intención de aumentar su sensibilidad, manteniendo su elevada especificidad. De acuerdo con estos criterios, tal y como se proponía en la última versión de las guías clínicas de la AEEH1, es posible establecer el diagnóstico de CHC sin necesidad de confirmación patológica cuando un nódulo de 1 cm de tamaño o más, detectado en un paciente con hepatopatía crónica, muestra en un estudio dinámico de imagen (TC o RM) intensa captación de contraste en fase arterial seguida de lavado en fase portal (y/o venosa si se trata de una TC o de una RM con contraste extracelular).
Se han publicado numerosos estudios y varios metaanálisis en los últimos años para determinar la eficacia diagnóstica de la TC y de la RM para el diagnóstico del CHC de pequeño tamaño en pacientes en riesgo, con resultados muy dispares132-136, que como conclusión han mostrado una tendencia que indica una mayor eficacia diagnóstica de la RM sobre la TC, aunque sin diferencias significativas que permitan hacer una recomendación formal de una técnica sobre la otra.
El ácido gadoxético es un contraste combinado de RM, con un componente extracelular que permite la adquisición de estudios en fases dinámicas, y un componente hepatobiliar que hace que los hepatocitos normofuncionantes capten el contraste en fase retardada. Este contraste en particular es captado por las células muy precozmente, por lo que las imágenes obtenidas más allá de la fase dinámica portal no deben ser interpretadas como fases venosas tardías, ya que son en realidad fases transicionales con un componente mixto extracelular y hepatobiliar137,138. Hay numerosa información disponible en la literatura que apunta a una mayor sensibilidad de la RM con ácido gadoxético con respecto a la TC y a la RM con contaste extracelular, sin aportar datos concretos sobre su especificidad139-144. El diseño retrospectivo, con sus sesgos de selección asociados, y la utilización de criterios de imagen no validados para la confirmación final del diagnóstico del CHC, constituyen las mayores limitaciones de estos estudios. Además, la mayoría de ellos se han realizado en Asia, en donde el CHC aparece frecuentemente en pacientes con infección crónica por VHB, sin una cirrosis hepática bien establecida, hecho que pudiera marcar diferencias con respecto al rendimiento de esta prueba de imagen cuando se aplica en una población compuesta por pacientes con una cirrosis hepática instaurada. Los estudios prospectivos publicados hasta la fecha que evaluaron la eficacia diagnóstica de la RM con contrastes extracelulares y la RM con ácido gadoxético mostraron que la RM con contraste órgano-específico no ofreció mayor sensibilidad ni precisión diagnóstica respecto a la RM con contraste extracelular145-147. No se dispone aún de datos de estudios prospectivos en pacientes con cirrosis hepática establecida por abuso de alcohol o infección por VHC incluidos en programas de cribado para CHC ≤ 2 cm que permita establecer el rendimiento de la RM con ácido gadoxético en este grupo seleccionado de pacientes.
El uso de ácido gadoxético en los estudios de RM está aceptado en la reciente actualización de las guías para el manejo del CHC de la EASL3 y de la AASLD148. En ambas sociedades científicas se considera como criterio diagnóstico no invasivo de CHC un patrón vascular definido como captación arterial y lavado en la fase portal, mientras que las características de la lesión en las fases transicional y hepatobiliar no son tenidas en cuenta ya que son fases mixtas o exclusivamente hepatobiliares en las que la hiposeñal de la lesión no es consecuencia de la disminución o ausencia de vasos portales en el CHC, sino de la disminución o ausencia de la expresión de OATP8, que es un transportador responsable de la captación celular del contraste, y que está generalmente ausente en el CHC. No obstante, puede estar presente en algunos CHC, especialmente en los bien diferenciados. La inclusión de la hiposeñal de la lesión en fases retardadas como signo de lavado y por tanto aplicable a los criterios de imagen no invasivos, conllevaría un aumento de la sensibilidad para la detección del CHC, pero sería a costa de reducir su especificidad149. Por otra parte, se han descrito artefactos respiratorios transitorios durante la fase arterial del ácido gadoxético en un porcentaje de estudios que oscila entre el 2,4% y el 18%, que se atribuyen a una dificultad de los pacientes para mantener la apnea durante los primeros segundos tras la inyección del contraste150-152. Finalmente, la secuencia en fase hepatobiliar suele ser deficiente en pacientes con insuficiencia hepática importante. Por tanto, la RM con ácido gadoxético con la lectura del lavado venoso limitado a la fase dinámica portal para evitar posibles sobre-diagnósticos es una técnica aceptada que puede ser empleada en el diagnóstico no invasivo del CHC. No obstante, la escasez de estudios prospectivos comparativos de su precisión diagnóstica con respecto a la RM obtenida con contraste extracelular hace que en el momento actual no se disponga de suficiente evidencia científica que apoye la recomendación de su uso como primera técnica diagnóstica, por delante de la RM con contraste extracelular.
Cuando el patrón vascular de un nódulo es atípico en la TC o la RM, y no muestra hallazgos de imagen que sugieran que se pudiera tratar de un proceso maligno, se ha propuesto el uso de la ecografía con contraste (CEUS) como test de segunda línea en la última actualización de las guías de la EASL3. El nivel de evidencia es moderado y el grado de recomendación es débil. La justificación para esta incorporación es el reciente refinamiento de los criterios ecográficos que favorece el diagnóstico diferencial entre CHC y colangiocarcinoma intrahepático (CCI). El lavado venoso se observa en la CEUS tanto en el CHC como en el CCI153,154, por lo que la especificidad de la RM y de la TC es superior a la de la CEUS155,156. No obstante, la mayoría de los CCI (50-88%) tienen un lavado precoz que tiene lugar antes de los 60 segundos de la inyección del contraste, mientras que este tipo de lavado aparece únicamente en el 16% de las lesiones de CHC, ya que en la mayoría de CHC el lavado de la lesión se produce después de los 60 segundos tras la inyección del contraste157-159. El patrón vascular del CHC en la CEUS sería la captación arterial homogénea de la lesión y un lavado lento y moderado, que se produce más allá de los 60 segundos después de la inyección del contraste, en contraposición con el CCI que mostraría captación arterial predominantemente periférica y lavado rápido e intenso. Estos nuevos criterios de la CEUS para el diagnóstico de CHC han sido adoptados por el American College of Radiology (ACR), que ha desarrollado recientemente los criterios CEUS–LIRADS versión 2017160, que están pendientes de validación prospectiva que permita conocer su precisión diagnóstica. Un estudio retrospectivo aplicando los criterios LIRADS para CEUS, mostró un valor predictivo positivo para la categorización LR5 de un 99% para el diagnóstico de CHC161. No obstante, en otro estudio retrospectivo, Shin et al. reportaron unos valores de sensibilidad y especificidad de la CEUS del 91,1% y 83,3% respectivamente para establecer el diagnóstico diferencial entre CHC y CCI162. Un estudio multicéntrico publicado por Aubé et al.163 compara el rendimiento diagnóstico de la TC, la RM y la CEUS de forma independiente y en combinación, para el diagnóstico del CHC de entre 1 y 3 cm de tamaño. Se trata un análisis retrospectivo de un grupo de pacientes recogidos de forma prospectiva a partir de los programas de cribado de los centros incluidos, y analiza 544 nódulos estudiados en 381 pacientes. La sensibilidad y especificidad del patrón vascular de captación arterial y lavado venoso del CHC de entre 1 y 2 cm (n = 342 lesiones) de la TC, la RM y la CEUS, fue del 67,9 y 76,8%, del 70,6% y 83,2%, y del 39,6% y 92,9% respectivamente. La sensibilidad y especificidad para el diagnóstico de CHC de 1-2 cm de la TC, la RM y la CEUS, de los 25 pacientes que tenían confirmación diagnóstica tras el tratamiento quirúrgico fue del 55,6 y 71,4%, del 61,1% y 85,7%, y del 22,2% y 85,7% respectivamente. Sorprende en este estudio la baja especificidad de la TC y de la RM, que oscila entre el 96-100% en otras series81,126-128. Por el momento faltan estudios prospectivos que validen los resultados de la CEUS para el diagnóstico de CHC en lesiones nodulares de entre 10 y 20 mm detectadas en la US de cribado que confirmen estos resultados iniciales, ya que la subjetividad en la evaluación de la intensidad del lavado podría suponer una limitación. Aunque en casos puntuales la CEUS puede ser de, ayuda en estos momentos no hay evidencia científica suficiente que justifique su utilización rutinaria después de una TC o RM no diagnósticas. Por tanto, y en un intento de no demorar el diagnóstico, cuando el patrón vascular de la lesión no es típico, la confirmación del diagnóstico de CHC debe basarse en la biopsia. Finalmente, en el caso de nódulos menores de 1 cm, dada la baja probabilidad de que sea de naturaleza maligna81 y la dificultad que supone su correcta caracterización, se recomienda realizar un seguimiento estrecho mediante una ecografía cada 3-4 meses con la finalidad de detectar su posible crecimiento, para entonces aplicar los criterios diagnósticos ya expuestos, tal como se observa en la figura 1. Estos criterios no invasivos basados en la detección del patrón vascular específico de CHC han sido validados externamente en Europa81,126,127, Norteamérica128 y Asia129 y son solo aplicables en pacientes con cirrosis hepática establecida o bien en pacientes con infección por VHB de larga evolución adquirida en periodo perinatal/infancia. En el resto de los pacientes, es necesario un estudio anatomopatológico para obtener un diagnóstico definitivo de la lesión. La detección de otros parámetros de imagen como la presencia de grasa intralesional, hipodensidad/hipointensidad de señal de la lesión en fases venosas de forma aislada, o la presencia de pseudocápsula, no aumenta significativamente el rendimiento diagnóstico164. El ACR propuso en el año 2011 el sistema LI-RADS (Liver Imaging Reporting and Data System) para la lectura de las imágenes de TC y RM, con la finalidad de estandarizar la interpretación de los informes de TC y RM hepática en pacientes con hepatopatía crónica, y seguidamente establecer una recomendación clínica según el grado de sospecha de que la lesión detectada correspondiera a un CHC. La ACR ha ido actualizando el sistema LI-RADS en varias ocasiones y su última versión ha sido publicada recientemente165,166. LI-RADS clasifica las observaciones en seis grandes categorías: LR-1 (definitivamente benigno), LR-2 (probablemente benigno), LR-3 (probabilidad intermedia para CHC), LR-4 (probablemente CHC), LR-5 (definitivamente CHC) y LR-M (other malignancies: lesiones con alta probabilidad de ser neoplasias malignas diferentes de CHC). La evaluación retrospectiva de una cohorte recogida de forma prospectiva de pacientes cirróticos incluidos en un programa de cribado de CHC en los que la US había detectado un nódulo único de nueva aparición de entre 1 y 2 cm de tamaño demostró que 69% de las lesiones categorizadas como LR-3 fueron CHC y que el criterio LR-4 según la versión LI-RADS del 2014, era tan eficaz como el LR-5 para el diagnóstico de CHC, por lo que uniendo ambas categorías se conseguiría aumentar la sensibilidad sin afectar la especificidad167.
Algoritmo para el diagnóstico de carcinoma hepatocelular.
TCMD: TC multidetector, RM-CE: Resonancia magnética con contraste extraceular, RM-AG: Resonancia magnética con ácido gadoxético.
* Dado que la probabilidad obtener un resultado falso negativo puede llegar hasta en un 30% en nódulos menores de 2 cm, en caso de biopsia negativa, considerar repetirla o seguimiento estrecho por imagen.
De acuerdo a estos resultados, la última versión del sistema LI-RADS propone considerar como LR-5 cualquier nódulo de tamaño no inferior a 10 mm, que en un estudio TC o RM muestre captación arterial de tipo no anular con lavado venoso no periférico, mostrando concordancia con los criterios clásicos ya validados. También se categorizan como LR-5 aquellas lesiones hipervasculares que aun sin mostrar un lavado venoso presenten un crecimiento tumoral de más del 50% en menos de seis meses, aunque faltan análisis prospectivos del valor del aumento del tamaño tumoral como criterio inequívoco para el diagnóstico de CHC166,168,169. Según estos criterios, la probabilidad de CHC asciende progresivamente en las categorías LR 2-4. Según publicaciones previas167,170 y aplicando las versiones LI-RADS de los años 2014 y 2017, el porcentaje de CHC entre las lesiones categorizadas como LR2 oscila entre el 13% y el 23%. En el caso de las lesiones LR3 oscila entre el 38% y el 69%, y en las lesiones LR4 oscila entre el 74% y el 91%, por lo que, y en espera de una validación prospectiva de la última versión del 2018 de los criterios LI-RADS, la confirmación patológica de las lesiones categorizadas como LR 2-4 debe ser recomendada para evitar demoras en el diagnóstico y tratamiento de los pacientes. Posiblemente, la gradación del riesgo de CHC en las lesiones LR 2-4 quizás pudiera tener valor a la hora de indicar una segunda biopsia tras una primera biopsia negativa171, si bien no hay datos disponibles para recomendar esta propuesta. La lectura sistemática de los estudios de imagen según los criterios LI-RADS puede proporcionar una homogeneización de la lectura de los diferentes hallazgos y observaciones, no obstante, el impacto clínico de la correlación de las distintas categorizaciones con la toma de decisiones no está justificada, ya que las categorizaciones LR 2-4 tienen todas ellas un riesgo no despreciable de CHC, y por tanto, seguir controles evolutivos de la lesión en lugar de indicar una biopsia, podría conllevar una demora en el diagnóstico y con ello, un peor pronóstico de los pacientes. Por otra parte, se trata de criterios no validados en estudios prospectivos que permitan conocer su precisión diagnóstica.
Las secuencias de difusión han mostrado potencial utilidad para el diagnóstico de CHC, pero hasta la fecha no existen estudios prospectivos que demuestren un claro aumento del rendimiento diagnóstico172,173. La tomografía por emisión de positrones (PET) con 18FDG es de bajo rendimiento para el diagnóstico del CHC, especialmente en el caso de las lesiones bien diferenciadas de pequeño tamaño, que suelen ser PET-negativas. Otros radiotrazadores como la 11C-Colina, han mostrado resultados iniciales esperanzadores, pero no comparables con los de la TC o la RM174-176.
A pesar del perfeccionamiento de las técnicas de imagen, en un número relevante de casos es preciso realizar una punción del nódulo hepático para llegar al diagnóstico de CHC. Sin embargo, el rendimiento diagnóstico de una biopsia en estos nódulos de pequeño tamaño no es óptimo, dado que existe una tasa de falsos negativos cercana al 30%81. Ello puede depender de un error de muestreo y de la dificultad de realizar un diagnóstico diferencial entre nódulos displásicos y CHC muy iniciales mediante la escasa muestra obtenida a través de una biopsia percutánea122. Por tanto, ante una biopsia negativa no se puede descartar el diagnóstico de CHC y se debe valorar la necesidad de obtener una nueva biopsia3,81,177. Respecto a la técnica para la obtención de material para análisis anatomo-patológico, no existe ningún estudio que haya comparado adecuadamente el rendimiento de la punción-aspiración con aguja fina con la punción con aguja de corte, por lo que no se puede realizar una recomendación generalizada. La citología posee un elevado rendimiento diagnóstico, pero si se pretende analizar la disposición arquitectural, el examen de bloque celular o «mini-biopsia» puede aportar información valiosa. La utilidad de realizar una biopsia del hígado no tumoral es controvertida.
En los últimos años se han propuesto diferentes firmas diagnósticas basadas en expresión génica178 y también tinciones inmunohistoquímicas que reflejarían esta diferente expresión a nivel proteico179-181. Cabe destacar el panel compuesto por glypican 3, heat-shock protein 70 y glutamine synthetase; inicialmente evaluado en tumores obtenidos tras resección quirúrgica o trasplante hepático179 y validado posteriormente en muestras obtenidas mediante biopsia percutánea180,182. Cuando la tinción es positiva para dos de estas proteínas se puede asegurar el diagnóstico, pero el panel inmunohistoquímico no sustituye a la evaluación experta y debería reservarse para confirmar la sospecha diagnóstica de CHC, en particular en aquellas muestras con material escaso o para patólogos con poca experiencia en la evaluación de tumores hepáticos182. Por último, algunos autores han alertado sobre el riesgo de diseminación local (seeding) tras punción de estos nódulos. Sin embargo, la incidencia de esta complicación es muy baja, inferior al 0,1%183,184, y siempre se debe valorar el riesgo asociado a la punción con el riesgo de aplicar tratamiento en pacientes sin CHC confirmado con criterios validados88. Existe controversia sobre la recomendación de realizar biopsias para confirmación diagnóstica con la finalidad de obtener material histológico que permitan evaluar diferentes marcadores moleculares. Aunque es indiscutible la necesidad de obtener muestras para poder avanzar en el conocimiento de las vías moleculares asociadas al CHC, dado que las técnicas radiológicas permiten confirmar el diagnóstico de CHC en un relevante número de pacientes, la obtención sistemática de biopsias debería realizarse en el contexto de un proyecto de investigación con el consentimiento informado del paciente y la aceptación por parte de los comités éticos de cada centro3,185.
Finalmente, el uso de AFP como herramienta diagnóstica presenta un rendimiento muy bajo81,129,186. Diferentes neoplasias como el colangiocarcinoma o metástasis de origen gastrointestinal pueden presentar elevaciones de AFP84,129,187,188. Por tanto, a pesar de encontrar unos niveles elevados de AFP de cualquier magnitud, si la masa hepática no presenta un patrón vascular específico por imagen, se debe realizar una biopsia confirmatoria.
Recomendaciones- •
Los nódulos mayores o iguales a 1 cm detectados mediante ecografía en pacientes cirróticos pueden ser diagnósticos de CHC sin necesidad de obtener una confirmación histológica si presentan captación de contraste en fase arterial seguido de lavado en fases venosas en una técnica de imagen (TCMD o RM con contraste extracelular) (evidencia alta, recomendación fuerte). Cuando se utiliza RM con ácido gadoxético el lavado debe ser evaluado únicamente en la fase venosa portal (evidencia moderada, recomendación débil). Se requieren estudios para validar la utilidad de ecografía con contraste.
- •
Los nódulos menores de 1 cm detectados mediante ecografía de cribado deben ser seguidos mediante una ecografía cada 3-4 meses. Si tras dos años no se detecta crecimiento, se debe volver al cribado habitual cada seis meses (evidencia baja, recomendación débil).
- •
Si el patrón vascular de una lesión focal no es específico de CHC se debe recomendar una biopsia. Si el análisis patológico es negativo, no se puede descartar el diagnóstico de CHC. Se debe valorar la realización de una nueva biopsia diagnóstica o bien realizar seguimiento estrecho de la lesión (evidencia moderada, recomendación fuerte).
- •
En el caso de pacientes sin hepatopatía crónica, la aplicación de estos criterios de imagen no es válida y es necesario la realización de una biopsia para obtener el diagnóstico (evidencia moderada, recomendación fuerte).
- •
La determinación de AFP no es útil para el diagnóstico de CHC (evidencia moderada, recomendación fuerte).
Una vez obtenido el diagnóstico, es necesario realizar el estudio de extensión de la enfermedad y una valoración pronóstica. Con ello es posible informar al paciente y a los familiares sobre la expectativa de vida, elegir el tratamiento más adecuado y evaluar su respuesta. El pronóstico de los tumores sólidos depende fundamentalmente del estadio tumoral. Sin embargo, dado que el CHC aparece en la mayoría de los casos asociado a una cirrosis hepática, y que el grado de alteración de la función hepática determina las opciones terapéuticas y la supervivencia independientemente de la presencia del CHC, es imprescindible considerar conjuntamente el grado de disfunción hepática y la extensión tumoral. Existen diferentes puntuaciones/clasificaciones que evalúan el grado de disfunción hepática, como la clasificación Child-Pugh189, el sistema MELD190 o la clasificación ALBI191. La clasificación ALBI fue diseñada para predecir la evolución de los pacientes con CHC e incluye la bilirrubina y albumina en su nomograma191. Ha sido evaluada en pacientes con diferentes estadios del tumor y tratamientos, pero actualmente su uso no forma parte de las recomendaciones de las mayoría de las guías clínicas en cuanto a tomar decisiones de tratamiento2,3. Finalmente, la presencia de síntomas relacionados con cáncer evaluados adecuadamente mediante escalas validadas, como la clasificación ECOG performance status192 o el índice Karnofsky193 ha mostrado un gran valor pronóstico, y al igual que el grado de reserva funcional hepática, determina la aplicabilidad de los diferentes tratamientos disponibles. Por tanto, aquellos sistemas pronósticos que tienen en cuenta una única dimensión de la enfermedad (extensión tumoral, función hepática o la presencia de síntomas asociados a cáncer) son inexactos y únicamente son útiles para detectar enfermedad terminal. En la última década han aparecido múltiples sistemas de estadificación que tienen en cuenta factores asociados a la extensión tumoral y a la función hepática194. Lamentablemente, la mayoría de ellos no tienen en cuenta la presencia de síntomas o evalúan la extensión tumoral de forma imprecisa. El único que vincula estadificación con tratamiento y que además ha sido validado externamente es el sistema Barcelona Clinic Liver Cancer (BCLC)194. Desde su publicación original en 1999195, el sistema se ha ido perfeccionando hasta su última versión en 2018194. Es el sistema de estadificación recomendado por las sociedades científicas más relevantes, aunque cada una de ellas ha sugeridos adaptaciones sobre dicha clasificación2,3,196,197.
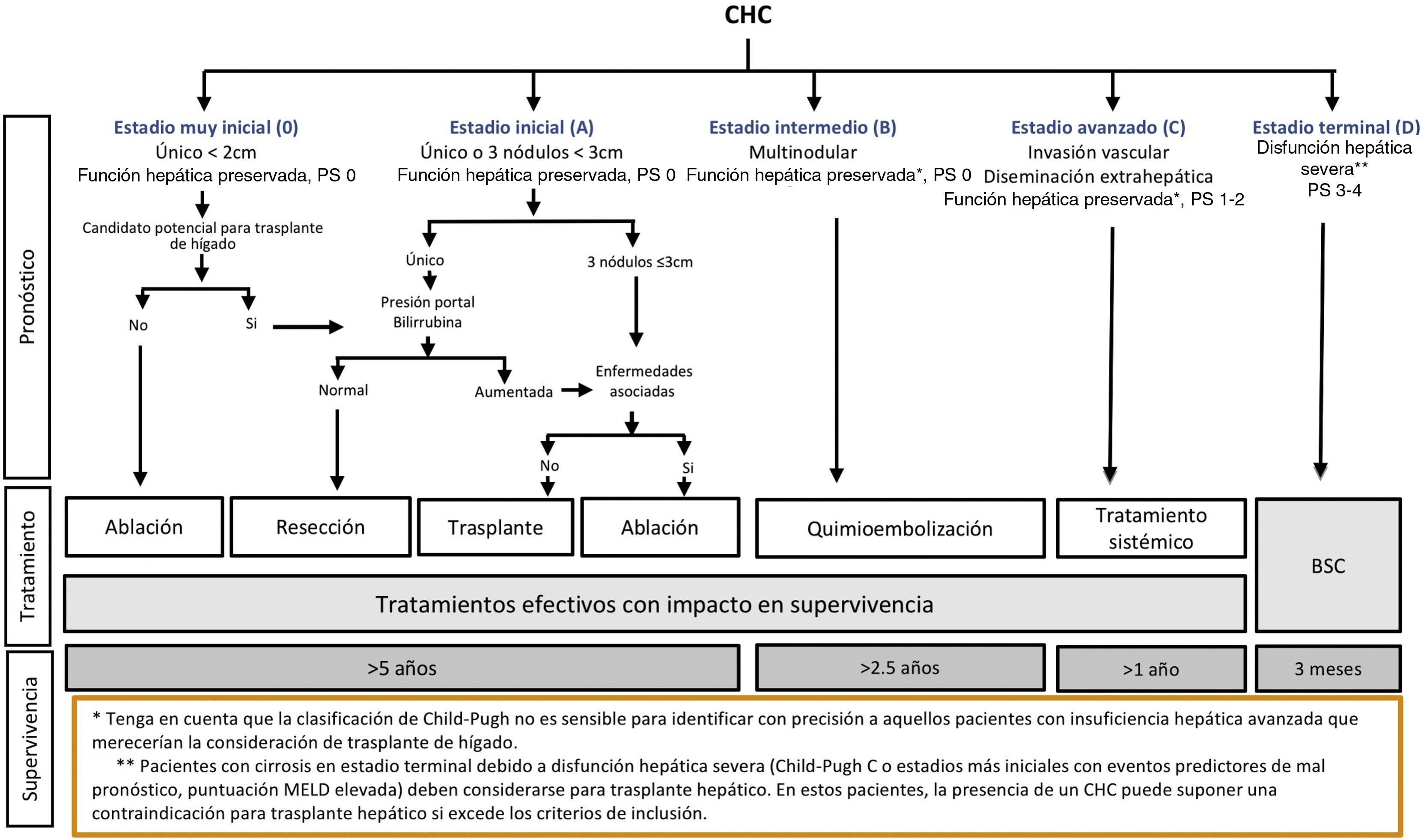
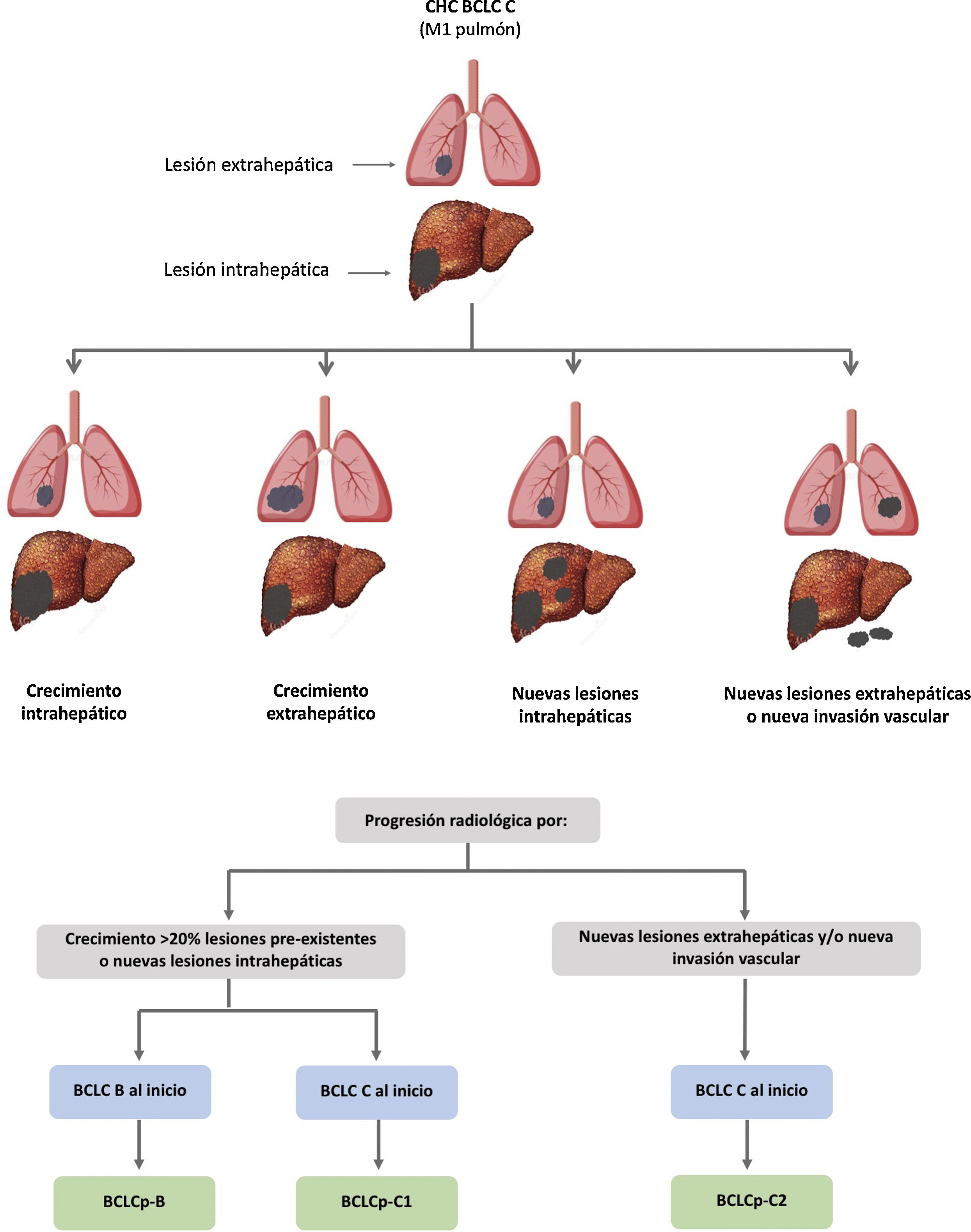
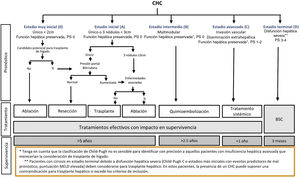
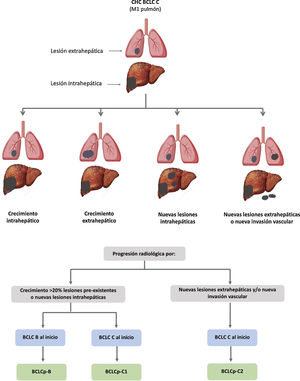
El sistema BCLC incluye variables asociadas al estadio tumoral, función hepática y presencia de síntomas y establece el pronóstico de acuerdo con cinco estadios que se vinculan a la posible indicación de tratamiento (fig. 2). El estadio muy inicial (estadio 0) constituye un grupo con especial buen pronóstico que incluye a pacientes con cirrosis hepática compensada (Child-Pugh A), totalmente asintomáticos, que presentan tumores únicos menores o iguales a 2 cm sin invasión vascular ni diseminación. Este estadio muy inicial correspondería al concepto de carcinoma in situ122. En estos casos, la ablación percutánea ofrece una alta probabilidad de curación, con supervivencias similares a las obtenidas con la resección quirúrgica, pero con menor coste y morbilidad, considerándose la primera opción terapéutica, particularmente en aquellos pacientes sin opciones futuras para trasplante hepático. El estadio inicial (estadio A) incluye pacientes asintomáticos con función hepática conservada (Child-Pugh A y B sin cumplir criterios de trasplante hepático por función hepática) con un CHC solitario o un máximo de tres nódulos hasta de 3 cm de diámetro. Estos pacientes pueden, en general, ser tratados con intención curativa mediante resección quirúrgica, ablación percutánea y trasplante hepático, con una supervivencia esperada a los cinco años entre el 50 y 75%. El estadio intermedio (estadio B) consiste en pacientes con tumores multinodulares que exceden los criterios anteriormente descritos, sin invasión vascular ni extrahepática, con función hepática y estado general conservado. La supervivencia esperada sin tratamiento en este grupo de pacientes es del 49,6% (IC 95% 32-75%) a un año198 y el único tratamiento que ha demostrado eficacia en términos de supervivencia es la quimioembolización hepática (transarterial chemoembolization, TACE)194. En el año 2012, Bolondi et al. propusieron una subclasificación del estadio B en cuatro subgrupos de acuerdo con la carga tumoral, presencia de síntomas y el grado de disfunción hepática199. Sin embargo, esta subclasificación incluye a pacientes con disfunción hepática grave que deberían evaluarse para trasplante hepático y en los que la presencia de un CHC constituye únicamente una contraindicación en caso de que la extensión tumoral exceda los criterios para poder ofrecer esta opción. Adicionalmente, sugiere considerar como BCLC-B los pacientes con PS 1 a pesar de que en el estudio de Bolondi et al. evaluando pacientes tratados con TACE se demuestra que presentar PS1 implica una supervivencia significativamente inferior200. Por último, debe señalarse que de acuerdo con el modelo BCLC, los tumores únicos sin afectación de PS se deben considerar BCLC A, y muchos análisis y propuestas de reformar el modelo BCLC los incluyen equivocadamente como BCLC B. Los pacientes con función hepática conservada, pero que presentan un CHC con invasión vascular y/o extra-hepática o con afectación leve del estado general son catalogados como estadio avanzado (estadio C). En este grupo de pacientes la supervivencia mediana sin tratamiento es de 4-8 meses y son candidatos a tratamiento sistémico. En el contexto de los pacientes con CHC avanzado en tratamiento con sorafenib se desarrolló una clasificación complementaria a la clasificación BCLC y que se denomina BCLC al momento de la progresión201. Esta clasificación es aplicable a los pacientes con CHC en tratamiento sistémico que desarrollan progresión radiológica, pero mantienen el estado general y la función hepática conservada. Los pacientes se clasifican según el estadio de BCLC basal y el patrón de progresión radiológico (fig. 3)202. Los pacientes que comienzan tratamiento sistémico en estadio BCLC-B y desarrollan nuevas lesiones dentro del hígado se denominan BCLCp-B; aquellos que comienzan el tratamiento sistémico en estadio BCLC-C y desarrollan nuevas lesiones dentro del hígado o crecen las lesiones preexistentes independientemente de la localización se denominan BCLCp-C1 y finalmente, aquellos pacientes que desarrollan nuevas lesiones fuera del hígado, independientemente del estadio de BCLC basal se denominan BCLC-C2. Estos grupos de pacientes tienen una mediana de supervivencia post-progresión diferente entre sí y varía entre 24, 15 y 7 meses respectivamente201.
Sistema de estadiaje BCLC (Barcelona-Clinic-Liver-Cancer).
PS: Performance status; BSC: Best supportive care.
Adaptado de Forner et al.194.
Valor pronóstico de los patrones de progresión. El patrón de progresión en la terapia de primera línea con sorafenib es un factor pronóstico en pacientes con carcinoma hepatocelular (CHC). Los pacientes que desarrollan nuevas lesiones extrahepáticas tienen una menor supervivencia que aquellos con otros patrones. De acuerdo con estadio basal y el patrón de progresión, se establecen diferentes grupos pronóstico, conocidos como clasificación BCLC (Barcelona-Clinic-Liver-Cancer) tras la progresión (BCLCp). BCLCp-B define la progresión radiológica debido al crecimiento de nódulos hepáticos existentes o nuevos focos intrahepáticos, pero el paciente se encuentra todavía dentro del estadio intermedio (BCLC B) a causa de la ausencia de invasión vascular o diseminación extrahepática. Los pacientes que presentan progresión radiológica y evolucionan a estadio avanzado (BCLC C) o progresan dentro de BCLC C se dividen en BCLCp-C1 (crecimiento de nódulos preexistentes o nuevos sitios intrahepáticos) y BCLCp-C2 (progresión por una nueva lesión extrahepática y/o invasión vascular).
Adaptado de Bruix et al.201.
Por último, los pacientes que presentan afectación grave del estado general y/o función hepática comprometida (cirrosis Child-Pugh C o Child-Pugh B con descompensaciones asociadas a pésimo pronóstico como por ejemplo ascitis refractaria, encefalopatía hepática crónica/recurrente o peritonitis bacteriana espontánea) y que no son candidatos a trasplante hepático corresponden al estadio D o terminal. En ellos la mediana de supervivencia es menor de tres meses198 y únicamente se debe indicar tratamiento sintomático.
Recomendación- •
Para evaluar el pronóstico de CHC se ha de considerar no solo el estadio tumoral, sino también la función hepática y la presencia de síntomas relacionados con el tumor. El sistema BCLC tiene en cuenta estos parámetros y es el único que relaciona la predicción pronóstica con la opción terapéutica recomendada (evidencia alta; recomendación fuerte).
El tratamiento del CHC presenta una complejidad especial debido al desarrollo del cáncer en el contexto de una enfermedad hepática crónica. Al mismo tiempo, la enfermedad hepática determina la necesidad de una valoración radiológica experta de los hallazgos de imagen, tanto para el diagnóstico no invasivo, como para la evaluación de la extensión o la aplicación y valoración del tratamiento loco-regional. El tratamiento quirúrgico debe contemplar la resección hepática (cirugía abierta o cirugía laparoscópica) y el trasplante hepático. En el tratamiento sistémico, la detección y manejo de toxicidad, especialmente la hepática, requiere un entorno sanitario que involucre los diversos especialistas que se precisan, especialmente cuando se aplican tratamientos combinados. Finalmente, cuando la hepatopatía de base se descompensa y no es posible un tratamiento oncológico específico debe existir un dispositivo asistencial para atender las necesidades de tratamiento sintomático de la descompensación hepática, con anticipación de los cuidados al final de la vida.
Estas consideraciones, junto con el hecho de que el CHC no es un tumor frecuente, llevan a recomendar que los pacientes con esta neoplasia sean atendidos en centros de referencia donde se disponga de las distintas especialidades y campos de conocimiento involucrados. Ello asegura la aplicación de medicina basada en la evidencia científica y avanzar hacia la medicina de precisión. En este sentido, las Unidades dedicadas a Cáncer Hepático deben incorporar enfermeras de práctica avanzada en oncología hepática con objeto de proporcionar la necesaria educación sanitaria y facilitar el empoderamiento de los pacientes y sus familias.
Resección hepáticaLa resección quirúrgica es el tratamiento de elección para tumores que se desarrollan sobre hígado no cirrótico, donde se pueden realizar resecciones más extensas asumiendo un riesgo bajo de morbimortalidad y una supervivencia aceptable203-205. En pacientes con EHGNA o con VHB, el CHC puede emerger sin una cirrosis de base. En estos pacientes la reserva funcional hepática puede ser adecuada, pero deben tenerse en cuenta la existencia de comorbilidades asociadas a estas entidades. Igual ocurre con la edad avanzada; no es una contraindicación per se, pero debe valorarse cuidadosamente la presencia de comorbilidades.
En nuestro medio, la mayoría de los CHC aparecen en el contexto de enfermedad hepática crónica, normalmente en fase de cirrosis. Por ello, el riesgo de morbimortalidad por fallo hepático postoperatorio al realizar resecciones hepáticas amplias es elevado y antes de indicar la cirugía, debe evaluarse cuidadosamente la función hepática y el volumen hepático remanente. La cirrosis descompensada es una contraindicación formal y el tratamiento a considerar sería el trasplante hepático una vez excluidas contraindicaciones para el mismo3.
Los mejores candidatos a resección quirúrgica son los pacientes con tumores únicos sin invasión vascular ni diseminación extrahepática, con bilirrubina normal y sin hipertensión portal clínicamente significativa (HPCS) es decir, ausencia de varices gastroesofágicas o gradiente de presión en venas suprahepáticas menor o igual 10 mmHg206,207. La presencia de HPCS se asocia con un mayor riesgo de complicaciones postoperatorias y un peor pronóstico a medio plazo. De este modo, en tumores multifocales o en presencia de hipertensión portal, la resección podría ser técnicamente factible y la morbimortalidad inmediata aparentemente aceptable, sin embargo, la supervivencia a cinco años puede ser inferior al 50%, por lo que estos pacientes han de ser considerados para trasplante hepático si cumplen los criterios de selección para ello.
La observación de varices esofágicas o ascitis confirma la existencia de HPCS. La detección de esplenomegalia y un recuento plaquetario inferior a 100.000/mm3 no identifica de forma precisa la presencia de HPCS208. La elastografía hepática puede identificar HPCS de modo que un valor superior a 21 kPa es altamente sugestivo de HPCS y valores inferiores a 13,6 kPa lo descartan110. Desafortunadamente, no hay un punto de corte inequívoco y la elastografía solo permite la correcta evaluación de HPCS en la mitad de los casos110,209.
No existe un tamaño límite para considerar la resección quirúrgica en tumores únicos. Es conocido que el riesgo de nódulos satélites y/o invasión vascular microscópica se incrementa en paralelo al tamaño tumoral, pero tras una estadificación adecuada que descarte estas características, no se observa un mayor riesgo de recurrencia en función del tamaño. Si el examen anatomopatológico detecta invasión vascular microscópica y/o satélites, el riesgo de recidiva es mayor210.
La resección hepática debe guiarse mediante ecografía peroperatoria y pretender una resección anatómica con margen libre de enfermedad con objeto de eliminar la satelitosis microscópica no visible mediante imagen. En tumores < 20 mm, la invasión microvascular con satelitosis es poco frecuente y el beneficio del margen no es evidente. Este beneficio puede existir en tumores de mayor tamaño, pero si ya se registra invasión vascular macroscópica o satélites preoperatoriamente, el beneficio en riesgo de recidiva o supervivencia desaparece.
En pacientes seleccionados de acuerdo a los criterios mencionados previamente e intervenidos quirúrgicamente por equipos experimentados, la mortalidad postoperatoria y las complicaciones postquirúrgicas graves debería ser inferior a 3% y 30%, respectivamente, con una tasa de transfusión inferior al 10%3. Sin embargo, la última versión de las guías clínicas de manejo de CHC de la EASL proponen ampliar estos criterios y la evaluación prospectiva de los criterios propuestos, así como definir el riesgo preoperatorio de dicha expansión3.
El riesgo de recidiva se halla en relación con algunos hallazgos anatomopatológicos, como son el grado de diferenciación tumoral, la presencia de satelitosis, multifocalidad o la presencia de invasión vascular microscópica210. Debido al alto riesgo de recurrencia y el riesgo de que la recurrencia exceda los criterios de indicación de trasplante, se ha propuesto incluir en lista de trasplante hepático aquellos pacientes que presentan hallazgos anatomopatológicos de mal pronóstico (indicación ab initio) antes de la recidiva tumoral, tras esperar un periodo de observación de seis meses, que permita discriminar CHC más agresivos con alto riesgo de recidiva también post-trasplante211.
Los avances en cirugía laparoscópica y robótica permiten tratamientos quirúrgicos menos invasivos y proporcionan resultados comparables en términos de recidiva y supervivencia, pero con menor morbilidad peri-operatoria y estancias hospitalarias más cortas212,213. Determinadas localizaciones (segmentos posterosuperiores), representan mayor dificultad y la cirugía abierta continúa siendo utilizada. El abordaje mínimamente invasivo está desempeñando un papel importante en cuanto a la posibilidad de expansión de los criterios quirúrgicos más allá del teórico «candidato ideal» descrito previamente. Esta posibilidad debería evaluarse prospectivamente en centros especializados.
Tratamiento adyuvante o neoadyuvanteLa recurrencia tumoral complica el 70% de los casos a los cinco años tras la resección quirúrgica, como reflejo de metástasis intrahepáticas (recurrencias llamadas «verdaderas diseminaciones») o por desarrollo de CHC de novo. No existe una definición clara de ambas entidades con base en datos clínicos o temporales. No se dispone de ninguna estrategia terapéutica que haya demostrado eficacia en reducir el riesgo de recidiva. Se espera que el tratamiento del virus de la hepatitis C pueda disminuir el riesgo de CHC de novo, pero hasta la fecha no se ha podido confirmar tras los primeros cinco años de seguimiento, ya que los trabajos publicados tienen medianas de seguimiento de aproximadamente 3-4 años9,10.
Un ensayo clínico en Asia expuso la eficacia de la inmunoterapia adoptiva en reducir la recurrencia y aumentar la supervivencia temprana (a dos años) tras tratamiento curativo214, lo que sugiere que los inhibidores de check-point como CTLA4, PD-1 o PDL1 podrían tener un rol en esta indicación. En un segundo estudio publicado por el mismo grupo se describió el seguimiento de estos pacientes a cinco años y los autores concluyen que tanto el riesgo de recidiva como el de muerte fueron menores en el grupo de inmunoterapia en comparación con el grupo control (HR de supervivencia 0,33; IC 95% 0,15-0,76; p = 0,006)215. Esto apoya el potencial de la inmunoterapia en disminuir el riesgo de recidiva y actualmente están en curso ensayos clínicos para establecer su eficacia.
Recomendaciones- •
La resección quirúrgica se recomienda en pacientes con CHC único sobre hígado no cirrótico o sobre hígado cirrótico con función hepática preservada, bilirrubina normal y gradiente de presión venosa hepática menor o igual a 10 mmHg. Por encima de estos límites, la supervivencia es significativamente inferior (evidencia alta, recomendación fuerte).
- •
En centros de referencia, la resección hepática debería considerarse con abordajes mínimamente invasivos, siguiendo las pautas de la resección hepática abierta (evidencia moderada; recomendación débil).
- •
En la actualidad ningún tratamiento adyuvante ha demostrado eficacia en la prevención de recurrencias tras la cirugía en CHC (evidencia alta, recomendación fuerte). Se recomienda la evaluación de nuevos tratamientos en el marco de ensayos clínicos.
Aunque conceptualmente el trasplante es el tratamiento oncológico de elección en pacientes con CHC, su aplicabilidad está limitada por el riesgo de recurrencia postrasplante (habitualmente diseminada, con pocas alternativas terapéuticas y elevada mortalidad)216 y por su potencial impacto en las listas de espera, donde un aumento excesivo de candidatos con CHC (muchas veces con función hepática preservada y, por tanto, con otras opciones de tratamiento) podría limitar el acceso al trasplante de los pacientes con insuficiencia hepatocelular o sin otra alternativa terapéutica.
Los criterios de Milán (un nódulo menor o igual a 5 cm o hasta 3 nódulos menor o igual a 3 cm, en ausencia de invasión macrovascular o enfermedad extrahepática) están ampliamente validados para seleccionar candidatos a recibir un trasplante hepático217. Sin embargo, algunos autores consideran que son criterios demasiado restrictivos ya que excluyen a pacientes que podrían beneficiarse del trasplante. Por otro lado, los criterios de Milán consideran solo factores morfológicos que, a su vez, dependen de la fiabilidad de las exploraciones radiológicas218, sin tener en cuenta otras variables relacionadas con el comportamiento biológico del tumor. Diversos estudios han demostrado que con «criterios expandidos» algo menos restrictivos se pueden obtener resultados similares a los obtenidos con criterios de Milán en cuanto a supervivencia postrasplante, aunque asociada a un incremento de la tasa de recurrencia.
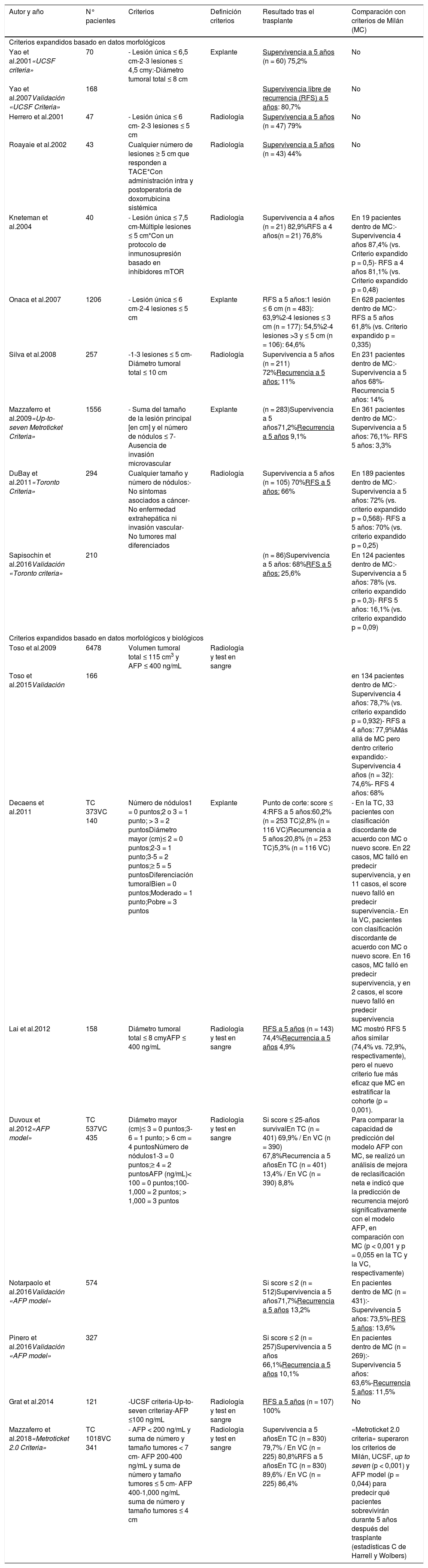
Estos «criterios expandidos» excluyen los casos con invasión macrovascular y/o diseminación extrahepática y, además de ampliar los límites morfológicos (mayor tamaño y/o número de lesiones), muchos programas proponen el uso de los niveles de AFP y/o la respuesta a tratamiento neoadyuvante (downstaging) como marcadores de comportamiento biológico favorable a incluir en los criterios de selección219,220. La tabla 1 resume las propuestas de expansión con mayor aceptación.
Criterios expandidos de trasplante hepático
| Autor y año | N° pacientes | Criterios | Definición criterios | Resultado tras el trasplante | Comparación con criterios de Milán (MC) |
|---|---|---|---|---|---|
| Criterios expandidos basado en datos morfológicos | |||||
| Yao et al.2001«UCSF criteria» | 70 | - Lesión única ≤ 6,5 cm-2-3 lesiones ≤ 4,5 cmy:-Diámetro tumoral total ≤ 8 cm | Explante | Supervivencia a 5 años (n = 60) 75,2% | No |
| Yao et al.2007Validación «UCSF Criteria» | 168 | Supervivencia libre de recurrencia (RFS) a 5 años: 80,7% | No | ||
| Herrero et al.2001 | 47 | - Lesión única ≤ 6 cm- 2-3 lesiones ≤ 5 cm | Radiología | Supervivencia a 5 años (n = 47) 79% | No |
| Roayaie et al.2002 | 43 | Cualquier número de lesiones ≥ 5 cm que responden a TACE*Con administración intra y postoperatoria de doxorrubicina sistémica | Radiología | Supervivencia a 5 años (n = 43) 44% | No |
| Kneteman et al.2004 | 40 | - Lesión única ≤ 7,5 cm-Múltiple lesiones ≤ 5 cm*Con un protocolo de inmunosupresión basado en inhibidores mTOR | Radiología | Supervivencia a 4 años (n = 21) 82,9%RFS a 4 años(n = 21) 76,8% | En 19 pacientes dentro de MC:- Supervivencia 4 años 87,4% (vs. Criterio expandido p = 0,5)- RFS a 4 años 81,1% (vs. Criterio expandido p = 0,48) |
| Onaca et al.2007 | 1206 | - Lesión única ≤ 6 cm-2-4 lesiones ≤ 5 cm | Explante | RFS a 5 años:1 lesión ≤ 6 cm (n = 483): 63,9%2-4 lesiones ≤ 3 cm (n = 177): 54,5%2-4 lesiones >3 y ≤ 5 cm (n = 106): 64,6% | En 628 pacientes dentro de MC:- RFS a 5 años 61,8% (vs. Criterio expandido p = 0,335) |
| Silva et al.2008 | 257 | -1-3 lesiones ≤ 5 cm- Diámetro tumoral total ≤ 10 cm | Radiología | Supervivencia a 5 años (n = 211) 72%Recurrencia a 5 años: 11% | En 231 pacientes dentro de MC:- Supervivencia a 5 años 68%- Recurrencia 5 años: 14% |
| Mazzaferro et al.2009«Up-to-seven Metroticket Criteria» | 1556 | - Suma del tamaño de la lesión principal [en cm] y el número de nódulos ≤ 7- Ausencia de invasión microvascular | Explante | (n = 283)Supervivencia a 5 años71,2%Recurrencia a 5 años 9,1% | En 361 pacientes dentro de MC:- Supervivencia a 5 años: 76,1%- RFS 5 años: 3,3% |
| DuBay et al.2011«Toronto Criteria» | 294 | Cualquier tamaño y número de nódulos:- No síntomas asociados a cáncer- No enfermedad extrahepática ni invasión vascular- No tumores mal diferenciados | Radiología | Supervivencia a 5 años (n = 105) 70%RFS a 5 años: 66% | En 189 pacientes dentro de MC:- Supervivencia a 5 años: 72% (vs. criterio expandido p = 0,568)- RFS a 5 años: 70% (vs. criterio expandido p = 0,25) |
| Sapisochin et al.2016Validación «Toronto criteria» | 210 | (n = 86)Supervivencia a 5 años: 68%RFS a 5 años: 25,6% | En 124 pacientes dentro de MC:- Supervivencia a 5 años: 78% (vs. criterio expandido p = 0,3)- RFS 5 años: 16,1% (vs. criterio expandido p = 0,09) | ||
| Criterios expandidos basado en datos morfológicos y biológicos | |||||
| Toso et al.2009 | 6478 | Volumen tumoral total ≤ 115 cm3 y AFP ≤ 400 ng/mL | Radiología y test en sangre | ||
| Toso et al.2015Validación | 166 | en 134 pacientes dentro de MC:- Supervivencia 4 años: 78,7% (vs. criterio expandido p = 0,932)- RFS a 4 años: 77,9%Más allá de MC pero dentro criterio expandido:- Supervivencia 4 años (n = 32): 74,6%- RFS 4 años: 68% | |||
| Decaens et al.2011 | TC 373VC 140 | Número de nódulos1 = 0 puntos;2 o 3 = 1 punto; > 3 = 2 puntosDiámetro mayor (cm)≤ 2 = 0 puntos;2-3 = 1 punto;3-5 = 2 puntos;≥ 5 = 5 puntosDiferenciación tumoralBien = 0 puntos;Moderado = 1 punto;Pobre = 3 puntos | Explante | Punto de corte: score ≤ 4:RFS a 5 años:60,2% (n = 253 TC)2,8% (n = 116 VC)Recurrencia a 5 años:20,8% (n = 253 TC)5,3% (n = 116 VC) | - En la TC, 33 pacientes con clasificación discordante de acuerdo con MC o nuevo score. En 22 casos, MC falló en predecir supervivencia, y en 11 casos, el score nuevo falló en predecir supervivencia.- En la VC, pacientes con clasificación discordante de acuerdo con MC o nuevo score. En 16 casos, MC falló en predecir supervivencia, y en 2 casos, el score nuevo falló en predecir supervivencia |
| Lai et al.2012 | 158 | Diámetro tumoral total ≤ 8 cmyAFP ≤ 400 ng/mL | Radiología y test en sangre | RFS a 5 años (n = 143) 74,4%Recurrencia a 5 años 4,9% | MC mostró RFS 5 años similar (74,4% vs. 72,9%, respectivamente), pero el nuevo criterio fue más eficaz que MC en estratificar la cohorte (p = 0,001). |
| Duvoux et al.2012«AFP model» | TC 537VC 435 | Diámetro mayor (cm)≤ 3 = 0 puntos;3-6 = 1 punto; > 6 cm = 4 puntosNúmero de nódulos1-3 = 0 puntos;≥ 4 = 2 puntosAFP (ng/mL)< 100 = 0 puntos;100-1,000 = 2 puntos; > 1,000 = 3 puntos | Radiología y test en sangre | Si score ≤ 25-años survivalEn TC (n = 401) 69,9% / En VC (n = 390) 67,8%Recurrencia a 5 añosEn TC (n = 401) 13,4% / En VC (n = 390) 8,8% | Para comparar la capacidad de predicción del modelo AFP con MC, se realizó un análisis de mejora de reclasificación neta e indicó que la predicción de recurrencia mejoró significativamente con el modelo AFP, en comparación con MC (p < 0,001 y p = 0,055 en la TC y la VC, respectivamente) |
| Notarpaolo et al.2016Validación «AFP model» | 574 | Si score ≤ 2 (n = 512)Supervivencia a 5 años71,7%Recurrencia a 5 años 13,2% | En pacientes dentro de MC (n = 431):-Supervivencia 5 años: 73,5%-RFS 5 años: 13,6% | ||
| Pinero et al.2016Validación «AFP model» | 327 | Si score ≤ 2 (n = 257)Supervivencia a 5 años 66,1%Recurrencia a 5 años 10,1% | En pacientes dentro de MC (n = 269):-Supervivencia 5 años: 63,6%-Recurrencia 5 años: 11,5% | ||
| Grat et al.2014 | 121 | -UCSF criteria-Up-to-seven criteriay-AFP ≤100 ng/mL | Radiología y test en sangre | RFS a 5 años (n = 107) 100% | No |
| Mazzaferro et al.2018«Metroticket 2.0 Criteria» | TC 1018VC 341 | - AFP < 200 ng/mL y suma de número y tamaño tumores < 7 cm- AFP 200-400 ng/mL y suma de número y tamaño tumores ≤ 5 cm- AFP 400-1,000 ng/mL suma de número y tamaño tumores ≤ 4 cm | Radiología y test en sangre | Supervivencia a 5 añosEn TC (n = 830) 79,7% / En VC (n = 225) 80,8%RFS a 5 añosEn TC (n = 830) 89,6% / En VC (n = 225) 86,4% | «Metroticket 2.0 criteria» superaron los criterios de Milán, UCSF, up to seven (p < 0,001) y AFP model (p = 0,044) para predecir qué pacientes sobrevivirán durante 5 años después del trasplante (estadísticas C de Harrell y Wolbers) |
Todos los estudios son observacionales. Las referencias completas a los estudios de la tabla se encuentran en el material complementario.
AFP, alfa-fetoprotein; MC, Milan Criteria; RFS, supervivencia libre de recurrencia; TACE, transarterial chemoembolitzation; TC, training cohort; VC, validation cohort; UCSF, University of California, San Francisco criteria.
La AFP elevada (o su incremento progresivo) es un predictor de invasión microvascular y de pobre diferenciación tumoral. Aunque no existe un valor de corte definido, el riesgo aumenta de manera clara a partir de 100 ng/mL, muchos centros establecen niveles de 400-500 ng/mL como contraindicación (al menos relativa) y es comúnmente aceptado que valores > 1000 ng/mL se asocian con un riesgo prohibitivo de recurrencia postrasplante221-223.
La respuesta al tratamiento neoadyuvante (downstaging) se considera otro marcador surrogado del perfil biológico tumoral favorable219,220. La regresión estable (habitualmente se considera seis meses) a los límites de Milán tras tratamiento locorregional en pacientes que previamente los excedían parece identificar un subgrupo de candidatos con resultados de supervivencia y recurrencia comparables a los criterios convencionales.
Existen distintos criterios compuestos que incluyen tamaño/número, volumen, AFP y/o respuesta a tratamientos locorregionales222 o incluso datos histológicos obtenidos por biopsia224. No obstante, los estudios que proponen la expansión de criterios y/o aplicación de downstaging adolecen frecuentemente de diversos defectos metodológicos: diseño retrospectivo vs. prospectivo, tamaño muestral inadecuado, cohortes «expandidas» poco representativas, tiempos en lista de espera variables, utilización de criterios expandidos radiológicos vs. histológicos, ausencia de definición de criterios empleados para estadificación tumoral o simple uso de informes no validados, periodos de observación y de seguimiento insuficientes. Por todo ello, actualmente no es factible una recomendación en este sentido.
Con todas las limitaciones anteriormente expuestas, una expansión moderada de los criterios de Milán podría ser adecuada siempre y cuando se mantenga un acceso al trasplante equitativo con respecto a pacientes con indicaciones diferentes al CHC. En la situación actual caracterizada por un descenso progresivo del número de pacientes en lista de espera de trasplante en nuestro país, la SETH ha elaborado un documento de consenso para expandir indicaciones de trasplante, incluido el CHC225. En dicho documento se recomienda la adopción de los criterios expandidos up to seven ya que son los que cuentan con un soporte científico más sólido (la suma del número de nódulos y del tamaño del nódulo mayor en cm menor o igual a 7)226,227, siempre y cuando exista un contexto de biología tumoral favorable (estimado por el nivel de AFP sérica y por la respuesta a tratamiento ablativo locorregional).
A la hora de llevar esta recomendación a la práctica debe tenerse en cuenta que existe una heterogeneidad epidemiológica entre diferentes comunidades autónomas, así como variables tasas de donación y composición de las listas de espera. Por tanto, la aplicación de las recomendaciones de la SETH a nivel regional requerirá de un análisis específico y un esfuerzo de planificación estratégica. Por otra parte, será indispensable monitorizar prospectivamente el impacto de la ampliación de criterios sobre la composición de las listas de espera para implementar las acciones correctivas necesarias en el futuro de modo que se preserven los principios éticos de utilidad, equidad y justicia del trasplante. Con respecto al downstaging, la SETH no ha emitido recomendaciones. Dada la heterogeneidad de la evidencia científica en este campo, parece una fuente de expansión de criterios subóptima y debería primar la cautela. En cualquier caso, la estrategia ideal sigue siendo aumentar la disponibilidad de órganos mediante donación en asistolia y/o donante vivo.
Recomendaciones- •
El trasplante hepático se recomienda como primera elección para pacientes con CHC dentro de los criterios de Milán no susceptibles de resección hepática (evidencia alta, recomendación fuerte). Los criterios de Milán son el marco de referencia para trasplante hepático por CHC y el comparador de cualquier otra alternativa (evidencia alta, recomendación moderada).
- •
Los pacientes que excedan discretamente los criterios convencionales se podrían considerar para trasplante hepático si dicha expansión no limita significativamente el acceso a trasplante al resto de pacientes e indicaciones. Criterios como el up to seven se consideran como referencia para expandir los criterios de trasplante en CHC, sobre todo en pacientes con AFP sérica baja y respuesta favorable a tratamientos locorregionales. Esta estrategia se debe desarrollar en el contexto de protocolos prospectivos bien definidos (evidencia moderada, recomendación débil).
- •
Los «criterios compuestos» que además del tamaño/número de nódulos informen sobre la biología tumoral (AFP es el marcador más evaluado hasta la fecha) e incluyan el patrón evolutivo tumoral y la respuesta a tratamientos previos, podrían reemplazar en el futuro a los criterios actuales. Estos criterios deberían ser determinados a priori y validados prospectivamente (evidencia baja, recomendación fuerte).
- •
La presencia de invasión vascular macroscópica y/o metástasis extrahepáticas es contraindicación absoluta para trasplante hepático (evidencia alta, recomendación fuerte).
En pacientes en estadio muy inicial, la ablación percutánea podría ofrecer resultados similares en supervivencia a la resección quirúrgica. En casos seleccionados en los que, por la situación del tumor, no es factible la ablación percutánea, ésta también puede realizarse guiada por laparoscopia.
En el momento actual, la ablación mediante radiofrecuencia (radiofrequency ablation, RFA) constituye la técnica de referencia, mientras que la inyección de alcohol (percutaneous ethanol injection, PEI) ha quedado reservada para indicaciones muy especiales por localización o para completar la ablación cuando existe mínima actividad residual228. La RFA ha demostrado mayor capacidad ablativa229-233, y ventaja en supervivencia respecto a la PEI233-236, especialmente en tumores mayores de 2 cm236. Sin embargo, presenta como inconvenientes una mayor frecuencia y severidad de efectos adversos237-239, mayor coste y una menor aplicabilidad, ya que en tumores subcapsulares, adyacentes a la vesícula biliar, hilio hepático o corazón su uso está limitado por riesgo de complicaciones. Además, su eficacia se ve limitada en aquellos tumores en íntimo contacto con vasos sanguíneos por un fenómeno de disipación de la energía térmica que dificulta la completa ablación de la lesión.
La ablación por microondas (MW) ha demostrado una gran capacidad ablativa, y a diferencia de la RFA, su eficacia no se ve afectada por la presencia de vasos sanguíneos adyacentes al tumor240. No obstante, hasta la fecha, no existe ningún estudio prospectivo randomizado que haya demostrado la superioridad de esta técnica respecto a la RFA241. Otras técnicas de ablación tales como láser242, crioablación243, HIFU (high-intensity focused ultrasound)244, o la electroporación irreversible245,246 no han demostrado superioridad respecto a la RFA y presentan un mayor coste y complejidad técnica.
Los sistemas de navegación electromagnéticos guiados por TAC y la fusión de imágenes ya están disponibles permitiendo un refinamiento de la ablación percutánea. Proporcionan punciones más precisas y seguras, reducen el factor operador dependiente y permiten alcanzar localizaciones de difícil acceso. Por otro lado, identifican el nódulo problema independientemente de que éste sea o no visible en la ecografía.
Al igual que la resección quirúrgica, el principal inconveniente de la ablación percutánea es la alta recurrencia (80% a los cinco años) a pesar de obtener una respuesta completa inicial238,247,248. Los ensayos clínicos realizados con el fin de prevenir la recidiva fueron negativos y actualmente están en marcha ensayos clínicos con inmunoterapia.
La ablación percutánea en tumores únicos ≤ 2 cm ofrece unas tasas de necrosis completa superiores al 95% y su eficacia ha sido comparada con la obtenida con la resección quirúrgica247,249-255, con resultados contradictorios. Lamentablemente, estos trabajos presentan problemas metodológicos, particularmente en la asignación de tratamiento y sesgos de selección, que invalidan sus resultados. Estudios de coste-eficacia explorando cuál de estas dos opciones es más coste-eficaz concluyen que la RFA puede ofrecer una supervivencia similar a la resección pero con menor coste256,257. Por tanto, la ablación percutánea puede constituir el tratamiento de primera elección en pacientes con CHC en estadio muy inicial.
Recomendaciones- •
La ablación tumoral es un tratamiento eficaz en aquellos pacientes con CHC inicial no candidatos a resección quirúrgica o como tratamiento durante el tiempo de espera del trasplante hepático (evidencia alta, recomendación fuerte).
- •
La inyección de etanol y la radiofrecuencia poseen una eficacia similar en tumores menores de 2 cm. La radiofrecuencia es el tratamiento ablativo de referencia (evidencia alta, recomendación fuerte).
- •
En tumores menores de 2 cm, la radiofrecuencia presenta una eficacia terapéutica similar a la resección quirúrgica (evidencia moderada, recomendación fuerte).
La TACE es el tratamiento de elección en los pacientes con CHC intermedio (estadio B de la clasificación BCLC). Consiste en la cateterización selectiva de la arteria hepática, y supraselectiva de arterias nutricias tumorales, y en la inyección de un agente quimioterápico juntamente con la oclusión del flujo arterial mediante una sustancia embolizante258. La TACE se halla indicada en pacientes con hepatopatía compensada con tumores multifocales sin invasión vascular ni diseminación extrahepática. Se considera contraindicada en pacientes con descompensación de la cirrosis y/o afectación multicéntrica de ambos lóbulos hepáticos que impidan una intervención selectiva, ausencia de flujo portal (trombosis o flujo hepatofugal), fístula arteriovenosa no tratable, anastomosis bilio-entérica o stent biliar y un aclaramiento de creatinina < 30 mL/min. En estos casos existe un alto riesgo de descompensación de la hepatopatía y aunque pueda conseguirse una respuesta tumoral objetiva, el beneficio en supervivencia es marginal259. El efecto adverso más frecuente de la TACE es el síndrome postembolización, mientras que la insuficiencia hepática, abscesos, colecistitis isquémica o incluso muerte afectan a menos del 1% de los pacientes. La fiebre es un marcador de necrosis tumoral y la antibioticoterapia profiláctica no evita el riesgo de infección260.
La TACE ha demostrado de forma robusta beneficio en términos de supervivencia261-263. Su técnica ha evolucionado en los últimos años y aún existen muchos aspectos a investigar264,265. La modalidad de tratamiento que demostró un beneficio en la supervivencia consiste en la administración de un agente quimioterápico juntamente con lipiodol como vehículo transportador, seguida de la oclusión vascular con partículas de espongostan. Esta modalidad de tratamiento se conoce como TACE convencional. En los últimos años se ha evaluado la seguridad y eficacia del uso de microesferas sintéticas cargadas con adriamicina (conocido como DEB [drug-eluting bead]-TACE). Las partículas cargadas consiguen una oclusión vascular simultáneamente con una liberación lenta del agente quimioterápico a nivel intratumoral. Esto permite menor paso del agente quimioterápico a la circulación sistémica, y con ello disminuye la potencial toxicidad de la quimioterapia una vez inyectadas las partículas266.
Además, es posible elegir el calibre de las microesferas en función del vaso a embolizar e incrementan la homogeneidad de la embolización resultante. La respuesta al tratamiento evaluada mediante la magnitud de la necrosis tumoral obtenida y la supervivencia de los pacientes no se incrementa con el uso de las esferas cargadas, pero se disminuye la toxicidad sistémica y se mejora la tolerancia al procedimiento200,267.
La TACE se puede repetir a intervalos regulares o en función de la respuesta tumoral, pero debe interrumpirse en caso de progresión intratable201,202. Esta situación se define como aquella progresión asociada a algún perfil que determine una contraindicación para el procedimiento como puede ser descompensación de la hepatopatía, invasión vascular, o diseminación extrahepática. En los últimos años se han publicado múltiples scores para guiar la decisión de retratar268-270. Sin embargo, su aplicabilidad es controvertida y estos scores muy posiblemente identifican pacientes que no deberían haberse tratado con TACE desde el inicio (mayoritariamente por incluir pacientes con reserva funcional limitada). Por otra parte, realizar sesiones de TACE de forma repetida, especialmente en tratamientos extensos, puede impactar de forma significativa en la reserva funcional hepática, restando oportunidad a los pacientes a acceder a los diferentes escalones terapéuticos posibles dentro del tratamiento sistémico actual. Por ello, la decisión de repetir la TACE se debería realizar siguiendo el concepto de progresión intratable259,264,271.
La asociación de TACE con agentes moleculares como sorafenib o brivanib no ha demostrado de forma concluyente una mejoría en tasa de respuestas, tiempo hasta progresión tumoral o supervivencia272,273, por lo que su uso no está recomendado. En la actualidad existen estudios en marcha evaluando la combinación con inmunoterapia, sin resultados reportados hasta la fecha. La combinación con ablación se sugiere como una estrategia para optimizar resultados en términos de necrosis local y supervivencia desde hace varios años, pero no se han publicado estudios adecuados que demuestren su beneficio en supervivencia274.
La radioembolización transarterial (transarterial radioembolization, TARE, también conocida como selective internal radiation therapy, SIRT) mediante esferas de Ytrio-90 ha sido evaluada en múltiples estudios de cohorte prospectivos, incluyendo pacientes en diferentes estadios de la enfermedad. Se han demostrado resultados positivos en términos de respuesta radiológica, buena tolerancia clínica al tratamiento junto con una supervivencia aparentemente comparable a la que se obtiene en pacientes tratados mediante TARE o con sorafenib275-280. Estos datos han proporcionado la base racional para ensayos clínicos aleatorizados en fase tres comparando la TARE asociada o no con sorafenib versus sorafenib. En el momento actual disponemos de los resultados de tres ensayos clínicos fase tres. En dos de ellos (SARAH281 y SIRveNIB282), pacientes afectos de CHC avanzado fueron aleatorizados a recibir TARE vs. sorafenib y el objetivo principal fue demostrar beneficio en supervivencia de la TARE. Ambos estudios estuvieron limitados por una aplicabilidad de la TARE de acuerdo a intención de tratamiento del 72-77%, y aunque la TARE ofreció mayor tasa de respuestas objetivas y un aparente mejor perfil de seguridad, esto no se tradujo en mejoría en la supervivencia, y por tanto, ambos estudios fueron negativos281,282. El estudio SORAMIC evaluó si la combinación de TARE con sorafenib ofrecía mejor supervivencia que sorafenib en pacientes con CHC avanzado283. Aunque la asociación de TARE con sorafenib no se acompañó de mayor toxicidad, el estudio resultó negativo. Se debe explorar el beneficio de una mejor dosificación de la irradiación e investigar subgrupos de pacientes en los que el efecto terapéutico se traduzca en un beneficio de la supervivencia.
Por tanto, en el momento actual no existe evidencia científica para recomendar esta opción terapéutica en pacientes con CHC avanzado y se halla pendiente la finalización de un último ensayo que evalúa la combinación de TARE con sorafenib comparado con sorafenib (STOP-HCC trial, NCT01556490). La eficacia de la TARE en otros escenarios como el CHC en estadio intermedio comparado con la TACE284, como tratamiento puente durante la lista de espera para trasplante285, o como herramienta para rescatar pacientes para resección quirúrgica286, se basa en estudios de cohortes284 o ensayos clínicos287-289 incluyendo un número limitado de casos, lo que impide realizar alguna recomendación. Por último, existen cada vez más evidencias de que la eficacia de la TARE depende directamente de la dosis de radiación liberada al tumor medida por dosimetría290. Por tanto, los futuros estudios que se lleven a cabo para evaluar la utilidad de la TARE deberían realizarse en centros con experiencia, con una selección apropiada de los pacientes y con una técnica adecuada.
Tanto las nuevas técnicas de radioterapia como la radioterapia conformada tridimensional (3D-CRT), la radioterapia de intensidad modulada (IMRT), la radioterapia estereotáxica guiada por imagen (SBRT) o la radioterapia con bomba de protones permiten administrar dosis elevadas de radiación sobre la lesión tumoral sin dañar el tejido circundante. Estos tratamientos se utilizan actualmente para el tratamiento de metástasis. Los resultados reportados en CHC son prometedores, pero es necesario confirmar su eficacia en series más amplias y en estudios aleatorizados291.
Recomendaciones- •
La TACE es el tratamiento de elección en pacientes asintomáticos, con función hepática conservada, que presentan un CHC multinodular sin invasión vascular ni extrahepática (evidencia alta, recomendación fuerte).
- •
La TARE presenta eficacia en términos de respuesta radiológica y adecuado perfil de seguridad, pero no ha sido capaz de demostrar un incremento significativo en términos de supervivencia en el CHC avanzado (evidencia alta, recomendación fuerte). Se recomienda su evaluación en el contexto de ensayos clínicos (recomendación fuerte).
- •
No existe evidencia suficiente para recomendar radioterapia externa (evidencia baja, recomendación débil). Su potencial utilidad debe evaluarse en el contexto de estudios clínicos.
Desde la publicación de las guías de manejo del CHC en el año 20161, se ha demostrado el beneficio en términos supervivencia de nuevos tratamientos sistémicos, tanto en primera (lenvatinib y la combinación de atezolizumab y bevacizumab)292,293, como en segunda línea (regorafenib, cabozantinib y ramucirumab)294-296 y estos fármacos han sido aprobados por la Agencia Europea del Medicamento (EMA) y la Food and Drug Administration(FDA). Asimismo, la inmunoterapia fue evaluada tanto en primera línea (nivolumab297 y la combinación atezolizumab y bevacizumab vs. sorafenib293) como en segunda línea (nivolumab en fase ii298 y pembrolizumab vs. placebo299). En este sentido, nivolumab y pembrolizumab recibieron una aprobación condicional por FDA en segunda línea con base en resultados del estudio fase i/ii Check-Mate 040298 y el ensayo fase ii KEYNOTE-224300, respectivamente. Sin embargo, el estudio CheckMate 459297 que comparó nivolumab con sorafenib en primera línea fue negativo y el estudio que comparó pembrolizumab con placebo en segunda línea tampoco demostró beneficios en términos de supervivencia, de acuerdo con las premisas fijadas por los ensayos clínicos299.
El único ensayo clínico que se realizó hasta la fecha en pacientes con CHC y leve disfunción hepática (Child-Pugh B7-8), evaluó el perfil de seguridad de nivolumab en segunda línea301. En esta población, el perfil de seguridad fue similar a la reportada en pacientes con CHC candidatos a segunda línea, pero con función hepática conservada (Child-Pugh-A). Sin embargo, tal como se mencionó previamente, se desconoce hasta la fecha cuál es el impacto de nivolumab en términos de supervivencia en segunda línea.
Las tablas 2 y 3 detallan las características de los ensayos clínicos de primera y segunda línea que han demostrado beneficio en términos de supervivencia publicados hasta la fecha (abril 2020), incluyendo el tiempo a progresión, progresión libre de enfermedad, supervivencia y frecuencia de discontinuación por efectos adversos relacionados a dichos tratamientos. Los ensayos con resultados negativos no se han incluido en dichas tablas297,299,302-312. Los ensayos de segunda línea son estudios fase iii, aleatorizados y doble ciego, diseñados a superioridad294-296. Los pacientes incluidos en los tres estudios habían recibido sorafenib como tratamiento de primera línea y el brazo control de todos ello fue placebo.
Descripción de ensayos clínicos que demostraron beneficio en la supervivencia de pacientes candidatos a primera línea
| SHARP311 | Asia-Pacífico312 | REFLECT292 | IMbrave150 trial293 | |||||
|---|---|---|---|---|---|---|---|---|
| Sorafenib | Placebo | Sorafenib | Placebo | Lenvatinib | Sorafenib | Atezolizumab + bevacizumab | Sorafenib | |
| Criterios exclusión | NA | NA | Invasión porta principal | ND | ||||
| Diferente a estudio SHARP | Infiltración de > 50% hígado | |||||||
| > 2 medicamentos anti-HTA | ||||||||
| Características basales y evolución durante el tratamiento recibido durante el Ensayo Clínico | ||||||||
| Child-Pugh A (%) | 95 | 98 | 97,3 | 97,4 | 99 | 99 | 99 | 100 |
| PS 0 (%) | 54 | 54 | 25,3 | 27,6 | 64 | 63 | ND* | |
| Invasión vascular (%) | 36 | 41 | 36 | 34,2 | 23 | 19 | 38 | 43 |
| Metástasis (%) | 53 | 50 | 68,3 | 68,4 | 61 | 62 | 63 | 56 |
| BCLC-C (%) | 82 | 83 | 95,3 | 96,1 | NR | 82 | 81 | |
| Hepatitis B (%) | 19 | 18 | 70,7 | 77,6 | 53 | 48 | 49 | 46 |
| Hepatitis C (%) | 29 | 27 | 10,7 | 3,9 | 19 | 26 | 21 | 22 |
| Alcohol (%) | 26 | 26 | NR | 8 | 4 | NR | ||
| NAFLD (%) | NR | NR | ||||||
| Mediana de tiempo en tratamiento (meses) | 5,3 | 4,3 | NR | 5,7 | 3,7 | A 7,4; Bev 6,9 | 2,8 | |
| Discontinuación por EA-relacionados al tratamiento (%) | 11 | 5 | 19,5 | 13,3 | 9 | 7 | 7 | 10 |
| Mediana de tiempo a progresión (RECIST) | 5,5 | 2,8 | 2,8 | 1,4 | 7,4 | 3,7 | ND | |
| HR (IC 95%) | 0,58; 0,45 - 0,74; p < 0,001 | 0,57;0,42–0,79; p = 0 0005 | 0,61; 0 51–0 72;< 0 0001 | |||||
| Mediana de tiempo a progresión (mRECIST) | NA | NA | 7,4 | 3,7 | ||||
| HR (IC 95%) | 0,60; 0 51–0 71; p < 0 0001 | |||||||
| Mediana supervivencia libre de progresión (RECIST) | NR | NR | 7,3 | 3,6 | 6,8 | 4,3 | ||
| HR (IC 95%) | 0,65; 0 56–0 77; p < 0 0001 | 0,59;0,47, 0,76; p < 0,0001 | ||||||
| Mediana supervivencia libre de progresión (mRECIST) | NA | NR | 7,3 | 3,6 | ND | |||
| HR (IC 95%) | 0,64; 0 55–0 75; p < 0 0001 | |||||||
| Mediana de supervivencia global (meses) | 10,7 | 7,9 | 6,5 | 4,2 | 13,6 | 12,3 | NE | 13,2 |
| HR (IC 95%) | 0,69; 0,55 - 0,87; p < 0,001 | HR 0,92, 0,79–1,06 | 0,58;0,42, 0,79; p = 0,0006 | |||||
NA, no aplicable; ND, no disponible; NR, no reportado HTA, hipertensión arterial; PS, performance status; BCLC, Barcelona Clínic Liver Cancer; NAFLD, enfermedad hepática por hígado graso; A, atezolizumab; Bev, bevacizumab; RECIST, Response Evaluation Criteria in Solid Tumors; mRECIST, Response Evaluation Criteria in Solid Tumors modificado.
Descripción de ensayos clínicos que demostraron beneficio en la supervivencia de pacientes candidatos a segunda línea
| RESORCE294 | CELESTIAL295 | REACH-2296 | ||||
|---|---|---|---|---|---|---|
| Regorafenib | Placebo | Cabozantiib | Placebo | Ramucirumab | Placebo | |
| Candidatos | Tolerantes a sorafenib | Segunda o tercera línea | Alfa-feto proteína ≥ 400 mg/dL | |||
| Descripción de evolución durante el tratamiento con sorafenib antes de entrar al Ensayo Clínico | ||||||
| Mediana de tiempo en sorafenib (meses) | 7,8 | 7,8 | 5,3 | 4,8 | 4,1 | 4,1 |
| Mediana de tiempo entre última dosis sorafenib e inicio del ensayo clínico | 0,9 | 0,9 | 1,4 | 1,2 | 1,2 | 1,1 |
| Motivo por el cual se suspendió sorafenib | ||||||
| Progresión radiológica | 100 | NR | 84 | 80 | ||
| Intolerancia a sorafenib* | NA | 16 | 20 | |||
| Características basales y evolución durante el tratamiento recibido durante el Ensayo Clínico | ||||||
| Child-Pugh A (%) | 98 | 97 | 98 | 99 | 62 | 57 |
| PS 0 (%) | 65 | 67 | 52 | 55 | 57 | 58 |
| Invasión vascular (%) | 29 | 28 | 27 | 34 | 36 | 35 |
| Metástasis (%) | 70 | 76 | 79 | 77 | 72 | 74 |
| BCLC-C (%) | 86 | 89 | 91 | 90 | 83 | 89 |
| Hepatitis B (%) | 38 | 38 | 38 | 38 | 36 | 38 |
| Hepatitis C (%) | 21 | 21 | 24 | 23 | 24 | 29 |
| Alcohol (%) | 24 | 28 | 24 | 16 | 24 | 22 |
| NAFLD (%) | 7 | 7 | 9 | 10 | 10 | 4 |
| Mediana de tratamiento (meses) | 3,6 | 1,9 | 3,8 | 2 | 3 | 2 |
| Discontinuación por EA-relacionados al tratamiento (%) | 10 | 4 | 16 | 3 | 11 | 3 |
| Mediana de tiempo a progresión (RECIST) | 3,9 | 1,5 | NR | 3 | 1,6 | |
| HR (IC 95%) | 0,41, IC 95% 0,34–0,51; p < 0 0001 | 0,427 [IC 95% 0,313–0,582]; p < 0,0001 | ||||
| Mediana de tiempo a progresión (mRECIST) | 3,2 | 1,5 | NR | |||
| HR (IC 95%) | 0,44 (IC 95% 0,36–0,55); p < 0 0001 | |||||
| Mediana supervivencia libre de progresión (RECIST) | 3,4 | 1,5 | 5,2 | 1,9 | 2,8 | 1,6 |
| HR (IC 95%) | 0,43, IC 95% 0,35–0,52; p < 0 0001 | 0,44 (IC 95%, 0,36 - 0,52; p < 0,001 | 0,452 [IC 95% 0,339–0,603]; p < 0 0001 | |||
| Mediana supervivencia libre de progresión (mRECIST) | 3,1 | 1,5 | NR | NR | ||
| HR (IC 95%) | 0,46 (IC 95% 0,37–0,56); p < 0 0001 | |||||
| Median Supervivencia global (meses) | 10,6 | 7,8 | 10,2 | 8 | 8,5 | 7,3 |
| HR (IC 95%) | 0,63 (0,50–0,79); p < 0 0001 | 0,76 (IC 95%, 0,63 - 0,92); p = 0,005 | 0,710 [IC 95% 0,531–0,949]; p = 0,0199 | |||
NA, no aplicable; NR, no reportado HTA, hipertensión arterial; PS, performance status; BCLC, Barcelona Clínic Liver Cancer; NAFLD, enfermedad hepática por hígado graso; RECIST, Response Evaluation Criteria in Solid Tumors; mRECIST, Response Evaluation Criteria in Solid Tumors modificado.
Dado que el único tratamiento disponible en los últimos 10 años ha sido sorafenib, las publicaciones post-comercialización se centran mayoritariamente en este fármaco.
Mecanismo de acción de los fármacos indicados para el tratamiento sistémico del CHCSorafenib, lenvatinib y regorafenib forman parte de la familia de inhibidores de tirosina quinasa, pero cada uno de ellos se dirige a dianas diferentes y presentan un perfil de seguridad propio. Cabozantinib es un inhibidor tirosina quinasa que actúa sobre múltiples receptores tales como VEGF 1, 2 y 3, MET y AXL, entre otros. Ramucirumab es un anticuerpo monoclonal que se une específicamente y con alta afinidad al dominio extracelular de VEGFR-2, evitando así la unión de VEGF a su receptor. Atezolizumab es un inhibidor de PD-L1 y bevacizumab es un anticuerpo monoclonal contra VEGF313.
Eficacia en primera líneaEl estudio REFLECT292 es un estudio aleatorizado, doble ciego, diseñado para no inferioridad que comparó lenvatinib vs. sorafenib en pacientes con CHC sin invasión de la vena porta principal ni de la vía biliar, con una carga tumoral hepática que no excediese más del 50% del hígado. Este estudio demostró que los pacientes tratados con lenvatinib presentaban un mayor tiempo en tratamiento, mayor tiempo libre de progresión y mayor tiempo a progresión que los tratados con sorafenib, pero los pacientes tratados en ambas ramas presentaron una supervivencia similar. Este estudio no consideró la seguridad dentro de sus objetivos y por ello, no comparó el perfil de seguridad entre ambos fármacos. Por tanto, no se dispone de datos que nos permitan definir si el perfil de seguridad de sorafenib o lenvatinib es más o menos favorable en esta población. Tanto lenvatinib como sorafenib están aprobados en Europa y España como tratamientos sistémicos comercializados de primera línea para CHC.
El estudio fase iii CheckMate 459297 evaluó la eficacia de nivolumab frente sorafenib en primera línea pero no consiguió demostrar una mejoría significativa de la supervivencia. Dicho estudio incluyo 743 pacientes, que fueron aleatorizados 1:1 a rama nivolumab (n = 371) o rama sorafenib (n = 372). El estudio fue negativo en términos de supervivencia de acuerdo con las definiciones preestablecidas (HR 0,84; p = 0,0419). El estudio no describió un perfil de seguridad diferente al observado previamente con nivolumab y sorafenib. En el análisis de calidad de vida se observó que nivolumab presentaba mejores indicadores de calidad de vida de los pacientes en comparación con sorafenib.
El estudio IMbrave150293 es un ensayo clínico fase iii que ha comparado la combinación de atezolizumab y bevacizumab (A + B) frente sorafenib (S) en pacientes con CHC que no habían recibido tratamiento sistémico previamente. Se incluyeron 501 pacientes que se aleatorizaron 2:1 en dos grupos: A + B (n = 336) y S (n = 165). Los pacientes pertenecían mayoritariamente al estadio BCLC-C (80%), siendo la causa predominante de la hepatopatía el virus de la hepatitis B (50%), un 40% de los pacientes presentaba un valor basal de AFP ≥ 400 mg/dL y aproximadamente un 40% de los pacientes había recibido previamente TACE. Todos los pacientes en la rama sorafenib eran Child-Pugh A y < 1% en la combinación Child-Pugh B 7 puntos. En agosto de 2019, la media de seguimiento era de 8,6 meses (8,9 meses en A + B y 8,1 en S) y en ese momento 28,6% de los pacientes que recibieron la combinación de A + B y 39,4% de los que recibieron S habían fallecido, siendo el HR para mortalidad de 0,58 (IC 95% 0,42-0,79); p < 0,001. La mediana de supervivencia en la rama de combinación no fue calculable y la supervivencia observada a los seis y 12 meses, fue de 84,8% y 67,2%; respectivamente en dicha rama. La mediana de supervivencia en la rama sorafenib fue 13,2 meses (IC 95% 10,4) y la supervivencia observada a los seis y 12 meses 72,2% y 54,6%, respectivamente. La supervivencia libre de progresión fue significativamente más prolongada en la rama de combinación, con una mediana de 6,8 meses (IC 95% 5,7-8,3) en los pacientes que recibieron la combinación y 4,3 meses (IC 95% 4,0-5,6) en los que recibieron sorafenib (HR 0,59; IC 95% 0,47-0,76; p < 0,001).
La mediana de duración del tratamiento fue 7,4 meses para la rama combinación y 2,8 meses para la rama sorafenib. La frecuencia global de efectos adversos (EA) fue similar en ambas ramas y los EA severos fueron más frecuentes en la combinación con respecto a la rama sorafenib (38% y 30,8%, respectivamente). El porcentaje de pacientes que interrumpieron el ensayo clínico por EA relacionados al tratamiento fue 15,5% en la rama combinación y 10,3% en la rama de sorafenib. El EA grado iii-iv más frecuente en ambas ramas fue la hipertensión arterial (HTA); 15,2% en la combinación y 12,2% en sorafenib. Sin embargo, el EA más frecuente independientemente del grado de severidad fue la HTA para la combinación (29,8%) y la reacción mano-pie para la rama sorafenib (48,1%).
La mayor dificultad para extrapolar los resultados del ensayo clínico IMbrave150293 en nuestra población se debe a que más del 40% de los pacientes en el ensayo clínico eran asiáticos y alrededor del 50% de los casos presentaban una infección crónica por el VHB potencialmente sin una cirrosis establecida. Este perfil de la población está reflejada en el bajo porcentaje de pacientes (26% en ambas ramas) que presentaban varices esofágicas al inicio del ensayo clínico. En la rama de combinación, ocho pacientes (2,4%) desarrollaron hemorragia digestiva por varices esofágicas de cualquier grado y seis (1,8%) grado 3-4. En la rama de sorafenib, un paciente (0,6%) presentó hemorragia digestiva por varices esofágicas y fue grado 3-4293. Aunque ninguna de dichas hemorragias fueron consideradas por los investigadores como relacionadas con el tratamiento, la hemorragia digestiva por varices esofágicas fue una de las causas de discontinuación del ensayo clínico. En relación con el tratamiento oncológico post-ensayo clínico, 20,5% en la rama de combinación y 44,2% en sorafenib recibieron tratamiento.
Eficacia en segunda líneaEl estudio fase iii RESORCE comparó regorafenib con placebo en pacientes con CHC tolerantes a sorafenib (definido como aquellos pacientes que toleran al menos 400 mg/día por un periodo mínimo de 20 días, durante los últimos 28 días de tratamiento), que presentaban progresión radiológica a sorafenib, buena función hepática y un estado general conservado294. El estudio CELESTIAL comparó cabozantinib con placebo en pacientes de segunda y tercera línea, independientemente del motivo por el que se suspendía sorafenib295. Por último, el estudio REACH-2 comparó ramucirumab vs. placebo e incluyó pacientes intolerantes o con progresión radiológica a sorafenib con un valor basal de AFP ≥ 400 ng/dL296. El estudio KEYNOTE 240 fue un estudio fase iii que aleatorizó 278 pacientes a recibir pembrolizumab y 135 a recibir placebo en pacientes con CHC en segunda línea y el objetivo primario fue supervivencia299. Los pacientes tratados con pembrolizumab presentaron mejor supervivencia (HR 0,78; one-sided p = 0,0238) y progresión libre de enfermedad (HR 0,78; one-sided p = 0,0209) que los pacientes tratados con placebo, pero la diferencia entre pembrolizumab y placebo no fue estadísticamente significativa según el plan estadístico pre-definido.
En resumen, actualmente se dispone de fármacos que aumentan la supervivencia tanto en primera como en segunda línea y la decisión de indicar uno u otro tratamiento puede estar condicionada por las características del paciente, el perfil de efectos adversos reportados en cada uno de los estudios y la disponibilidad de los diferentes tratamientos en cada medio. El espectro de evolución de los pacientes depende no solo de la extensión tumoral o la función hepática sino también de las comorbilidades que presenten los pacientes. Por tal motivo, los resultados de los sub-análisis de cada uno de los estudios y/o estudios de cohorte post comercialización serán de gran utilidad para definir la aplicabilidad de los diferentes fármacos. En este sentido, los únicos datos disponibles para la aplicación de tratamientos sistémicos en poblaciones especiales, como son los pacientes con HIV, trasplantados hepáticos o pacientes de edad avanzada o diálisis provienen de estudios de cohortes314-316.
Perfil de efectos adversos en primera y segunda líneaLa comparación de los perfiles de seguridad entre los diferentes ensayos clínicos no es posible ya que no han sido diseñados con este objetivo. Por lo cual, tomar la decisión de indicar un fármaco u otro en función de la comparación directa del porcentaje de pacientes que discontinuaron el tratamiento por efectos adversos (EA) entre los diferentes ensayos clínicos puede llevar a una infra/sobre valoración del impacto de la seguridad al momento de indicar un determinado fármaco.
El análisis de la seguridad en el contexto de los tratamientos sistémicos es complejo y requiere de un análisis crítico de los mismos. Se ha demostrado que los pacientes tratados con sorafenib que desarrollan EA ≥ grado ii presentan mejor supervivencia que los pacientes que no los desarrollan317. Sin embargo, al ser los EA eventos evolutivos que se desarrollan a lo largo del tiempo, su desarrollo podría estar condicionado por el tiempo en tratamiento e inducir a un sesgo de interpretación. Actualmente, el único EA que ha sido validado como predictor de supervivencia es el desarrollo de EA dermatológicos tempranos (EADt-dentro de los 60 días de iniciar sorafenib y que este EA condicione una modificación de dosis) con sorafenib318-320 o regorafenib321. Los pacientes que desarrollan EADt presentan una mediana de supervivencia significativamente más prolongada que aquellos pacientes que no lo desarrollan. Sin embargo, la mediana de supervivencia de los pacientes que no desarrollan estos efectos adversos es similar a la descripta en los ensayos clínicos que demostraron el beneficio de sorafenib en pacientes con CHC.
Eficacia y seguridad de los fármacos en función de los parámetros de estratificación de los ensayos clínicos o datos de estudios post-comercializaciónA pesar de que los ensayos clínicos estratifican a los pacientes según diferentes factores, los resultados de seguridad según dicha estratificación podrían estar sesgados por el limitado número de pacientes en cada subanálisis. Es por ello por lo que los resultados de los subanálisis permiten generar nuevas hipótesis, pero no otorgan evidencia sólida para tomar decisiones. Asimismo, los estudio post-comercialización permiten disponer de datos para la aplicabilidad en pacientes fuera de ensayos clínicos, pero no modifican el nivel de evidencia generada en los ensayos clínicos.
Aplicabilidad del tratamiento secuencialAl disponer de tratamientos de primera y segunda línea, la decisión de continuar con fármacos de primera línea hasta progresión sintomática como se realizó en los estudios SHARP322 y Asia-Pacifico323 hace más de 10 años es actualmente controvertida. Asimismo, no disponemos de estudios randomizados que consideren sorafenib o lenvatinib como rama control en los ensayos de segunda línea, por lo cual la decisión de continuar o no con fármacos de primera línea post-progresión se basa en la interpretación empírica de la información disponible hasta la actualidad. El estado general del paciente192, el patrón de progresión201,202, y la función hepática189-191 son parámetros que se contemplan al momento de definir si se modifica o no el tratamiento de primera línea.
Los datos de tratamiento post progresión radiológica con sorafenib provienen del estudio SHARP322, Asia-Pacifico323 y estudios de cohortes324. En el año 2013 se publicó el impacto de los patrones de progresión radiológica en pacientes con CHC tratados con sorafenib en pacientes candidatos a tratamientos de segunda línea.202 Este estudio demostró que los pacientes que presentan progresión radiológica por desarrollo de nuevas lesiones extrahepáticas o aparición de nueva invasión vascular presentan una mediana de supervivencia post progresión (SPP) significativamente inferior que los que desarrollan otro tipo de progresiones. Estos datos fueron validados en los ensayos clínicos RESORCE294, METIV311, REACH/REACH-2325, y cohortes de pacientes tratados con sorafenib201, pero hasta la fecha no se dispone del impacto del patrón de progresión en pacientes tratados con lenvatinib, combinación atezolizumab más bevacizumab, o cabozantinib.
La supervivencia de los pacientes que inician segunda línea por progresión al fármaco de primera línea está condicionada por el tipo de progresión durante el tratamiento con sorafenib y es por ello por lo que la clasificación BCLC al momento de la progresión (fig. 3) permite caracterizar mejor el pronóstico de los pacientes candidatos a segunda línea. Esta clasificación, como se mencionó previamente, es complementaria a la clasificación de BCLC y ha sido validada por estudios de cohorte en pacientes tratados con sorafenib y ensayos clínicos en segunda línea que evaluaron regorafenib y tivantinib201.
Sin embargo, la evolución de los pacientes con CHC en tratamiento sistémico requiere analizar no solo la progresión radiológica, sino también otros eventos evolutivos que se desarrollan durante el seguimiento de los pacientes (desarrollo de EA tempranos o el impacto del tiempo que transcurre entre la suspensión del tratamiento de primera línea y el inicio de la segunda línea, entre otros). En este sentido, a pesar que se ha demostrado el impacto del desarrollo de EADt en la supervivencia320, la información disponible sobre la evolución de los pacientes considerando conjuntamente ambos factores es limitada y no se dispone de estos datos en pacientes tratados con lenvatinib, cabozantinib ni ramucirumab.
Seguimiento clínico y radiológico en pacientes con tratamiento sistémicoNo existe consenso en relación con el esquema de seguimiento clínico ni radiológico de los pacientes en tratamiento sistémico. Se recomienda hacer un seguimiento clínico cercano durante este periodo de tiempo que puede variar entre los primeros 15-30 días del inicio del tratamiento, que es cuando se desarrollan la mayoría de los EA tempranos, y cada 30-60 días durante el seguimiento posterior. Los pacientes que reciben tratamientos endovenosos requieren una analítica preinfusión, y en este escenario, el seguimiento está condicionado por el esquema de administración de cada fármaco.
Tampoco existe consenso respecto a cuál es el esquema de seguimiento más adecuado para realizar el control radiológico, pero se suele realizar cada 2-3 meses en el contexto de práctica clínica. Se recomienda realizar una prueba de imagen dinámica que permita evaluar tanto el abdomen como el tórax (tomografía o resonancia). Dado que actualmente se dispone de tratamientos de segunda línea, la necesidad de hacer control radiológico debería ser una prioridad.
Recomendaciones- •
Sorafenib y lenvatinib mejoran la supervivencia en pacientes con CHC en comparación con placebo en primera línea. La combinación atezolizumab con bevacizuamb demostró mejoría de la supervivencia y progresión libre de enfermedad en comparación con sorafenib en pacientes de primera línea (evidencia alta, recomendación fuerte).
- •
En segunda línea, regorafenib mejora la supervivencia en pacientes que progresan y son tolerantes a sorafenib, cabozantinib en pacientes candidatos a tratamientos de segunda y tercera línea y ramucirumab en pacientes candidatos a tratamientos de segunda línea que presentan un valor de AFP ≥ 400 ng/dL (evidencia alta, recomendación fuerte).
- •
La decisión de considerar una opción de tratamiento frente a la otra debería estar basada en los criterios de inclusión/exclusión de los ensayos clínicos y en el perfil de los pacientes. La elección de un determinado tratamiento en primera/segunda línea debe considerar no solo la función hepática, estado general y carga tumoral de los pacientes, sino las comorbilidades que podrían condicionar un mayor riesgo de desarrollar efectos adversos. Por este motivo, se recomienda contemplar el perfil de efectos adversos e impacto de cada tratamiento según el patrón de progresión en la elección de los tratamientos de segunda/tercera línea (evidencia moderada, recomendación fuerte).
El desarrollo de marcadores serológicos suficientemente robustos para la detección de CHC sigue siendo una necesidad en la práctica clínica. La investigación actual en el campo de la biopsia líquida ha conseguido resultados prometedores en cuanto a identificación de nuevas herramientas de detección de esta enfermedad. La llamada biopsia líquida es un procedimiento mínimamente invasivo que se basa en la identificación de componentes tumorales liberados a fluidos biológicos, en particular, la sangre. Estos componentes tumorales son células tumorales circulantes (CTC), ácidos nucleicos tumorales circulantes, ADN (ctADN) y ARN (microARN y ARN no codificantes largos) y vesículas extracelulares326.
El número de CTC es muy bajo (se estima en 0-10 CTC por cada 7 x 106 células nucleadas) y, por tanto, su detección, basada en propiedades físicas o en la presencia de antígenos de superficie, es aún un desafío en la práctica. Un metaanálisis reciente que recoge 20 estudios mostró una alta precisión diagnóstica, si bien, los autores no recomiendan el análisis de CTC como herramienta de diagnóstico327. Otro trabajo ha demostrado un mejor rendimiento de la combinación de detección y aislamiento de CTC junto con análisis mediante qPCR de un panel de marcadores de células madre. Esta aproximación ha demostrado precisión para diagnóstico de CHC con AFP normal en estadio inicial328. Recientemente se ha reportado la potencial utilidad en CHC de la secuenciación de mRNA de célula única en CTC329. En resumen, se trata de un campo prometedor pero aún hacen falta mejoras tecnológicas y estandarización de procedimientos antes de que la detección y aislamiento de CTC sea de utilidad clínica330.
También hay un gran interés por explorar la utilidad del análisis de ctADN. El ctADN contiene información relevante de alteraciones genéticas y epigenéticas específicas de los tumores, incluidas mutaciones puntuales, variaciones en el número de copias, reordenamientos cromosómicos y metilación del ADN que se ha demostrado en relación a las evidenciadas en los correspondientes tejidos tumorales331. Hasta ahora, la mayoría de los estudios han evaluado mutaciones en ctADN utilizando métodos de detección altamente sensibles de forma dirigida (PCR digital) y no dirigida (next generation sequencing, NGS)330. Hace tiempo se ha descrito que los niveles de cfDNA en pacientes con CHC relacionado con VHC se relacionan con recurrencia extrahepática y peor supervivencia tras resección332,333. Un estudio piloto reciente ha demostrado que es viable detectar mutaciones de ctADN mediante secuenciación ultraprofunda dirigida en pacientes con CHC en estadios iniciales, evidenciando una alta correlación con las mutaciones presentes en sus correspondientes tejidos tumorales334. Los cambios en metilación también se pueden analizar en ctADN335. Los primeros estudios ya demostraron que la metilación del gen RASSF1A podía detectarse en el 90% de los pacientes con CHC, lo que discrimina a individuos sanos336. En este sentido, un estudio que utilizó muestras de plasma de un gran número de pacientes con CHC describió un panel de marcadores de metilación con una alta sensibilidad (83,3%) y especificidad (90,5%) en una cohorte de validación para diagnóstico precoz de CHC y con valor pronóstico337. Aun así, deben refinarse aspectos técnicos, como la selección de sitios de metilación específicos de CHC y la metilación no asociada a los tumores. La combinación de análisis de ctADN con marcadores de proteínas tumorales establecidos también puede mejorar el rendimiento de la biopsia líquida para la detección precoz de tumores338. Se han descrito paneles de microARN circulantes con buena sensibilidad diagnóstica para CHC, aunque la mayoría de estos biomarcadores se encuentran en sus primeras fases de desarrollo335. En resumen, se necesitan refinamientos técnicos y estudios sistemáticos que incluyan muestras de cirrosis hepática, antes de que se pueda implementar en clínica el uso de la biopsia líquida para el diagnóstico precoz de CHC.
Pronóstico y seguimiento de pacientes con CHCHasta el momento, ningún análisis basado en la biopsia líquida ha alcanzado la práctica clínica para seguimiento de pacientes con CHC, si bien, hay evidencia experimental que apoya el potencial de esta tecnología para evaluación de estadio, carga tumoral, potencial recurrencia después de tratamiento, y, en definitiva, pronóstico de la enfermedad.
Los primeros estudios reportados describieron una asociación entre la presencia de CTC positivas para EpCAM y la recidiva tumoral en pacientes con CHC tratados con resección quirúrgica, así como su valor pronóstico en términos de presencia de invasión vascular y supervivencia global330. Recientemente, una mejora en la caracterización de CTC con fenotipo de célula madre ha demostrado valor clínico para predecir recurrencia tumoral tras resección quirúrgica328.
El análisis de ctADN también es prometedor en cuanto a seguimiento de pacientes con CHC, dada la facilidad con la que se pueden obtener muestras seriadas que pueden proporcionar una instantánea del perfil genético del tumor y su evolución clonal en el tiempo, evitando los problemas derivados de la heterogeneidad tumoral en muestras de biopsias únicas336. Recientemente, un panel diagnóstico con diez marcadores de metilación analizados en ctADN ha demostrado una elevada correlación con carga tumoral, respuesta al tratamiento, estadio, y estimación pronóstica en términos de supervivencia337. De manera similar, los niveles circulantes de microARN específicos y los ARN no codificadores largos se han asociado con tamaño tumoral, recurrencia temprana y pronóstico335. Sin embargo, y a pesar de lo interesante de los resultados, estos estudios necesitan validaciones adicionales en ensayos multicéntricos con mayor número de pacientes y plataformas tecnológicas estandarizadas.
Evaluación pronóstica y predicción de la respuesta terapéutica con biomarcadores en el CHCEl National Cancer Institute define un biomarcador como la molécula biológica (en tejido, sangre u otros fluidos) que es un signo de un proceso normal, anormal o enfermedad, o que determina la respuesta del organismo a una terapia339. Aparte de las variables clínicas (ECOG-PS, invasión vascular, diseminación extrahepática, BCLC) descritas anteriormente, algunos biomarcadores tienen capacidad pronóstica o predictiva de respuesta en el CHC. El nivel de evidencia para aceptar un biomarcador en una guía clínica depende de si se ha obtenido en el contexto de un ensayo clínico controlado y específicamente diseñado para el biomarcador (nivel A), si han sido obtenidos mediante estudio de muestras de pacientes incluidos en estudio fase iii no diseñado para el biomarcador (nivel B), o con base en estudios de cohortes (nivel C) o retrospectivos (nivel D)340. Se considera nivel de evidencia i los estudios de nivel A o B con validación externa; y se considera nivel ii de evidencia los estudios B sin validación o C con validación externa. El nivel i (y algunos estudios con nivel ii) determinan cambios en la práctica clínica, mientras que el resto de niveles no tienen impacto clínico340.
Biomarcadores pronósticosLos niveles plasmáticos de la AFP tienen capacidad predictiva independiente de la mortalidad, tanto en estadios iniciales como avanzados de CHC. Aunque la AFP tiene valor pronóstico como variable cuantitativa, la mayoría de estudios establece dos niveles pronósticos, AFP > 200 ng/mL o > 400 ng/mL, y ambos se han aceptado en las guías clínicas europeas cómo pronósticos y útiles en la estratificación de pacientes en ensayos clínicos3. En fases iniciales de la enfermedad, estos niveles de AFP se han relacionado con peor pronóstico tras resección, trasplante hepático y tratamientos loco-regionales (ablación con radiofrecuencia y quimio-embolización)3. En estadio avanzado (BCLC C), los pacientes con AFP > 200-400 ng/mL en el contexto de estudios fase iii han presentado peor pronóstico294,296,341,342, con medianas de supervivencia de 5-7 meses296 y niveles elevados de AFP han mostrado capacidad predictiva independiente de la mortalidad en estudios multivariados (nivel i-A)341.
Aparte de la AFP, múltiples estudios han evaluado la capacidad pronóstica de la supervivencia de las subclases moleculares del CHC y de firmas genéticas u otros perfiles moleculares. La firma genética de 182 genes de tejido no-tumoral343 y la de cinco genes de tejido tumoral344 han mostrado capacidad predictiva independiente de la mortalidad, junto con otras variables clínicas (por ej. plaquetas, BCLC o invasión vascular). Estos estudios, sin embargo, tienen un nivel ii-C de evidencia, y los biomarcadores no se han trasladado a la práctica clínica. La evaluación de biomarcadores y de perfiles moleculares en una cohorte prospectiva obtenida en el contexto del ensayo de sorafenib vs. placebo para la prevención de la recidiva post-resección identificó la activación de pERK como predictor de mayor riesgo (nivel ii-B de evidencia), mientras que ninguna de las firmas propuestas anteriormente en estudios retrospectivos tuvieron capacidad pronóstica independiente345.
Biomarcadores predictores de respuesta terapéuticaEn tumores sólidos se han aprobado biomarcadores predictores de respuesta terapéutica en más de 30 indicaciones, por ejemplo, vemurafenib en melanoma con mutaciones en BRAF V600E o crizotinib en cáncer de pulmón con aberraciones en ALK (nivel i-A)346. Generalmente, estos marcadores definen una subpoblación de tumores con un oncogén dominante que es efectivamente bloqueado por una terapia molecular. En CHC los oncogenes/tumores supresores más prevalentes (TERT, CTNNB1, TP53) no tienen fármacos efectivos y aquellos menos prevalentes que los tienen (FGF19, IGF2, VEGFA, TSC1/TSC2) aún no han mostrado eficacia en el contexto de ensayos fase iii347,348.
En la actualidad, hay seis fármacos eficaces en CHC avanzado que han mostrado mejor supervivencia en el contexto de estudios fase iii: sorafenib322,323, lenvatinib292 y la combinación atezolizumab-bevacizumab293 en primera línea y regorafenib294, cabozantinib295 y ramucirumab296 en segunda línea. Los estudios con biomarcadores predictores de respuesta de sorafenib han sido negativos341. En cambio, estudios recientes han identificado proteínas plasmáticas y microRNA asociados a mejor supervivencia con regorafenib, con un nivel ii-B de evidencia349. Asimismo, la AFP plasmática > 400 ng/mL también ha mostrado predecir el beneficio de ramucirumab en pacientes con CHC que habían progresado a sorafenib296. Éste es el primer estudio fase iii positivo en CHC en el que se ha seleccionado la población diana mediante un biomarcador (nivel i-A), lo que determinará el uso de este fármaco solo en esta subpoblación, que representa alrededor del 40% de los pacientes con CHC avanzado en segunda línea de tratamiento.
Los tratamientos con inmunoterapia (nivolumab y pembrolizumab) han sido aprobados por la FDA y otras agencias reguladoras para CHC avanzado en segunda línea terapéutica con base en resultados esperanzadores obtenidos en estudios fase ii (respuesta objetiva del 14-18%). Aunque los pacientes cuyos tumores exhiben PD-L1 en sus células tumorales o PD-1 en sus linfocitos tienen respuestas tumorales con mayor frecuencia y mejor supervivencia, las diferencias no son lo suficientemente discriminativas como para tener una utilidad en la selección de pacientes. No se conocen en la actualidad los predictores de respuesta y/o supervivencia de estos fármacos en el CHC298,350.
Becas y agradecimientos- •
María Reig: Ayuda para la investigación del Instituto de Salud Carlos iii (PI15/00145 and PI18/00358).
- •
Alejandro Forner: Ayuda para la investigación del Instituto de Salud Carlos iii (PI18/00542).
- •
Matías A. Ávila: «Proyecto Hepacare» de la Fundación «La Caixa».
- •
Beatriz Mínguez: Ayuda para la investigación del Instituto de Salud Carlos iii (PI18/00961).
- •
Bruno Sangro: Ayuda para la investigación del Instituto de Salud Carlos III (PI16/01845, PI19/00742 y AC16/00065).
- •
Jordi Bruix: Ayuda para la investigación del Instituto de Salud Carlos iii (PI18/00768), AECC (PI044031), Secretaria d’Universitats i Recerca del Departament d’Economia i Coneixement (2014 SGR 605) y WCR (AICR) 16-0026.
- •
CIBEREHD está financiado por el Instituto de Salud Carlos iii.
María Reig: Consultaría para Bayer HealthCare Pharmaceuticals, BMS, Roche, Ipsen, AstraZeneca y Lilly. Conferencias para Bayer, BTG, BMS, Gilead y Lilly. Proyectos de investigación Bayer e Ipsen. Viajes: Bayer, Gilead, Lilly.
Alejandro Forner: Consultoría para Bayer HealthCare Pharmaceuticals, AstraZeneca y Guerbert. Conferencias para Bayer HealthCare Pharmaceuticals, Gilead y MSD.
Carmen Ayuso: Conferencias para Bayer HealthCare Pharmaceuticals.
Beatriz Mínguez: Consultaría para Bayer HealthCare Pharmaceuticals. Conferencias para Bayer HealthCare Pharmaceuticals, Gilead y Eisai-Merck.
María Varela: Consultoría para Bayer HealthCare Pharmaceuticals, BMS, Sirtex, Ipsen, Roche, Astra-Zéneca. Conferencias para Boston Scientific, Gilead, MSD y Bayer HealthCare Pharmaceuticals.
José Ignacio Bilbao: Proctor de Sirtex Medical Europe.
Marta Burrel: Conferencias para Terumo, BTG y Guerbet.
Joana Ferrer: Conferencias para Bayer HealthCare Pharmaceuticals.
Miguel Ángel Gómez: Declara no tener ningún conflicto de interés.
Josep María Llovet: Proyectos de investigación para Bayer HealthCare Pharmaceuticals, Eisai Inc., Bristol-Myers-Squibb, Boehringer-Ingelheim e Ipsen. Consultoría para Bayer HealthCare Pharmaceuticals, Merck, Eisai Inc., Bristol-Myers Squibb, Celsion Corporation, Eli Lilly, Roche, Genentech, Glycotest, Nucleix, Can-Fite Biopharma, AstraZeneca y Exelixis.
Ana Matilla: Consultoría para Bayer HealthCare Pharmaceuticals. Conferencias para consultoría de Bayer HealthCare Pharmaceuticals, BTG y Bristol-Myers Squibb.
Josep Tabernero: Consultoría para Array Biopharma, AstraZeneca, Bayer, BeiGene, Boehringer Ingelheim, Chugai, Genentech Inc., Genmab A/S, Halozyme, Imugene Limited, Inflection Biosciences Limited, Ipsen, Kura Oncology, Lilly, MSD, Menarini, Merck Serono, Merrimack, Merus, Molecular Partners, Novartis, Peptomyc, Pfizer, Pharmacyclics, ProteoDesign SL, Rafael Pharmaceuticals, F. Hoffmann-La Roche Ltd, Sanofi, SeaGen, Seattle Genetics, Servier, Symphogen, Taiho, VCN Biosciences, Biocartis, Foundation Medicine, HalioDX SAS y Roche Diagnostics.
Ruth Vera: Consultoría para Roche, Amgen, Sanofi, MERCK, Bristol-Myers Squibb, MSD, SERVIER, Bayer HealthCare Pharmaceuticals, Astra-Zeneca.
Bruno Sangro: Consultoría para Adaptimmune, Astra-Zeneca, Bayer HealthCare Pharmaceuticals, Bristol-Myers-Squibb, BTG, Eisai, Eli Lilly, Ipsen, Onxeo, Roche, Sirtex. Conferencias para Astra-Zeneca, Bayer HealthCare Pharmaceuticals, Bristol-Myers-Squibb, Sirtex. Proyectos de investigación con Bristol-Myers-Squibb, Onxeo, Sirtex.
Jordi Bruix: Consultoría para Arqule, Bayer HealthCare Pharmaceuticals, Novartis, Bristol-Myers-Squibb, BTG-Biocompatibles, Eisai, Kowa, Terumo, Gilead, Bio-Alliance/Onxeo, Roche, AbbVie, Merck, Sirtex, Ipsen, Astra-Medimmune, Incyte, Quirem, Adaptimmune, Lilly. Proyectos de investigación con Bayer HealthCare Pharmaceuticals and BTG. Colaboración para eventos educativos Bayer HealthCare Pharmaceuticals y BTG. Conferencias para Bayer HealthCare Pharmaceuticals, BTG- Biocompatibles, Eisai, Terumo, Sirtex e Ipsen.
Matías A Ávila, Itxarone Bilbao, Javier Bustamante, Manuel de la Mata, Fernando Pardo, Miguel A. Pastrana, Manuel Rodríguez-Perálvarez y José Urbano: Declaran no tener ningún conflicto de interés.