La presente revisión sistemática analiza el papel de soluble fms-like tyrosine kinase-1 (sFLT-1) como biomarcador indirecto de disfunción endotelial en sepsis o shock séptico de artículos publicados en PubMed entre 2010 y marzo de 2022.
Materiales y métodosSe ha realizado una revisión sistemática de estudios estudiando la monitorización de sFLT-1 en unidades de cuidados intensivos en adultos con sepsis o shock séptico vs. controles para diagnóstico y pronóstico de sepsis (Registro PROSPERO CRD42023412929).
ResultadosLa disfunción endotelial de la sepsis es una de las claves para el desarrollo de la enfermedad. VEGF se une a sFLT-1 actuando como un inhibidor competitivo de la señalización del VEGF en las células endoteliales y, por lo tanto, neutraliza sus efectos proinflamatorios. La disfunción endotelial se ve reflejada en el aumento de los valores de sFLT-1. Los valores elevados de sFLT-1 se emplearon para el diagnóstico diferencial de la sepsis frente a otras patologías inflamatorias, el shock séptico frente a otros tipos de shock; en un análisis ajustado, estuvieron elevados a lo largo del tiempo, estimación del pronóstico de la enfermedad, correlación con la gravedad de la sepsis, la disfunción orgánica y predicción de mortalidad.
ConclusionesSe evidencia como la sepsis se fundamenta en la disfunción endotelial. sFLT-1 es uno de los principales biomarcadores de alteración microvascular y resulta biomarcador predictivo diagnóstico y pronóstico.
The present systematic review analyses the role of soluble fms-like tyrosine kinase-1 (sFLT-1) as an indirect biomarker of endothelial dysfunction in sepsis or septic shock from articles published in PubMed between 2010 and March 2022.
Materials and methodsA systematic review of studies studying sFLT-1 monitoring in intensive care units in adults with sepsis or septic shock vs. controls for sepsis diagnosis and prognosis has been carried out (PROSPERO CRD42023412929 Registry).
ResultsThe endothelial dysfunction of sepsis is one of the keys to the development of the disease. VEGF binds to sFLT-1 acting as a competitive inhibitor of VEGF signalling in endothelial cells and thus neutralizes its pro-inflammatory effects. Endothelial dysfunction is reflected in increased sFLT-1 levels. High values of sFLT-1 were used for the differential diagnosis of sepsis versus other inflammatory pathologies, septic shock versus other types of shock, were elevated over time, estimation of disease prognosis, correlation with sepsis severity, organ dysfunction, and mortality prediction.
ConclusionsIt is evident that sepsis is based on endothelial dysfunction. sFLT-1 is one of the main biomarkers of microvascular alteration and is a predictive diagnostic and prognostic biomarker.
La sepsis se define como disfunción orgánica grave, y potencialmente mortal, secundaria a una desregulación del sistema inmune frente a una infección1. Un estudio reciente del Institute for Health Metrics and Evaluation (IHME) sobre la carga global de sepsis estima una incidencia de 48,9 millones con una mortalidad de 11 millones en todo el mundo en 2017, rondando los 24.000 millones de dólares de coste anual en EE.UU.2.
La sepsis se produce por una reacción generalizada a partir de una lesión local no controlada, produciendo lo que en la clasificación SEPSIS-2 se denominaba SIRS (síndrome respuesta inflamatoria sistémica). Dicho fenómeno no es del todo conocido, aunque dependerá fundamentalmente del microorganismo y la forma de respuesta del huésped.
Actualmente el tratamiento de la sepsis se basa en una triple terapia protagonizada por la antibioterapia precoz, control del foco y soporte hemodinámico por objetivos3.
Por la gran mortalidad y repercusión económica de los pacientes con sepsis1, así como la elevada alza de bacterias multirresistentes4, es de especial interés la búsqueda de nuevos marcadores más sensibles y específicos que los que se presentan en la actualidad. Tal y como Tan et al.5 describen en su metaanálisis, la PCR y PCT presentan un valor grado moderado para el diagnóstico de sepsis en pacientes adultos. Para la PCR objetivaron una AUC 0,73 (IC95%, 0,69-0,77), con una sensibilidad y especificidad de 0,80 (IC95%, 0,63-0,90) y 0,61 (IC95%, 0,50-0,72), respectivamente. En cuanto a la PCT presentó una AUC de 0,85 (IC95%, 0,82-0,88), con una sensibilidad y especificidad de 0,80 (IC95%, 0,69-0,87) y 0,77 (IC95%, 0,60-0,88). Dichos resultados ponen en valor la necesidad de encontrar biomarcadores más discriminativos.
A nivel molecular se ha descrito la disfunción endotelial como una de las causas del paso de la infección localizada a la presentación de repercusiones sistémicas. Entre las múltiples causas de disfunción endotelial destaca la fisiopatología del déficit de neoangiogénesis mediado por el factor de crecimiento endotelial vascular (VEGF)6.
El VEGF es un regulador clave de angiogénesis normal, durante la cual promueve las células endoteliales supervivencia, crecimiento y migración. Los efectos de VEGF están mediados por dos receptores: el receptor de tirosina quinasa 1 tipo FMS (FLT-1) o el receptor de tirosina quinasa similar a FMS (FLK-1). Soluble fms-like tyrosine kinase-1 (sFLT-1) puede actuar para secuestrar VEGF y evitar la unión a FLK-1, que es capaz de transducir una señal mucho más fuerte, inhibiendo así la unión de VEGF y su efecto vasodilatador y neoangiogénico7.
Tal y como hemos mencionado, la neoangiogénesis juega un papel fundamental en la disfunción endotelial. Dicho fenómeno surge del equilibrio entre una variedad de factores proangiogénicos (VEGF, PlGF) y antiangiogénicos (sFLT-1)6.
Dada la gran dificultad para evaluar de forma directa la disfunción endotelial, el objetivo de la bioquímica moderna será averiguar distintos biomarcadores indirectos que nos permitan evaluar las posibles interacciones que tienen lugar a nivel molecular.
Hasta la actualidad numerosos estudios de cohortes han evaluado este biomarcador en sepsis o shock séptico. Confirmar la relevancia de dicho biomarcador podría suponer un antes y un después en el diagnóstico precoz de la sepsis, así como ser un biomarcador de seguimiento para dicha patología, predicción de mortalidad y desescalada antibiótica, entre otros papeles.
Por lo tanto, el objetivo de nuestra revisión sistemática es evaluar el valor pronóstico al inicio de la sepsis de sFLT-1 en pacientes adultos con sepsis o shock séptico.
Material y métodosRecuperación de bibliografíaSe realizó una revisión sistemática del biomarcador sFLT-1, de acuerdo con la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA 2020). Se realizaron búsquedas en la base de datos PubMed desde el año 2010 hasta marzo de 2022. Como estrategia de búsqueda se emplearon los siguientes términos: Búsqueda avanzada sFlt-1 [All Fields] AND («sepsis»[MeSH Terms] OR «sepsis»[All Fields]). El protocolo de la presente revisión se registró en el International Prospective Register of Systematic Reviews «PROSPERO» (CRD42023412929).
Criterios de elegibilidadLas preguntas de revisión se desarrollaron de acuerdo con el marco PICOS (Participantes, intervenciones, comparaciones, resultados y diseño de estudios):
Participantes: Pacientes de 19 años o más que presentaron sepsis o shock séptico.
Intervención: Prueba diagnóstica y pronóstica.
Comparación: No se aplicó ninguna restricción sobre el grupo control.
Resultado: Comparativa de biomarcadores frente a controles sanos, diagnóstico diferencial frente a otras patologías, relación con la disfunción orgánica, gravedad y pronóstico.
Diseño del estudio: Ensayo clínico, cuasiexperimental, casos y controles, cohortes.
Criterios de inclusión y exclusiónSe incluyeron solo aquellos textos publicados en inglés y que fueran originales. Se limitaron los resultados a pacientes adultos en sepsis y shock séptico, eliminando las revisiones sistemáticas y metaanálisis. Por la gran importancia y relación que tiene con la sepsis, se incluyeron aquellos artículos que incluían pacientes con neumonía por COVID 19.
Cribado de la bibliografíaLas publicaciones se examinaron inicialmente por título y resumen y, posteriormente, por texto completo. Las decisiones con respecto a la inclusión y exclusión de estudios se tomaron de forma independiente por parte de dos revisores y cualquier discrepancia se resolvió mediante discusión. Si no se pudo llegar a un consenso, la adjudicación fue proporcionada por un tercer revisor.
Extracción de datos y evaluación de la calidadInformación general como autor, año de publicación, número y características de los casos y controles, tipo de biomarcador, etc., e información de parámetros de diagnóstico como riesgo relativo, odds ratio, intervalos de confianza, área bajo la curva, sensibilidad, especificidad, falsos positivos, falsos negativos, etc. Se documentaron autor y año de publicación. Se consideraron los siguientes desenlaces de interés: valores según patologías, disfunción orgánica, entre otras.
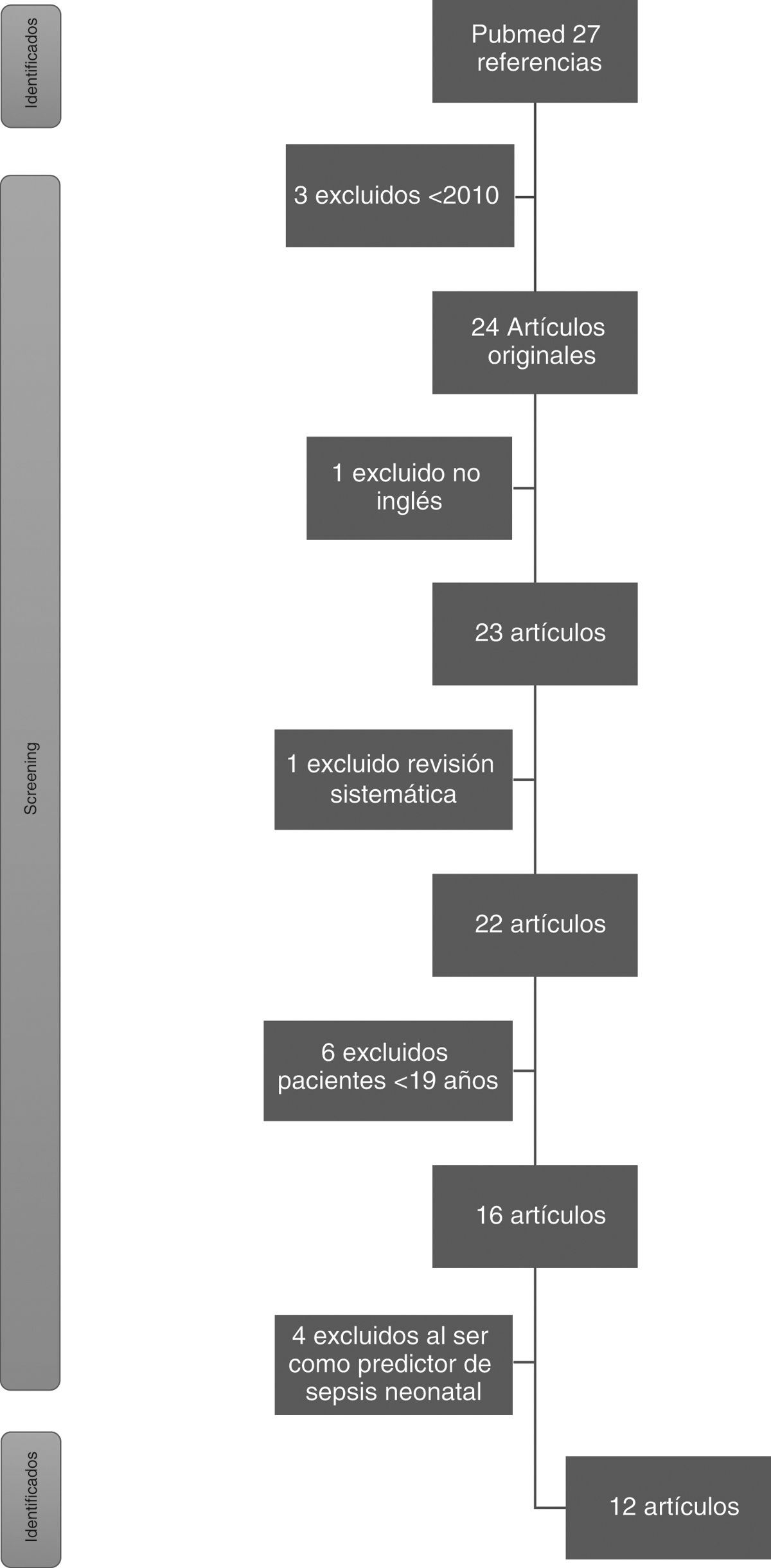
ResultadosLa búsqueda bibliográfica en PubMed recuperó un total de 27 artículos. Se eliminaron 3 artículos anteriores a 2010 y uno por no ser en inglés. Se eliminó una revisión sistemática y 6 artículos por ser en pacientes menores de 19 años. Por último, 4 fueron eliminados por analizar el biomarcador como predictor de sepsis neonatal y uno por estudiar pancreatitis aguda. Finalmente, 11 artículos fueron incluidos en esta revisión (fig. 1).
De los 11 artículos finalmente seleccionados, 10 de ellos fueron observacionales prospectivos. De estos, uno ha sido de casos y controles y los 9 restantes, de cohortes, entre los que se destacan 2 estudios de cohortes prospectivos multicéntricos. El artículo restante analizado ha sido un ensayo clínico. Como común denominador, en todos los estudios incluidos se tomaron muestras de sangre al ingreso del paciente para la determinación de biomarcadores.
Los aspectos principalmente analizados han sido: los valores frente a los controles, el diagnóstico diferencial frente a otras patologías, la relación con la disfunción orgánica, la gravedad de la sepsis y la mortalidad. El número de pacientes en estos estudios varió de 41 a 605, presentando edad mínima de 18 años, así como múltiples patologías. Para determinar mejor el valor pronóstico de los biomarcadores, se analizaron las AUC, OR y las cifras de significación estadística.
Los valores de sFLT-1 se analizaron utilizando kits de inmunoanálisis ya comercializados tipo ELISA (Enzyme-Linked ImmunoSorbent Assay). Se emplearon los umbrales 136,2 (96,3-211) para los controles sanos, con una AUC=0,70.
Schuetz et.al.8 plantean el estudio de biomarcadores para el diagnóstico diferencial de shock en urgencias. Para ello obtienen dos grupos: sepsis vs. shock de causa no séptica. sFLT-1 (227,4; 142,4-328,2) vs. (136,2; 96,3-211) p<0,001. E-selectina (53,2; 34,9-79,2) vs. (30,5; 20,0-40,8) p<0,001. ICAM-1 (2; 152-267) vs. (149; 115-224) p=0,04. VEGF (271; 91-496) vs. (118; 43-270) p=0,01. PAI-1 no significativo.
En cuanto a las AUC se describieron como estadísticamente significativos: sFLT-1 0,70 (2,01; 1,07-3,79) p=0,03 y E-selectina 0,74 (3,67; 1,72-7,84) p=0,001, mientras que el resto de los biomarcadores analizados fueron no significativos.
Day et.al.9 realizaron la identificación de biomarcadores para el diagnóstico diferencial entre shock séptico y otras causas de shock. Para ellos obtuvo significación estadística para los siguientes biomarcadores: sFLT-1 (0,51 vs. 1,48; p=0,03), E-selectina (1,75 vs. 1,97; p<0,01), sICAM-1 (2,29 vs. 2,5; p<0,01), PAI-1 (1,77 vs. 2,06 p<0,01), IL-6 (1,14 vs. 2,05 p<0,01) y procalcitonina (−0,8 vs. 0,31 p<0,01). Se emplearon AUC para discriminar la capacidad diagnóstica empleando los parámetros clínicos como referencia (AUC 0,76, IC95%, 0,67-0,85, p<0,01), biomarcadores (AUC 0,82, IC95%, 0,75-0,90, p<0,01) y el uso conjunto de clínica y biomarcadores (AUC 0,88, IC95%, 0,81-0,94, p<0,01).
Skibsted et.al.10 analizaron la tendencia entre grupos (sepsis, sepsis severa y shock séptico) presentando unos valores de sFLT-1 (p<0,0001), sE-selectina (p<0,001), sVCAM-1 (p<0,002), PAI-1 (p<0,001) y sICAM-1 (p<0,001). En cuanto a su relación con la escala SOFA, se correlacionó sFLT-1 (r=0,6) y PAI-1 (r=0,4), sE-selectina (r=0,3) todas ellas con p<0,0001 salvo sICAM-1 (r=0,15) que mostró p=0,03. Todos los biomarcadores se correlacionaron con IL-6, especialmente sFLT-1 (r=0,63, p<0,0001). En cuanto a la escala APACHE-II, se demostró la correlación con sFLT-1 (r=0,64), PAI-1 (r=0,58), sE-selectina (r=0,31), sVCAM-1 (r=0,38) todas ellas p<0,0001 salvo sICAM-1 (r=0,17, p<0,05).
Para evaluar aún más la precisión de los diferentes marcadores extraídos en urgencias se analizó la mortalidad intrahospitalaria mediante AUC. sFLT-1 (0,87; 0,79-0,95), PAI-1 (0,87; 0,78-0,95), sE-selectina (0,77; 0,69-0,85), ICAM (0,71; 0,60-0,81), sVCAM-1 (0,78; 0,68-0,89) todos ellos p<0,05 salvo IL-6 (0,80; 0,69-0,91, p=0,54).
Hou et.al.11 analizaron la resucitación hemodinámica en urgencias guiada por objetivos vs. tratamiento habitual. No hubo diferencias en el resultado clínico entre las estrategias de reanimación, ni en los perfiles de biomarcadores de permeabilidad vascular (sFLT-1, VEGF, Ang-2) ni hemostasia (vWF, tPA, TM) en las 6h ni a las 24h de los biomarcadores analizados. Todos los biomarcadores previamente mencionados fueron indicadores significativos de mortalidad, tanto basalmente como a las 6h como a las 24h. Resulta de especial interés la toma basal de biomarcadores como predictores de mortalidad que demostraron tener AUC significativas todas ellas: sFLT-1 0,70 (0,61-0,78), VEGF 0,56 (0,47-0,66), Ang-2 0,67 (0,58-0,76), vWF 0,60 (0,51-0,69), tPA 0,69 (0,61-0,77) y trombomodulina 0,69 (0,60-0,77).
Con respecto a los pacientes con sistema inmune comprometido (neutropénicos y diabéticos), se obtuvieron las siguientes conclusiones:
Alves et al.12 llevaron a cabo un estudio retrospectivo en el que se compararon 31 pacientes con sepsis vs. 10 pacientes con shock séptico neutropénicos de causa hematológica. Al inicio de la fiebre no presentaron diferencias en los valores de VEGF-A (20,7pg/ml, 7,9-129,3pg/ml) vs. (20,0pg/ml, 9,3-158,9pg/ml; p=0,9) ni en los valores de sFLT-1 (47,3pg/ml, 20,8-117,6pg/ml) vs. (49,2pg/ml, 29,6-91,1pg/ml; p=0,3) ni en sepsis ni shock séptico.
Sin embargo, después de 48h, los valores de ambos marcadores fueron mayores en pacientes con shock séptico en comparación con pacientes sépticos (116,0pg/ml, 42,7-208,4pg/ml) vs. (42,9pg/ml, 25,9-472,9pg/ml; p=0,002). En cuanto a la correlación respecto a la escala SOFA se demostró VEGF-A al inicio (Rs=−0,21; p=0,23) vs. 48h (Rs=−0,17; p=0,33) y sFLT-1 al inicio (Rs=0,3; p=0,04) vs. 48h (Rs=0,25; p=0,16). Dichos valores son refrendados en las áreas bajo la curva (AUC) a las 48h VEGF (0,76, 0,55-0,97; p=0,02) y sFLT-1 (0,87, 0,73-1,00; p<0,01).
Por el contrario, Fiusa et al.13 al analizar a pacientes con fiebre neutropénicos encontraron no significativos VEGF-A ni sFLT-1 en cuanto al riesgo de desarrollar shock séptico. Posteriormente comparan pacientes no complicados vs. complicados en cuanto a la angiopoyetina: Ang-1 (898,8pg/ml; 77,9-5420pg/ml) vs. (1220pg/ml; 32,5-47.924pg/ml) p=0,07. Ang-2 (4467pg/ml; 1289-37.318pg/ml) vs. (6494pg/ml, 173-49.611pg/ml), p=0,02. Dado el papel antagónico de Ang-1 vs. Ang-2, se analiza el cociente Ang-1/Ang-2 mostrando un ratio (5,3; 0,6-57,1) vs. (1,9; 0,1-64,6) p=0,01. Se estimó una AUC 0,68 (IC95%, 0,55-0,81; p=0,01). Ratio de 5 presentó sensibilidad 60% (IC95%, 36,1-80,9%) y especificidad 77,2% (IC95%, 66,4-85,9%). Valor predictivo positivo y negativo 47% y 85%, respectivamente. El cociente Ang-2/Ang-1 por encima de 5 aumentó el riesgo relativo de fallecer a los 28 días por 5,8 (IC95%, 1,96-17,59; p=0,001) y 2,74 (IC95%, 1,054-7,160; p=0,03) ante valores mayores de la mediana.
En cuanto a la diabetes, Schuetz et al.14 seleccionaron pacientes en sepsis, en sepsis severa y en shock séptico y los dividieron según su patología de base (diabetes vs. no diabetes). En primer lugar, compararon el papel de la diabetes y la sepsis demostrando el aumento de E-selectina (71,4, 45,8-116) vs. (45,1, 30,1-68,6; p<0,0001) y sFLT-1 (192, 103-378) vs. (112, 70-187; p<0,0001), mientras ICAM-1 y PAI-1 no fueron estadísticamente significativos en diabéticos vs. no diabéticos. Una vez establecida la relación positiva en cuanto a la diabetes, se analizó la sepsis vs. shock séptico, demostrando E-selectina (119, 71-168) vs. (61, 37-83; p<0,001) y sFLT-1 (370, 243-712) vs. (190, 113-351; p=0,001), siendo no significativo ICAM-1, VCAM ni PAI-1. Tras realizar el estudio multivariante se concluyó la mayor asociación en la escala SOFA en pacientes diabéticos al ajustar por sepsis, entre otras variables (β 0,09; p=0,006).
Skibsted et.al.15 plantearon el seguimiento de StO2 llevándolo a cabo en tres fases: inicial, fase oclusión y fase de recuperación post liberación del torniquete. Se realizó el estudio multivariante en las tres fases comparándolo con los biomarcadores sE-selectina, sVCAM-1, ICAM-1, IL-6, sFLT-1 y PAI-1. Siendo únicamente estadísticamente significativos estos dos últimos: sFLT-1 (r=−0,08, p<0,001) y PAI-1 (r=−0,06, p<0,001). Sin embargo, al realizar el estudio por subgrupos, en el grupo de la sepsis ninguno de los biomarcadores resultó estadísticamente significativo (tablas 1 y 2).
sFLT-1 como biomarcador de clasificación de gravedad
| Autor | Año | Diseño | Pacientes | Hallazgos |
|---|---|---|---|---|
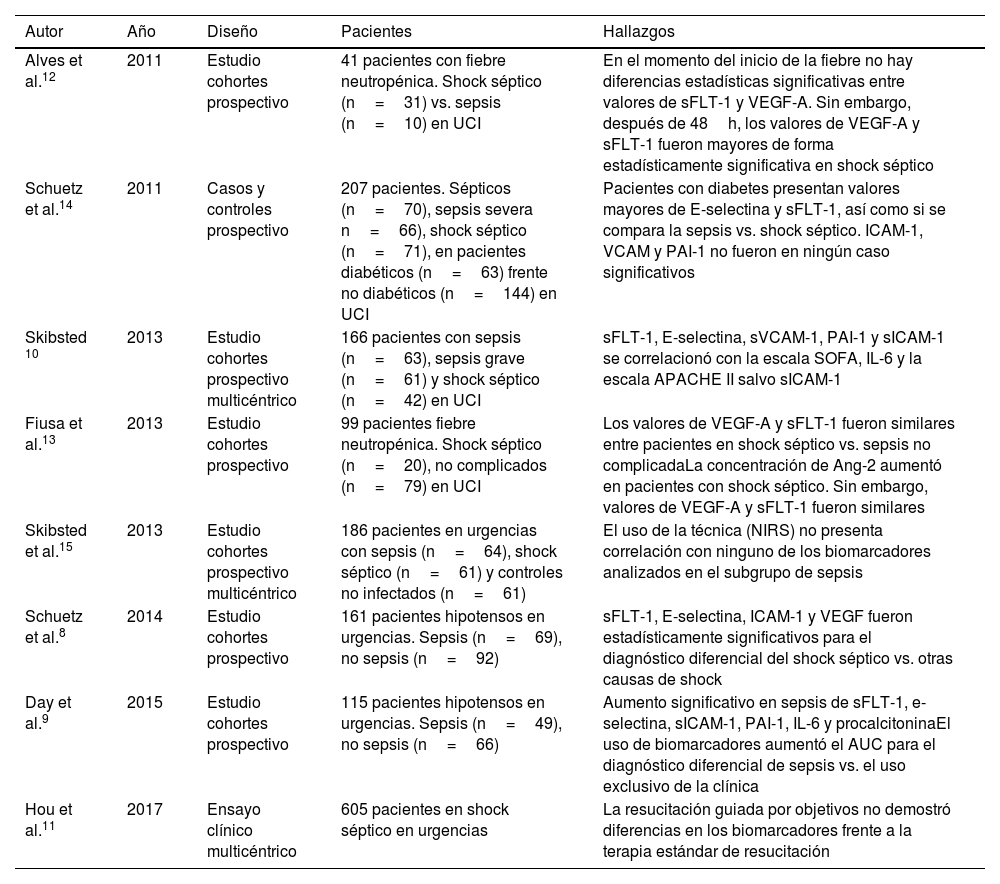
| Alves et al.12 | 2011 | Estudio cohortes prospectivo | 41 pacientes con fiebre neutropénica. Shock séptico (n=31) vs. sepsis (n=10) en UCI | En el momento del inicio de la fiebre no hay diferencias estadísticas significativas entre valores de sFLT-1 y VEGF-A. Sin embargo, después de 48h, los valores de VEGF-A y sFLT-1 fueron mayores de forma estadísticamente significativa en shock séptico |
| Schuetz et al.14 | 2011 | Casos y controles prospectivo | 207 pacientes. Sépticos (n=70), sepsis severa n=66), shock séptico (n=71), en pacientes diabéticos (n=63) frente no diabéticos (n=144) en UCI | Pacientes con diabetes presentan valores mayores de E-selectina y sFLT-1, así como si se compara la sepsis vs. shock séptico. ICAM-1, VCAM y PAI-1 no fueron en ningún caso significativos |
| Skibsted 10 | 2013 | Estudio cohortes prospectivo multicéntrico | 166 pacientes con sepsis (n=63), sepsis grave (n=61) y shock séptico (n=42) en UCI | sFLT-1, E-selectina, sVCAM-1, PAI-1 y sICAM-1 se correlacionó con la escala SOFA, IL-6 y la escala APACHE II salvo sICAM-1 |
| Fiusa et al.13 | 2013 | Estudio cohortes prospectivo | 99 pacientes fiebre neutropénica. Shock séptico (n=20), no complicados (n=79) en UCI | Los valores de VEGF-A y sFLT-1 fueron similares entre pacientes en shock séptico vs. sepsis no complicadaLa concentración de Ang-2 aumentó en pacientes con shock séptico. Sin embargo, valores de VEGF-A y sFLT-1 fueron similares |
| Skibsted et al.15 | 2013 | Estudio cohortes prospectivo multicéntrico | 186 pacientes en urgencias con sepsis (n=64), shock séptico (n=61) y controles no infectados (n=61) | El uso de la técnica (NIRS) no presenta correlación con ninguno de los biomarcadores analizados en el subgrupo de sepsis |
| Schuetz et al.8 | 2014 | Estudio cohortes prospectivo | 161 pacientes hipotensos en urgencias. Sepsis (n=69), no sepsis (n=92) | sFLT-1, E-selectina, ICAM-1 y VEGF fueron estadísticamente significativos para el diagnóstico diferencial del shock séptico vs. otras causas de shock |
| Day et al.9 | 2015 | Estudio cohortes prospectivo | 115 pacientes hipotensos en urgencias. Sepsis (n=49), no sepsis (n=66) | Aumento significativo en sepsis de sFLT-1, e-selectina, sICAM-1, PAI-1, IL-6 y procalcitoninaEl uso de biomarcadores aumentó el AUC para el diagnóstico diferencial de sepsis vs. el uso exclusivo de la clínica |
| Hou et al.11 | 2017 | Ensayo clínico multicéntrico | 605 pacientes en shock séptico en urgencias | La resucitación guiada por objetivos no demostró diferencias en los biomarcadores frente a la terapia estándar de resucitación |
sFLT-1 como biomarcador de mortalidad
| Autor | Año | Diseño | Pacientes | Hallazgos |
|---|---|---|---|---|
| Skibsted et al.10 | 2013 | Estudio cohortes prospectivo multicéntrico | 166 pacientes con sepsis (n=63), sepsis grave (n=61) y shock séptico (n=42) en UCI | Los biomarcadores sFLT-1, sE-selectin, ICAM y sVCAM-1 se demuestran predictores de mortalidad intrahospitalaria |
| Fiusa et al.13 | 2013 | Estudio cohortes prospectivo | 99 pacientes fiebre neutropénica. Shock séptico (n=20), no complicados (n=79) en UCI | El cociente Ang-2/Ang-1 se presenta como biomarcador de aumento del riesgo de fallecer a los 28 días |
| Hou et al.11 | 2017 | Ensayo clínico multicéntrico | 605 pacientes en shock séptico en urgencias | Los biomarcadores basales y a las 24h mostraron ser predictores de mortalidad |
A continuación, se describen los 3 artículos que se obtenían al aplicar los criterios de inclusión previamente mencionados que presentan relación con la infección por SARS-CoV-2. Se decide la inclusión de estos al presentar una patología de neumonía intersticial bilateral viral que acaba condicionando un síndrome de distrés respiratorio del adulto y que lleva consigo gran cantidad de complicaciones infecciosas bacterianas. Dicha disfunción endotelial surge de la disfunción microcirculatoria por la infiltración de las células endoteliales que expresan ACE2.
Greco et al.16 comparan valores de sFLT-1 en sujetos infectados vs. controles sanos, ante cifras de 90,3pg/ml (AUC 0,902, sensibilidad 83,89%, especificidad 86,67%, p<0,001). sFLT-1 apareció asociado con la extensión y la gravedad de la enfermedad. Tercer día (122,4±6,9 vs. 155,6±10,6pg/ml, p=0,01), segunda semana de 199,4±32,4pg/ml, tercera semana 199,0±12,0pg/ml. En los pacientes control observamos una concentración de sFLT-1 de 78,9±2,5pg/ml. Agruparon por cuartiles los valores de sFLT-1 y linfocitosis, neutrofilia, PCR, LDH, ferritina y procalcitonina, demostrándose aumentado en fallecidos por COVID-19. Se analizó el uso de CA 15.3 como marcador de progresión de fibrosis, mostrando valores séricos de CA 15.3 de pacientes ingresados en UCI en comparación con los pacientes que fueron hospitalizados en planta de hospitalización y sujetos control (42,6±3,3 vs. 25,7±1,5U/ml vs. pacientes control 14,5±0,3U/ml p<0,0001).
Espino-y-Sosa et al.17 compararon mujeres embarazadas positivas para COVID-19 graves vs. no graves. Dicha comparativa evidenció significación estadística en la comparativa de las cifras de sFLT-1 (1424; 1054-2099 vs. 6119; 2099-7900, p=0,0001), con un cociente sFLT-1/ANG-II ratio (0,92; 0,25-2,03 vs. 14,27; 4,47-42,46 p=0,0001). En esa línea se concluyeron unas OR para sepsis grave de sFLT-1 (1,01; 1,00-1,01 p<0,0001) y sFLT-1/ANG-II (1,31; 1,09-1,56 p=0,003). Por último, un cociente sFLT-1/ANG-II ≥3,06 obtuvo una AUC para neumonía grave 0,96 presentando sensibilidad 0,96 (IC95%, 0,88-1,0), especificidad 0,886 (IC95%, 0,80-0,972), VPP 8,48 (IC95%, 3,97-18) y VPN 0,045 (IC95%, 0,01-0,31). Del mismo modo las AUC para el ratio ≥3,06 de sFLT-1/ANG-II para riesgo ingreso UCI, intubación, sepsis viral y muerte materna también fueron significativas.
En la misma línea, Torres-Torres et al.18 analizaron la relación entre sFLT-1 y gravedad de COVID-19 (no grave vs. grave). Los valores de sFLT-1 fueron mayores en pacientes con COVID grave (1789; 1171-3286 vs. 4050; 2099-11.490 p=0,002). Hubo una asociación significativa entre sFLT-1 neumonía OR 1,817 (IC95%, 1,365-2,418; p<0,0001), ingreso en la UCI OR 2,195 (IC95%, 1,582-3,047), sepsis viral OR 2,318 (IC95%, 1,407-3,820) y muerte materna OR de 5,504 (IC95%, 1,079-28,076). En cuanto a las AUC fueron todas significativas destacando la de gravedad de neumonía 0,715 (0,582-0,828), VPP 38,7 (9,7-61,3), VPN 45,2 (29-64,5) (tabla 3).
sFLT-1 como biomarcador diagnóstico y de gravedad en neumonía por SARS-CoV-2
| Autor | Año | Diseño | Pacientes | Hallazgos |
|---|---|---|---|---|
| Greco et al.16 | 2021 | Estudio cohortes prospectivo | 262 pacientes hospitalizados por neumonía COVID vs. 101 controles sanos | Valores séricos de sFLT-1 resultaron significativos para el diagnóstico de neumonía COVID-19 vs. sujetos sanos, así como la estratificación de la gravedad del cuadro. En cuanto a CA 15.3, resultó significativo para predicción de fibrosis pulmonar |
| Espino-y-Sosa et al.17 | 2021 | Estudio cohortes prospectivo multicéntrico | 80 mujeres embarazadas COVID positivas. COVID grave (n=25) y no grave(n=55) en urgencias | Se describe un aumento de sFLT-1 y del cociente sFLT1/ANG-II como predictores de gravedad, así como de complicaciones |
| Torres-Torres et al.18 | 2022 | Estudio cohortes prospectivo | 113 embarazadas COVID+. COVID no grave (n=82), COVID grave (n=31) en urgencias | Los valores de sFLT-1 se asociaron con gravedad de enfermedad, así como aumento de complicaciones |
Un diagnóstico precoz que permita un rápido tratamiento intensivo inicial son claves para la mejora del pronóstico de la sepsis. Ciertos biomarcadores potencialmente utilizables para dicho fin se encuentran ampliamente descritos y gran parte de ellos ya disponibles en la práctica clínica habitual. Sin embargo, estos reactantes de fase aguda también se elevan en patologías de etiología no infecciosa, por lo que resulta mandatorio la identificación de nuevos biomarcadores con sensibilidad y especificidad suficientes para dicho propósito19.
SFLT-1 forma parte del equilibrio entre factores angiogénicos presentando bajos valores en personas sin patología endotelial asociada.
Tal y como se describe de forma amplia previamente, sFLT-1 se identifica como significativo en pacientes en shock séptico frente a otros tipos de shock o en pacientes con sepsis leve (criterios Sepsis-2). Dichos resultados se describen ampliamente destacando en el diagnóstico diferencial de shock en urgencias entre sepsis vs. no sepsis8, otras causas de shock9 y diferencias entre sepsis, sepsis severa y shock séptico. En este último artículo vale la pena reseñar la correlación con la IL-6, así como la escala APACHE-II, escala ya validada para la sepsis para predecir la gravedad y el pronóstico de los pacientes en unidades de cuidados intensivos10. Estos 3 artículos se engloban ya que presentan gran coherencia, ya que hacen referencia a la significación estadística y clínica del aumento de SFLT-1 en estudios comparativos sepsis-shock séptico vs. shock no séptico.
Una de las fortalezas de esta revisión es la descripción detallada de cada estudio de análisis multivariante de las patologías ajustadas por comorbilidades, ya que resulta evidente el papel del estado previo de los pacientes como condicionante de elevación de marcadores de disfunción endotelial8–10. En esa línea otro de los artículos identificó la diabetes como un factor añadido a la alteración endotelial objetivando que, en estos pacientes, se produce un incremento significativo adicional de sFLT114. En este caso, no se analizó el pronóstico de dichos pacientes realizando análisis multivariante diabetes-biomarcador-pronóstico, motivo por el cual, su estudio, resultaría de gran interés clínico.
Uno de los criterios de exclusión que presentan gran parte de los artículos es la inmunodepresión de predominio secundaria a patología tumoral, hematológica, diabética, iatrogénica, etc. Por este motivo los artículos que van a ser descritos a continuación resultan especialmente interesantes para el devenir del uso de sFLT-1.
En primer lugar, se comparó sepsis vs. shock séptico en pacientes neutropénicos de causa hematológica, no presentando diferencias en los valores de sFLT-1; sin embargo, a las 48h en los pacientes con shock séptico el aumento fue marcado. Resulta interesante la correlación entre SOFA y sFLT-112.
Los valores de sFLT-1 resultaron no significativos y discreparon con el artículo anterior, aunque el cociente que sí fue de interés fue el Ang-1/Ang-2 que sí fue significativo13. Resulta mandatorio realizar más estudios en esta población dado que en pacientes inmunodeprimidos los resultados de los estudios resultan contradictorios. Del mismo modo, una de las limitaciones de esta revisión se centra en el papel único de la neutropenia febril secundaria a quimioterapia en el cáncer, ya que no se estudian otras causas de neutropenia febril de causa no iatrogénica.
En el artículo14, se comparan biomarcadores en pacientes diabéticos con sepsis, sepsis severa y shock séptico. Los resultados muestran que sFLT-1 es positivo en pacientes diabéticos y en aquellos con sepsis más grave. Esto sugiere que la diabetes es un factor añadido a la alteración endotelial en la sepsis.
En cuanto a la mortalidad vale la pena destacar la capacidad de predicción de mortalidad intrahospitalaria de sFLT-1 al ser analizado en urgencias10, así como su nivel basal, a las 6h, a las 24h, independientemente de la estrategia de resucitación hemodinámica empleada (que no resultó diferencial el cambio de biomarcadores)11. El cociente Ang-1/Ang-2 mostró un ratio significativo para el riesgo relativo de fallecer a los 28 días, no así el sFLT-113.
La pandemia de COVID-19 ha demostrado que el virus SARS-CoV-2 induce disfunción endotelial, lo que puede conducir a una neumonía intersticial viral. Los estudios han demostrado que los valores de sFLT-1, un biomarcador de la disfunción endotelial, son elevados en pacientes con COVID-19, y que los valores más altos se asocian con una enfermedad más grave.
En particular, los estudios han demostrado que:
- •
En pacientes no embarazadas con COVID-19, los valores de sFLT-1 aumentan con la gravedad de la enfermedad y se asocian con un mayor riesgo de mortalidad16.
- •
En mujeres embarazadas con COVID-19, los valores de sFLT-1 también aumentan con la gravedad de la enfermedad y se asocian con un mayor riesgo de neumonía grave, ingreso en UCI, intubación, sepsis viral y muerte materna17.
- •
En mujeres embarazadas con COVID-19, el ratio sFLT-1/ANG-II también aumenta con la gravedad de la enfermedad, pero no se asocia con un mayor riesgo de preeclampsia18.
Estos hallazgos sugieren que sFLT-1 podría ser un biomarcador útil para la evaluación de la gravedad de la COVID-19 y para la identificación de pacientes con un mayor riesgo de complicaciones.
Skibsted et al. comparan el uso de biomarcadores frente al análisis de oxigenación a pie de cama con sistemas NIRS, desestimando este procedimiento ante la discrepancia con los biomarcadores y la dificultad técnica15.
Respecto a las limitaciones del estudio, podríamos citar la falta de análisis estadístico debido a la gran variabilidad de los datos ofrecidos por las diversas publicaciones trabajadas. Aunque a priori podría parecer un limitador de cara a generalizar, resulta interesante que en todos los estudios relacionan sFLT-1 como sepsis, gravedad y pronóstico desde enfoques distintos. Schuetz et al.8 plantean el estudio de biomarcadores para el diagnóstico diferencial de shock en urgencias, la falta de discriminación de los estudios en relación con el foco primario de la sepsis8,9, la falta de descripción entre las diferentes causas de sepsis, así como diferenciar las causas de otros tipos de shock en los grupos control9.
Day et al.9 identificaron biomarcadores para el diagnóstico diferencial entre shock séptico y otras causas de shock. Sin embargo, los estudios presentaron sesgos de selección de pacientes, como una población reducida, unicéntrica, así como criterios de inclusión restrictivos. Además, la mayoría de los estudios solo midieron los biomarcadores en un momento puntual, lo que podría limitar su utilidad clínica.
Es importante señalar que los biomarcadores no miden el daño endotelial de forma directa sino indirectamente. Por lo que se podría caer en un sesgo de confusión en el que los biomarcadores indirectos resultaran significativos y no se produjera una disfunción endotelial in situ, aunque esta última opción no resulta muy factible.
Por último, todos los artículos resultan significativos por lo que llevarlo a cabo en una muestra propia podría indicarnos si se presenta sesgo de publicación. Derivado del presente trabajo podemos afirmar que sería de muy alto interés la realización, en un futuro próximo, de los estudios correspondientes que permitieran concretar no solo los valores pronóstico, sino también su incorporación en escalas de predicción de complicaciones nosocomiales y la morbimortalidad.
Tras sintetizar de forma pormenorizada todos los artículos resulta evidente el papel de sFLT-1 en la disfunción endotelial en primer lugar. En cuanto al papel de la patología microvascular, es obvio que forma parte de muchas patologías entre las que se destaca la sepsis. En ese sentido, los estudios muestran direccionalidad entre patología infecciosa vs. no infecciosa y gravedad según los biomarcadores empleados. El hecho de presentar estudios heterogéneos podría suponer un hándicap, pero interpretamos que es un beneficio ya que muestra distintos tipos de pacientes (pacientes en urgencias, UCI, neutropénicos, diabéticos, COVID-19 y embarazadas) en los que se demuestra el papel de sFLT-1 en la disfunción endotelial de la sepsis, lo que resulta beneficioso de cara a generalizar a toda la población. En esa línea resulta interesante que los resultados no dependen del momento de la extracción de la muestra, sino que permanece inalterable la relación entre biomarcadores y gravedad. Por todo lo citado anteriormente se señala la importancia de la incorporación de sFLT-1 en la práctica clínica, ya que añade información a los criterios clínicos y biomarcadores actuales.
Las nuevas teorías van a favor del uso de fármacos cuyas dianas terapéuticas sean específicas de la inflamación, respuesta inmune o disfunción endotelial. La primera de todas es la que más se ha desarrollado hasta ahora, sobre todo en patologías autoinmunes, aumentando el número de dianas terapéuticas más allá de la corticoterapia. En esa línea un potencial estudio que se podría plantear es el papel de sFLT-1 en los pacientes en tratamiento activo con hidrocortisona en casos de shock séptico refractario, asumiendo el sesgo de inclusión de pacientes más graves. De este modo se podría analizar el papel de los tratamientos antiinflamatorios como predictores de cambio en los biomarcadores.
ConclusiónEl grado de presencia de sFLT-1 es relevante en el diagnóstico diferencial entre sepsis y otras patologías, para detectar el grado de gravedad del proceso infeccioso y para la evaluación de la mortalidad en pacientes en shock séptico.
Su detección y análisis son factibles para un uso clínico generalizado, sirviendo como nexo para la identificación de nuevos biomarcadores (o nuevas combinaciones o correlaciones entre biomarcadores ya conocidos) para el diagnóstico precoz de la alteración endotelial ya que representarán un antes y después en el pronóstico de la disfunción orgánica, permitiendo así un tratamiento más rápido, más preciso y, con ello, más eficaz.
FinanciaciónApoyado por la Caja Rural de Soria para la redacción del artículo. El Instituto de Salud Carlos III (PI18/01238, CIBERINFEC CB21/13/00051), Junta de Castilla y León (GRS 2425/A/ 21 GRS 2399/A/ 21, GRS 1922/A/19, GRS 2057/A/19), Fundación Ramón Areces (CIVP19A5953).
Contribución de los autoresMiguel Ugalde Azpiazu: concepción y diseño del estudio, adquisición de datos, análisis e interpretación de los datos, redacción del borrador del artículo, aprobación definitiva de la versión que se presenta.
Alberto Caballero: concepción y diseño del estudio, redacción del borrador del artículo, revisión crítica del contenido intelectual, aprobación definitiva de la versión que se presenta.
Marta Martín: diseño y ejecución de la estrategia de búsqueda bibliográfica, adquisición de datos.
Eduardo Tamayo: adquisición de datos, análisis e interpretación de los datos, redacción del borrador del artículo, revisión crítica del contenido intelectual, aprobación definitiva de la versión que se presenta.
Olga de la Varga: adquisición de datos, análisis e interpretación de los datos, redacción del borrador del artículo, revisión crítica del contenido intelectual, aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran que no existen potenciales conflictos de interés con respecto a la investigación y/o autoría del presente manuscrito.
Instituto de Ciencias de la Salud de Castilla y León (ICSCYL).