La ecografía es un recurso del que disponemos de primera mano los médicos de familia y al que cada vez más frecuentemente recurrimos, hasta el punto de formar ya parte de nuestra exploración física. Es una técnica diagnóstica de fácil acceso, asequible, versátil y no invasiva que emplea los ultrasonidos para definir las estructuras anatómicas de nuestro cuerpo sin necesidad de radiación y que se realiza en tiempo real, pudiendo permitir una exploración dinámica.
Pese a todo lo mencionado, la ecografía vascular y, en concreto, la de los troncos supraaórticos no está tan extendida en nuestro ámbito, pese a su importante papel en el ámbito de la prevención cardiovascular, fundamental en la atención primaria. Por este motivo en este artículo se pretende llevar a cabo una breve y clara descripción de la técnica con el objetivo de extender su uso en la práctica cotidiana.
Ultrasound is a resource that family doctors have first-hand and that we use more and more frequently, to the point of becoming part of our physical examination. It is an easily accessible, affordable, versatile and non-invasive diagnostic technique that uses ultrasound to define the anatomical structures of our body without radiation and is performed in real time, allowing a dynamic exploration.
Despite all the above, vascular ultrasound and, specifically, the supra-aortic trunks ultrasound is not as widespread in our setting, despite its important role in the field of cardiovascular prevention, which is essential in primary care. For this reason, this article aims to carry out a brief-and-clear description of the technique with the aim of extending its use in daily practice.
En nuestro día a día de la consulta de atención primaria, el manejo del paciente incluye una completa anamnesis y una correcta exploración física. Debido a que se trata de una técnica cada vez más asequible y de fácil acceso, frecuentemente complementamos nuestra exploración física con la ecografía clínica, con el objetivo de enfocar mejor nuestras posibilidades diagnósticas y terapéuticas. Tal es la frecuencia de su uso en la actualidad, que algunos expertos la consideran el quinto pilar de la exploración física1.
Además de lo ya mencionado anteriormente, se trata de una técnica versátil, no invasiva y en tiempo real, lo que permite llevar a cabo una exploración dinámica del paciente sin el riesgo de radiación que presentan otro tipo de pruebas radiológicas2. Permite además optimizar los recursos sanitarios disponibles para el manejo del paciente y dar así una mejor atención, lo que lleva a un aumento de confianza y satisfacción del paciente atendido precozmente con un diagnóstico rápido e individualizado3.
Pero no todo son ventajas, ya que se trata de una prueba operador-dependiente, que requiere por parte de este una curva de aprendizaje que, no obstante, es fácilmente adquirible. A la vez, es paciente-dependiente, cuyas características pueden dificultar los esfuerzos por nuestra parte y disminuir la rentabilidad diagnóstica de la técnica4.
Por todo ello, está cada vez más extendido en el día a día el recurso a la ecografía a nivel abdominal, pulmonar o musculoesquelético. Sin embargo, hay otros campos de la ecografía que quedan relegados a la cola del aprendizaje y de su uso, como es el caso de la ecografía de los troncos supraaórticos, especialmente importante en el ámbito de la prevención cardiovascular, tema muy importante en atención primaria.
Peculiaridades de la ecografía de los troncos supraaórticosLa ecografía de los troncos supraaórticos arteriales (TSA) es una herramienta fundamental para la estimación del riesgo cardiovascular, así como para el manejo preventivo y terapéutico del accidente cerebrovascular (ACV). Esto se debe a que aproximadamente el 90% de los ACV se van a producir en territorio carotídeo, y, de estos, el 30% serán consecuencia de una enfermedad aterotrombótica de grandes vasos5-9.
La mayoría de los grupos incluyen la valoración de las arterias vertebrales, a pesar de su pobre relevancia pronóstica, por lo que nos centraremos en el estudio de las arterias carótidas.
El examen carotídeo permite detectar fases iniciales de aterosclerosis en pacientes con factores de riesgo e incluso permite mejorar la estratificación de los pacientes con un riesgo intermedio, permitiendo hacer un tratamiento más intensivo en los que presenten una afectación de la pared arterial significativa, así como hacer un seguimiento de estos. También permite identificar la existencia de una estenosis arterial significativa, lo que predice el elevado riesgo de padecer un ACV y permite realizar un tratamiento preventivo del ictus mediante el tratamiento de la estenosis10.
Anatomía de los troncos supraaórticosLos TSA se originan del cayado aórtico. El tronco braquiocefálico derecho es la primera de las ramas y se dirige hacia arriba y la derecha hasta su bifurcación en la arteria carótida común (ACC) y la arteria subclavia derechas. La ACC y arteria subclavia izquierdas surgen directamente del cayado de la aorta sin formar un tronco arterial previo11.
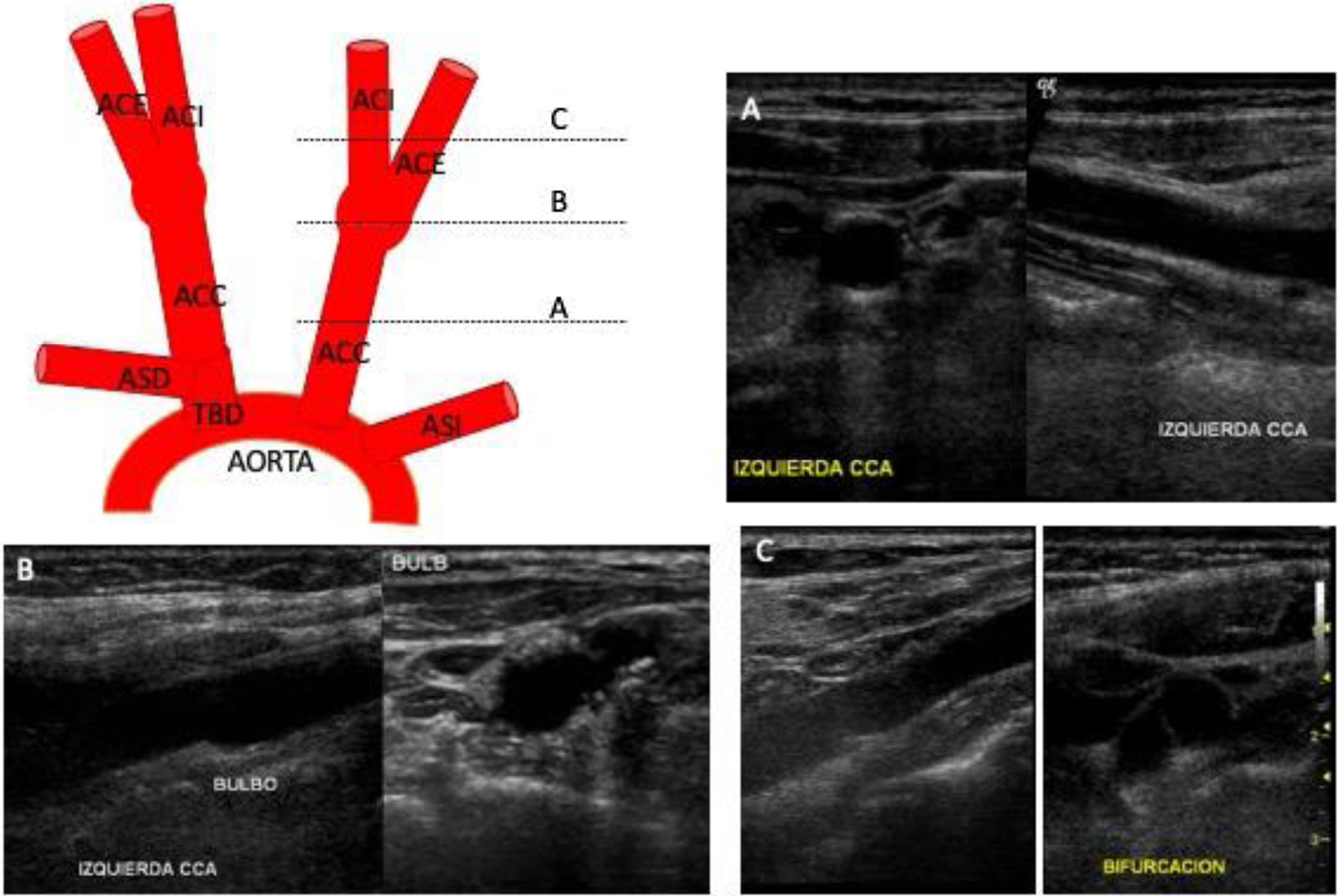
Ambas ACC se localizan posteriores al músculo esternocleidomastoideo y se dirigen superiormente sin dar ramas colaterales hasta dividirse en arteria carótida interna (ACI) y arteria carótida externa (ACE). Aunque el nivel de la bifurcación es variable, suele localizarse a nivel del borde superior del cartílago tiroides, a nivel de la cuarta vértebra cervical12 (fig. 1).
Anatomía de los troncos supraaórticos y visión ecográfica de las arterias carótidas en diferentes trayectos en corte longitudinal y transversal. A)A nivel de la arteria carótida común. B)A nivel del bulbo carotídeo. C)A nivel de la bifurcación de la arteria carótida común en carótida interna y externa.
ACC: arteria carótida común; ACE: arteria carótida externa; ACI: arteria carótida interna; ASD: arteria subclavia derecha; ASI: arteria subclavia izquierda; TBD: tronco braquiocefálico derecho.
A nivel de la bifurcación, la ACC presenta una dilatación, el bulbo carotídeo (fig. 1). La ACE tiene un origen anterior y medial respecto a la ACI. Se dirige hacia arriba y se lateraliza a lo largo de su trayecto hacia la base del cráneo, dividiéndose en dos arterias terminales: la temporal superficial y la arteria maxilar13. Previamente, da ramas colaterales: la tiroidea superior, la faringe ascendente, la lingual, la facial, la occipital y la auricular posterior, que irrigan la superficie externa del cráneo, la cara y la porción superior del cuello14.
La ACI se origina posterior y lateralmente respecto a la ACE y se dispone medial a ella, subiendo a lo largo del cuello sin emitir colaterales hasta llegar al conducto carotídeo y hacerse intracraneal.
La arteria vertebral se origina de la arteria subclavia. Tras su origen, penetra en el foramen transverso de la sexta vértebra cervical y atraviesa los forámenes transversos de las vertebrales cervicales desde C6 hasta C113.
Protocolo de exploración: posición del paciente, equipo y sistemática de estudioLa exploración se realiza con el paciente en decúbito supino con cuello en hiperextensión y rotación de 45° hacia el lado contrario del lado explorado. Se necesita de una sonda lineal de alta frecuencia: 7-14MHz15.
Empezaremos utilizando la ecografía en modoB y luego el Doppler color, con un barrido axial en dirección craneal desde la región supraclavicular hasta el ángulo de la mandíbula. Identificaremos en la zona infraclavicular el origen del tronco braquiocefálico, el origen de la arteria subclavia y seguiremos la ACC cranealmente hasta la bifurcación, identificando la ACI medial y la ACE en la zona laterocervical, por debajo del ángulo mandibular (fig. 1).
Deberemos valorar la luz y la pared arterial, el grosor del complejo íntima-media (CIM) y la existencia de placas de ateroma atendiendo a sus características, localización, tamaño y número de estas15.
Engrosamiento del complejo íntima-mediaEl CIM es la separación entre las líneas que representan las interfaces de luz vascular -íntima y media -adventicia, y se engrosa en fases iniciales de la aterosclerosis por depósito de lípidos16.
El grosor del CIM debe medirse en la pared posterior de la ACC 1cm prebifurcación, con el vaso paralelo al transductor. Los valores normales de CIM varían con la edad y el sexo, pero independientemente de esto, un CIM superior a 1,5mm implica la existencia de una placa de ateroma17,18.
Placas de ateromaUna vez identificada ecográficamente una placa de ateroma, por existir un engrosamiento parietal focal mayor de 1,5mm, debemos valorar sus características (localización, grosor, longitud, disposición espacial, morfología, ecogenicidad, ecoestructura, características de la superficie endoluminal) y el grado de estenosis condicionado por la misma. Estas características, en su conjunto, permiten orientar hacia su estabilidad o inestabilidad, y así valorar el riesgo de posibles ACV.
La enfermedad ateromatosa afecta principalmente a las bifurcaciones arteriales y a los segmentos adyacentes, por la existencia de turbulencias de flujo. En la raíz de los TSA, la bifurcación carotídea, el origen de la ACI y el origen de la ACE es donde se encuentran hasta el 80% de las placas de ateroma19.
La longitud de la placa se debe medir en las imágenes en plano sagital, mientras que el grosor y la morfología de la placa se tienen que valorar con imágenes en el plano axial. Para el grosor, recurriremos también al Doppler color, que permite una valoración de la morfología de la placa con el flujo arterial20.
Según sus características ecográficas, las placas de ateroma pueden ser homogéneas o heterogéneas. Las placas homogéneas pueden ser fibrosas o calcificadas, y presentan una superficie regular. Las placas heterogéneas son más inestables y sintomáticas, pueden tener una superficie irregular (ulceración) y áreas hipoecogénicas en su interior.
Estenosis de la arteria carótida común e internaEl Doppler espectral o pulsado es una representación gráfica cuantitativa de las velocidades y las direcciones del flujo en la muestra Doppler y nos va a permitir valorar la velocidad de flujo y la morfología del espectro, registrando las velocidades de pico sistólica (VPS) o sistólica máxima, velocidad de pico diastólica (VPD) y el índice de resistencia (IR; o resistencia al flujo arterial originado por el lecho distal) en la ACC, en la ACI proximal y en la ACE proximal21. Si existen zonas de estenosis debemos registrar los parámetros en el punto de máxima estenosis e inmediatamente distal.
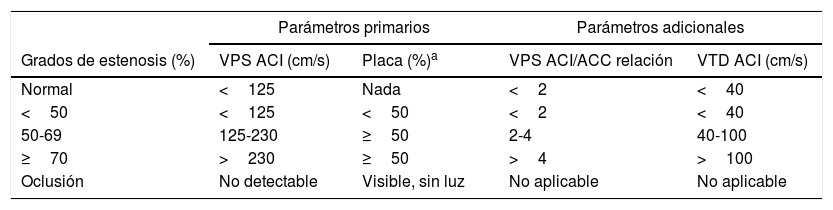
Los criterios para cuantificar el grado de estenosis en la ACI incluyen la VPS y el porcentaje de estenosis visible, así como el cociente de VPS en ACI/ACC y la velocidad telediastólica (VTD)22,23 (tabla 1).
Criterios de consenso para el diagnóstico de estenosis de la arteria carótida interna por ecografía en escala de grises y Doppler
| Parámetros primarios | Parámetros adicionales | |||
|---|---|---|---|---|
| Grados de estenosis (%) | VPS ACI (cm/s) | Placa (%)a | VPS ACI/ACC relación | VTD ACI (cm/s) |
| Normal | <125 | Nada | <2 | <40 |
| <50 | <125 | <50 | <2 | <40 |
| 50-69 | 125-230 | ≥50 | 2-4 | 40-100 |
| ≥70 | >230 | ≥50 | >4 | >100 |
| Oclusión | No detectable | Visible, sin luz | No aplicable | No aplicable |
Placa (reducción del diámetro) verificada con ecografía y escala de grises y Doppler.
ACI: arteria carótida interna; ACC: arteria carótida común; VPS: velocidad pico sistólica; VPS ACI/ACC: cociente de velocidades pico sistólicas en arteria carótida interna y arteria carótida común; VTD: velocidad telediastólica.
Adaptado de Grant et al.23.
El porcentaje de estenosis arterial se obtiene midiendo en el plano axial la relación entre el área de la arteria en el plano axial y el área de la luz residual en el punto de máxima estenosis.
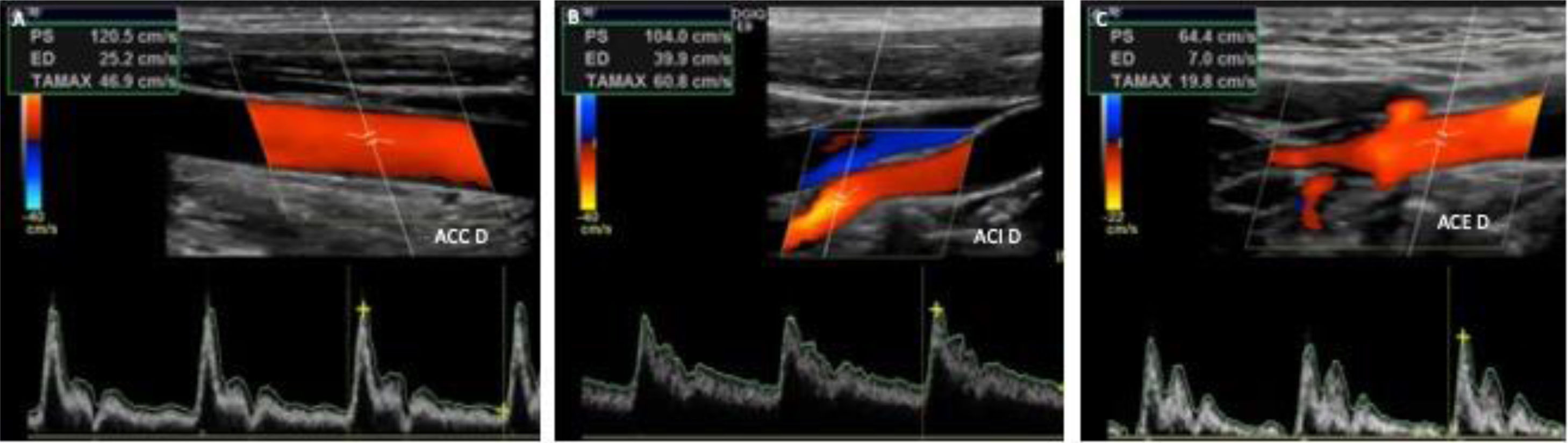
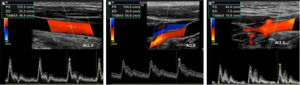
Para el resto de los criterios debemos tener en cuenta que el espectro Doppler de la ACC es monofásico, con componente diastólico bien representado y bajas resistencias vasculares, con una VPS que no supera los 125cm−1 (fig. 2A). En la ACI el patrón es también monofásico, con componente sistólico y abundante componente diastólico. La VPS es igual o ligeramente inferior a la de la ACC, con una VTD elevada (fig. 2B). En la ACE y la arteria subclavia el patrón es trifásico, con un pico sistólico rápido seguido por un mínimo componente negativo y un escaso componente diastólico, típico de los vasos que se distribuyen a territorios con altas resistencias arteriales24 (fig. 2C).
Espectro Doppler normal de las arterias carótida común, carótida interna y carótida externa derechas. A y B)Las arterias carótida común derecha (ACCD) y carótida interna derecha (ACID) presentan un registro monofásico que muestra morfología de baja resistencia, sin ensanchamiento espectral. C)La arteria carótida externa derecha (ACED) presenta un patrón espectral trifásico, con un pico sistólico rápido seguido por un mínimo componente negativo y un escaso componente diastólico.
Las estenosis hemodinámicamente significativas presentan aumento de VPS superior a 230cm−1, reducción de la luz del vaso mayor o igual al 50%, ensanchamiento de la onda espectral, turbulencia postestenótica con Doppler color, presencia de «aliasing» (falso espectro de color que se observa como una heterogeneidad cromática distal a un punto de estenosis, y se produce debido a las altas velocidades a dicho nivel), VTD mayor de 100cm−1 y cociente de VPS en ACI/ACC mayor de 424.
Cuando la estenosis supera el 95% se habla de suboclusión, viendo un flujo filiforme con Doppler color. En la oclusión completa habrá ausencia de flujo Doppler, visualización de un trombo que ocupa toda la luz vascular, inversión de la onda espectral proximal a la lesión y ondas de alta resistencia en vasos proximales25,26.
Estenosis de la arteria carótida externaEn la ACE, las placas obstructivas son menos frecuentes y su relevancia clínica es escasa, por lo que no suele precisar tratamiento. Sin embargo, la ACE aporta flujo colateral en pacientes con oclusión ipsilateral de la ACI, y esto puede influir en la decisión del tratamiento quirúrgico de la ACE estenótica27.
Consideraciones éticasEl artículo no implica la experimentación con humanos.
FinanciaciónEl artículo no ha contado con patrocinio alguno.
Conflicto de interesesNo existe conflicto de intereses en el artículo.