La enfermedad pulmonar obstructiva crónica (EPOC) es la cuarta causa de mortalidad en nuestro medio y habitualmente se consideraba circunscrita al territorio pulmonar. Los estudios más novedosos sugieren que se trata de una enfermedad sistémica cuya etiopatogenia más probable es un estado de inflamación crónica de baja intensidad que se reagudiza durante las exacerbaciones. La evidencia científica reciente ha puesto de relieve que las enfermedades cardiovasculares son una de las principales causas de hospitalización y mortalidad en estos pacientes. Esta relación debe comprenderse considerando que ambos sistemas, el pulmonar y el cardiovascular, se encuentran íntimamente relacionados constituyendo el eje cardiopulmonar. Por lo tanto, el abordaje terapéutico de la EPOC no debe comprender solo el tratamiento de las complicaciones respiratorias, sino también la prevención y tratamiento de las enfermedades cardiovasculares, muy frecuentes en estos pacientes. En este sentido, en los últimos años se han desarrollado estudios que analizan el efecto de los diferentes tipos de terapia inhalada sobre la mortalidad por todas las causas y la mortalidad cardiovascular en particular.
Chronic obstructive pulmonary disease (COPD) is the fourth leading cause of mortality in our environment and was usually considered to be confined to the lung territory. The latest studies suggest that it is a systemic disease whose most probable etiopathogenesis is a state of low-intensity chronic inflammation that worsens during exacerbations. And recent scientific evidence has highlighted that cardiovascular diseases are one of the main causes of hospitalization and mortality in these patients. This relationship must be understood considering that both systems, the pulmonary and the cardiovascular, are closely related constituting the cardiopulmonary axis. Therefore, the therapeutic approach to COPD should not only include the treatment of respiratory complications, but also the prevention and treatment of cardiovascular diseases, which are very common in these patients. In this sense, in the last years, studies have been carried out that analyze the effect of the different types of inhaled therapy on all-cause mortality and cardiovascular mortality in particular.
Hasta hace poco tiempo, la enfermedad pulmonar obstructiva crónica (EPOC) se consideraba una patología estrictamente ligada a la vía aérea y al pulmón. Sin embargo, las evidencias de los estudios epidemiológicos y de los ensayos clínicos han demostrado que se trata de una enfermedad sistémica en la que la enfermedad cardiovascular (ECV) es un motivo frecuente de ingreso y una de las principales causas de morbilidad y mortalidad en estos pacientes1. Se estima que como mínimo 40% de la mortalidad de la EPOC se debe a causas cardiovasculares2, aunque esta cifra puede estar infra estimada. Ya los resultados del Lung Health Study mostraron cómo las ECV son responsables de 42% de los primeros ingresos del paciente EPOC y de 48% de las readmisiones3. Asimismo, las exacerbaciones son una de las principales causas de eventos cardiovasculares en estos pacientes4.
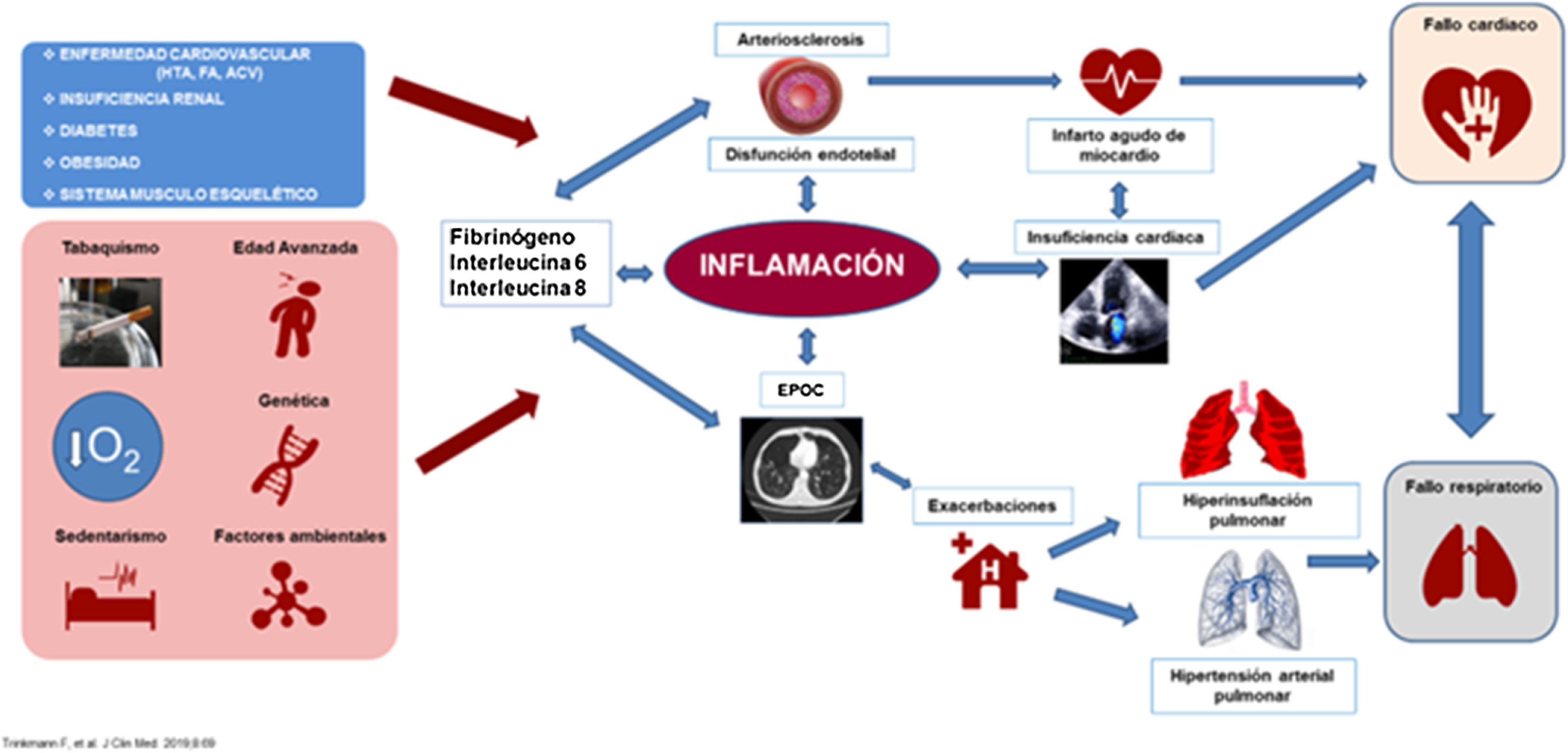
El sustrato sobre el que se desarrolla esta íntima relación entre la EPOC y las ECV es el eje cardiopulmonar. Si bien la relación entre el sistema respiratorio y el sistema circulatorio siempre ha estado presente, sólo en los últimos años los estudios han manifestado la importancia del eje y el continuum cardiopulmonar (fig. 1). Dado que la EPOC es tras las ECV y el cáncer, la cuarta causa de mortalidad en nuestro medio5 se hace imprescindible realizar una revisión sobre las evidencias epidemiológicas, los mecanismos fisiopatológicos y el abordaje terapéutico precoz y adecuado de las complicaciones cardiovasculares en el paciente con EPOC.
Relación entre la EPOC y la ECVLa prevalencia de la ECV en la EPOC está actualmente suficientemente documentada, si bien oscila entre 15-70% en función de los estudios y las poblaciones seleccionadas6,7, siendo la insuficiencia cardiaca (IC) la principal causa de mortalidad en el paciente con EPOC8. La presencia de ECV se asocia a un mayor riesgo de hospitalización, mayor duración de la estancia y mortalidad por todas las causas. Además, el impacto económico asociado a las ECV en esta población es considerable y el coste acumulado del tratamiento de las comorbilidades puede superar al del tratamiento de la propia EPOC9.
Alteración funcional pulmonar subclínica y ECVLa evidencia sustenta como las alteraciones iniciales de la función pulmonar son un factor de riesgo para el desarrollo de la ECV10. Datos del estudio NHANES I muestran como los pacientes de edad entre 40 y 60 años con un flujo espiratorio máximo en el primer segundo (FEV1) de 63% presentan el doble de riesgo de mortalidad cardiovascular y hospitalización en comparación con los que tienen un FEV1 de 109%11. Incluso, aquellos con un FEV1 de 88%, que se puede considerar en el rango de la normalidad, presentan un riesgo de eventos cardiovasculares de 78% (RR 1,78, IC 95% 1,18-2,70) en comparación con los que tienen un FEV1 de 109%11.
Al considerar variables dinámicas de la función pulmonar, los resultados del estudio ARIC mostraron que un descenso anual del 1,9% en el FEV1 o de 2,1% de la capacidad vital forzada (CVF) se asociaron de forma independiente a un aumento en la incidencia de IC izquierda12. Asimismo, datos de las cohortes de los estudios CARDIA y del propio ARIC mostraron asociación entre el accidente cardiovascular y el descenso del FEV1 y CVF y el descenso de la CVF respectivamente12,13.
ECV establecida en la EPOC- A.
Insuficiencia cardiaca
La prevalencia de EPOC en la IC varía entre 11-52% mientras que la prevalencia de IC entre los pacientes EPOC oscila entre 10-46%14,15. En un amplio metaanálisis que incluyó a 27 estudios, el riesgo de IC en el EPOC fue 2,57 (IC 95% 1,90-3,47)6. El riesgo de ingreso por IC en los pacientes con EPOC se incrementa un 2,9 por año en comparación con el paciente sin EPOC y la mortalidad se relaciona directamente con las exacerbaciones15.
- B.
Cardiopatía isquémica
La prevalencia de EPOC en los pacientes con un infarto agudo de miocardio (IAM) oscila entre 7-28%, si bien es difícil determinarla con exactitud por las distintas poblaciones seleccionadas y los diferentes criterios diagnósticos16. De manera inversa, el riesgo relativo de IAM en los pacientes EPOC moderado es de 1,40, siendo de 3,00 en los pacientes con enfermedad severa17. La frecuencia y gravedad de las exacerbaciones influyen sobre el riesgo de IAM, de manera que es mayor en las exacerbaciones severas que en las moderadas (RR 2.58, IC 95% 2,26-2,95 y RR 1,58, IC 95% 1,46–1,70, respectivamente)18. El aumento de riesgo no se circunscribe a la hospitalización, sino que se mantiene en las semanas posteriores, siendo la troponina al ingreso un predictor de IAM y mortalidad cardiovascular al alta19.
- C.
Arritmias
La EPOC se asocia con un aumento en la incidencia de arritmias ventriculares (AV), fibrilación auricular (FA) y muerte súbita cardiaca (MSC)20. La severidad de las arritmias se relaciona con la severidad de la EPOC, la edad, las exacerbaciones y la obstrucción al flujo aéreo. La hipoxia, la hipercapnia, la desaturación nocturna, el daño miocardio directo, la disfunción ventricular, la dilatación auricular y los tratamientos farmacológicos explican al menos parcialmente, la elevada incidencia de arritmias. Los antimuscarínicos de larga duración (LAMA) y los betaadrenérgicos de larga duración (LABA) en monoterapia parecen seguros desde el punto de vista arritmogénico. En cambio, la evidencia sobre su seguridad en combinación es escasa. La mayoría de los ensayos que evalúan la combinación no están específicamente diseñados para analizar la seguridad cardiovascular y excluyen pacientes de alto riesgo con comorbilidades, y patología cardiovascular. Asimismo, la información procedente de los estudios en vida real también es escasa y poco concluyente. Por otro lado, es posible que los beta2 agonistas de corta acción (SABA) tengan una mayor predisposición a desencadenar arritmias al afectar el periodo refractario nodal21.
Mecanismos etiopatogénicos del eje cardiopulmonarLos posibles factores que aumentan la incidencia de la ECV en el paciente EPOC pueden dividirse en dos grupos (tabla 1).
Mecanismos etiopatogénicos implicados en el desarrollo de las enfermedades cardiovasculares en los pacientes con EPOC
| Factores de riesgo comunes | Factores dependientes de la EPOC |
|---|---|
| TabacoEdadFactores de riesgo cardiovascularPolución ambientalSobrepesoAntecedentes familiares de ECV | Inflamación sistémica crónica de baja intensidadAlteraciones de la función plaquetariaDisfunción endotelialEstrés oxidativoHipoxiaHipercapniaDesarrollo pulmonar incompletoAlteraciones de la función pulmonarDegradación de la elastinaAlteraciones sistema proteasas/antiproteasasEfectos secundarios de los broncodilatadoresInfra diagnóstico e infra tratamiento de la ECVSenescencia celular aceleradaLeucocitosis y monocitosis en la EPOC |
ECV: enfermedad cardiovascular.
Tomada parcialmente de: Qu S, Zhu J. A Nomogram for Predicting Cardiovascular Diseases in Chronic Obstructive Pulmonary Disease Patients. J Healthc Eng. 2022;2022:6394290.
- A.
Tabaco
El humo del tabaco es el principal factor de riesgo en la etiopatogenia de la EPOC y asimismo en uno de los principales factores de riesgo de enfermedad aterosclerótica, con especial repercusión en la isquemia coronaria y en la enfermedad arterial periférica (EAP). El tabaco produce una respuesta inflamatoria sistémica con aumento del estrés oxidativo, disfunción endotelial y desarrollo y progresión de la placa aterosclerótica que predisponen a la enfermedad arterial22.
- B.
Edad
La edad se relaciona tanto con la EPOC como con las ECV. Recientemente algunos autores consideran la EPOC como una patología ligada al envejecimiento precoz y acelerado de los pulmones23. El pulmón de los ancianos tiene muchos cambios fisiológicos estructurales y anatómicos similares a la EPOC. La senescencia celular endotelial, la disminución de la regeneración celular, y las alteraciones de los telómeros son más frecuentes en los pacientes EPOC, especialmente en aquellos con enfisema24.
- C.
Factores de riesgo cardiovascular clásicos
La hipertensión arterial (HTA), la obesidad, la diabetes mellitus tipo 2 (DM2), la dislipemia y el sedentarismo se presentan con más frecuencia en el paciente EPOC que en la población general de la misma edad y sexo. La HTA es el factor de riesgo cardiovascular (FRCV) más frecuente en la EPOC, siendo 1,71 veces más frecuente una vez ajustado por el resto de FRCV (OR 1,71, IC 95% 1,37-2,13)25. Igualmente, la prevalencia de DM2 y síndrome metabólico (SM) es más elevada en los pacientes EPOC, especialmente en aquellos con una enfermedad más severa (1,47, IC 95% 1,09-1,88)26.
- D.
Polución ambiental
La exposición a las partículas ambientales, especialmente las de pequeño tamaño se ha relacionado con un efecto deletéreo sobre pulmón y corazón, aumentando la incidencia de la ECV y exacerbando las lesiones pre-existentes27.
Factores intrínsecos de la EPOC- A.
Inflamación sistémica
La respuesta sistémica inflamatoria de la EPOC es la principal hipótesis que la relaciona con la ECV. Diferentes estudios han demostrado como los biomarcadores de inflamación sistémica se encuentran más elevados en los pacientes con EPOC y ECV concomitante28,29. Biomarcadores como la proteína C reactiva (PCR) y el fibrinógeno, se encuentran aumentados en la EPOC y se relacionan con la severidad de la enfermedad y con un aumento de morbilidad y mortalidad30. Otros marcadores inflamatorios de ECV como la troponina y el pro-BNP también se encuentran elevados, tanto durante la fase estable como durante las exacerbaciones de la enfermedad31.
Las consecuencias de este estado de inflamación crónica subaguda sistémica es la alteración de la estructura arterial, con desarrollo, progresión y en su caso desprendimiento de la placa aterosclerótica, mecanismos principales de la enfermedad coronaria aguda y de la arteriopatía periférica.
- B.
Alteraciones de la función plaquetaria
La agregación y reactividad plaquetaria y la trombocitosis son especialmente relevantes durante las exacerbaciones y en las semanas inmediatamente posteriores. Datos del estudio SUMMIT mostraron como el riesgo de sufrir un evento cardiovascular se multiplica por diez después de una exacerbación (RR 9,9, IC 95% 6,6-14,9)32. Asimismo, la cifra de trombocitosis al ingreso se relaciona con la mortalidad hospitalaria y la mortalidad en el primer año33.
- C.
Disfunción endotelial
El deterioro de la función endotelial es más severo en los pacientes con EPOC en comparación con los pacientes sin EPOC. Esta disfunción endotelial se ha relacionado con una mayor degradación de la elastina pulmonar y arterial34, si bien la causa última no es bien conocida. Se argumenta que puede ser el resultado de una alteración en el balance proteasas/antiproteasas, circunstancia que también se relaciona con la edad. Parece que la disfunción endotelial se correlaciona positivamente con la severidad de la obstrucción, de la inflamación y con las exacerbaciones previas35.
- D.
Hipoxia
La hipoxia, que es una de las principales consecuencias clínicas de la EPOC, potencia la inflamación sistémica, el estrés oxidativo, la producción de células grasas y la adhesión celular al endotelio36, todos ellos factores predisponentes de la ECV. Asimismo, induce el remodelado arterial, la disfunción endotelial pulmonar y la vasoconstricción arterial que aumenta la presión en la circulación pulmonar (HTP) y conduce a la hipertrofia ventricular derecha (HVD) y a la dilatación de la aurícula derecha (HAD). La HAD puede predisponer a arritmias severas mientras que la HVD acaba produciendo IC derecha. Por otro lado, la hipoxia reduce el aporte de oxígeno al miocardio, lo que predispone a la isquemia coronaria y al IAM tipo 2 (por desequilibrio del balance aporte/necesidad de oxígeno).
- E.
Tratamientos farmacológicos de la EPOC
En ocasiones, el tratamiento de la EPOC se ha relacionado con un aumento de las ECV, especialmente la teofilina y los betaadrenérgicos inhalados (tabla 2).
Posibles efectos cardiovasculares de los fármacos utilizados en el tratamiento de la EPOC13 (Adaptada)
| Tratamiento | Efectos respiratorios | Potenciales efectos cardiacos | Evidencia |
|---|---|---|---|
| LABAs | Mejora de la obstrucción al flujo aéreoDisminución de la disneaAumento de la tolerancia al ejercicio | Isquemia miocárdicaArritmiasProlongación del QT | En su conjunto, no han mostrado aumentar el riesgo de eventos cardiacos, si bien pueden inducir arritmias en pacientes con IC establecida por lo que se recomienda individualizar el tratamiento |
| LAMAs | Disminución de la disneaReducción de exacerbacionesAumento de la tolerancia al ejercicio | ArritmiasInfarto agudo de miocardioInsuficiencia cardiaca | En algunos estudios se ha asociado a una mayor incidencia de arritmias y mortalidad, si bien la evidencia es escasa, por lo que se consideran seguros |
| CI + LABAs | Mejora de la obstrucción al flujo aéreoDisminución de la disneaDisminuyen las exacerbacionesMejora de la tolerancia al ejercicio | Los corticoides inhalados pueden empeorar la IC establecida mientras que tienen un efecto protector sobre el IAM | La evidencia sobre el empeoramiento de la IC es insuficiente y se precisan más estudios. |
| Teofilina | Broncodilatador | Arritmias | Predisponen a las arritmias a dosis altas. También inducen latidos ectópicos y taquicardia sinusal a dosis bajas. |
| Roflumilast | Mejora de la función pulmonar | Arritmias (FA) | No existe evidencia de efectos adversos cardiovasculares |
LABAs: agonistas betaadrenérgicos de larga duración; LAMAs: antagonistas muscarínicos de larga duración; IC: corticoide inhalado.
Bien es cierto que la teofilina ha desaparecido prácticamente del tratamiento farmacológico, mientras que los betaadrenérgicos agonistas de acción corta (SABA) y larga (LABA) forman parte del tratamiento de base. La estimulación por parte de los SABA y LABA del sistema adrenérgico podría ser un factor predisponente de arritmias y desencadenante de IC, si bien este efecto se minimiza o es inexistente con los beta2 selectivos24. Los corticoides inhalados por otra parte parece que reducen la mortalidad cardiovascular, si bien se les ha atribuido ser un factor de riesgo de FA y AV37. Sin embargo, globalmente, la evidencia de los estudios muestra que la terapia inhalada del EPOC no tiene un efecto significativo sobre el desarrollo de la ECV y así queda reflejado en la recientemente publicada guía GOLD 202338. Resultados del estudio SUMMIT reflejan como la terapia con LABA con o sin corticoides inhalados, reduce el declinar del FEV1, y la mejora de este se correlaciona con un efecto neutro o positivo sobre la ECV30. Sin embargo, es importante resaltar que la evidencia de los efectos de la terapia inhalatoria de la EPOC sobre la ECV tiene algunas lagunas, dado que en la mayoría de los estudios se excluyeron pacientes con ECV establecida, por lo que es complicado evaluar el efecto de la terapia en estos pacientes, por otro lado, muy comunes en la población con EPOC.
- F.
Infra diagnóstico e infra tratamiento en la ECV de los pacientes con EPOC
La sintomatología de la ECV, en especial la disnea de la IC es con frecuencia difícil de diferenciar de la disnea de la insuficiencia respiratoria, lo que conlleva en muchas ocasiones un infra diagnóstico de la IC y en consecuencia un infra tratamiento. Asimismo, el dolor torácico de la cardiopatía isquémica en el paciente con EPOC es con frecuencia atípico, lo que ocasiona los mismos problemas que en el caso de la IC.
En el terreno de la cardiopatía isquémica establecida, ha existido sobre todo en el pasado, una controversia sobre el uso de los betabloqueadores y su posible efecto deletéreo sobre la función pulmonar, de manera que algunos médicos son/eran reacios a utilizar estos fármacos en los pacientes con EPOC. La evidencia muestra como el uso de los betabloqueadores en el paciente con enfermedad coronaria isquémica y EPOC se asocia a una disminución de 27% de la mortalidad cardiovascular y por todas las causas (RR 0,73, IC 95% 0,60-0,90 y RR 0,77, IC 95% 0,61-0,97, respectivamente)39. En otro estudio, la supervivencia se redujo en 50% en los pacientes EPOC ingresados con un IAM a los que se les pauto betabloqueadores en comparación con aquellos a los que no se les prescribió (RR 0,50, IC 95% 0,36-0,69)1. A pesar de la evidencia incuestionable, estudios observacionales en poblaciones con IAM, muestran una prescripción al alta de betabloqueadores inferior entre 4-30% en los pacientes EPOC en comparación con los pacientes sin EPOC19. Por lo tanto, tanto el infra diagnóstico como el infra tratamiento farmacológico pueden ser una causa de la mayor prevalencia e incidencia de ECV en estos pacientes.
Seguridad cardiovascular de la terapia broncodilatadora de la EPOCEl tratamiento broncodilatador estándar de la EPOC se basa en los betaagonistas inhalados, antimuscarínicos inhalados y corticoides inhalados, bien en monoterapia o en combinación.
Seguridad cardiovascular de los beta2 agonistas en monoterapiaLa evidencia disponible del efecto de los beta2 agonistas de larga duración (LABA) sobre la seguridad cardiovascular no es concluyente. Los beta2 agonistas incrementan la frecuencia cardiaca y los niveles de potasio y en algunos estudios aumentan la incidencia de eventos cardiovasculares, como cardiopatía isquémica y arritmias sobre todo en pacientes con obstrucción severa al flujo aéreo, con IC prexistente y durante las primeras semanas de tratamiento40,41. Por el contrario, en el estudio SUMMIT donde se incluyeron pacientes de alto riesgo cardiovascular, vilanterol no produjo aumento de arritmias o complicaciones cardiacas en comparación con placebo42. Resultados también contradictorios existen para los beta2 de acción corta.
Por otro lado, los beta2 agonistas mejoran la hiperinflación, la función pulmonar y la hipoxia, de manera que pueden beneficiar la hemodinámica cardiaca tanto de las cavidades derechas como del ventrículo izquierdo43.
Seguridad cardiovascular de los antimuscarínicos de larga duración (LAMA)La evidencia sobre el efecto de los LAMA sobre los eventos cardiovasculares tampoco es concluyente. Al inhibir el sistema parasimpático, pueden inducir taquiarritmias44. Estudios de cohortes y metaanálisis no confirman los datos anteriores y consideran seguros los LAMA desde el punto de vista cardiovascular45,46. Un reciente metaanálisis no encuentra aumento de los eventos cardiovasculares con los LAMA, mientras que pueden tener un efecto cardiovascular beneficioso al incrementar el FEV1, disminuir las exacerbaciones y mejorar la hipoxia47.
Seguridad de la terapia broncodilatadora dual- A.
Combinación de LABA y LAMA
La terapia dual es una estrategia frecuente en el paciente EPOC. En principio, al actuar estimulando el sistema simpático e inhibiendo el parasimpático, los posibles efectos adversos cardiovasculares podrían ser sumatorios. Los resultados sobre la seguridad de los LAMA en combinación inicialmente eran discordantes, aunque con una mayoría de estudios que mostraban su seguridad cardiovascular frente a los que sugerían un mayor riesgo48. En un metaanálisis reciente de Zhang, no se encuentra una mayor incidencia de arritmias, ictus, cardiopatía isquémica o IC al utilizar la combinación de LABA y LAMA49, lo cual es congruente con las indicaciones recientes de la guía GOLD 202338. En cualquier caso, son necesarios más estudios diseñados específicamente para valorar la seguridad cardiovascular y, mientras tanto, debe individualizarse el tratamiento, teniendo especial atención en los pacientes con IC previa.
- B.
Corticoides inhalados en monoterapia y en combinación
El análisis post hoc del estudio EUROSCOP mostró como tras un seguimiento de tres años, 800 μg/día de budesonida inhalada reducía la incidencia de cardiopatía isquémica en comparación con placebo en una población con FEV1 de 75% y edad de 52 años de media (3,0 vs. 5,3%; p = 0,048, IC 95% -4,7–-0,0%)50. En el estudio TORCH, la combinación de fluticasona y salmeterol mostró una reducción de 17,7% de la mortalidad por todas las causas en comparación con placebo (0,825, IC 95% 0,681- 1,002; p = 0,052) siendo la mortalidad cardiovascular inferior en el grupo de salmeterol en monoterapia en comparación con la terapia dual y fluticasona sola 51. Posteriormente, el estudio SUMMIT tampoco encontró diferencias en la mortalidad total y mortalidad cardiovascular para la combinación fluticasona/vilanterol frente a placebo52. Con respecto a variables cardiovasculares intermedias, la combinación LABA/corticoide reduce la hiperinsuflación pulmonar y como consecuencia, mejora la función del ventrículo derecho y el volumen de las cavidades izquierdas42,53. En general la combinación de corticoides con LABA no parece aumentar el riesgo cardiovascular, si bien tampoco ha demostrado reducir los eventos cardiovasculares.
Triple terapia y mortalidad cardiovascularLa eficacia y seguridad de la triple terapia LABA/LAMA/CI ha sido evaluada en diversos ensayos clínicos.
El ensayo clínico TRIBUTE54 en pacientes con EPOC severo y muy severo con exacerbaciones previas, no encontró diferencias significativas en la mortalidad total al comparar beclometasona/formoterol/glicopirronio frente a indacaterol/glicopirronio, si bien disminuyeron las exacerbaciones en un 15% en favor de la triple terapia.
El ensayo clínico IMPACT (10,355 pacientes con EPOC con FEV1<50% y exacerbaciones previas), comparó la triple terapia de fluticasona/umeclidinium/vilanterol frente a dos terapias duales CI/LABA o LABA/LAMA. La triple terapia redujo la incidencia de exacerbaciones, las hospitalizaciones relacionadas con el EPOC y en un 28% la mortalidad por todas las causas (RR 0,72, IC 95% 0,53-0,99) en comparación con la terapia dual umeclidinium/vilanterol55. Con respecto a la mortalidad cardiovascular, en el estudio IMPACT no se encontraron beneficios significativos en el grupo fluticasona/umeclidinium/vilanterol frente a la terapia dual56.
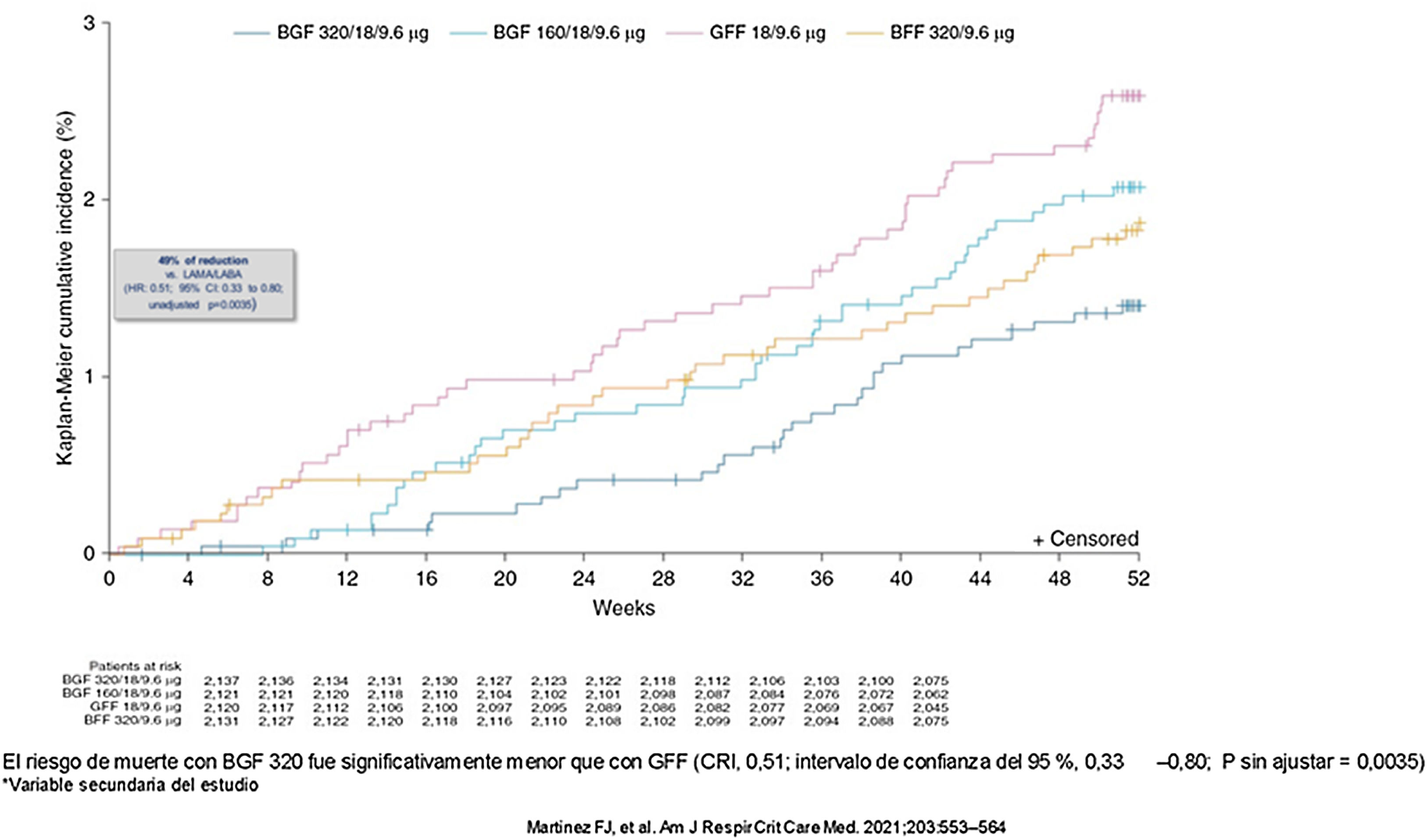
El estudio ETHOS incluyó a 8509 pacientes entre 40-80 años con un FEV1<50% y antecedentes de exacerbaciones con el objetivo de comparar dos dosis de triple terapia de formoterol/glicopirronio/budesonida (320 o 160 μg) frente a dos terapias duales de LAMA/LABA y LABA/CI. El 70% de los pacientes tenía al menos un FRCV. La triple terapia redujo las exacerbaciones en comparación con la terapia dual, siendo mayor en la rama de budesonida 320 μg. En el análisis post hoc que excluía los casos perdidos, la triple terapia con budesonida 320 μg redujo significativamente la mortalidad por todas las causas en un 49% en comparación con la terapia dual LABA/LAMA (RR 0,51, IC 95% 0,33-0,80) y en 28% no estadísticamente significativo con respecto a la terapia CI/LABA y triple terapia con budesonida 160 μg57 (fig. 2). La mortalidad de origen cardiovascular también se redujo en la triple terapia con budesonida 320 μg (0,5%) en comparación con LABA/LAMA (1,4%) y con la triple terapia budesonida 160 μg (0,8%), siendo similar con respecto a la terapia dual LABA/CI (0,5%) (tabla 3).
Mortalidad por todas las causas en el estudio ETHOS57.
Causas de mortalidad en el estudio ETHOS57 (Adaptada)
| BGF 320/18/9,6(n = 2.137) | BGF 160/18/9,6(n = 2.121) | GFF 18/9,6(n = 2.120) | BFF 320/9,6(n = 2.131) | Todos(n = 8.509) | |
|---|---|---|---|---|---|
| Muertes totales | |||||
| Datos originales | 30 (1,4) | 44 (2,1) | 52 (2,5) | 38 (1,8) | 164 (1,9) |
| Datos revisados | 37 (1,7) | 55 (2,6) | 64 (3,0) | 46 (2,2) | 202 (2,4) |
| Muertes adjudicadas | |||||
| Datos originales | 27 (1,3) | 42 (2,0) | 47 (2,2) | 35 (1,6) | 151 (1,8) |
| Datos revisados | 28 (1,3) | 43 (2,0) | 50 (2,4) | 35 (1,6) | 156 (1,8) |
| Cardiovascular | 11 (0,5) | 16 (0,8) | 29 (1,4) | 11 (0,5) | 67 (0,8) |
| Respiratoria | 7 (0,3) | 13 (0,6) | 8 (0,4) | 6 (0,3) | 34 (0,4) |
| EPOC | 5 (0,2) | 7 (0,3) | 5 (0,2) | 5 (0,2) | 22 (0,3) |
| Neumonia | 2 (< 0,1) | 3 (0,1) | 3 (0,1) | 1 (< 0,1) | 9 (< 0,1) |
| Otras | 0 | 3 (0,1) | 0 | 0 | 3 (< 0,1) |
| Cáncer | 2 (< 0,1) | 6 (0,3) | 3 (0,1) | 7 (0,3) | 18 (0,2) |
| Otras | 8 (0,4) | 8 (0,4) | 10 (0,5) | 11 (0,5) | 37 (0,4) |
| Muertes no adjudicadas | |||||
| Datos originales | 3 (0,1) | 2 (< 0,1) | 5 (0,2) | 3 (0,1) | 13 (0,2) |
| Datos revisados | 9 (0,4) | 12 (0,6) | 14 (0,7) | 11 (0,5) | 46 (0,5) |
BFG: budesonida/formoterol/glicopirronio; GFF: glicopirronio/formoterol; BFF: budesonida formoterol.
Unidades de los tratamientos en microgramos. Los datos son valores absolutos y porcentajes (%).
En consecuencia, la actualización de la guía GOLD 2023 incluye la triple terapia como tratamiento eficaz en la reducción de la mortalidad por todas las causas en los pacientes con EPOC sintomático de acuerdo con los resultados de los estudios ETHOS e IMPACT38.
Posibles mecanismos implicados en la reducción de la mortalidad con la triple terapiaLa hiperinsuflación pulmonar es una de las principales consecuencias de la EPOC y tiene un impacto relevante sobre la hemodinámica cardiaca. Tanto la triple terapia como la terapia dual han demostrado mejorar la funcionalidad pulmonar, disminuir el declive del FEV1 y disminuir la hiperinsuflación pulmonar y como consecuencia mejorar los parámetros hemodinámicos cardiacos, lo que indirectamente podría reducir la comorbilidad cardiovascular58.
La triple terapia también mejora la hipoxemia del paciente EPOC, lo que reduce la resistencia vascular del territorio pulmonar, disminuyendo la postcarga del ventrículo derecho y la HAD, así como aumenta el gasto cardiaco59.
En tercer lugar, tanto la terapia dual como la triple terapia han mostrado en diferentes estudios y poblaciones reducir las exacerbaciones. Durante las exacerbaciones moderadas y severas, se produce una activación de la inflamación pulmonar y sistémica, con aumento de los biomarcadores inflamatorios, que a su vez están implicados en el desarrollo y evolución de la aterosclerosis, en las arritmias cardiacas y en la IC.
En cuarto lugar, las complicaciones cardiacas están muy relacionadas con el estado de inflamación sistémica crónica de baja intensidad que supone uno de los principales mecanismos fisiopatológicos de la EPOC. El estado inflamatorio se relaciona más específicamente con la formación, progresión y ruptura de la placa aterosclerótica y por lo tanto con la cardiopatía isquémica y el ictus. La presencia de los corticoides en la triple terapia pude reducir la actividad inflamatoria sistémica y la cascada de biomarcadores aterogénicos. La reducción de la mortalidad cardiovascular en el estudio ETHOS fue superior en la rama de budesonida 320 μg en comparación con budesonida 160 μg (tabla 3)57, lo que sugiere una relación dosis dependiente de los corticoides inhalados, compatible con los resultados del estudio EUROSCOP50.
Finalmente, los estudios con terapia dual LABA + CI no lograron beneficios en términos de mortalidad global y cardiovascular mientras que la triple terapia, en especial el estudio ETHOS, si ha demostrado beneficios en ambas variables. Cabe por ello sugerir que la asociación de los LAMA a la terapia dual LABA + CI puede tener un papel relevante añadido sobre la mortalidad total y cardiovascular, más aun teniendo en cuenta, que su beneficio en monoterapia ya fue demostrado previamente60.
En resumen, como hipótesis, se puede sugerir que la triple terapia de budesonida 320 μg /glucopirronio/formoterol produce un beneficio en la mortalidad cardiovascular como consecuencia de mejorar la hemodinámica cardiaca al reducir la hiperinsuflación y la hipoxia y disminuir la actividad inflamatoria sistémica tanto crónica como la aguda durante las exacerbaciones.
Tratamiento de la comorbilidad cardiovascular en la EPOCBetabloqueadoresLa utilización de los betabloqueadores (BB) en la EPOC siempre ha sido un tema controvertido, a pesar de que, desde hace tiempo, las guías de IC recomiendan su utilización independientemente de la presencia de la enfermedad. Los beta2 agonistas inhalados estimulan los receptores de la pared bronquial produciendo broncodilatación, que podría ser revertida por los betabloqueadores no selectivos como el propanolol. Existe abundante evidencia de que esto no ocurre con los beta1 selectivos como bisoprolol, carvedilol, metropolol o atenolol, que tienen una afinidad 20 veces mayor por los receptores beta1 en comparación con los beta2. Más aún, el bloqueo de los receptores beta1 podría aumentar la expresión y sensibilidad de los receptores beta2 convirtiendo el efecto de los BB y los beta2 agonistas en sinérgico61. Una revisión sistemática pone de manifiesto como la utilización de los BB selectivos en presencia de obstrucción al flujo aéreo, no produce un aumento de las exacerbaciones, no empeora el FEV1 ni la CVF, no aumenta la disnea ni produce otros efectos adversos respiratorios62, y, por otro lado, su utilización se asocia a importantes beneficios cardiovasculares también en los pacientes con EPOC, reduciendo la mortalidad, los ingresos hospitalarios, las exacerbaciones y no aumentando la mortalidad peri hospitalaria63,64.
Inhibidores del sistema renina angiotensina aldosterona (SRAA)Los SRAA intervienen en la etiopatogenia de la EPOC por medio de mecanismos como la actividad proinflamatoria y la fibrosis pulmonar. Datos del Multi Ethnic Study of Atherosclerosis que incluyó pacientes entre 45 y 84 años sin ECV sugieren que el bloqueo del SRAA a altas dosis protege de la evolución del enfisema65. Existe el inconveniente de que los inhibidores de la enzima de conversión (IECAS) inducen tos con frecuencia, por lo que en otro estudio se les ha asociado a un aumento de la obstrucción al flujo aéreo66. En consecuencia, aunque parece que pudieran tener un efecto beneficioso en la EPOC, debe individualizarse su uso y seleccionar preferentemente los antagonistas de receptor AT2. Recientemente se ha publicado un subanálisis del estudio PARADIGM-HF en el que se demuestra que el beneficio de sacubitrilo valsartán frente a enalapril es similar en los pacientes con EPOC y sin EPOC, por lo que los pacientes con EPOC pueden beneficiarse de este bloqueo dual del SRAA67.
EstatinasLos posibles beneficios de las estatinas en el paciente con EPOC son controvertidos a la luz de la evidencia existente, si bien parecen ser seguras y no afectar negativamente la función pulmonar. Algunos estudios muestran como el uso de estatinas se asocia a una disminución de la mortalidad a largo plazo en pacientes EPOC en comparación con aquellos que no las usaron, mientras que otros estudios sugieren una reducción de la obstrucción al flujo aéreo y un enlentecimiento del declive del FEV168,69. En un estudio en pacientes con comorbilidad de IC, no mostraron beneficios en términos de morbimortalidad70. En cualquier caso, las estatinas tienen efecto antiinflamatorio que podría ser beneficioso en la EPOC, y tienen indicaciones claras e inequívocas en la comorbilidad cardiovascular, sobre todo aterosclerótica.
AntiagregantesLa trombocitosis y las alteraciones de la funcionalidad plaquetaria están presentes en la EPOC, especialmente durante las exacerbaciones moderadas y severas y constituyen un factor de riesgo de aterotrombosis, ictus y cardiopatía isquémica. Aunque la evidencia no es concluyente, en dos estudios parece observarse una reducción de la mortalidad en los pacientes con EPOC33,71.
Otros fármacos usados en la comorbilidad cardiovascularLos antagonistas del receptor mineralocorticoide (ARM) son fármacos de primera elección en los pacientes con IC y fracción de eyección reducida, comorbilidad frecuente en el paciente EPOC. Un análisis conjunto de los estudios RALES (espironolactona) y EMPHASIS-HF (eplerenona) pone de manifiesto que los beneficios de los ARM frente a placebo sobre la variable principal de mortalidad cardiovascular y hospitalización por IC son consistentes entre los pacientes con EPOC y sin EPOC (RR de 0,66 y 0,65, p de interacción 0,93)72.
Otros fármacos de primera línea en el tratamiento de la IC recientemente introducidos son los inhibidores del receptor SGLT2 (iSGLT2). Un reciente metaanálisis que incluye 1.292 pacientes con COPD muestra como los iSLT2 en comparación con placebo reducen un 28% la variable combinada de mortalidad cardiovascular y hospitalización por IC (RR = 0,72, IC 95% 0,60-0,86)73. En cuanto a la seguridad, otro metaanálisis que analiza 86 efectos adversos cardiovasculares y 58 efectos adversos respiratorios demuestra como los iSGLT2 frente a placebo reducen la incidencia de seis efectos adversos respiratorios, entre ellos la EPOC (RR 0,77, IC 95% 0,62-0,96) sin encontrar diferencias en los 52 restantes74.
Los diuréticos son utilizados en el tratamiento de la IC sintomática. Si bien la evidencia no es abundante, las tiazidas no aumentan las exacerbaciones ni complicaciones respiratorias en el paciente con EPOC mientras que la evidencia sobre los diuréticos de asa es menos concluyente75. Por ello, el uso de diuréticos debe ser individualizado, teniendo en cuenta que el uso de dosis elevadas puede reducir la hidratación y dificultar la expulsión de las secreciones bronquiales.
Finalmente, el estado protrombótico y procoagulante es frecuente en los pacientes con EPOC y en algunos fenotipos en particular. Por ello, además de los antiagregantes, los anticoagulantes pueden jugar un papel relevante todavía no bien definido. Una revisión reciente sobre el efecto de los anticoagulantes en los pacientes con EPOC sugiere que pueden reducir la mortalidad sin aumentar el riesgo de sangrado mayor en estos pacientes76.
En conclusión, la asociación de la patología cardiovascular en el paciente EPOC se basa en el nexo común del eje cardiopulmonar. La comorbilidad cardiovascular es muy frecuente en el paciente con EPOC e incrementa notablemente el riesgo de mortalidad y hospitalización en estos pacientes; Incluso, las complicaciones cardiovasculares y la IC en particular, son la principal causa de segundos ingresos por encima de las causas respiratorias. Por ello, reducir las exacerbaciones utilizando de forma precoz e intensiva la triple terapia puede ser la terapia más eficaz para reducir la mortalidad y morbilidad asociada al eje cardiopulmonar. Asimismo, es muy importante el tratamiento intensivo de la comorbilidad cardiovascular en el paciente EPOC, ya que la mayor parte de los fármacos cardiovasculares han demostrado ser seguros y en muchos casos reducir la incidencia de eventos cardiovasculares.
Consideraciones éticasAl tratarse de una revisión, no existe investigación en seres humanos.
FinanciaciónEl presente trabajo no ha recibido ningún tipo de financiación pública o privada.
Conflicto de interesesEl autor declara haber recibido honorarios como consultor o ponente en los últimos cinco años para Astra Zeneca, Boheringer Ingelheim, Casen-Recordati, Daiichi Sankyo, Glaxo, Lilly, Novo Nordisk, Sanofi, Viatris.