Actualmente la conmoción cerebral se considera un problema de gran magnitud, siendo los adolescentes y jóvenes la población de riesgo, ya que se encuentran en proceso de maduración. Nuestro objetivo ha sido comparar la eficacia de diferentes intervenciones (ejercicio físico terapéutico, terapia vestibular y descanso) en adolescentes y jóvenes con conmoción cerebral.
DesarrolloSe realizó una búsqueda bibliográfica en las principales bases de datos. Una vez aplicados los criterios de inclusión/exclusión y la escala metodológica Physiotherapy Evidence Database PEDro, fueron revisados seis artículos. Los resultados apoyan la utilización del ejercicio y la terapia vestibular en las etapas iniciales para disminuir los síntomas posconmoción. Según la mayoría de los autores, el ejercicio físico terapéutico y la terapia vestibular reportan mayores beneficios, aunque se necesitaría un protocolo que unificara escalas de valoración, variables de estudio y parámetros de análisis para poder realizar la inferencia en la población diana.
ConclusiónDesde el momento del alta hospitalaria del paciente, la aplicación combinada de ejercicio físico y terapia vestibular, podría considerarse como la mejor opción para disminuir los síntomas posconmoción.
Currently, concussion considers a problem of great magnitude, adolescents and young people being the population at risk, since it is in the process of maturation. Our goal has been to compare the effectiveness of different interventions (exercise therapy, vestibular rehabilitation and rest) in adolescents and young people with concussion.
DevelopmentA bibliographic search was carried out in the main databases. Once the inclusion / exclusion criteria and the PEDro methodological scale were applied, 6 articles were reviewed. The results support the use of exercise and vestibular rehabilitation in the initial stages to reduce post-concussion symptoms. According to most authors, therapeutic physical exercise and vestibular rehabilitation report greater benefits, although a protocol that unifies assessment scales, study variables and analysis parameters would be needed to be able to make the inference in the target population.
ConclusiónFrom the moment of hospital discharge, the combined application of exercise and vestibular rehabilitation could be the best option to reduce post-concussion symptoms.
El traumatismo craneoencefálico (TCE) es una patología que engloba una lesión primaria debido a las fuerzas mecánicas que actúan durante el impacto, y una lesión secundaria como consecuencia de los cambios fisiológicos y biomoleculares producidos durante la isquemia cerebral y la hipertensión cerebral1–3.
Dentro del TCE, encontramos el TCE leve que corresponde a la lesión más aguda del cerebro provocada por una fuerza externa que impide desarrollar la vida del sujeto en condiciones normales en su área social, psicológica y física4,5.
La conmoción cerebral es una alteración fisiopatológica del cerebro causada por una fuerza impulsiva transmitida a la cabeza que resulta en un deterioro de corta duración de la función neuronal y sin lesión estructural en los estudios de neuroimagen6–8.
Según el Centro de Control y Prevención de Enfermedades, las causas más comunes de lesión son provocadas por las caídas entre los menores de 15 años y mayores de 65 años9.
En la conmoción cerebral se puede percibir una gran variedad de síntomas, entre los más importantes se encuentran la pérdida de conciencia tras la lesión y el dolor de cabeza8,10. Broglio et al. describen la aparición de mareos como un predictor de mayor tiempo de recuperación11.
Entre los deportes con más incidencia de conmociones cerebrales en el género masculino se encuentran el fútbol americano, el hockey sobre hielo y el lacrosse (semejante al béisbol), mientras que en las mujeres es más frecuente que se presente en hockey sobre hielo, fútbol y baloncesto12,13.
El TCE es una de las patologías más conocidas y de mayor impacto a nivel mundial, afectando a millones de personas de diferentes edades cada año. Es considerado como una de las lesiones discapacitantes más complejas, presentando un 15,7% de la pérdida de funcionalidad en el individuo y hasta 14 veces más limitante que una lesión medular14.
A nivel mundial se estima que el 80-90% de las conmociones son resueltas entre siete y 10 días, sin embargo, en poblaciones especiales como niños y adolescentes, este proceso de recuperación podría ser más largo7,15. Este problema de salud ha generado programas de concienciación, mientras que en España aún no es conocida su existencia8,16–18.
Diagnóstico y tratamientoEl criterio diagnóstico en los 10 últimos años ha supuesto un gran avance en este campo. Desde sus inicios, el TCE se definía como «lesión craneal» y provocaba la utilización de un amplio espectro diagnóstico. Aun así, la introducción del término TCE no ha servido para conceptualizar la patología de manera más precisa, pero es cierto, que ha sido de gran ayuda en el ámbito epidemiológico, del tratamiento y de la investigación. Con la aparición de los grados de lesión, comienza a utilizarse el concepto TCE leve. El diagnóstico del TCE leve utilizado universalmente se basa de manera fundamental en la aparición de signos y síntomas durante el impacto de una fuerza externa en la cabeza, provocando modificaciones en la función del cerebro. Sin embargo, el TCE leve está suponiendo un reto debido a su infradiagnóstico, el cual abarca e incluye con el tiempo, más criterios evaluativos19,20. Mayer et al. describen en su estudio el diagnóstico ideal del TCE leve y sus distintos estados (Figura A.1. y Figura A.2)20.
En la figura A.1 se muestra el diagnóstico actual del TCE leve. La conmoción cerebral (Cnc, color cian) es la forma más leve de lesión y abarca todos los tipos de diagnóstico. La forma simple de TCE leve (smTBI, color verde) se encuentra dentro del diagnóstico de conmoción cerebral, aunque no se evidencia sus criterios diagnósticos. La forma complicada de TCE leve (cmTBI, color rojo, naranja y morado) se representa como un diagnóstico de imagen positivo. Las lesiones repetidas de la cabeza (RHI, color amarillo, naranja y azul) se pueden presentar en cualquiera de los diagnósticos anteriores. Las subconmociones (Cncsub, color blanco) no se recogen en el diagnóstico y son especulativos. Los síntomas prolongados de la posconmoción (PPCS) se asocian a los diagnósticos agudos y a trastornos leves o mayores. Las probables encefalopatías crónicas (pCTE) suceden después de la smTBI. PPCS y pCTE se presentan en los tres meses posteriores al diagnóstico agudo.
En la figura A.2 se muestra el diagnóstico del TCE leve desde el estadio agudo al estadio crónico. El esquema de color utilizado es igual al de la figura A.1. Además, el diagnóstico propone términos individualizados en vez de combinarlos, y los define a través de biomarcadores específicos y objetivos, representados con flechas verticales de distinto color, aunque sólo exista para el cmTBI. Se distinguen entre los biomarcadores la Y para sí, S para algunos o N para ninguno.
En términos generales, el protocolo que se lleva a cabo cuando un individuo sufre una conmoción siempre comienza por el descanso tanto físico como cognitivo hasta que desaparezcan los síntomas. Desde el primer día de la lesión, se aplica la escala de síntomas posconmoción Posconcussion Symptom Scale Score (PCSS) (Tabla A.1., Apéndice A). Una vez hayan pasado 48 horas o no se remitan síntomas, se inicia un protocolo de vuelta a la actividad física (Tabla A.2, Apéndice A)21. En torno al ejercicio físico terapéutico no se describe ningún parámetro estándar22. No obstante, la terapia vestibular se considera un tratamiento novedoso para tratar déficits vestibulares, aunque con limitaciones con base en evidencias que la respalden23–25. Por otro lado, el descanso es considerado el tratamiento de primera línea pese a no evidenciarse sus efectos26–28.
Justificación del estudioLa conmoción cerebral y el TCE leve son dos términos utilizados por numerosos autores como sinónimos para representar el grado más leve de un TCE cuando se produce un impacto en la cabeza29. Debido a la controversia que genera esta terminología científica, en nuestro estudio utilizaremos ambos conceptos como idénticos.
Los datos epidemiológicos con los que cuentan los investigadores a nivel mundial son escasos, aunque ya, Estados Unidos ha informado de la magnitud de este gran problema de salud al que se enfrenta el sistema de salud y la comunidad científica30.
Por otra parte, la población adolescente y juvenil presentan mayores riesgos de padecerla (siendo la práctica del deporte cada día más en auge, uno de esos factores), e incluso que su proceso de recuperación sea mucho mayor, ya que fisiológicamente se encuentran en un proceso de maduración31. Además, el abordaje en urgencias, de estos pacientes, está resultando deficiente informándose de la persistencia de síntomas en uno de cada tres individuos32.
El propósito de esta revisión ha sido analizar y comparar las intervenciones como el ejercicio físico terapéutico, la terapia vestibular y el descanso sobre los síntomas que presentan los adolescentes y jóvenes con conmoción cerebral e intentar dilucidar la/s intervención/es que más beneficios pueden reportar.
Material y métodosDiseñoEn el diseño de este trabajo se ha utilizado la estrategia PICO (Tabla B.1), para la construcción de la pregunta de investigación y la elección de la mejor evidencia científica en la selección de artículos33,34.
Pregunta de investigación: ¿Qué beneficios reporta el ejercicio físico terapéutico en la recuperación y mejora de los síntomas de la posconmoción en adolescentes/jóvenes en comparación a las terapias de descanso/reposo y rehabilitación vestibular?
Estrategia de búsquedaSe realizó una búsqueda electrónica en las bases de datos: Cochrane Library, PubMed, Web of Science (WOS), SPORTDiscus, CINAHL, LILACS, PEDro, Dialnet, Scopus y ENFISPO.
Los términos empleados, incluidos en el Descriptor de Ciencias de la Salud (DeCS) y en tesauro Medical Subject Headings (MeSH), fueron los siguientes:
(Brain concussion OR Mild Traumatic Brain Injury) AND (Adolescent OR Young Adult) AND (Exercise Therapy OR Rest OR Vestibular Rehabilitation). Límites: Clinical Trial, Review. Las búsquedas fueron realizadas hasta el 15 de diciembre del 2017.
El resultado del proceso de búsqueda permitió seleccionar seis artículos. La figura B.1. muestra el diagrama de flujo según Prisma35.
Selección de los estudiosSe incluyeron ensayos clínicos aleatorizados publicados entre 01 de enero de 2010 y 01 de octubre de 2018, en inglés o en español, llevados a cabo en población adolescente y joven entre 13 y 25 años, con conmoción cerebral o TCE leve. La calidad metodológica de los estudios se analizó según la escala PEDro y solo se incluyeron aquellos que superaron una puntuación mínima de 6.
Como criterios de exclusión, se descartaron todos aquellos artículos en las que las intervenciones fueron distintas a ejercicio físico terapéutico, terapia vestibular y descanso.
También quedaron excluidos aquellos trabajos realizados sobre poblaciones con edades superiores a 25 años.
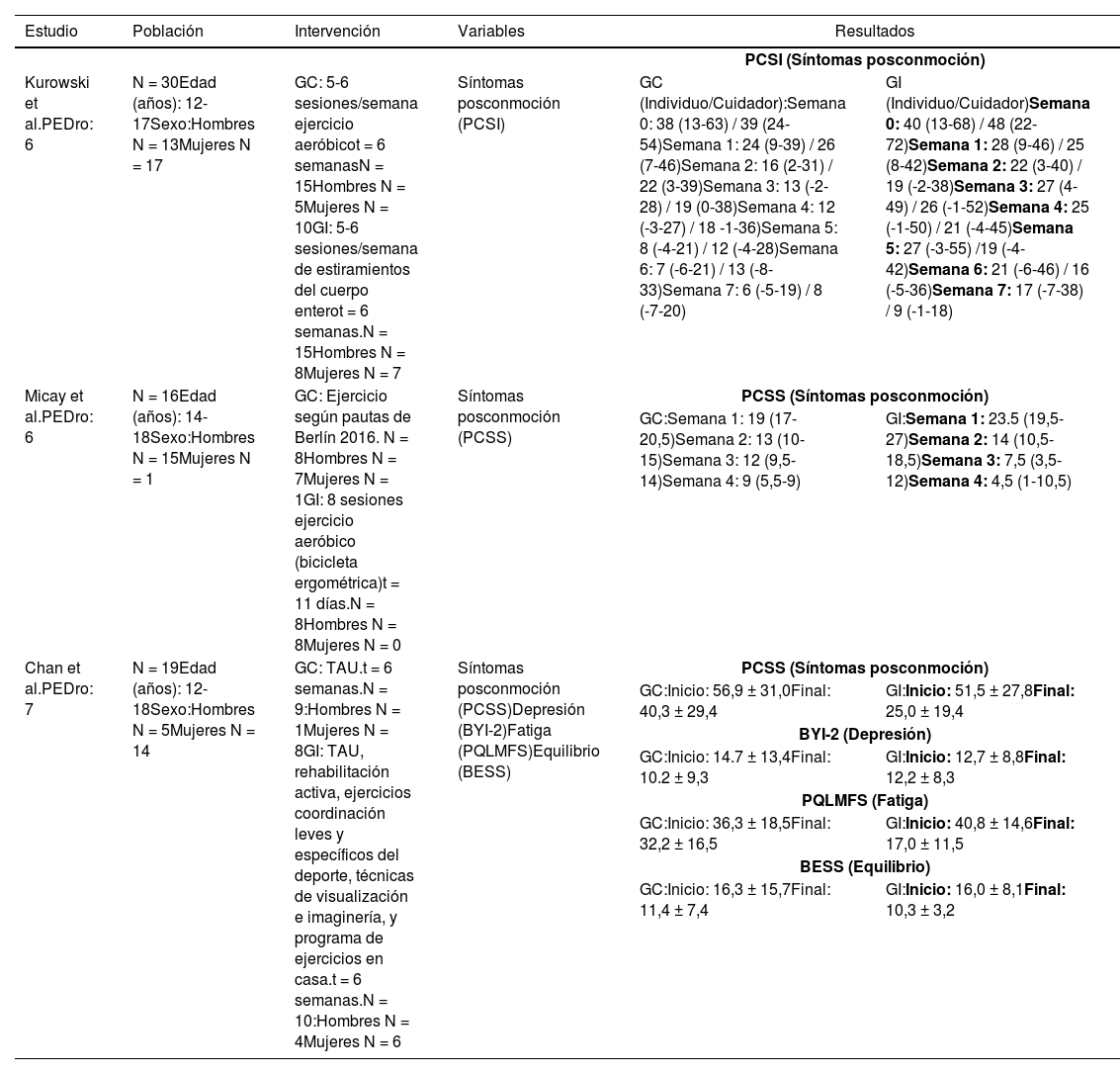
Síntesis de resultadosEjercicio físico terapéuticoEn el estudio de Kurowski et al.36, el grupo control realizó ejercicio aeróbico en bicicleta ergométrica y practicado en casa, donde fue medido al 80% de la primera prueba evaluativa en la que apareció la exacerbación de los síntomas. Mientras que al grupo intervención, se le practicó un programa de estiramientos de cuerpo entero rotados durante dos semanas. A los cuidadores se les pidió que recogiesen los síntomas posconmoción mediante la escala PCSS.
Analizando la variable, síntomas posconmoción (tabla C.1) se demostró una disminución significativa (F = 4,11, p = 0,044) en el grupo control con respecto al grupo intervención en lo que se refiere a los síntomas posconmoción informados por el sujeto, en comparación con los resultados recogidos por los cuidadores durante dicha intervención que no reportaron ser estadísticamente significativos (F = 0,17, p = 0,68).
Resumen de resultados de los artículos relacionados con el ejercicio físico terapéutico
| Estudio | Población | Intervención | Variables | Resultados | |
|---|---|---|---|---|---|
| PCSI (Síntomas posconmoción) | |||||
| Kurowski et al.PEDro: 6 | N = 30Edad (años): 12-17Sexo:Hombres N = 13Mujeres N = 17 | GC: 5-6 sesiones/semana ejercicio aeróbicot = 6 semanasN = 15Hombres N = 5Mujeres N = 10GI: 5-6 sesiones/semana de estiramientos del cuerpo enterot = 6 semanas.N = 15Hombres N = 8Mujeres N = 7 | Síntomas posconmoción (PCSI) | GC (Individuo/Cuidador):Semana 0: 38 (13-63) / 39 (24-54)Semana 1: 24 (9-39) / 26 (7-46)Semana 2: 16 (2-31) / 22 (3-39)Semana 3: 13 (-2-28) / 19 (0-38)Semana 4: 12 (-3-27) / 18 -1-36)Semana 5: 8 (-4-21) / 12 (-4-28)Semana 6: 7 (-6-21) / 13 (-8-33)Semana 7: 6 (-5-19) / 8 (-7-20) | GI (Individuo/Cuidador)Semana 0: 40 (13-68) / 48 (22-72)Semana 1: 28 (9-46) / 25 (8-42)Semana 2: 22 (3-40) / 19 (-2-38)Semana 3: 27 (4-49) / 26 (-1-52)Semana 4: 25 (-1-50) / 21 (-4-45)Semana 5: 27 (-3-55) /19 (-4-42)Semana 6: 21 (-6-46) / 16 (-5-36)Semana 7: 17 (-7-38) / 9 (-1-18) |
| Micay et al.PEDro: 6 | N = 16Edad (años): 14-18Sexo:Hombres N = 15Mujeres N = 1 | GC: Ejercicio según pautas de Berlín 2016. N = 8Hombres N = 7Mujeres N = 1GI: 8 sesiones ejercicio aeróbico (bicicleta ergométrica)t = 11 días.N = 8Hombres N = 8Mujeres N = 0 | Síntomas posconmoción (PCSS) | PCSS (Síntomas posconmoción) | |
| GC:Semana 1: 19 (17-20,5)Semana 2: 13 (10-15)Semana 3: 12 (9,5-14)Semana 4: 9 (5,5-9) | GI:Semana 1: 23.5 (19,5-27)Semana 2: 14 (10,5-18,5)Semana 3: 7,5 (3,5-12)Semana 4: 4,5 (1-10,5) | ||||
| Chan et al.PEDro: 7 | N = 19Edad (años): 12-18Sexo:Hombres N = 5Mujeres N = 14 | GC: TAU.t = 6 semanas.N = 9:Hombres N = 1Mujeres N = 8GI: TAU, rehabilitación activa, ejercicios coordinación leves y específicos del deporte, técnicas de visualización e imaginería, y programa de ejercicios en casa.t = 6 semanas.N = 10:Hombres N = 4Mujeres N = 6 | Síntomas posconmoción (PCSS)Depresión (BYI-2)Fatiga (PQLMFS)Equilibrio (BESS) | PCSS (Síntomas posconmoción) | |
| GC:Inicio: 56,9 ± 31,0Final: 40,3 ± 29,4 | GI:Inicio: 51,5 ± 27,8Final: 25,0 ± 19,4 | ||||
| BYI-2 (Depresión) | |||||
| GC:Inicio: 14.7 ± 13,4Final: 10.2 ± 9,3 | GI:Inicio: 12,7 ± 8,8Final: 12,2 ± 8,3 | ||||
| PQLMFS (Fatiga) | |||||
| GC:Inicio: 36,3 ± 18,5Final: 32,2 ± 16,5 | GI:Inicio: 40,8 ± 14,6Final: 17,0 ± 11,5 | ||||
| BESS (Equilibrio) | |||||
| GC:Inicio: 16,3 ± 15,7Final: 11,4 ± 7,4 | GI:Inicio: 16,0 ± 8,1Final: 10,3 ± 3,2 | ||||
PCSI: Post-Concussion Symptom Inventory; GC: Grupo Control; GI: Grupo Intervención; PCSS: Post-Concussion Symptom Scale; TAU: Una sesión de terapia ocupacional, y una consulta al maestro afiliado al hospital y al fisiatra; BYI-2: Beck Youth Inventories Second Edition; PQLMFS: Pediatric Quality of Life Multidimensional Fatigue Scale; BESS: Balance Error Scoring System.
En la investigación llevada a cabo por Micay et al.37, el grupo control realizó una intervención centrada en la realización de ejercicio progresivo según las pautas de Berlín (fase 1: no actividad, fase 2: leve ejercicio aeróbico, fase 3: ejercicio del deporte específico, fase 4: ejercicios de entrenamiento sin contacto, fase 5: práctica de ejercicio con contacto y fase 6: vuelta al deporte). El grupo intervención llevó a cabo un tratamiento basado en ocho sesiones de ejercicio aeróbico en bicicleta ergométrica durante 11 días, cuya primera sesión de 10 minutos se realizó al 50% del ritmo cardíaco del sujeto, mientras que las siguientes siete sesiones de 20 minutos tenían la finalidad de aumentar en un 5% el ritmo cardíaco inicial del sujeto con la intensidad del ejercicio. La variable síntomas posconmoción, evidenció una disminución significativa del tiempo de recuperación del grupo intervención (t(7) = 7,8, p < 0,01), con respecto al grupo control (t(6) = 2,5, p < 0,05) (tabla C.1).
En el trabajo de Chan et al.38, todos los individuos que participaron en el estudio, recibieron una sesión de terapia ocupacional y una consulta al médico afiliado al hospital y al fisiatra (tau), previo al proceso de aleatorización y distribución en grupos control o intervención, posteriormente el grupo intervención realizó bicicleta o cinta ergométrica al 60% de la capacidad máxima aeróbica durante un máximo de 15 minutos, ejercicios de coordinación leves y específicos del deporte durante 10 minutos, técnicas de visualización e imaginería motora, y un programa de ejercicios para casa postratamiento.
Los resultados obtenidos para la variable síntomas posconmoción, demostraron una reducción estadísticamente significativa en el grupo de intervención en comparación al grupo control.
Las variables depresión, fatiga y equilibrio fueron evaluadas mediante las escalas Beck Youth Inventories Second Edition (BYI-2), Pediatric Quiality of Life Multidimensional Fatigue Scale (PQLMFS), y Balance Error Scoring Scale (BESS), respectivamente los resultados fueron recogidos con fines exploratorios y descriptivos, mostrando un mínimo cambio en el grupo intervención (tabla C.1. continuación).
Terapia vestibularEn el estudio de Schneider et al.39, al grupo control y al grupo intervención se les entrenó con ejercicios de rango de movimiento no provocativos, estiramientos, educación postural, y reposo hasta ausencia de síntomas seguido de esfuerzo gradual. Además, al grupo intervención se les realizó fisioterapia de columna cervical basada en terapia manual de la columna cervical y torácica (técnicas de movilización articular), ejercicios terapéuticos que consisten en el reentrenamiento neuromotor cervical (flexor craneovertebral y reentrenamiento extensor) y reeducación sensoriomotora, así como terapia vestibular individualizada centrada en: un programa individualizado de habituación, estabilización de la mirada, ejercicios de adaptación, ejercicios de equilibrio dinámico y de pie, y maniobras de reposicionamiento del canal.
De acuerdo con las variables seleccionadas (tabla C.2) los resultados del grupo intervención muestran una mejoría con respecto al grupo control en todas las variables (χ2 = 13,08, p < 0,001).
Resumen de resultados de los artículos relacionados con terapia vestibular
| Estudio | Población | Intervención | Variables | Resultados | |
|---|---|---|---|---|---|
| Autor: Schneider et alPEDro: 8 | N = 31Edad (años): 12-30Sexo:Hombres N = 18Mujeres N = 13 | GC: Ejercicios de rango de movimiento no provocativos, estiramientos, educación postural, y reposo hasta ausencia de síntomas, seguido de esfuerzo gradualt = 8 semanasN = 16:Hombres N = 7Mujeres N = 9GI: Ejercicios de rango de movimiento no provocativos, estiramientos, educación postural, reposo hasta ausencia de síntomas, seguido de esfuerzo gradual, y rehabilitación de columna cervical y terapia vestibular individualizadat = 8 semanasN = 15:Hombres N = 11Mujeres N = 4 | Intensidad del dolor (NPRS)Equilibrio (ABC)Mareo (DHI)Conmoción cerebral (SCAT2) | NPRS (Intensidad del dolor) | |
| GC:Inicio:Dolor de cuello: 3 (0–9)Dolor de cabeza: 4 (0–9)Mareo: 5 (0–8)Final (N1 = 1 / N2 = 12):Dolor de cuello: −4 / −1,5 (−8, 3)Dolor de cabeza: −7 / −2,5 (−7, 1)Mareo: −5 / −1,5 (−6, 0) | GI:Inicio:Dolor de cuello: 3 (0–7)Dolor de cabeza: 4 (0–8)Mareo: 3 (0–8)Final (N1 = 11 / N2 = 4):Dolor de cuello: −3 (−5, 0) / −1 (−5, 0)Dolor de cabeza: −3 (−8, 0) / −2,5 (−4, 0)Mareo: −2 (−7, 0) / −1 (−4, 1) | ||||
| ABC (Equilibrio) | |||||
| GC:Inicio: 85% (45–100)Final (N1 = 1 / N2 = 12): 30 / 12,75 (0, 55) | GI:Inicio: 80% (40–95)Final (N1 = 11 / N2 = 4): 8 (0, 52) / 19,5 (−6, 43,5) | ||||
| DHI (Mareo) | |||||
| GC:Inicio: 42 (0–66)Final (N1 = 1 / N2 = 12): −48 / −21 (−58, 2) | GI:Inicio: 46 (6–84)Final (N1 = 11 / N2 = 4): −24 (−50, −6) / −13 (−16, −8) | ||||
| SCAT2 (Conmoción cerebral) | |||||
| GC:Inicio: 70 (47–92)Final (N1 = 1 / N2 = 12): 26 / 12 (−5, 42) | GI:Inicio: 71 (52–96)Final (N1 = 11 / N2 = 4): 18 (10, 30) / 8,5 (−9, 11) | ||||
| Autor: Reneker et al.PEDro: 7 | N = 41Edad (años): 10-23Sexo:Hombres N = 25Mujeres N = 16 | GC: Simulación de técnicas mínimamente progresivas, ejercicios de columna cervical y ejercicios de cancelación del reflejo vestibuloocular.t = 14 meses.N = 19:Hombres N = 11Mujeres N = 8GI: Rehabilitación vestibular, control oculomotor y neuromotor, ejercicios de equilibrio y en casa (con su educación).t = 14 meses.N = 22:Hombres N = 14Mujeres N = 8 | Síntomas posconmoción (PCSS) | PCSS (Síntomas posconmoción) | |
| Día 0GC: Muy alto (21-43: 39,2)GI: Muy alto (21-43: 39,2) | Recuperación (≤ 9)GC: Día 17GI: Día 13,5 | ||||
NPRS: Numeric Pain Rating Scale; ABC: Activities-specific Balance Confidence Scale; DHI: Dizziness Handicap Index; SCAT2: Sport Concussion Assessment Tool 2; N1: Reciben alta médica; N2: No reciben alta médica.
Reneker et al.40 dividieron la muestra de estudio en un grupo control sobre el que desarrolló una intervención basada en técnicas simuladas, terapéuticas, no terapéuticas y no progresivas hasta técnicas terapéuticas mínimamente progresivas, ejercicios isométricos cervicales, de rango de movimiento suaves para la columna cervical y de cancelación del reflejo vestibuloocular, y un grupo intervención que llevaron a cabo un protocolo de rehabilitación vestibular (incluye habituación y adaptación), control oculomotor y neuromotor (incluye conciencia propioceptiva y cinestésica), y ejercicios de equilibrio y en casa, además de su posterior educación. Si presentaban disfunción cervical se les trataba con liberación de tejidos blandos, movilizaciones y/o manipulaciones con thrust.
En la tabla C.2. continuación se evidencia cómo aparece una disminución significativa en la variable recuperación sintomática en el grupo intervención con respecto al grupo control (log-rank = 0,13).
En estos estudios cabe destacar que la variable síntomas posconmoción fue analizada en las escalas Sport Concussion Assesment Tool 2 (SCAT2)39 (esta escala recoge un apartado de síntomas idéntico a la escala PCSS) y PCSS40, reportando una disminución de la sintomatología de la conmoción cerebral. Para las variables intensidad del dolor, mareo y equilibrio, Schneider et al.39 las recoge en las escalas Numeric Pain Rating Scale (NPRS), Dizziness Handicap Index (DHI), y Activities-specific Balance Confidence Scale (ABC), demostrando beneficios encontrados cada una de ellas en el grupo intervención.
DescansoEn el ensayo de Thomas et al.41, los sujetos fueron divididos en grupo control, cuya intervención comprendió uno o dos días de descanso, y en grupo intervención, basado en cinco días de descanso. Ambos grupos recibieron las instrucciones con las pautas a seguir del plan de cuidado Ace-Emergency Departement (ACE-ED), que consistió en un periodo de descanso y remisión de los síntomas en este periodo para centrar la vuelta gradual al colegio y al ejercicio físico, entendiendo este de forma estructurada. Se comenzaba con ejercicio aeróbico en bicicleta ergométrica o corriendo para aumentar el ritmo cardíaco durante 10 o 15 minutos, seguido de actividades específicas del deporte sin contacto, ejercicios con progresión sin contacto, ejercicios con contacto, y por último, vuelta al deporte. Las variables de interés fueron síntomas posconmoción, y equilibrio. Para las variables indicadas, los autores no encontraron diferencias significativas entre los grupos de comparación (tabla C.3).
Resumen resultados de los artículos relacionados con descanso
| Estudio | Población | Intervención | Variables | Resultados | |
|---|---|---|---|---|---|
| Thomas et alPEDro: 7 | N = 99Edad (años): 11-22Sexo:Hombres N = 65Mujeres N = 34 | GC (cuidado común): 1 o 2 días de descanso, y tras descanso, vuelta al colegio, y vuelta gradual a la actividad físicat = 10 díasN = 50:Hombres N = 32Mujeres N = 18GI (descanso estricto): 5 días descanso, tras descanso, vuelta al colegio y vuelta gradual a la actividad físicat = 10 díasN = 49:Hombres N = 33Mujeres N = 16 | Síntomas postconmoción (PCSS)Equilibrio (BESS) | PCSS (Síntomas posconmoción) | |
| GC:Día 3: 17 (11-24)Día 10: 8 (4-12) | GI:Día 3: 24 (17-30)Día 10: 12.5 (8-17) | ||||
| BESS (Equilibrio) | |||||
| GC:Día 0*: 8.4 (6.6–10.2)Día 3: 22.4 (18.8–25.9)Día 10: 19 (15.9–22.1) | GI:Día 0*: 10.8 (8.2–13.4)Día 3: 23.6 (21.0–26.1)Día 10: 21 (18.4–23.6) | ||||
Una vez analizados las variables y las intervenciones de los estudios incluidos en esta revisión, podemos comentar que algunos autores reportan que el descanso, el ejercicio físico terapéutico y la terapia vestibular utilizados de manera temprana proporcionan mejoras en la sintomatología de adolescentes y jóvenes con conmoción cerebral36–40.
Con relación a la intervención de ejercicio físico terapéutico, los trabajos de Chan et al., Micay et al. y Kurowski et al., indican una disminución significativa de los síntomas en los pacientes que llevaron a cabo un protocolo de ejercicio aeróbico, aun no coincidiendo en la medida de la capacidad del individuo a la que realizan dicho ejercicio (entre 50-80%). Si bien, las diferencias encontradas intergrupal (Micay et al.) podrían deberse a un tamaño poblacional pequeño y a un número reducido de mujeres participantes en el estudio.
En consonancia con estos resultados existen otros estudios36–38 en los que demuestran que realizar un protocolo de ejercicio aeróbico al 80% de la capacidad del individuo disminuye significativamente los síntomas posconmoción con respecto al grupo control.
En este mismo sentido apuntan los resultados obtenidos por Leddy et al. que observaron que un menor umbral de esfuerzo cardíaco se relacionaba con un peor pronóstico (tiempo de recuperación prolongado)42. Además observó que el ejercicio aeróbico subsintomático individualizado de 20 minutos provocaba una disminución de los síntomas posconmoción y una recuperación temprana, previniendo su prolongación más allá de los 30 días que realizar estiramientos43.
Sin embargo, Maerlander et al. asocian las intensidades altas a un retraso en la recuperación, pudiendo también influir las intensidades moderadas, por lo que propone una guía más específica sobre los parámetros a utilizar44. Aunque, si bien, el tamaño poblacional fue pequeño y el número de varones participantes en el estudio, reducido.
Asimismo, Yuan et al.45 evidencia que los beneficios mostrados del ejercicio aeróbico con respecto al estiramiento pueden deberse al aumento de la eficiencia global y una diminución de la longitud de trayectoria característica normalizada. A pesar de sus beneficios, Kurowski propone utilizar la terapia vestibular como complemento a los individuos que presenten alteraciones vestibulares y oculomotores por su mayor dificultad a recuperarse36.
Respecto a la terapia vestibular, Schneider y Reneker45,46 muestran evidencias sólidas que esta intervención disminuye considerablemente los síntomas posconmoción asociados al sistema vestibular en comparación a los grupos controles, analizados a las ocho semanas de realización. El estudio de Kleffelgard et al.46 reportó, asimismo, los efectos beneficiosos que produce la terapia vestibular sobre los síntomas posconmoción, a corto plazo (entre dos y tres meses). Aunque habría que tener en consideración que el trabajo de Kleffelgard se llevó a cabo en pacientes con edades comprendidas entre 16-60 años y que padecían un TCE de leve a moderado.
Habría que tener en cuenta que en los estudios de Schneider y Reneker39,40 se incluyeron intervenciones complementarias a la terapia vestibular. Si bien, Schneider et al. destaca los efectos positivos que podrían obtenerse de la combinación de la terapia vestibular y el ejercicio físico terapéutico.
Una vez analizadas las investigaciones que utilizan el descanso como terapia, habría que comentar que Thomas et al.47 no encontraron diferencias en cuanto al tiempo prescrito. Otros autores como Sufrinko et al.48 apoyan estos resultados, no encontrando mejorías en los síntomas posconmoción en los 10 días posteriores a la lesión, o el estudio de Varner et al.49 entre dos a cuatro semanas. Estos resultados podrían ser debidos al corto periodo de tiempo (siete a 30 días)48,49. Los estudios muestran que un largo periodo de descanso se asocia con la presencia de mayor número de síntomas y a la actividad mental47.
En lo referente a las intervenciones, se ha comprobado que el ejercicio físico terapéutico y la terapia vestibular son los tratamientos más efectivos, obteniéndose resultados significativos en los estudios analizados en este trabajo.
ConclusiónEl ejercicio físico terapéutico, concretamente el ejercicio de tipo aeróbico reporta una mejora en los síntomas posconmoción y la calidad de vida en pacientes jóvenes y adolescentes. Aunque esta mejora fue mayor cuando se complementó con la intervención de terapia vestibular. La realización de un descanso prolongado puede conllevar a que los sujetos permanezcan sintomáticos un mayor número de días.
El papel del fisioterapeuta es fundamental en la supervisión de la práctica del ejercicio físico terapéutico y la terapia vestibular para controlar la correcta realización de los mismos, establecer unos parámetros adecuados en función de la edad del paciente y la gravedad de la lesión, en coordinación con el equipo multidisciplinar que lo haya evaluado.
Atendiendo a las consideraciones anteriormente expuestas, consideraríamos importante estandarizar las intervenciones tanto en intensidad, número de sesiones y cantidad de contenidos y adaptarlos al nivel de niños y adolescentes con la finalidad de provocar mayor adherencia terapéutica.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias en el sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesAna Quintero Cabello, declaró la no existencia de conflicto de intereses y ello ha quedado reflejado en el manuscrito.
Álvaro Jesús Reina Ruiz, declaró la no existencia de conflicto de intereses y ello ha quedado reflejado en el manuscrito











![A. Diagnóstico diferencial actual del TCE leve. Fuente: Mayer AR et al. The spectrum of mild traumatic brain injury. A review. Neurology [Internet]. 2017;89(6):623–32. A. Diagnóstico diferencial actual del TCE leve. Fuente: Mayer AR et al. The spectrum of mild traumatic brain injury. A review. Neurology [Internet]. 2017;89(6):623–32.](https://static.elsevier.es/multimedia/02134853/0000003900000004/v1_202404170527/S0213485322000068/v1_202404170527/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Diagnóstico diferencial ideal para el TCE leve. Fuente: Mayer AR, Quinn DK, Master CL. The spectrum of mild traumatic brain injury. A review. Neurology [Internet]. 2017;89(6):623–32. Available from: http://n.neurology.org/content/89/6/623.long. Diagnóstico diferencial ideal para el TCE leve. Fuente: Mayer AR, Quinn DK, Master CL. The spectrum of mild traumatic brain injury. A review. Neurology [Internet]. 2017;89(6):623–32. Available from: http://n.neurology.org/content/89/6/623.long.](https://static.elsevier.es/multimedia/02134853/0000003900000004/v1_202404170527/S0213485322000068/v1_202404170527/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


