El lóbulo paramediano del cerebelo está involucrado en el desempeño correcto de las habilidades motoras a través de la práctica. Las espinas dendríticas son estructuras dinámicas que regulan la estimulación sináptica excitadora. En este trabajo se estudiaron los posibles cambios plásticos en espinas de células de Purkinje del lóbulo paramediano cerebelar de ratas, durante el aprendizaje motor.
MétodosSe entrenaron a ratas macho adultas durante un período de seis días, en un paradigma de aprendizaje motor acrobático y se cuantificó tanto la densidad como los tipos de espinas dendríticas en cada uno de los seis días de estudio, mediante una modificación al método de Golgi.
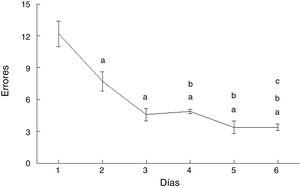
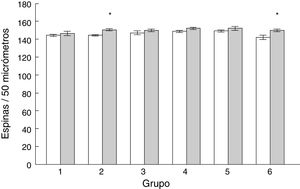
ResultadosLa curva de aprendizaje reflejó una disminución consistente de los errores cometidos en el transcurso de los días de entrenamiento. Así mismo, se observaron más espinas dendríticas en los días 2 y 6 y, en particular, más espinas delgadas en los días 1, 3 y 6, menos espinas en hongo el día 3, menos espinas gordas el día 1 y más espinas anchas los días 4 y 6.
ConclusiónEl período inicial de aprendizaje motor podría estar asociado con el procesamiento rápido de la información sináptica subyacente y con un aparente «silenciamiento» de los procesos de consolidación mnémica, en una base de regulación de la excitabilidad neuronal.
The paramedian lobule of the cerebellum is involved in learning to correctly perform motor skills through practice. Dendritic spines are dynamic structures that regulate excitatory synaptic stimulation. We studied plastic changes occurring in the dendritic spines of Purkinje cells from the paramedian lobule of rats during motor learning.
MethodsAdult male rats were trained over a 6-day period using an acrobatic motor learning paradigm; the density and type of dendritic spines were determined every day during the study period using a modified version of the Golgi method.
ResultsThe learning curve reflected a considerable decrease in the number of errors made by rats as the training period progressed. We observed more dendritic spines on days 2 and 6, particularly more thin spines on days 1, 3, and 6, fewer mushroom spines on day 3, fewer stubby spines on day 1, and more thick spines on days 4 and 6.
ConclusionThe initial stage of motor learning may be associated with fast processing of the underlying synaptic information combined with an apparent “silencing” of memory consolidation processes, based on the regulation of the neuronal excitability.
La neuroplasticidad subyace a la respuesta restauradora del cerebro ante los factores ambientales que deterioran los procesos neurobiológicos. El daño neuropatológico que provoca la disfunción motora es comúnmente seguido por respuestas plásticas que actúan para restaurar la actividad normal a diferentes niveles, incluyendo el de los contactos sinápticos. Sin embargo, la restauración espontánea de la función motora perdida es infrecuente, lo que sugiere que algunos de los eventos neuroplásticos que tienen lugar durante el período de recuperación no son eficientes. De hecho, estos son escasamente conocidos.
Para lograr la recuperación ciertas habilidades deben ser reaprendidas, un proceso en el que la actividad del cerebelo desempeña un papel preponderante1–3. El lóbulo paramediano de la corteza neocerebelar está estrechamente relacionado con el aprendizaje motor. Las células de Purkinje (CP) del lóbulo paramediano de la corteza cerebelar integran la información aferente procedente de los sistemas neurales tanto extrínsecos como intrínsecos que es necesaria para codificar los patrones subyacentes al aprendizaje motor. Se han reportado cambios plásticos en las sinapsis distales entre las CP y las fibras paralelas (FP) de las células granulares subyacentemente al aprendizaje motor por parte de ratas que han sido entrenadas para adquirir nuevas habilidades motoras4–6. Correspondientemente, se ha reportado un aumento de espinas dendríticas en las dendritas distales de las PC después de un período de 26 días de aprendizaje motor acrobático, en el cual, el número de traspiés cometidos en la prueba disminuyó durante los seis primeros días para luego estabilizarse asintóticamente4,7,8. Estos hallazgos sugieren la ocurrencia de eventos neuroplásticos a nivel de las sinapsis distales entre FP y CP mediadas por espinas dendríticas en el lóbulo paramediano cerebelar, durante el período crítico del aprendizaje motor. De acuerdo con Doyon y Benali2 y Dayan y Cohen9, las habilidades motoras se aprenden después de varias fases distintas cuya duración depende de la tarea impuesta. La primera es la llamada fase «rápida», en la cual la adquisición de habilidades motoras resulta ser significativamente evidente y cuya eficiencia mejora considerablemente conforme dicha fase transcurre.
Las espinas dendríticas pueden sufrir varios tipos de cambios plásticos, incluyendo neoformación, reabsorción y remodelación geométrica; particularmente en relación con la «traducción» de la información aferente10–14. Dado que las sinapsis FP-CP están involucradas en la modulación del aprendizaje motor, se llevó a cabo un estudio sobre la citoarquitectura de las espinas dendríticas distales de las CP de la corteza del lóbulo paramediano del cerebelo de ratas entrenadas de acuerdo con un paradigma de aprendizaje motor.
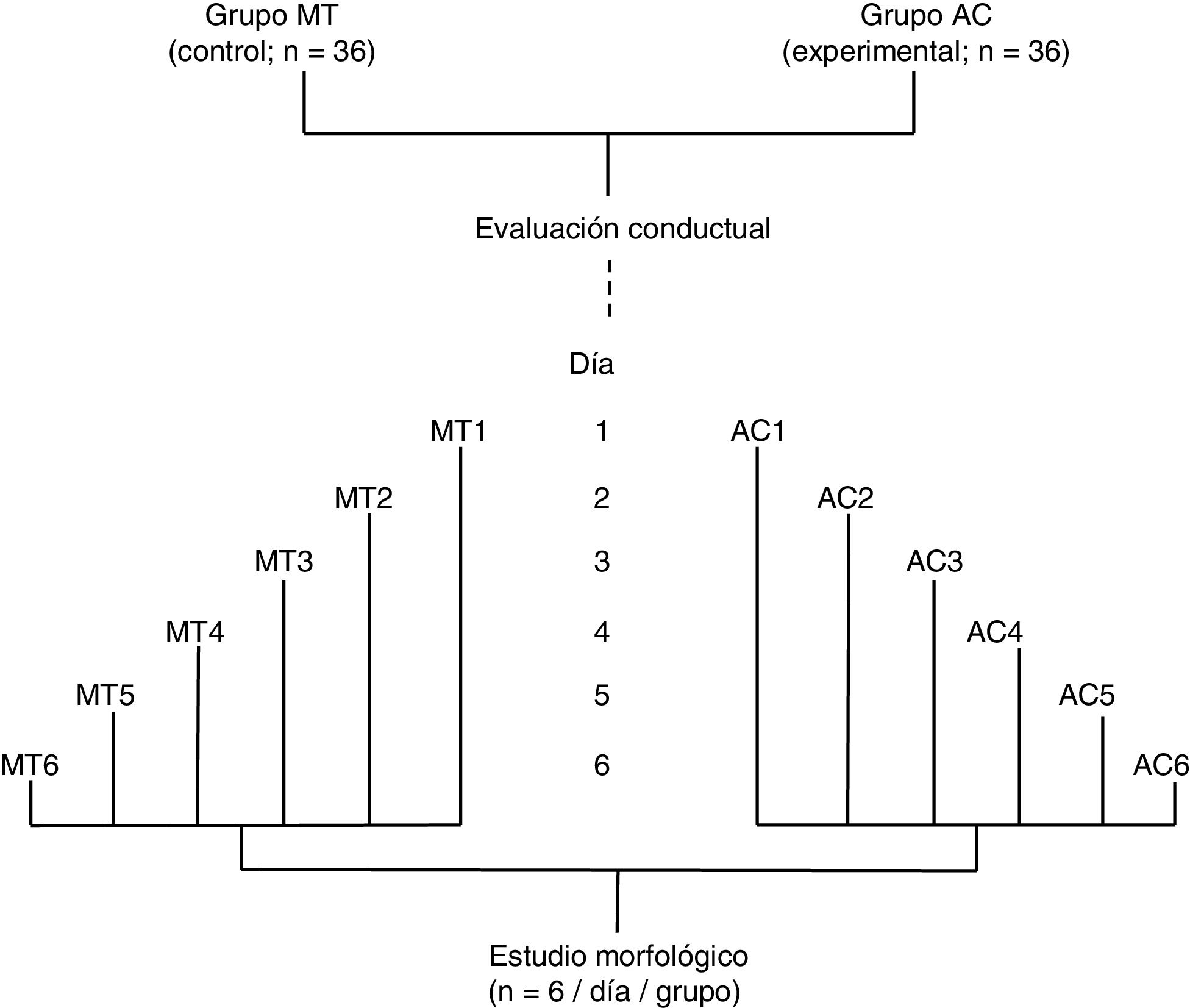
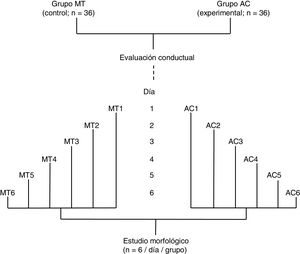
Material y métodosSe utilizaron 72 ratas macho adultas (250-300g) de la cepa Sprague-Dawley, las cuales fueron mantenidas en condiciones estándar: ciclos de 12 h de luz y oscuridad (07:00-19-00h), 45-50% de humedad ambiental, temperatura ambiental de 22 ± 2°C y libre acceso a agua y alimento convencional para roedores. Los protocolos experimentales fueron aprobados por el Comité de Ética en Investigación del Instituto Mexicano del Seguro Social (México) y se realizaron de acuerdo con las pautas del Instituto Nacional de Salud para el Cuidado y Uso de Animales de Laboratorio (NIH Publicaciones N.o 80-23, revisión de 1996).
Se formaron dos grupos: un grupo experimental (AC; n = 36) fue sometido a una prueba de aprendizaje motor acrobático durante seis días consecutivos y, un grupo control (MT; n = 36) recorrió la misma distancia que el grupo AC, pero en una superficie plana sin obstáculo alguno. Los 36 animales de cada grupo fueron subdivididos en seis subgrupos (n = 6 / subgrupo). Los seis animales de cada subgrupo tanto de AC como de MT llevaron a cabo la prueba en días consecutivos, desde el día 1 (AC1 / MT1) al día 6 (AC6 / MT6), de manera que el número de días de entrenamiento fue aumentando por subgrupo (fig. 1). De acuerdo con estudios previos6–8, el período de aprendizaje motor rápido2,9 en un paradigma de tiempo espaciado15 ocurre durante la primera semana de entrenamiento.
Estudio conductualLos animales del grupo AC fueron entrenados para cruzar una ruta elevada (4,25 m a 1m sobre el nivel del piso) en cuatro ensayos por día sin límite de tiempo, con intervalos de 60 seg entre ensayos, entre las 11:00 y las 14:00h. La ruta consistió en una secuencia de una cadena de acero (50cm de largo), una escalera horizontal de madera (10cm de ancho y 50cm de largo) cuyos peldaños estaban recubiertos por popotes rodantes, un tubo de alambre tejido (30cm de diámetro y 80cm de longitud), una escalera de madera horizontal cubierta de bolas pequeñas de ábaco (10cm de ancho y 60cm de largo), barras paralelas (5cm de ancho y 50cm de largo), barras paralelas con una armadura cruzada de ligas (15cm de ancho y 60cm de largo) y una barra simple de equilibrio (2cm de ancho y 75cm de largo). Al final de la ruta se colocó una jaula a manera de estancia de escape7. Debido a que las ratas necesitaban coordinación motora y equilibrio para superar los obstáculos a lo largo del camino, se cuantificó tanto el tiempo necesario para completar la prueba como el número de fallas de pie (errores) cometidas por ensayo, como índices de aprendizaje motor. Los animales de cada grupo de estudio se alojaron en grupos de seis animales por jaula, manteniéndose las jaulas de mantenimiento en una estancia diferente a la utilizada para el entrenamiento.
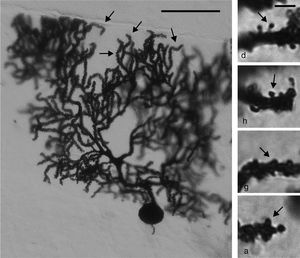
Estudio morfológicoInmediatamente después de terminar el entrenamiento conductual de los seis animales de AC y MT correspondientes a cada día, estos se anestesiaron con ketamina (30mg / kg im) y pentobarbital sódico (50mg / kg ip). Enseguida fueron perfundidos con 200ml de solución salina amortiguada con solución de fosfatos (pH 7,4; 0,01M) que contenía heparina sódica (1.000 UI / L) como anticoagulante y clorhidrato de procaína (1g / l) como vasodilatador16. Acto seguido, los animales fueron perfundidos con 200ml de una solución fijadora a base de formaldehído al 4% amortiguado. Ambas soluciones fueron perfundidas con un flujo de 11,5ml / min. Los cerebros de los animales se obtuvieron por craneotomía y se mantuvieron durante 48 h en 100ml de solución fijadora fresca. Se diseccionó un bloque de tejido de 3mm de espesor de ambos hemisferios cerebelares que contenían el lóbulo paramediano17 y fueron impregnados de acuerdo con una variante del método de Golgi18. A partir de cortes sagitales de 75μ m de espesor, se estudiaron «en ciego» seis CP claramente visibles de cada rata. En cada una de las seis células estudiadas por rata, las espinas dendríticas se contaron en un tramo total de 50μ m a partir de 3-4 ramificaciones terminales dendríticas apicales distales al soma (fig. 2, panel izquierdo).
Panel izquierdo: fotomicrografía de una célula de Purkinje de la corteza del lóbulo paramediano del cerebelo. Las flechas indican ramificaciones dendríticas distales en las cuales se realizaron los conteos de espinas. Escala: 100μm. Panel derecho: fotomicrografías representativas de espinas delgada d), en hongo h), gorda g) y ancha a) (flechas), como aquellas que se contaron en este estudio. Escala: 2μm.
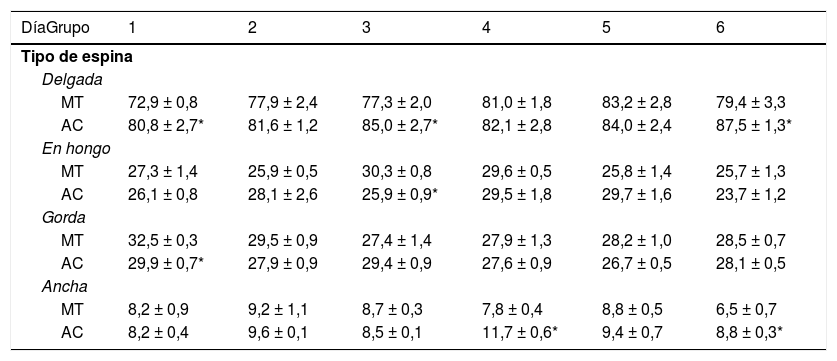
Se cuantificaron la densidad numérica y la densidad proporcional de espinas delgadas, en hongo, gordas y anchas; de acuerdo con criterios previamente establecidos11,19–23 (fig. 2, panel derecho). El conteo se realizó a 2.000 X, utilizando un cambiador de aumento acoplado a un microscopio óptico con un objetivo 100 X APO y un analizador de imágenes (LAS 4.0).
Análisis estadísticoTanto el tiempo como el número de errores, así como la densidad de espinas dendríticas y los tipos de espinas se promediaron para los seis animales estudiados en el día correspondiente y se realizaron comparaciones entre los subgrupos 1, 2, 3, 4, 5, o 6 mediante ANOVA de dos vías (grupos x días), seguido de la prueba t de Student para muestras independientes.
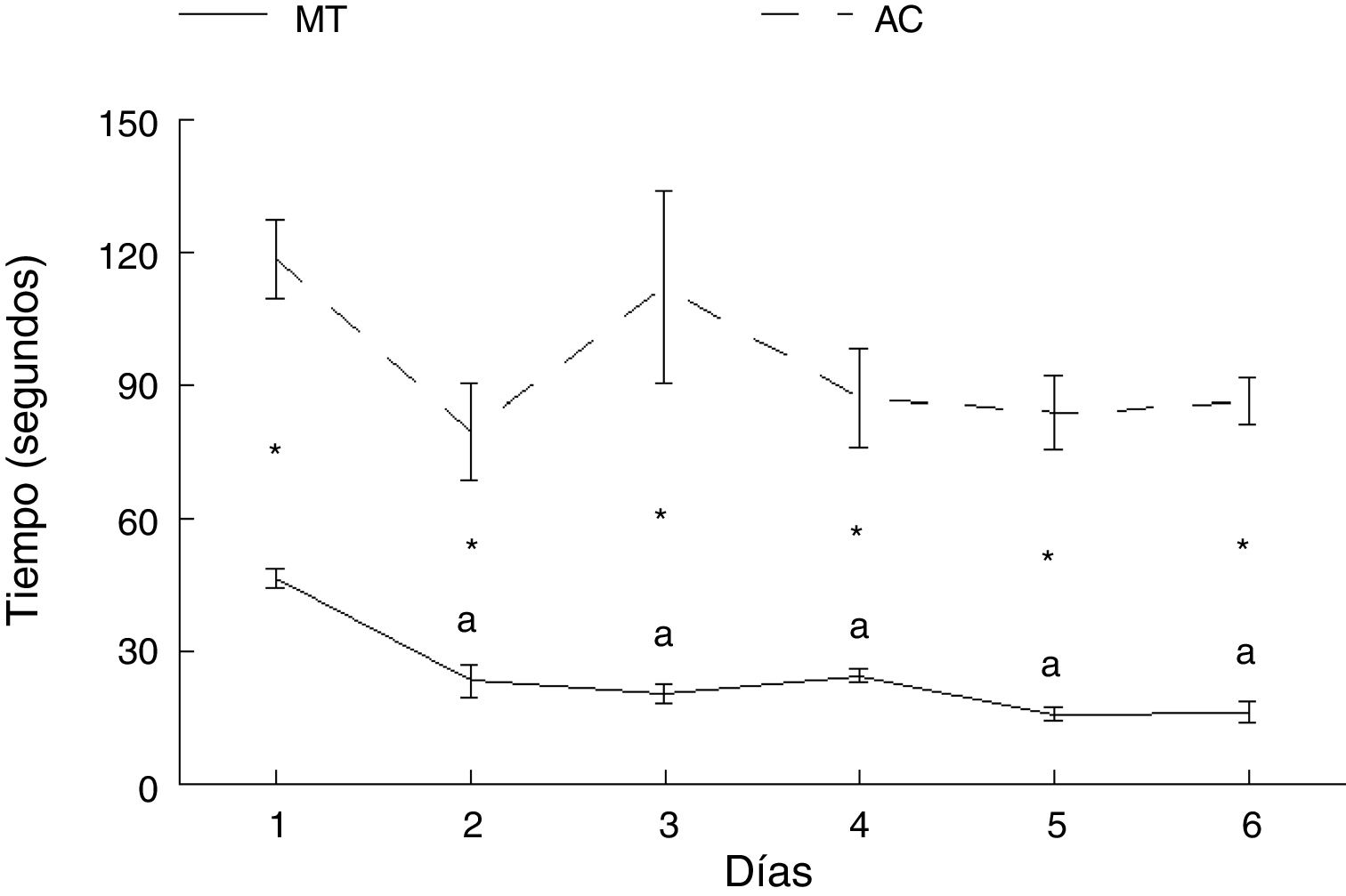
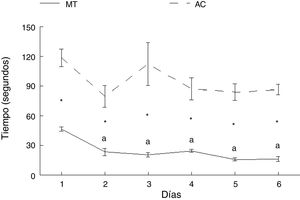
ResultadosAprendizaje motorTiempoLos animales del grupo AC tardaron más en cruzar la ruta que aquellos del grupo MT, en cada uno de los días de entrenamiento: día 1: t = −7.847, p < 0,0001; día 2: t = −4.847, p < 0,001; día 3: t = −4.137, p < 0,002; día 4: t = −5.543, p < 0,0001; día 5: t = −8.081, p < 0,0001; día 6: t = −11.675, p < 0,0001. No hubo diferencias en el tiempo en que los animales del grupo AC recorrieron la ruta entre ninguno de los seis días de estudio. Por su parte, los subgrupos correspondientes a MT mostraron diferencias en el tiempo para completar la prueba (F = 21.614, p < 0,0001); MT2 (p < 0,0001), MT3 (p < 0,0001), MT4 (p < 0,0001), MT5 (p < 0,0001) y MT6 (p < 0,0001) recorrieron la ruta en menos tiempo que el subgrupo MT1. No hubo diferencias entre MT2, MT3, MT4, MT5 y MT6 subgrupos (fig. 3).
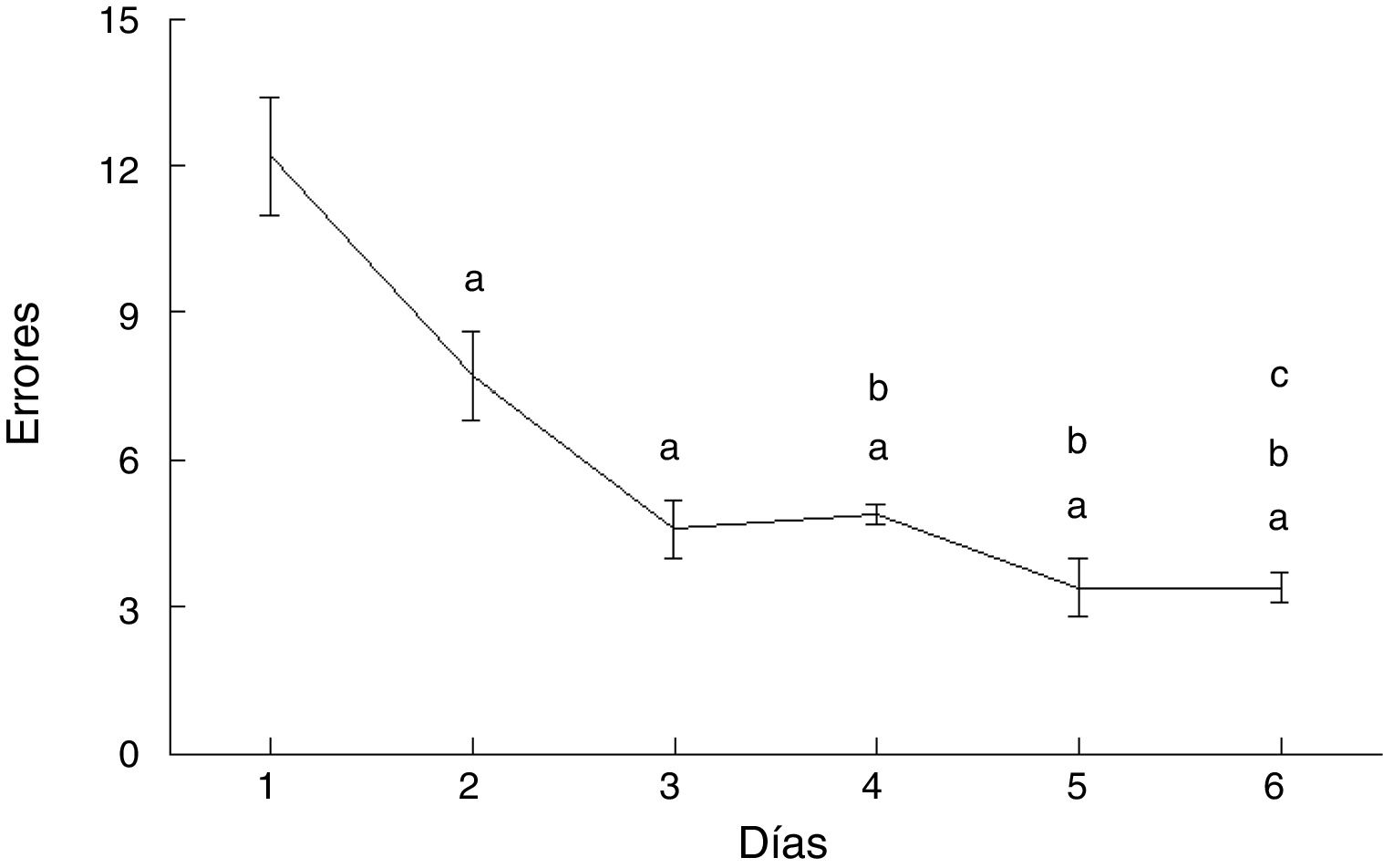
ErroresLos errores cometidos por los animales del grupo AC disminuyeron con el paso de los días de prueba (F = 20.169, p < 0,0001). En comparación con el día 1, cometieron menos errores en los días 2 (p < 0,003), 3 (p < 0,0001), 4 (p < 0,0001), 5 (p < 0,0001) y 6 (p < 0,0001). Además, en los días 4 (p < 0,03), 5 (p < 0,004) y 6 (p < 0,004) cometieron menos errores que aquellos del subgrupo AC2, en tanto que el día 6 cometieron menos errores que el día 4 (p < 0,02) (fig. 4).
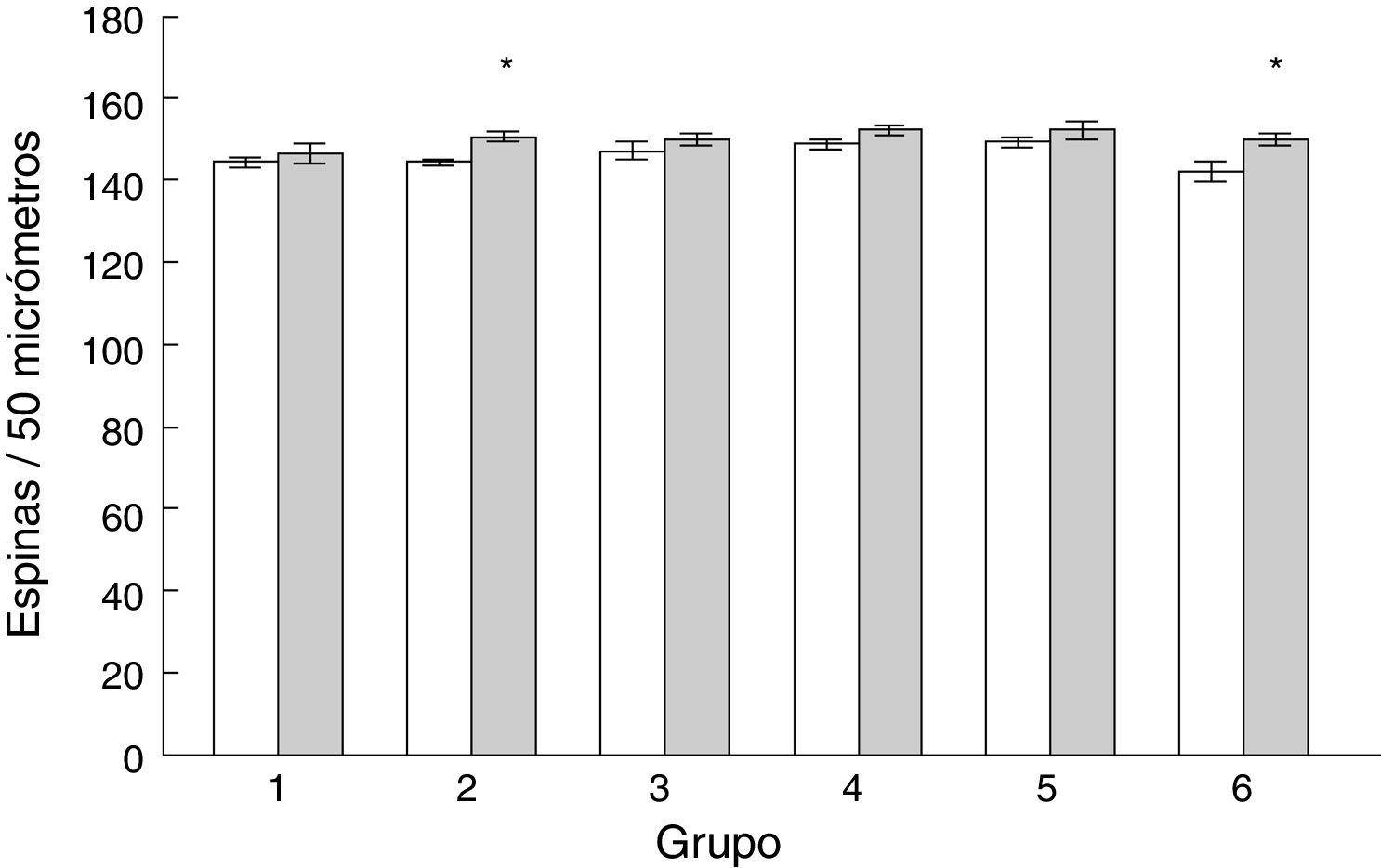
Densidad de espinas dendríticasLa densidad de espinas dendríticas en las células de Purkinje del lóbulo paramediano de los subgrupos AC2 (t = −3.713, p < 0,004) y AC6 (t = −2.577, p < 0,02) fue mayor que en los subgrupos control correspondientes MT2 y MT6, respectivamente (fig. 5).
Tipos de espinas dendríticasLos animales de los subgrupos AC1, AC3 y AC6 tuvieron más espinas delgadas que los subgrupos control MT1, MT3 y MT6 (t = −2.709, p < 0,02; t = −2.223, p < 0,05; t = −2.235, p < 0,04; respectivamente). Por su parte, AC3 mostró menos espinas en hongo que su control MT3 (t = 3.452, p < 0,006). La densidad de espinas gordas fue menor en AC1 que en MT1 (t = 3.059, p < 0,01), en tanto que los animales del subgrupo AC4 tuvieron más espinas anchas que MT4 (t = −4.902, p < 0,001), al igual que AC6 con respecto a MT6 (t = −2.976, p < 0,01) (tabla 1).
Densidad proporcional de los diferentes tipos de espinas dendríticas en las células de Purkinje del lóbulo, paramediano del cerebelo, en cada uno de los días de entrenamiento conductual
| DíaGrupo | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Tipo de espina | ||||||
| Delgada | ||||||
| MT | 72,9 ± 0,8 | 77,9 ± 2,4 | 77,3 ± 2,0 | 81,0 ± 1,8 | 83,2 ± 2,8 | 79,4 ± 3,3 |
| AC | 80,8 ± 2,7* | 81,6 ± 1,2 | 85,0 ± 2,7* | 82,1 ± 2,8 | 84,0 ± 2,4 | 87,5 ± 1,3* |
| En hongo | ||||||
| MT | 27,3 ± 1,4 | 25,9 ± 0,5 | 30,3 ± 0,8 | 29,6 ± 0,5 | 25,8 ± 1,4 | 25,7 ± 1,3 |
| AC | 26,1 ± 0,8 | 28,1 ± 2,6 | 25,9 ± 0,9* | 29,5 ± 1,8 | 29,7 ± 1,6 | 23,7 ± 1,2 |
| Gorda | ||||||
| MT | 32,5 ± 0,3 | 29,5 ± 0,9 | 27,4 ± 1,4 | 27,9 ± 1,3 | 28,2 ± 1,0 | 28,5 ± 0,7 |
| AC | 29,9 ± 0,7* | 27,9 ± 0,9 | 29,4 ± 0,9 | 27,6 ± 0,9 | 26,7 ± 0,5 | 28,1 ± 0,5 |
| Ancha | ||||||
| MT | 8,2 ± 0,9 | 9,2 ± 1,1 | 8,7 ± 0,3 | 7,8 ± 0,4 | 8,8 ± 0,5 | 6,5 ± 0,7 |
| AC | 8,2 ± 0,4 | 9,6 ± 0,1 | 8,5 ± 0,1 | 11,7 ± 0,6* | 9,4 ± 0,7 | 8,8 ± 0,3* |
AC: grupo experimental; MT: grupo control.
Media ± EEM.
* p < 0,05.
El lóbulo paramediano del cerebelo participa en la integración de información relacionada con el aprendizaje motor, como ha sido reportado en estudios que muestran incremento en la actividad metabólica de esta región cerebelar durante los días iniciales de la adquisición de habilidades motoras9,24. Con base en lo anterior, la actividad cerebelar podría estar influenciada por cambios en el procesamiento de la información sináptica entre FP y CP4–6, a partir de la remodelación de las espinas dendríticas mediada por el aprendizaje motor. En concordancia con lo anterior, en el presente estudio se observó un aumento de espinas dendríticas en CP durante el período rápido de aprendizaje motor, correspondientemente con una reducción en los errores cometidos en el recorrido de la ruta acrobática impuesta.
Aunque la distancia recorrida por los animales experimentales y control fue la misma, el tiempo empleado para recorrer la ruta con obstáculos fue mayor, lo que se podría explicar a partir de que las demandas motrices fueron más complejas para el grupo experimental. Aunque la latencia para completar la tarea por parte de los animales con entrenamiento acrobático no fue significativa en comparación con el día 1, se observó una tendencia a disminuir, lo que estaría parcialmente de acuerdo con reportes previos7,8.
De acuerdo con estudios anteriores7,8 el número de errores cometidos por las ratas del grupo experimental disminuyó con el transcurso de los días de entrenamiento. Esto se podría interpretar como un aumento gradual y progresivo de la precisión y control de la actividad motora y demuestra la ocurrencia de un proceso de aprendizaje25,26. Las entradas sinápticas a la región dendrítica apical de las CP tienen una relación directa con la organización de los eventos psiconeurales que conducen a un mejor desempeño de las habilidades motoras1,4–8,27 y, de acuerdo con otros autores28, la estimulación sináptica subyacente podría estar relacionada tanto con la potenciación como con la depresión de las sinapsis entre fibras paralelas y espinas dendríticas de CP. Así, la eficiencia gradual observada a lo largo del entrenamiento podría haber implicado modificaciones estructurales de las sinapsis en el lóbulo paramediano cerebelar15, que podrían corresponder a cambios plásticos en las espinas dendríticas, como de hecho fueron observados en el presente estudio.
El mayor número de espinas dendríticas registrado en los días dos y seis de entrenamiento sugiere un mayor nivel de actividad presináptica como resultado del aprendizaje motor. Varios estudios han asociado el aumento de espinas dendríticas con una mayor actividad presináptica29,30, incluida la relacionada con el aprendizaje motor19,28,31. Más aún, además de la densidad de espinas, los cambios plásticos de los tipos de espinas dendríticas también podrían estar involucrados en los eventos neurobiológicos subyacentes al procesamiento de información relacionado con el aprendizaje de habilidades motoras. Las CP poseen varios tipos de espinas dendríticas que se distinguen por su forma geométrica, incluyendo delgadas, en hongo, gordas y anchas19–21. Las espinas delgadas están relacionadas con la neurotransmisión sináptica rápida y altamente eficiente, con la inducción de la potenciación a largo plazo32, y con los eventos asociados con la adquisición de información o aprendizaje novedoso13,14. Por su parte, los estímulos sinápticos en espinas de hongos son procesados en el núcleo de la célula, lo que se ha vinculado a la consolidación de la información adquirida previamente a manera de trazos de memoria13,14. Cuando la estimulación sináptica de las neuronas es lo suficientemente alta como para no permitir la integración sináptica19, la actividad funcional de las espinas gordas y anchas participarían regulando la excitabilidad de la propia neurona postsináptica11,12,33, en virtud de carecer de un cuello estrecho34,35.
Las espinas delgadas mostraron una tendencia a ser más abundantes en todos los días de entrenamiento, siendo significativas los días 1, 3 y 6. Dada la exposición de los animales a una experiencia novedosa en el primer día de entrenamiento y que la transmisión de esta nueva información mediada por sinapsis con espinas delgadas en las CP implica el procesamiento rápido de la información36, el aumento de este tipo de espinas parece haber sido funcionalmente significativo. El aumento de las espinas delgadas también podría estar causalmente relacionado con la naturaleza de la tarea conductual impuesta. Se ha demostrado que el volumen de la cabeza de las espinas grandes disminuye después del aprendizaje espaciado y que pueden cambiar lo suficiente como para transformarse en la variedad delgada15, lo cual estaría relacionado con la potenciación y depresión de largo plazo asociadas con la actividad sináptica en los contactos entre FP y PC28. Por lo tanto, la mayor densidad de espinas delgadas en forma sostenida a lo largo del entrenamiento podría subyacer a la adquisición cada vez más precisa de las habilidades necesarias para resolver la tarea conductual, esto es, al aprendizaje motor.
La densidad de espinas en hongo solo fue diferente el día 3 del entrenamiento, al cual fue menor respecto a su correspondiente control. Dado que las espinas en hongo se relacionan con el almacenamiento de la información13,14, este hallazgo resulta relevante al asociarlo con el mayor número de espinas delgadas. En conjunto, estos eventos podrían significar que la actividad sináptica relacionada con el almacenamiento de la información subyacente al desempeño motor sería secundaria a la adquisición de la misma, representada por la preponderancia de las espinas delgadas. De ser así, la capacidad de adquirir nueva información no estaría sometida a la eventual consolidación de la información representada por las espinas en hongo, lo que se traduce en una capacidad «liberada» para adquirir consistentemente información novedosa durante todos los días del entrenamiento. Lo anterior estaría de acuerdo con reportes previos que muestran incremento de todos los tipos de espinas (incluidas las en hongo) cuatro semanas después de la imposición de un paradigma de aprendizaje motor semejante al del presente estudio y en el que después de la primera semana del entrenamiento la curva de aprendizaje ya no se modifica tras una etapa inicial de aprendizaje consistente4,7,8. Esto sugiere que la información requerida para realizar la tarea de manera eficiente y sostenida había sido consolidada presumiblemente con la participación preponderante de espinas en hongo como mediadoras de los procesos sinápticos asociados al aprendizaje motor.
La proporción de espinas gordas fue menor el día 1 de entrenamiento, en tanto que la de las espinas anchas fue mayor los días 4 y 6. La menor cantidad de espinas gordas el día 1 podría significar que las entradas sinápticas a las CP podrían ser altamente específicas al correlacionarse con el incremento proporcional de espinas delgadas observado este mismo día del entrenamiento. Por su parte, la mayor cantidad de espinas anchas registrada los últimos días del entrenamiento sugiere que, aunque aún existe un proceso activo de aprendizaje de habilidades motoras, el sometimiento a la realización de la tarea que cada vez se realiza con mayor eficiencia implicaría actividad sináptica funcionalmente redundante lo cual, de ser así, se reflejaría en un incremento de las espinas implicadas en la regulación de la actividad sináptica aferente, como es el caso de las anchas.
La evidencia anterior apunta a una estrecha relación entre la adquisición de nuevas habilidades motoras y la plasticidad de las espinas dendríticas. En este sentido, se ha reportado que el aprendizaje motor induce cambios plásticos «no lineales» en las espinas dendríticas durante etapas sucesivas de entrenamiento37, lo cual está claramente de acuerdo con los hallazgos del presente estudio.
Algunas otras conexiones sinápticas entre los elementos neuronales que componen la corteza del lóbulo paramediano del cerebelo estarían involucradas en la integración de información relacionada con el aprendizaje motor38–40 y, más aún, probablemente no solo el paramediano sino también otros lóbulos cerebelares41. Además, las posibles variaciones en la citoarquitectura de las CP de diferentes zonas42 en el mismo lóbulo paramediano también podrían considerarse como una fuente de variaciones plásticas en la citoarquitectura de las espinas que eventualmente afectarían el aprendizaje motor. Estas posibilidades requieren de investigaciones posteriores.
El presente trabajo destaca la importancia de los fenómenos plásticos a nivel sináptico en las etapas iniciales del aprendizaje motor, que influyen para favorecer la adquisición de habilidades motoras en condiciones normales o neuropsicopatológicas.
FinanciaciónEste trabajo fue financiado por el Fondo de Investigación en Salud del Instituto Mexicano del Seguro Social, con número de registro FIS/IMSS/PROT/G14/1336.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Una parte de este trabajo fue presentado en el XLV Congreso de la Society for Neuroscience.