El término síndrome de Fisher-Bickerstaff (SFB) ha sido propuesto para describir el espectro clínico que engloba el síndrome de Miller-Fisher y la encefalitis de Bickerstaff. Su fisiopatología y las características de la neuropatía subyacente, axonal o desmielinizante son todavía objeto de debate. En este estudio describimos los principales hallazgos del estudio neurofisiológico realizado de forma precoz en 12 pacientes diagnosticados de SFB.
Pacientes y métodosSe han evaluado de forma retrospectiva las características clínicas y los hallazgos electrofisiológicos de 12 pacientes con diagnóstico de SFB y estudio realizado en los primeros 10 días de evolución. El estudio electrofisiológico de control ha sido evaluado en los pacientes en los que estaba disponible.
ResultadosEl hallazgo electrofisiológico más frecuente fue una reducción de la amplitud del potencial de acción nervioso sensitivo (PANS) en uno o más nervios, presente en 5 (42%) pacientes. La neurografía motora presentó hallazgos aislados y poco frecuentes, ninguno de ellos dentro de un rango desmielinizante. Tres pacientes presentaron alteración en el estudio de pares craneales (neurografía facial y/o blink reflex). En el estudio neurofisiológico seriado, 3 pacientes presentaron resolución de la reducción de la amplitud del PANS, indicando la presencia de bloque de conducción reversible sensitivo. La resonancia magnética craneal fue normal en todos los pacientes.
ConclusiónUn patrón electrofisiológico de neuropatía axonal sensitiva es un hallazgo precoz en pacientes afectados de FBS, sin hallazgos indicativos de desmielinización. La realización de estudio neurofisiológico precoz y de seguimiento es fundamental en el diagnóstico de pacientes afectos de FBS.
The term Fisher-Bickerstaff syndrome (FBS) has been proposed to describe the clinical spectrum encompassing Miller-Fisher syndrome (MFS) and Bickerstaff brainstem encephalitis. The pathophysiology of FBS and the nature of the underlying neuropathy (demyelinating or axonal) are still subject to debate. This study describes the main findings of an early neurophysiological study on 12 patients diagnosed with FBS.
Patients and methodsRetrospective evaluation of clinical characteristics and electrophysiological findings of 12 patients with FBS seen in our neurology department within 10 days of disease onset. Follow-up electrophysiological studies were also evaluated, where available.
ResultsThe most frequent electrophysiological finding, present in 5 (42%) patients, was reduced sensory nerve action potential (SNAP) amplitude in one or more nerves. Abnormalities were rarely found in motor neurography, with no signs of demyelination. The cranial nerve exam revealed abnormalities in 3 patients (facial neurography and/or blink reflex test). Three patients showed resolution of SNAP amplitude reduction in serial neurophysiological studies, suggesting the presence of reversible sensory nerve conduction block. Results from cranial MRI scans were normal in all patients.
ConclusionAn electrophysiological pattern of sensory axonal neuropathy, with no associated signs of demyelination, is an early finding of FBS. Early neurophysiological evaluation and follow-up are essential for diagnosing patients with FBS.
El síndrome de Miller-Fisher (SMF) se considera una variante clínica del síndrome de Guillain-Barre (SGB) y se caracteriza por la tríada de ataxia, arreflexia y oftalmoplejía, con mínima, si presente, debilidad muscular asociada1. La encefalitis de tronco de Bickerstaff (EB) se caracteriza por alteración del nivel de consciencia o hiperreflexia asociada a la tríada clásica y comparte con el MFS la asociación con los anticuerpos anti-GQ1b2,3. Dicho mecanismo autoinmune común hace que más recientemente se haga referencia a ambas entidades dentro del espectro clínico del llamado síndrome anti-GQ1b4. Asimismo, desde el punto de vista nosológico, ambas entidades forman un espectro clínico continuo con afectación variable entre sistema nervioso central (SNC) y periférico, por lo que término síndrome Fisher-Bickerstaff se ha propuesto para definir todo el rango de la enfermedad5,6.
El mecanismo patogénico responsable de la ataxia que presentan los pacientes se ha relacionado con la alteración de la conducción en el sistema propioceptivo aferente (fibras ia originadas en los husos musculares)7,8. Algunos estudios indican un papel fisiopatológico directo de los anticuerpos anti-Gq1b9, que se unen a regiones paranodales de los nervios oculomotores, ganglios dorsales, y a husos musculares, donde no existe barrera hematoencefálica (BHE)10. La presencia de disfunción del SNC en estos pacientes se ha relacionado con la alteración de la BHE mediada por metaloproteinasas11.
Históricamente, diversos trabajos han discutido sobre la naturaleza axonal o desmielinizante de la neuropatía subyacente en el FBS. La mayoría de los estudios demuestran la presencia de una afectación del sistema nervioso periférico en forma de neuropatía generalmente de perfil axonal, si bien en algunos casos se demuestran hallazgos electrofisiológicos de desmielinización6,12-17. Estudios más recientes apoyan la presencia de una neuropatía axonal o no primariamente desmielinizante con presencia, al igual que en la neuropatía motora axonal aguda (AMAN), de bloqueo de conducción reversible en nervios sensitivos y motores. Ello explicaría la mejoría de la amplitud de los potenciales obtenidos en estudios seriados y coloca el SFB en el espectro de las paranodopatías18,19.
Diversos estudios han evaluado el estudio neurofisiológico realizado en un estadio precoz en SMF12,17-19. Dicho estudio, aunque con frecuencia puede no ser concluyente para un diagnóstico definitivo, aporta datos fisiopatológicos importantes que deberán corroborarse en estudios neurofisiológicos seriados, para el establecimiento del tipo de neuropatía subyacente18-22.
En este estudio se presentan los hallazgos clínicos y electrofisiológicos de pacientes con diagnóstico de FBS evaluados los primeros 10 días del inicio de la clínica. Se evalúa la hipotética utilidad del estudio neurofisiológico precoz para la caracterización y el diagnóstico de FBS.
Pacientes y métodosSe ha evaluado de forma retrospectiva a los pacientes ingresados en el servicio de neurología del Hospital Universitario de Bellvitge con diagnóstico al alta de SMF clásico o EB en los últimos 10 años. Se ha seleccionado a los pacientes con estudio electrofisiológico realizado dentro de los primeros 10 días del inicio de la clínica. Se ha excluido a los pacientes con variantes clínicas de SMF clásico, superposición de SGB, polineuropatía previa conocida o pacientes con presencia de factores predisponentes para el desarrollo de neuropatía4.
Se ha recogido información respecto a síntomas precedentes e iniciales, exploración neurológica, presencia de disociación albúmino citológica (proteínas en líquido cefalorraquídeo [LCR] ≥ 45mg/dl con celularidad ≤ 5μl) y hallazgos de resonancia magnética (RM) craneal. Los anticuerpos antigangliósidos GM1, GM2, GD1a, GD1b, GT1b y GQ1b fueron evaluados mediante ELISA y considerados patológicos a partir de título ≥ 500. Todos los estudios neurofisiológicos se realizaron mediante el mismo aparato de electromiografía (Synergy, CareFusion, San Diego, CA 92130, EE. UU.). El registro se realizó siguiendo métodos estándar23. Los estudios de conducción nerviosa fueron realizados con electrodos de superficie. En la evaluación de la neurografía motora (NM) se realizó al menos un nervio mediano, cubital y peroneo unilateral. Se evaluaron la amplitud del potencial motor evocado, la latencia distal motora, la velocidad de conducción motora y la presencia de dispersión temporal. La latencia mínima de la onda F fue evaluada en al menos un nervio. Se consideró una onda F como ausente o bloqueada cuando la persistencia de respuesta fue menor del 20%. La neurografía sensitiva (NS) se realizó mediante estimulación antidrómica en al menos un nervio mediano, cubital y sural unilateral, evaluando principalmente la amplitud del potencial de acción nervioso sensitivo (PANS). El estudio neurofisiológico de pares craneales incluyó blink reflex (BR) y neurografía de nervio facial (NF). El estudio de BR se realizó mediante estimulación del nervio supraorbital con registro en musculatura orbicular mediante electrodos de superficie. Se evaluaron los componentes tempranos y tardíos (R1, R2 y R2c). La neurografía facial se realizó mediante registro en músculo nasalis y estimulación anterior al tragus. Un valor fue definido como anormal si se encontraba fuera de los valores de normalidad corregidos por edad de nuestro laboratorio. Para la definición de valor en rango desmielinizante se utilizaron los criterios de la EFNS/PNS 201024.
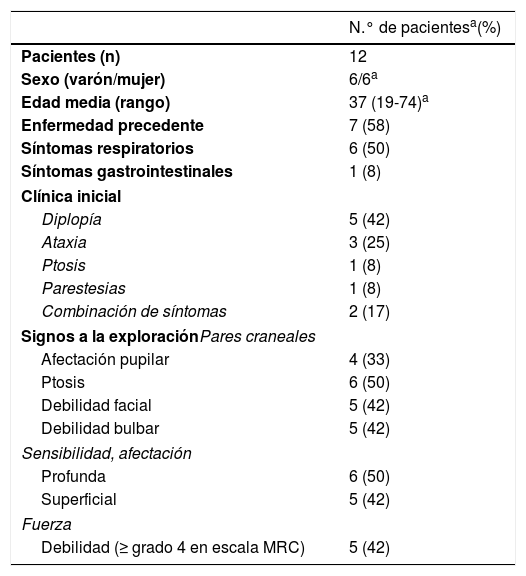
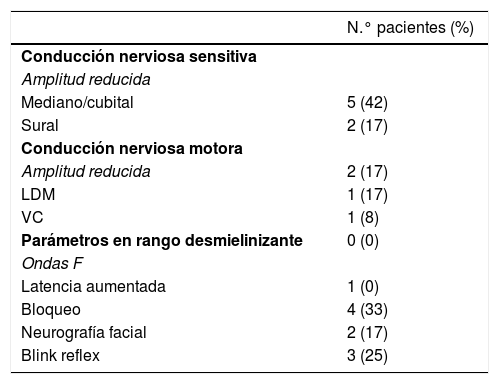
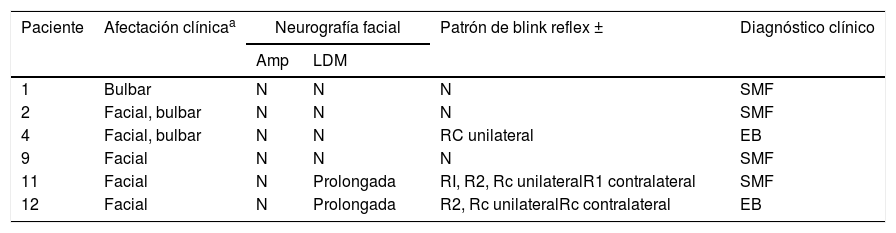
ResultadosDoce pacientes con diagnóstico clínico de FBS y estudio electrofisiológico realizado antes de 10 días del inicio de la clínica fueron finalmente incluidos (10 paciente con diagnóstico de SMF y 2 con EB). Los hallazgos clínicos se resumen en la tabla 1. Todos los pacientes presentaban clínicamente ataxia y oftalmoparesia. Dos pacientes presentaron patrón indicativo de oftalmoplejía interna (un paciente con síndrome de Parinaud y otro con oftalmoplejía internuclear). Un paciente precisó de ingreso en la Unidad de Cuidados Intensivos por afectación bulbar severa. En 4 pacientes (33%) se detectó disociación albuminocitológica en el LCR. La determinación de anticuerpos antigangliósidos estaba disponible en 9 pacientes, presentado anticuerpos IgG anti-GQ1b 5 de ellos (55%). Ocho pacientes se realizaron RM craneal, informada como normal en todos ellos. Todos los estudios electrofisiológicos se realzaron en un rango de 2-10 días del inicio de la clínica. Los hallazgos electrofisiológicos se resumen en la tabla 2 y se presenta el patrón de afectación en cada paciente en la tabla 3. En 3 pacientes, el estudio neurofisiológico precoz no presentó alteraciones significativas (paciente 5, 7 y 9). Los hallazgos patológicos descritos en el resto de los pacientes fueron predominantes en la NS, siendo patológica en todos los nervios explorados en 2 pacientes. Los hallazgos patológicos en la NM fueron menos frecuentes, con predominio de afectación de las ondas F (en 3 pacientes el bloqueo de ondas F fue el único hallazgo destacable). Ningún paciente presentó amplitud del PEM menor del 20% del valor normal y no se detectaron parámetros alterados dentro de un rango desmielinizante. Un paciente presentó alteración de la amplitud de PANS en extremidades superiores con normalidad de nervio sural, compatible con patrón de preservación del sural o «sural sparing». Cinco pacientes tenían afectación clínica del NF. En 2 de estos pacientes la NF fue patológica, ambos con BR anormal consistente en alargamiento de latencia o ausencia de R1 y R2 homolateral con normalidad de respuestas contraterales. Un paciente presentó afectación clínica de NF con NF normal y BR anormal consistente en alargamiento de R2c con R1 normal (patrón más indicativo de afectación central). El patrón de afectación de pares craneales se resume en la tabla 4. Ningún paciente cumplió criterios electrofisiológicos para SGB.
Características clínicas de los pacientes SFB
| N.° de pacientesa(%) | |
|---|---|
| Pacientes (n) | 12 |
| Sexo (varón/mujer) | 6/6a |
| Edad media (rango) | 37 (19-74)a |
| Enfermedad precedente | 7 (58) |
| Síntomas respiratorios | 6 (50) |
| Síntomas gastrointestinales | 1 (8) |
| Clínica inicial | |
| Diplopía | 5 (42) |
| Ataxia | 3 (25) |
| Ptosis | 1 (8) |
| Parestesias | 1 (8) |
| Combinación de síntomas | 2 (17) |
| Signos a la exploraciónPares craneales | |
| Afectación pupilar | 4 (33) |
| Ptosis | 6 (50) |
| Debilidad facial | 5 (42) |
| Debilidad bulbar | 5 (42) |
| Sensibilidad, afectación | |
| Profunda | 6 (50) |
| Superficial | 5 (42) |
| Fuerza | |
| Debilidad (≥ grado 4 en escala MRC) | 5 (42) |
MRC: Medical Research Council Scale.
Hallazgos electrofisiológicos
| N.° pacientes (%) | |
|---|---|
| Conducción nerviosa sensitiva | |
| Amplitud reducida | |
| Mediano/cubital | 5 (42) |
| Sural | 2 (17) |
| Conducción nerviosa motora | |
| Amplitud reducida | 2 (17) |
| LDM | 1 (17) |
| VC | 1 (8) |
| Parámetros en rango desmielinizante | 0 (0) |
| Ondas F | |
| Latencia aumentada | 1 (0) |
| Bloqueo | 4 (33) |
| Neurografía facial | 2 (17) |
| Blink reflex | 3 (25) |
Total pacientes evaluados 12, excepto en neurografía facial 11.
LDM: latencia distal motora; VC: velocidad de conducción.
Patrón de hallazgos electrofisiológicos
| Neurografía sensitiva | Neurografía motora | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Paciente (días evol.) | Mediano | Cubital | Sural | Mediano | Cubital | Peroneal | Pares craneales facial/BR | |||||||||
| A | A | A | A | DML | CV | F | A | DML | CV | F | A | DML | CV | F | ||
| 1 (8) | x | x | X | |||||||||||||
| 2 (2) | x | |||||||||||||||
| 3 (5) | x | |||||||||||||||
| 4 (3) | x | x | X | x | x | |||||||||||
| 5 (5) | ||||||||||||||||
| 6 (8) | x | x | x | x | ||||||||||||
| 7 (6) | ||||||||||||||||
| 8 (4) | x | Aa | ||||||||||||||
| 9 (9) | ||||||||||||||||
| 10 (10) | x | |||||||||||||||
| 11 (10) | x | x | x | x | x | x | x | x | x | |||||||
| 12 (3) | x | x | x | |||||||||||||
Hallazgos solo especificados si patológicos.
A: amplitud; BR: blink reflex; evol.: evolución; F: ondas F; LDM: latencia distal motora; VC: velocidad de conducción.
Patrón clínico y electrofisiológico de afectación de pares cranealesa
| Paciente | Afectación clínicaa | Neurografía facial | Patrón de blink reflex ± | Diagnóstico clínico | |
|---|---|---|---|---|---|
| Amp | LDM | ||||
| 1 | Bulbar | N | N | N | SMF |
| 2 | Facial, bulbar | N | N | N | SMF |
| 4 | Facial, bulbar | N | N | RC unilateral | EB |
| 9 | Facial | N | N | N | SMF |
| 11 | Facial | N | Prolongada | RI, R2, Rc unilateralR1 contralateral | SMF |
| 12 | Facial | N | Prolongada | R2, Rc unilateralRc contralateral | EB |
Amp: amplitud del potencial motor evocado; EB: encefalitis de Bickerstaff; LDM: latencia distal motora; N: normal; R1: respuesta 1; R2: respuesta 2; Rc: respuesta contralateral; SMF: Síndrome de Miller Fisher.
En 6 pacientes se pudo evaluar un estudio neurofisiológico de control realizado en un rango entre 14-62 días desde el inicio de la clínica. Uno de ellos (paciente 2), a los 27 días de evolución presentó una reducción de la amplitud del PEM del NF, manteniendo la NS y la NM dentro de la normalidad, a excepción de ondas F, que persistieron bloqueadas. En ese momento, el paciente presentaba persistencia de afectación bulbar y ataxia. En los pacientes 4 y 11, con estudio neurofisiológico realizado a los 15 y 18 días de evolución, respectivamente, se evidenció una mejoría de la amplitud de los potenciales sensitivos en extremidades superiores, sin cambios en la duración del potencial, con persistencia de neurografía de nervio sural alterada en el paciente 4. En ambos pacientes persistía, aunque con mejoría clínica, la presencia de ataxia, así como arreflexia e hipopalestesia en las extremidades inferiores en el paciente 4. En el paciente 8 la amplitud del PS del nervio sural se normalizó a los 62 días de evolución, desapareciendo las ondas A detectadas previamente en múltiples nervios. La exploración neurológica era normal. Finalmente, el paciente 12 solamente disponía de estudio de BR a los 14 días de evolución, persistiendo alargamiento de latencia de R1, presentando clínicamente afectación severa de oftalmoparesia y debilidad facial. El paciente 1 no presentó cambios significativos en estudio realizado a los 23 días de evolución.
DiscusiónLos hallazgos clínicos descritos en nuestros pacientes son superponibles a los descritos ampliamente en estudios previos4,25. Sin embargo, los anticuerpos anti-GQ1b se detectaron en una frecuencia inferior de la esperada. Una posible explicación para este hecho es que las muestras fueron recogidas más de 2 semanas después del inicio de la clínica, lo que puede haber incrementado la posibilidad de falsos negativos26.
Respecto al estudio de la afectación del sistema nervioso periférico de nuestros pacientes, el hecho de que el primer estudio neurofisiológico sea realizado de forma precoz añade controversia a la interpretación de los hallazgos electrofisiológicos, tal y como puede ocurrir en el SGB20-22.
En nuestro estudio, 9 (75%) de los pacientes evaluados presentaron alguna alteración en estudio electrofisiológico, siendo el hallazgo más frecuente, una reducción de la amplitud de los PANS en uno o más nervios, presentando hallazgos en el estudio de conducción motora leves o aislados y en rango axonal. Estos hallazgos indican la presencia de una neuropatía axonal predominantemente sensitiva, apoyando la presencia de afectación de las fibras sensitivas aferentes cutáneas en la fisiopatología del SFB. El patrón descrito parece diferir del descrito en el estudio neurofisiológico precoz del SGB, en el que se describe un predominio de alteraciones en NM, con parámetros en rango desmielinizante incluso de forma precoz y con estudio completo raramente estrictamente normal20-22.
Una limitación importante de este estudio es la ausencia de información del reflejo H o de estudio postural que aporte información sobre la afectación del sistema propioceptivo aferente (fibras ia), posible responsable principalmente de la ataxia que presentan los pacientes6,7.
La resolución o mejoría de la amplitud en los PAS en el estudio neurofisiológico de control realizado entre los 15 y 18 días de evolución, de 2 de nuestros pacientes, sin un aumento significativo en la duración del potencial, apoya la presencia de un bloqueo de conducción reversible sensitivo, tal y como indica en el estudio Umapathi et al. En este estudio se describe la presencia de BCR en 6 de los 15 pacientes evaluados con SMF, imitando los hallazgos previamente descritos en SGB axonal (AMAN)19. Estos hallazgos indican asimismo una disfunción nodal o paranodal, colocando al SFB en el espectro del SGB axonal y de las nodo-paranodopatías27.
La evidencia de afectación del SNC es limitada en nuestros pacientes. A pesar de la presencia de clínica indicativa de afectación central como somnolencia o patrón de oftalmoplejía interna en 2 pacientes, la RM fue normal en estos y el resto de los pacientes evaluados. Es interesante recalcar que el BR indicó afectación del SNC en el paciente diagnosticado de encefalitis de Bickerstaff por presentar somnolencia. Sugerimos que el estudio mediante BR y/o neurografía facial puede, por tanto, aportar evidencia de afectación del SNP o SNC en el estudio de pacientes afectados de FBS, siendo recomendable su realización de forma rutinaria.
En conclusión, los hallazgos electrofisiológicos en nuestros pacientes apoyan la implicación de una neuropatía axonal, no desmielinizante, en la fisiopatología del SFB. La presencia de BCR sensitivo explica la rápida resolución de las alteraciones en la conducción nerviosa sensitiva en 3 de los pacientes evaluados. La realización de estudios neurofisiológicos seriados es crucial para el estudio de pacientes con FBS o SGB.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Parte de este trabajo ha sido presentado en la reunión anual de la SEN 2013.