La hiperCKemia asintomática o paucisintomática es uno de los motivos más frecuentes de consulta en las Unidades de Patología Neuromuscular. Las causas de hiperCKemia son múltiples incluyendo distintas miopatías hereditarias. Entre ellas se encuentra la anoctaminopatía causada por mutaciones en el gen ANO5 (11p14.3). Mutaciones recesivas en dicho gen son causantes de un espectro fenotípico amplio que incluye la distrofia de cinturas LGMD2L, la miopatía de Miyoshi tipo 3 y la hiperCKemia aislada o con intolerancia al ejercicio1.
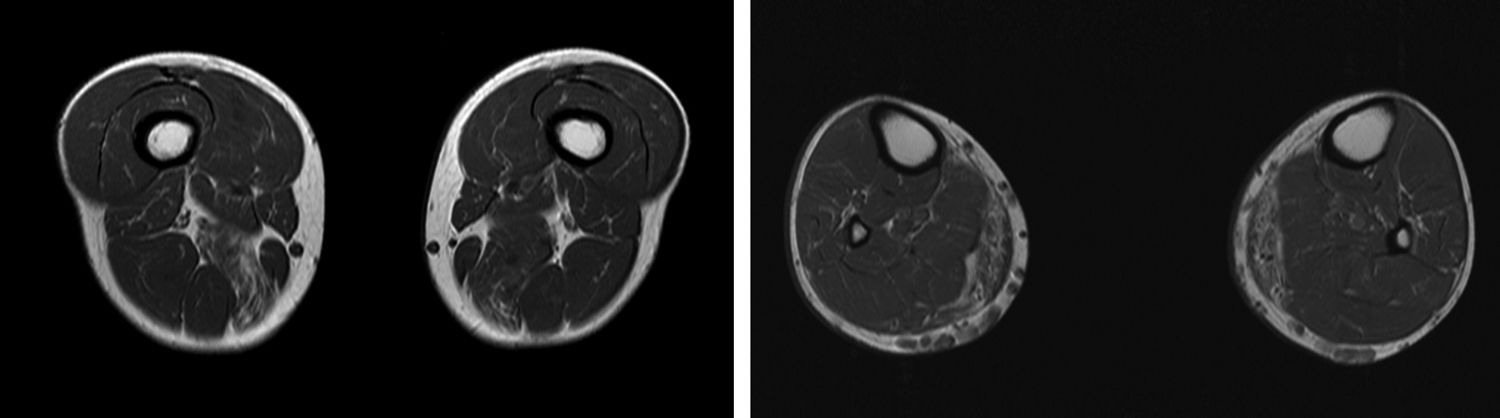
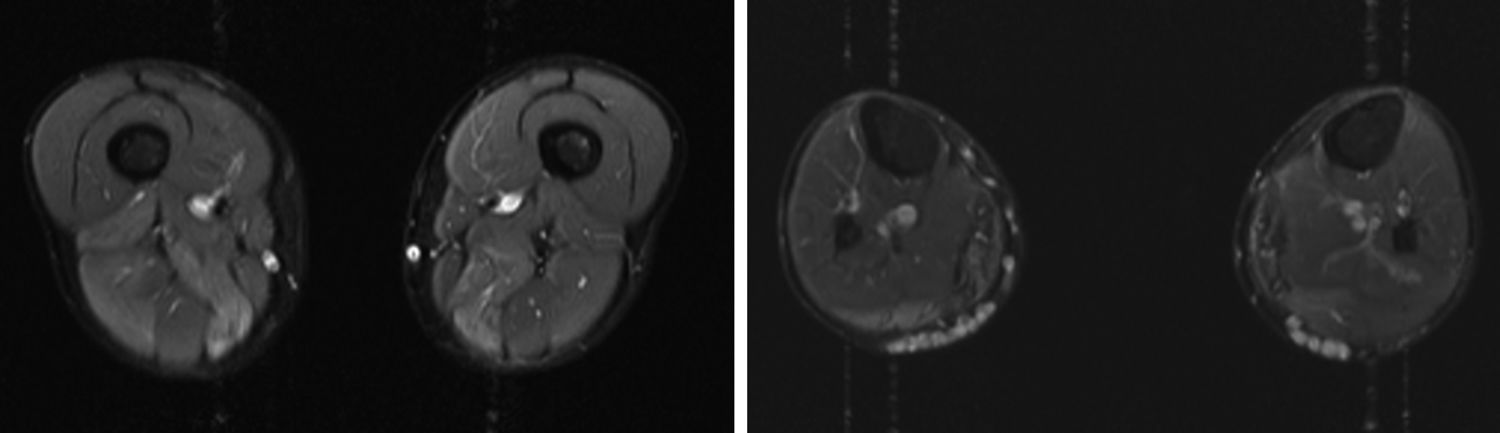
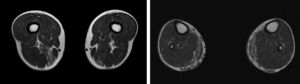
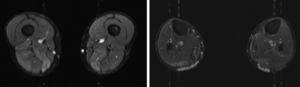
Presentamos el caso de un varón de 41 años, sin antecedentes de interés, con historia de 6 años de evolución de cifras elevadas de CK detectadas en analítica rutinaria (CK 1200-4500 U/l). Realizaba ejercicio físico, tanto aeróbico como anaeróbico, con intolerancia al mismo en el último año. Nunca había presentado episodios de coluria o rabdomiólisis. A la exploración no presentaba debilidad, amiotrofias o fenómeno miotónico. El electromiograma mostraba potenciales de unidad motora de características miopáticas en la musculatura de ambos miembros inferiores, sin actividad espontánea patológica. La RM muscular evidenció infiltración grasa asimétrica de los músculos semimembranoso y gastrocnemio medial (fig. 1) con mioedema en secuencia STIR en semimembranoso, bíceps femoral y gastrocnemios (fig. 2), a pesar de la ausencia de debilidad clínicamente evidente. El ecocardiograma transtorácico y holter-ECG fueron normales. La biopsia muscular objetivó un patrón distrófico con variación del tamaño de las fibras, abundantes núcleos internalizados e imágenes de necrosis y regeneración; a esto se sumaba ausencia de alteraciones en inmunohistoquímica y Western blot en distrofinas, sarcoglicanos, calpaína, disferlina y caveolina.
Dados los cambios distróficos inespecíficos en RM y biopsia se solicitó análisis de un panel de genes asociados a enfermedades neuromusculares mediante tecnología de secuenciación masiva (NGS), objetivándose la variante c.1982T>C en homocigosis, en el exón 18 del gen ANO5 (secuencia de referencia: NM_213599) que provoca el cambio aminoacídico p.Leu661Pro, variante registrada en la base de datos gnomAD con una frecuencia de 0,00003230 pero sin estar asociada previamente a patología. Se realizó estudio familiar demostrando que ambos progenitores eran portadores en heterocigosis. Tras más de 8 años de seguimiento el paciente no ha desarrollado debilidad ni otra sintomatología más allá de discreta intolerancia al ejercicio.
Se presenta un caso de hiperCKemia paucisintomática secundaria a mutación en el gen ANO5 cuyo diagnóstico final se logró mediante técnica de secuenciación masiva del ADN, analizando un grupo de genes prefijado en relación con el problema clínico del paciente. Como se ha comentado previamente, las causas de hiperCKemia pueden ser múltiples pudiéndose utilizar diferentes algoritmos diagnósticos que implican la realización de distintas pruebas complementarias2,3, sin que de momento incluyan la realización de paneles de genes. Entre las pruebas inicialmente empleadas en nuestro paciente, la RM y biopsia muscular sugerían la posibilidad de una distrofia subyacente pero sin precisar cuál. La RM muscular mostraba un patrón de afectación que podía hacer sospechar una anoctaminopatía, al predominar la afectación asimétrica del compartimento posterior de muslos y piernas4. Sin embargo este hallazgo es inespecífico requiriendo la realización de otras pruebas complementarias como podría ser la biopsia muscular. Si bien se ha descrito en la anoctaminopatía la presencia de depósitos de amiloide5 o datos de miopatía necrotizante6, no existe ningún marcador histopatológico en la biopsia muscular que en el momento actual permita un diagnóstico de certeza. Por este motivo se decidió solicitar el análisis de un panel de genes mediante técnica NGS lográndose el diagnóstico definitivo. Este resultado es congruente con estudios recientes realizados en pacientes con hiperCKemia asintomática o paucisintomática en los cuales la mutación en el gen ANO5 era una causa relativamente frecuente de la misma7.
La tecnología para la secuenciación del ADN ha avanzado enormemente en los últimos años, pudiendo secuenciar un genoma completo de forma rápida y con un coste relativamente bajo gracias a métodos como la secuenciación de última generación8. En el campo de las enfermedades neuromusculares y debido a su gran heterogeneidad genética no siempre es posible hacer un diagnóstico exhaustivo de todas las posibles mutaciones siendo preciso acotar el campo de estudio. Teniendo en cuenta que el diagnóstico molecular debe hacerse considerando los factores clínicos, la estrategia por paneles de genes relacionados con una determinada condición patológica como puede ser la hiperCKemia podría ser la estrategia más coste-efectiva9. Por esta razón consideramos razonable incluir la secuenciación de paneles de genes en el algoritmo diagnóstico de hiperCKemia asintomática o paucisintomática, sobre todo si pruebas previamente realizadas como la RM o la biopsia muscular sugieren la existencia de una miopatía subyacente.